Актуальность исследования аминокислот обусловлена тем, что они являются жизненно важными молекулами: входят в состав белков как структурные мономеры, участвуют в биохимических процессах в организме (обмене веществ, синтезировании белка, передаче межклеточных импульсов, регуляции экспрессии генов и др.) [1, 2]. Особое значение приобретает развитие физико-химических основ для определения конформационной стабильности и функциональной активности белковых образований, активизирующихся при изменении состояния среды (под действием температуры, рН, ионной силы). Взаимодействие белковых молекул с молекулами растворителя является важным фактором, влияющим на их состояние в растворе [3, 4], что способствовало увеличению числа работ по изучению сольватационных эффектов при моделировании молекулярных свойств и реакций в растворе, включая биологические среды [5–8]. Несмотря на имеющиеся литературные данные [9–12], в настоящее время ощущается недостаток исследований по влиянию температуры и кислотности среды как на ионное состояние молекул биологически активных соединений, так и на их термодинамические свойства, что существенно сужает возможности теоретической базы для изучения характера и движущих сил межмолекулярных взаимодействий в реальных физиологических условиях.
Лизин (2S-2,6-диаминогексановая кислота, H2N–(CH2)4–CαH(NH2)COOH, Lys) является незаменимой основной аминокислотой, молекула которой содержит концевые α-амино и α-карбоксильную группы, а также дополнительную сильноосновную боковую NH2-группу, которые являются потенциальными сайтами для взаимодействия с молекулами растворителя и других веществ. Лизин участвует во многих биологических и химических процессах, включая расщепления протеаз, хелатирование тяжелых металлов, сохранение эндоплазматического ретикулума; играет важную роль в выработке различных ферментов и гормонов, а также при формировании костей и мышц [13–15]. Кроме того, лизин является структурным блоком полилизинового пептида, обладающего широким антимикробным действием в отношении дрожжевых грибков, грамположительных и грамотрицательных бактерий [16]. Полилизин может применяться в качестве безопасного консерванта для пищевых продуктов и входить в состав антимикробной упаковки [17].
Как известно [18], объемные свойства растворов наиболее чувствительны к взаимодействиям растворенного вещества с растворителем, а также к изменению гидратации под действием температуры и среды. В литературе имеется всего несколько работ по экспериментальному исследованию плотности водных растворов L-лизина [19–21] и практически отсутствуют данные по влиянию температуры на объемные свойства Lys в буферных растворах. Задачей настоящего исследования является использование методов денсиметрии для определения влияния температуры и среды на объемные свойства и межмолекулярные взаимодействия L-лизина в воде (рН 5.4) и водном буферном растворе (рН 7.4) в изученном интервале температур и концентраций. Обсуждение рассчитанных кажущихся молярных объемов и предельных парциальных молярных объемов проведено на основе рассмотрения взаимодействий (растворенное вещество – растворитель) в рамках подхода Гэрни [22].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали L-лизин (Sigma-Aldrich, Switzeland, CAS 56-87-1). Содержание основного вещества составляло >98%. Аминокислоту сушили в вакуумном шкафу при 343 К в течение 24 ч и выдерживали в эксикаторе (над P2O5) не менее 48 ч непосредственно перед использованием. Методом К. Фишера (Volumetric KF Titrator V30, Mettler Toledo) было определено содержание воды в аминокислоте, которое составляло менее 0.8 мас. %.
Для приготовления водных растворов использовали бидистиллированную воду (с рН 5.4). Измерения плотности проводили в чистой воде и фосфатном буферном растворе. Водный буферный раствор, содержащий 0.0416 моль кг–1 NaH2PO4 и 0.2049 моль кг–1 Na2HPO4, обеспечивал постоянство кислотности среды (рН 7.4) в условиях эксперимента. Значения рН растворов фиксировали цифровым рН-метром Mettler Toledo, модель Five-Easy. Все растворы приготовлены весовым методом, используя весы Sartorius-ME215S (с точностью взвешивания 1 × 10–5 г). Концентрацию (моляльность – m) аминокислоты варьировали от ~(0.0030 до 0.0318) моль кг–1. Погрешность приготовления растворов указанной концентрации не превышала ±2 × 10–4 моль кг–1.
Измерения плотности исследуемых растворов выполнены на цифровом вибрационном денсиметре DMA-5000M (Anton Paar, Австрия) при температурах (288.15, 293.15, 298.15, 303.15, 308.15 и 313.15) K. Прибор имеет встроенный термостат, включающий два платиновых термометра Pt100 в сочетании с элементами Пельтье, что обеспечивало термостатирование образца внутри ячейки с погрешностью 5 × 10–3 К. Перед каждой серией измерений проводили калибровку ячейки сухим воздухом и дважды дистиллированной дегазированной водой при атмосферном давлении. Денсиметр обладает точностью измерения ±1.0 × × 10–3 кг м–3 и воспроизводимостью ±3.0 × 10–3 кг м–3. Подробное описание процедуры измерения дано ранее [23]. Совокупная стандартная погрешность измерения плотности исследуемых растворов не превышала ±1.24 × 10–2 кг м–3. Экспериментальные данные по плотности (ρ) исследуемых растворов приведены в табл. 1 и 2. Как видно из таблиц, значения ρ уменьшаются с температурой и возрастают с концентрацией аминокислоты. Необходимо отметить, что сравнение экспериментальных значений плотности растворов L‑лизина в воде и буфере с литературными данными затруднительно. Имеющиеся измерения плотности водных растворов L-лизина были выполнены для другой области концентраций аминокислоты [24] или для моногидрохлорида [25, 26] и моногидрата [27] L-лизина, а в случае буферных растворов Lys они были получены при одной температуре 298.15 К [28].
Таблица 1.
Плотность водных растворов L-лизина (ρ, г cм‒3) при разных концентрациях и температурах
| m, моль кг–1 | 288.15 K | 293.15 К | 298.15 К | 303.15 К | 308.15 К | 313.15 К |
|---|---|---|---|---|---|---|
| 0.00000 | 0.999099 | 0.998203 | 0.997043 | 0.995645 | 0.994029 | 0.992212 |
| 0.00364 | 0.999241 | 0.998344 | 0.997182 | 0.995784 | 0.994167 | 0.992349 |
| 0.00713 | 0.999376 | 0.998477 | 0.997315 | 0.995916 | 0.994298 | 0.992481 |
| 0.01230 | 0.999573 | 0.998674 | 0.997510 | 0.996111 | 0.994493 | 0.992672 |
| 0.01783 | 0.999781 | 0.998882 | 0.997718 | 0.996316 | 0.994697 | 0.992875 |
| 0.02163 | 0.999922 | 0.999021 | 0.997858 | 0.996458 | 0.994835 | 0.993012 |
| 0.03182 | 1.000293 | 0.999391 | 0.998226 | 0.996823 | 0.995202 | 0.993376 |
Таблица 2.
Плотность водных буферных растворов L-лизина (ρ, г cм–3) при разных концентрациях и температурах
| m, моль кг–1 | 288.15 K | 293.15 К | 298.15 К | 303.15 К | 308.15 К | 313.15 К |
|---|---|---|---|---|---|---|
| 0.00000 | 1.030005 | 1.028839 | 1.027473 | 1.025604 | 1.023353 | 1.021925 |
| 0.00263 | 1.030097 | 1.028926 | 1.027556 | 1.025684 | 1.023431 | 1.022002 |
| 0.00808 | 1.030260 | 1.029074 | 1.027693 | 1.025816 | 1.023557 | 1.022125 |
| 0.01236 | 1.030361 | 1.029161 | 1.027767 | 1.025887 | 1.023621 | 1.022186 |
| 0.01610 | 1.030422 | 1.029220 | 1.027823 | 1.025940 | 1.023678 | 1.022231 |
| 0.02120 | 1.030494 | 1.029277 | 1.027877 | 1.025975 | 1.023707 | 1.022259 |
| 0.03120 | 1.030590 | 1.029354 | 1.027918 | 1.025999 | 1.023716 | 1.022267 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
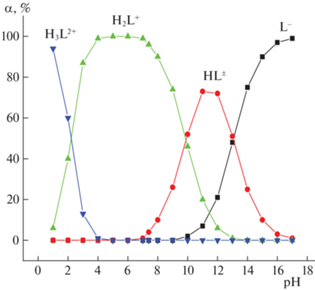
В водных растворах лизин может существовать в двух катионных ([H3L]2+, [H2L]+), цвиттерионной ([HL]±) или анионной ([L]–) формах. Диссоциацию лизина в водных растворах можно представить схемой:
Кажущийся молярный объем Lys (φV) вычислен по уравнению на основе экспериментальных данных по плотности:
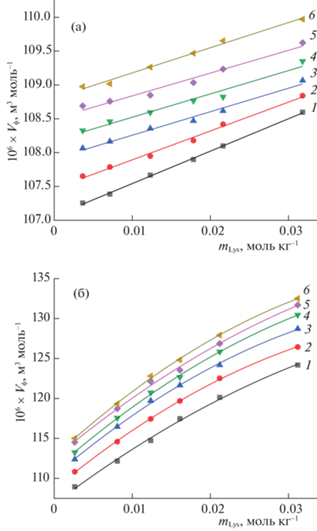
где ρ0 и ρ – плотности растворителя и раствора, m – моляльная концентрация аминокислоты, М – молекулярная масса. Средняя погрешность значений φV с учетом погрешности измерения плотности составила ≈0.7 × 10–6 м3 моль–1. На рис. 2 представлены графики концентрационных зависимостей кажущихся молярных объемов аминокислоты в воде и буферном растворе при разных температурах. Показано, что зависимости φV = = f(m) для Lys в воде описываются линейной функцией, а в буферном растворе хорошо аппроксимируются полиномом второй степени: где φV° – предельное значение кажущегося молярного объема Lys, равное парциальному молярному объему при бесконечном разбавлении, a1, a2 – постоянные коэффициенты. Значения φV увеличиваются с ростом концентрации аминокислоты и температуры.Рис. 2.
Концентрационные зависимости кажущихся молярных объемов L-лизина (φV) в воде (а) и водном буферном растворе (б) при температурах: 1 – 288.15, 2 – 293.15, 3 – 298.15, 4 – 303.15, 5 – 308.15, 6 – 313.15 К.
В табл. 3 представлены парциальные молярные объемы при бесконечном разбавлении φV°, полученные из уравнения (2), положительные значения которых указывают на присутствие взаимодействий между аминокислотой и растворителем. Насколько нам известно, в литературе отсутствуют сведения о парциальных молярных объемах Lys в фосфатном буферном растворе при разных температурах (кроме 298.15 К). В случае водных растворов полученные нами значения φV° согласуются в пределах экспериментальной погрешности с имеющимися данными для Lys при 298.15 К (108.71 ± 0.16) × 10–6 м3моль–1 [21] и 108.50 × 10-6 м3моль–1 [19]), но отличаются от значений φV° для моногидрата лизина (118.15 ± 0.06) × × 10–6 м3моль–1 [20].
Таблица 3.
Предельные кажущиеся молярные объемы (φV°) L-лизина (Lys) при бесконечном разбавлении, парциальные молярные расширяемости ($E_{\varphi }^{^\circ }$) и значения парциальных молярных объемов переноса (${{\Delta }_{{{\text{tr}}}}}V_{\varphi }^{^\circ }$) Lys из воды в буферный раствор при разных температурах
| T, K | Lys – вода | Lys – буфер | ${{\Delta }_{{{\text{tr}}}}}V_{\varphi }^{^\circ }$ × 106, м3 моль–1 |
||
|---|---|---|---|---|---|
| φV° × 106, м3 моль–1 |
$E_{\varphi }^{^\circ }$ × 106, а м3 моль–1 K–1 |
φV° × 106, м3 моль–1 |
$E_{\varphi }^{^\circ }$ × 106, а м3 моль–1 K–1 |
||
| 288.15 | 107.06 | 0.0912 | 107.43 | 0.3327 | 0.36 |
| 293.15 | 107.54 | 0.0801 | 108.79 | 0.2860 | 1.24 |
| 298.15 | 107.98 | 0.0688 | 110.31 | 0.2393 | 2.33 |
| 303.15 | 108.17 | 0.0576 | 111.22 | 0.1926 | 3.04 |
| 308.15 | 108.50 | 0.0464 | 112.35 | 0.1459 | 3.85 |
| 313.15 | 108.76 | 0.0352 | 112.71 | 0.0992 | 3.95 |
а $E_{\varphi }^{^\circ }$ = (∂φV°/∂T)p вычислено по уравнению (5).
Парциальные молярные объемы φV° чувствительны к сольватации растворенного вещества Lys, молекулы которого содержат как зарядные и полярные гидрофильные группы, так и гидрофобные фрагменты. В водных растворах происходит гидратация ионизацированных α‑карбоксильной и α-амино-групп молекулы Lys, протонирование боковой ε-амино-группы и гидратация неполярных (–CH2–) фрагментов. Значение рН водного раствора аминокислоты в изученной области концентраций равнялось 9.7 ± 0.1, при этом образуется смесь двух ионных форм Lys – монокатиона ([H2L]++–) и цвиттериона ([HL]±) в соотношении ~2 : 1. В случае растворов Lys в фосфатном буфере гидратированные ионы электролита (Na+, H2PO$_{4}^{ - }$, HPO$_{4}^{{2 - }}$) взаимодействуют с гидратированными тремя зарядными центрами (α-NH$_{3}^{ + }$, α-COO–, ε-NH$_{3}^{ + }$) монокатионов Lys, которые доминируют в условиях рН 7.4. Также диполи молекул воды попадают под воздействие электростатических сил вблизи катионов, анионов и монокатионов. В результате происходит усиление взаимодействий, обусловленных, прежде всего, электростатическими силами и образованием водородных связей между аминокислотой и компонентами растворителя.
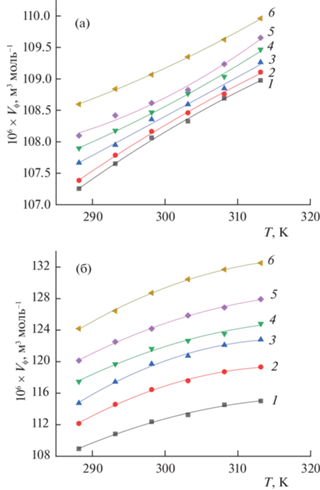
Температурные зависимости кажущихся молярных объемов φV = f(T) для Lys в воде и буферном растворе приведены на рис. 3. Наблюдается монотонная последовательность в расположении изоконцентрационных кривых φV(T) с ростом концентрации аминокислоты, что указывает на отсутствие процессов образования комплексов между Lys и компонентами буферного растворителя. Отметим, что изоконцентраты аминокислоты как в воде, так и буферном растворе описываются полиномом второй степени: φV = b0 + b1T + + b2T2, где b0, b1, b2 – константы.
Рис. 3.
Температурные зависимости кажущихся молярных объемов φV L-лизина при разных концентрациях: (а) в воде (1 – 0.0036, 2 – 0.0071, 3 – 0.0123, 4 – 0.0178, 5 – 0.0216, 6 – 0.0318 m) и (б) в водном буферном растворе (1 – 0.0026, 2 – 0.0081, 3 – 0.0124, 4 – 0.0161, 5 – 0.0212, 6 – 0.0312 m).
Парциальные молярные объемы переноса при бесконечном разбавлении (${{\Delta }_{{{\text{tr}}}}}V_{\varphi }^{^\circ }$) аминокислоты из воды в буферный раствор вычислены по соотношению (3) и приведены в табл. 3:
(3)
${{\Delta }_{{{\text{tr}}}}}V_{\varphi }^{^\circ } = {}^{\varphi }V^\circ ({\text{Lys}}{\kern 1pt} --{\kern 1pt} {\text{буфер}}) - {}^{\varphi }V^\circ ({\text{Lys}}{\kern 1pt} --{\kern 1pt} {\text{вода}}).$Как видно из табл. 3, значения φV° увеличиваются с ростом температуры, что согласуется с данными для других аминокислот в водных растворах [20, 41–43]. Изменение парциального молярного объема φV° с температурой может быть вызвано разными причинами, такими как тепловое расширение, ослабление сетки Н-связей, высвобождение молекул воды из сольватных слоев и т.д. Учитывая наличие сольватных (гидратных) сфер вокруг монокатионов и цвиттерионов аминокислоты в растворе, увеличение значений φV° с повышением температуры обусловлено, прежде всего, высвобождением части электрострикционно сжатой воды из рыхлых гидратных сфер растворенного вещества в объем раствора [34]. При более высоких температурах этот процесс происходит легче, что приводит к расширению раствора, о чем свидетельствуют более высокие значения φV° при более высоких температурах. Следует отметить, что в интервале температур от 288.15 до 313.15 К изменение объема ΔφV° составило 1.7 × × 10–6 м3 моль–1 и 5.28 × 10–6 м3 моль–1 для Lys в воде и буфере соответственно. Можно полагать, что влияние температуры на φV° более выражено для буферных растворов Lys.
Изменения предельного кажущегося молярного объема φV° с температурой в воде и буфере, представленные в графической форме на рис. 4, описываются полиномом второй степени:
где α, β и γ – константы, T – температура. Значения коэффициентов уравнения (4) приведены в табл. 4. Парциальная молярная расширяемость ($E_{\varphi }^{^\circ }$) при бесконечном разбавлении в исследуемых растворах вычислена по соотношению, полученному путем дифференцирования уравнения (4) по температуре:(5)
$E_{\varphi }^{^\circ } = {{({{\partial }^{\varphi }}V^\circ {\text{/}}\partial T)}_{p}} = \beta + 2\gamma T.$Рис. 4.
Температурные зависимости парциальных молярных объемов φV° L-лизина в воде (1) и буферном растворе (2).
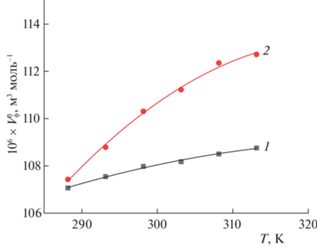
Таблица 4.
Коэффициенты α, β, γ уравнения (4) для L‑лизина в воде и водном буферном растворе
| Система | α, см3 моль–1 | β, см3 моль–1 К–1 | γ, см3 моль–1 К–2 |
|---|---|---|---|
| Lys–вода | –12.581 | 0.7367 | –0.00112 |
| Lys–буфер | –376.443 | 3.0241 | –0.00467 |
Таким образом, методом денсиметрии получены экспериментальные значения плотности растворов L-лизина в воде и фосфатном буферном растворе (рН 7.4) в интервале концентраций (~0.003–0.031 моль кг–1) и температур (288.15–313.15) К. Определены кажущиеся и парциальные молярные объемы (φV, φV°) L-лизина, а также предельные кажущиеся молярные объемы переноса (${{\Delta }_{{{\text{tr}}}}}V_{\varphi }^{^\circ }$) Lys из воды в буферный раствор. Положительные значения φV и φV° предполагают присутствие взаимодействий растворенного вещества с растворителем и характеризуют поведение Lys в растворах как гидрофильного растворенного вещества. Установлено увеличение значений φV, φV° и ${{\Delta }_{{{\text{tr}}}}}V_{\varphi }^{^\circ }$ Lys в воде и буферном растворе с повышением температуры, что обусловлено, прежде всего, высвобождением части электрострикционно сжатой воды из гидратных сфер монокатионной и цвиттерионной форм аминокислоты и ионов электролита в объем раствора. Показано, что влияние температуры на значения φV° более выражено для буферных растворов Lys, чем для воды. Монотонная последовательность в расположении изоконцентрационных кривых φV(T) с ростом концентрации аминокислоты указывает на отсутствие процессов образования комплексов между Lys и компонентами буферного растворителя.
Наблюдаемые положительные значения объема ${{\Delta }_{{{\text{tr}}}}}V_{\varphi }^{^\circ }$ переноса Lys из воды в буфер при всех изученных температурах являются результатом, прежде всего, эффектов гидратации и взаимодействия между гидратированными ионными формами Lys и ионами электролитов буферного раствора через электростатические силы и образование водородных связей. Иными словами, ион-гидрофильные и гидрофильно-гидрофильные взаимодействия доминируют над гидрофобно-гидрофобными и ион-гидрофобными взаимодействиями в исследуемых растворах L-лизина.
Определены парциальные молярные расширяемости ($E_{\varphi }^{^\circ }$) и их производные по температуре (∂$E_{\varphi }^{^\circ }$/∂T)p при бесконечном разбавлении в водном и буферном растворах L-лизина. Показано, что полученные положительные значения $E_{\varphi }^{^\circ }$ понижаются с ростом температуры. L-лизин не способствует укреплению структуры раствора, что отражается в отрицательных значениях параметра (∂$E_{\varphi }^{^\circ }$/∂T)p. Выявлено, что по сравнению с водным раствором, структурно-разрушающие эффекты Lys усиливаются в водном буферном растворе.
Измерения плотности выполнены на оборудовании центра коллективного пользования “Верхневолжский региональный центр физико-химических исследований” ИХР РАН (http://www.isc-ras.ru/ru/struktura/ckp).