ВВЕДЕНИЕ
Потемнение клеток в процессе культивирования растительных объектов – одна из основных причин, препятствующая их дальнейшему росту и дифференцировке in vitro [1]. Потемнение сопровождается снижением пролиферации клеток и остановкой их дальнейшего развития [2, 3], что подтверждается возрастанием количества отмирающих клеток при увеличении интенсивности потемнения [4]. Особенно много проблем возникает с культивированием тканей и органов хвойных растений [1], в том числе у сосны обыкновенной (Pinus sylvestris L.) [1, 4, 5]. Представители рода Pinus играют важное экономическое значение. Несмотря на то, что для многих видов описан биотехнологический способ размножения путем соматического эмбриогенеза [6, 7], массовое тиражирование P. sylvestris в культуре in vitro до сих пор остается труднодостижимым, и одна из проблем – это быстрое потемнение каллуса [4, 5].
Для количественной характеристики стадии развития каллуса наряду с цитологической оценкой [8–10] применяют различные биометрические показатели. Биометрические показатели культуры in vitro являются важными индивидуальными параметрами при предварительном отборе деревьев-доноров для дальнейшего успешного культивирования. Считается, что их можно использовать для оценки репродуктивного потенциала растений [11]. К таким параметрам относят: частоту инициации (число эксплантов, образовавших каллус, к общему числу эксплантов), скорость образования первичного каллуса, скорость роста каллуса, жизнеспособность каллусных тканей, начало потемнения, интенсивность потемнения и др. [11].
Потемнение клеток связано с накоплением фенольных соединений и хинонов [1], которые могут ингибировать активность некоторых ферментов, особенно оксидоредуктаз и гидролаз. На биохимическом уровне потемнение сопровождается изменением активности пероксидазы (ПО, КФ 1.11.1.7) и полифенолоксидазы (ПФО, КФ 1.14.18.1) [12]. Данные ферменты совместно участвуют в реакциях потемнения эксплантов, катализируя окисление полифенолов в хиноны и затем в танины, которые постепенно накапливаются и внешне выражаются появлением коричневой окраски [13]. В клетке работа ПО и ПФО неразрывно связана с другими ферментами антиоксидантной системы (АОС), такими как супероксиддисмутаза (СОД, КФ 1.15.1.1) и каталаза (КАТ, КФ 1.11.1.6). В ряде работ отмечают изменение активности СОД и КАТ как во время развития каллуса, так и при его потемнении [14]. Известно и об участии фенилаланинаммиаклиазы (ФАЛ, КФ 4.3.1.5) в процессах потемнения каллуса. Это фермент, переключающий метаболизм на синтез флавоноидов, относится к ферментам вторичного метаболизма. Он участвует в реакции образования из фенилаланина транс-коричной кислоты – предшественника большинства фенольных соединений [15].
Основным источником углеводов в культуре in vitro является сахароза, которая сама по себе метаболически инертна. Утилизация сахарозы в тканях происходит при участии ферментов ее гидролиза – инвертазы (Инв, КФ 3.2.1.26) и сахарозосинтазы (СС, КФ 2.4.1.13) [16]. Инвертаза расщепляет молекулу сахарозы на две гексозы – глюкозу и фруктозу. Метаболизация сахарозы с участием СС, как правило, сопряжена с преобладанием в клетках активных синтетических процессов. Мембраносвязанная форма СС образует комплекс с целлюлозосинтазой [17], что дает возможность прямого использования образуемой в результате активности СС УДФ-глюкозы для биосинтеза целлюлозы. В ряде работ показано, что активность СС в пролиферирующем эмбриогенном каллусе остается на постоянном уровне [18, 19]. Изменение активности ферментов, метаболизируюших сахарозу, в основном изучают при развитии зиготических и соматических зародышей. Работ, исследующих их динамику при потемнении каллуса, нам не встречалось.
Цель работы – комплексный анализ каллуса P. sylvestris в процессе его потемнения, включающий оценку биометрических и цитогенетических показателей и определение активности ферментов, метаболизирующих сахарозу, ферментов АОС и фенольного метаболизма.
МАТЕРИАЛЫ И МЕТОДЫ
Отбор растительного материала и введение в культуру in vitro
Деревья-доноры P. sylvestris произрастали в подзоне средней тайги на Петрозаводской лесосеменной плантации I порядка (ЛСП I) (61.91972° с.ш.; 34.41389° в.д.). ЛСП (площадь 238 га) была основана в 1976 г. и расположена в 15 км от Петрозаводского городского округа, вдали от крупных автотранспортных магистралей, и окружена сосновыми и еловыми фитоценозами. Поле, на котором произрастают исследуемые деревья, закладывалось по рандомизированной схеме с расстоянием между деревьями 5 × 8 м, вегетативным потомством плюсовых деревьев, отобранных в популяциях P. sylvestris на территории Карелии. Возраст деревьев на плантации – 36–40 лет. На основании селекционно-генетической оценки, проведенной сотрудниками Института леса Карельского научного центра РАН под руководством д.с.-х.н. Б. В. Раевского, были отобраны 20 генотипов сосны обыкновенной (по пять клонов в каждом генотипе), которые произрастают в пределах одного поля плантации. Отобранные деревья были схожи по морфологическим параметрам и статистически не отличались между собой по высоте (15.1 ± 2.1 м), диаметру на высоте 1.3 м (27 ± 3.5 см), форме и протяженности (66 ± 11%) кроны.
В период вынужденного покоя (конец февраля – начало марта 2021 г.) с 32 деревьев сосны (16 генотипов по 2 клона в каждом) из верхней части кроны (на высоте 11–13 м) были собраны вегетативные почки. Почки с частью побега поверхностно обрабатывали 10% мыльным раствором в течение 10 мин с обильным промыванием под проточной водой. Далее в асептических условиях бокса микробиологической безопасности SAVVY (“LAMSYSTЕMS”, Германия) растительный материал в течение 10 мин обрабатывали 5% раствором гипохлорита натрия (коммерческий отбеливатель “Белизна”, Россия), трехкратно промывали стерильной дистиллированной водой, в течение 10 мин обрабатывали 20% раствором перекиси водорода, затем снова промывали стерильной дистиллированной водой три раза. Далее почки очищали от почечных чешуй, вырезали поперечные диски толщиной 1–2 мм и помещали срезом на среду. Экспланты культивировали на питательной среде МС в модификации A. Hohtola [20], в качестве регуляторов роста использовали 2,4-D и БАП в концентрациях 2 и 1 мг/л, соответственно, источником углеводов служила сахароза в концентрации 10 г/л (табл. 1). Величина выборки для каждого дерева составила 5–6 повторностей. В каждой колбе (одна повторность) культивировали по 4–5 эксплантов почек.
Таблица 1.
Состав питательной среды МС по Hohtola [20] с модификациями
| Макроэлементы, мг/л | Другие компоненты, мг/л | ||
|---|---|---|---|
| NH4NO3 | 825 | Никотиновая кислота | 0.75 |
| KNO3 | 950 | Пиридоксин ⋅ HCl | 0.75 |
| CaCI2 ⋅ 2H2O | 220 | Тиамин ⋅ HCl | 0.15 |
| MgSO4 ⋅ 7H2O | 370 | Миоинозитол | 100 |
| KH2PO4 | 340 | Глицин | 3 |
| Микроэлементы, мг/л | L-глутамин | 200 | |
| KI | 1.66 | Сахароза | 10 000 |
| H3BO3 | 12.4 | Агар | 7000 |
| MnSO4 ⋅ 4H2O | 22.3 | Гормоны, мг/л | |
| ZnSO4 ⋅ 7H2O | 8.6 | ||
| Na2MoO4 ⋅ 2H2O | 0.5 | 2,4-D | 2 |
| CuSO4 ⋅ 5H2O | 0.025 | 6-БАП | 1 |
| CoC12 ⋅ 6H2O | 0.05 | ||
| Na2–Fe–EDTA | 39 | ||
Определение биометрических показателей
При культивировании эксплантов фиксировали время начала каллусообразования, количество эксплантов, которые образовали каллус, а также время начала потемнения каллусной массы. Через 30 дней культивирования каллусную ткань в каждой повторности делили на светлую и темную части, давали им визуальную характеристику (цвет, консистенция) и взвешивали на аналитических весах Sartorius CP124S (“Sartorius AG”, Германия). Для исследуемых генотипов рассчитывали следующие параметры: 1) частоту инициации каллусообразования (доля эксплантов, образовавших каллус, к общему числу эксплантов, %), 2) долю светлого каллуса (отношение массы светлого каллуса к общей массе каллуса на 1 повторность через 30 дней культивирования, %).
Цитологические и цитогенетические исследования
Для проведения цитологического анализа каллусную ткань различного цвета помещали на предметное стекло, выдерживали 1–2 мин в красителе (0.2% водный раствор сафранина с добавлением капли насыщенного спиртового раствора метиленового синего) [8]. Для цитогенетических исследований растительный материал фиксировали в спиртово-уксусной смеси (3 : 1 96% этиловый спирт : ледяная уксусная кислота) в течение 24 ч. Окрашивали каллус 1% ацетогематоксилином, перед окрашиванием материал выдерживали 5 мин в 4% растворе железоаммонийных квасцов [10, 21]. Давленые препараты готовили по стандартным методикам. Препараты просматривали под световым микроскопом Carl Zeiss Primo Star (“Carl Zeiss”, Германия) при увеличении 40×. Для микрофотосъемки использовали цифровую камеру-окуляр ADFstd 10 (“ADF”, Китай). Для приготовления одного препарата отбирали по 5 мг каллуса. Проанализировано 6533 клетки на стадиях метафазы и ана-телофазы митоза и 27 403 клетки на стадии интерфазы в каллусах, образованных из почек деревьев сосны.
Биохимические исследования
Культуру клеток, сформированную эксплантами, собранными с различных деревьев, разделяли на светлую и темную части и анализировали отдельно. Навеску каллуса растирали с жидким азотом и буфером для экстракции (50 мМ Hepes (pH 7.5), 1 мМ ЭДТА, 1 мМ ЭГТА, 3 мМ ДТТ, 5 мМ MgCl2, 0.5 мМ PMSF) (“Sigma-Aldrich”, Германия) в соотношении ткань : буфер 1 : 10. После 15 мин инкубации при 4°C гомогенат центрифугировали при 12 000 об/мин в течение 10 мин (центрифуга MPW-351R, “MPW Med. Instruments”, Польша). В осадке определяли активность апопластной инвертазы (АпИнв), в супернатанте – остальных ферментов. Супернатант очищали на п/э колонках объемом 20 см3, заполненных гелем Sephadex G-25 medium (“GE HealthCare”, США). Содержание белка определяли по методу Бредфорда. Ферментативную активность определяли спектрофотометрически на планшетном ридере SpectroStarNano (“BMG Labtech”, Германия).
Активность СОД определяли по уменьшению оптической плотности (λ = 560 нм) после 30 мин инкубации под светом флуоресцентных ламп. Среда инкубации состояла из 67 мМ K,Na-фосфатного буфера (рН 7.8), 0.1% тритона Х-100, 50 мМ ЭДТА, 172 мкМ нитросинего тетразолия (“AppliChem”, Германия), 210 мкМ метионина-L, 24 мкМ рибофлавина (“Sigma-Aldrich”, Германия). Активность СОД выражали в усл. ед. на 1 мг белка за 30 мин (усл. ед./мг белка) [22].
Активность КАТ определяли по уменьшению оптической плотности (λ = 240 нм), которая свидетельствует об убывании перекиси водорода. Содержание перекиси водорода рассчитывали по предварительно построенному градуировочному графику. Среда инкубации состояла из 67 мМ K,Na-фосфатного буфера (рН 7.8) и 14.7 мМ перекиси водорода. Активность КАТ выражали в мкмоль израсходованной перекиси водорода на мг белка за 4 мин (мкмоль H2O2/мг белка) [22].
Активность ПО определяли по увеличению оптической плотности (λ = 470 нм) за счет образования продукта реакции – тетрагваякола (ТГ). Количество ТГ рассчитывали с учетом коэффициента экстинкции (ε = 0.0266 мкМ–1 см–1). Реакцию наблюдали во времени в течение 60 мин. Зависимость скорости реакции от времени имела линейный характер. Среда инкубации состояла из 67 мМ K,Na-фосфатного буфера (рН 5.0), 2.6 мМ перекиси водорода и 21.5 мМ гваякола (“Sigma-Aldrich”, Германия). Активность ПО выражали в мкмоль образовавшегося ТГ на мг белка за 30 мин (мкмоль ТГ/мг белка) [22].
Активность ПФО определяли по возрастанию оптической плотности в той части спектра, где поглощают продукты окисления пирокатехина (λ = 420 нм). Реакцию наблюдали в течение 30 мин. Зависимость скорости реакции от времени имела линейный характер. Среда инкубации для определения активности ПФО состояла из 67 мМ K,Na-фосфатного буфера (рН 7.2) и 16.4 мМ пирокатехина (“Sigma-Aldrich”, Германия). Активность ПФО выражали в усл. ед. на 1 мг белка за 1 мин (усл. ед./мг белка) [22].
Активность ФАЛ определяли по увеличению оптической плотности (λ = 270 нм), которая связана с образованием продукта реакции – транс-коричной кислоты после 60 мин инкубации при 37°C. Содержание транс-коричной кислоты рассчитывали по предварительно построенному градуировочному графику. Инкубационная среда состояла из 60 мМ Na-боратного буфера (рН 8.6), 201.8 мМ L-фенилаланина (о.с.ч. “Вектон”, Россия). Активность ФАЛ выражали в мкмоль коричной кислоты на 1 мг белка за 60 мин (мкмоль коричной кислоты/мг белка).
Активность кислых инвертаз (АпИнв и ВакИнв) определяли по количеству образовавшейся глюкозы после инкубации при 30°С в течение 30 мин. Инкубационная среда содержала 50 мМ ацетатный буфер (рН 4.7) и 50 мМ сахарозу. Образовавшуюся в процессе инкубации глюкозу определяли глюкозооксидазным методом, количество ее рассчитывали по предварительно построенному градуировочному графику. Активность цитоплазматической инвертазы (ЦитИнв) и СС определяли по количеству образовавшейся фруктозы, как описано в работе Nguyen с соавт. [23]. Инкубационная среда для определения активности ЦитИнв содержала 50 мМ Hepes (рН 7.5) и 100 мМ сахарозу; СС – 50 мМ Hepes (рН 7.5), 100 мМ сахарозу и 1 мМ уридиндифосфат. Инкубация при 37°С в течение 60 мин. Образовавшуюся в процессе инкубации фруктозу определяли в реакции с 2,3,5-трифенилтетразолием хлористым по увеличению оптической плотности при λ = 495 нм, количество ее рассчитывали по предварительно построенному градуировочному графику. Активность СС и Инв выражали в мкмоль метаболизированной сахарозы на 1 мг белка за 30 мин (мкмоль/мг белка).
Статистическая обработка данных
Статистическая обработка данных осуществлялась в среде Microsoft Excel и PAST. На диаграммах приведены средние значения с учетом указанной биологической (n) и двукратной аналитической повторностей и их стандартные ошибки. Выборки проверялись на нормальность с использованием критерия Шапиро–Уилка. Для оценки достоверности различий применяли критерий Манна–Уитни (обозначены на графиках латинскими буквами). Для разделения деревьев-доноров на группы по биометрическим показателям (1) и активности изучаемых ферментов (2) использовали кластерный анализ. Для изучения взаимосвязи биометрических параметров внутри выделенных групп между собой и активности ферментов между собой применяли корреляционный анализ. Статистически значимыми считали различия при Р < 0.05.
Исследования выполнены на научном оборудовании Центра коллективного пользования Федерального исследовательского центра “Карельский научный центр Российской академии наук”.
РЕЗУЛЬТАТЫ
Характеристика каллусообразования у разных генотипов сосны
Каллус начинал формироваться на 5–11 сутки культивирования. В среднем, 60% эксплантов, введенных в культуру, образовывали каллус. Потемнение каллуса отмечалось примерно через 15 дней культивирования. На 1 эксплант в среднем приходилось 104 ± 48 мг каллуса, доля (по массе) светлого каллуса сильно варьировала: от 0 до 100%. Мы обнаружили, что частота и продолжительность инициации каллусообразования, а также потемнение массы клеток зависели от дерева-донора растительного материала (табл. 2). Массив данных, включающий в себя частоту инициации, долю светлого каллуса и среднее значение массы каллуса на одну повторность, с помощью кластерного анализа разделили на две группы. В первую группу вошли генотипы с высокой долей светлого каллуса (43 ± 6%), во вторую группу – генотипы, у которых доля светлого каллуса была значительно ниже (7.8 ± 2%). Частота инициации мало отличалась между группами и составляла 53 ± 6% и 62 ± 8%, соответственно. Напротив, средняя масса каллуса на 1 повторность достоверно отличалась у первой и второй групп (0.47 ± 0.06 и 0.31 ± 0.1 г, соответственно). В первой группе – светлом каллусе – частота инициации коррелировала с долей светлого каллуса и средней массой (r = 0.66; P = 0.006 и r = 0.54; P = 0.03, соответственно), во второй группе корреляций не обнаружено.
Таблица 2.
Биометрические показатели каллусных культур
| Генотип | Число эксплантов | Частота инициации, % | Масса каллуса, г | Масса каллуса, г (max–min значение) | Доля светлого каллуса, % (max–min значение) |
|---|---|---|---|---|---|
| 1025 | 40 | 80.0 ± 10.0 | 0.49 ± 0.11 | 1.13–0.08 | 100–32 |
| 1026 | 45 | 71.0 ± 1.0 | 0.67 ± 0.08 | 1.19–0.33 | 100–25 |
| 864 | 40 | 62.5 ± 17.5 | 0.82 ± 0.14 | 1.45–0.16 | 100–0 |
| 853 | 44 | 80.8 ± 14.2 | 0.37 ± 0.04 | 0.62–0.24 | 61–0 |
| 876 | 39 | 66.8 ± 6.8 | 0.29 ± 0.05 | 0.47–0.12 | 49–0 |
| 371 | 39 | 43.3 ± 11.7 | 0.24 ± 0.09 | 0.39–0.07 | 40–0 |
| 1231 | 40 | 60.0 ± 20.0 | 0.56 ± 0.03 | 0.62–0.48 | 40–6 |
| 829 | 40 | 32.5 ± 7.5 | 0.46 ± 0.10 | 0.90–0.32 | 53–18 |
| 856 | 40 | 55.0 ± 25.0 | 0.50 ± 0.08 | 0.70–0.21 | 38–0 |
| 114 | 40 | 26.3 ± 5.3 | 0.27 ± 0.06 | 0.63–0.15 | 43–0 |
| 516 | 40 | 90.0 ± 10.0 | 0.47 ± 0.06 | 0.74–0.25 | 42–0 |
| 962 | 40 | 95.0 ± 5.0 | 0.31 ± 0.03 | 0.51–0.21 | 38–0 |
| 1042 | 40 | 42.5 ± 7.5 | 0.54 ± 0.09 | 0.76–0.14 | 36–0 |
| 158 | 40 | 75.0 ± 5.0 | 0.19 ± 0.06 | 0.39–0.02 | 0 |
| 835 | 40 | 57.5 ± 42.5 | 0.47 ± 0.03 | 0.54–0.36 | 0 |
| 107 | 39 | 20.5 ± 0.5 | 0.11 ± 0.02 | 0.18–0.07 | 0 |
Цитологический и цитогенетический анализ культуры клеток
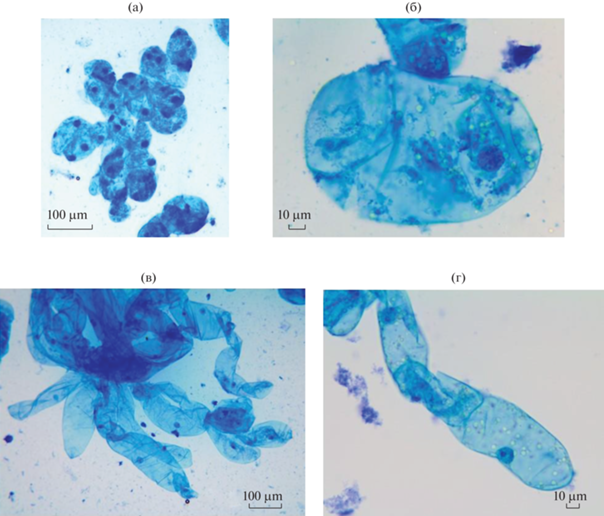
Цитологическое исследование культуры клеток P. sylvestris показало, что в светлом и светло-коричневом каллусе имелось два типа клеток – округлые, меристематического типа (рис. 1а, б) и вытянутые, паренхимного типа (рис. 1в, д), в которых отчетливо просматривалось ядро.
Рис. 1.
Развитие соматических клеток Pinus sylvestris в культуре in vitro: а, б – округлые клетки светлого каллуса; в, г – вытянутые клетки светлого каллуса.
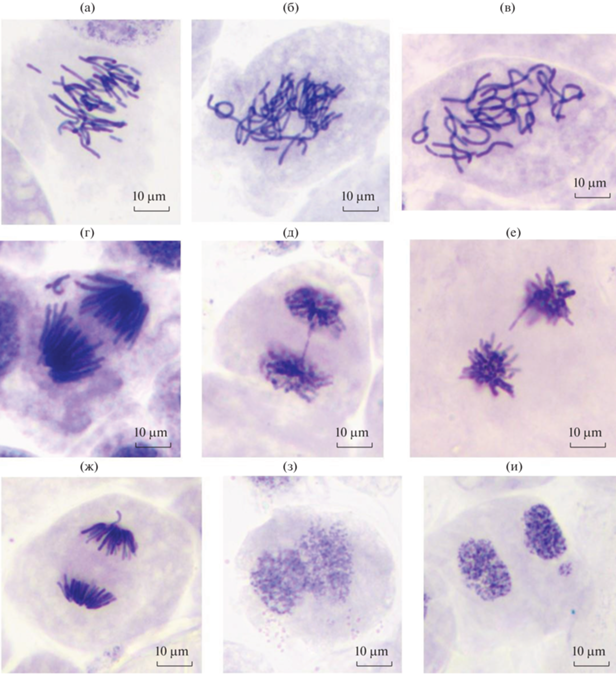
В результате цитогенетического анализа (через 30 дней культивирования) выявлено, что среднее число пролиферирующих клеток на стадиях метафазы и ана-телофазы было значимо выше в светлом каллусе по сравнению с темным и составляло 66.5 ± 11.1 и 15.0 ± 5.8 шт. на препарат (Р < 0.0005), соответственно. Исследование митоза в культуре in vitro показало, что частота аберрантных клеток не превышала 4.2% и в среднем была равна 2.6 ± 0.3%. На стадии метафазы нарушения наблюдали редко (14% от общего числа аберрантных клеток). Спектр патологий на данной стадии митоза состоял из забегания хромосом (отдельные хромосомы опережают остальные при движении к полюсу), фрагментации и обособления хромосом, К-митоза (остановка деления клетки) и сложных (несколько типов патологий встречаются одновременно) нарушений (рис. 2). В ана-телофозе наиболее часто встречали забегание хромосом (76%) и мосты (11%) (рис. 3). Также в клетках изредка наблюдали прямое деление ядра – амитоз (рис. 2). В рамках исследования в интерфазных клетках регистрировали микроядра, которые в большинстве случаев имели небольшой размер и округлую форму. В среднем, доля клеток с микроядрами составляла 0.1 ± 0.03% от общего числа изученных клеток на данной стадии. Важно отметить, что микроядра были зафиксированы также на стадии телофазы митоза (рис. 2).
Рис. 2.
Патологии митоза в клетках каллуса Pinus sylvestris: а – фрагментация в метафазе; б – сложное нарушение в метафазе (кольцевая хромосома, обособление и фрагментация хромосом); в – К-митоз в метафазе; г – обособление хромосомы в анафазе; д – мост в телофазе; е – отставание в анафазе; ж – забегание в анафазе; з – амитоз; и – микроядро в телофазе.
Изменение активности ферментов при потемнении каллуса
Ряд исследователей, изучая процессы потемнения в культуре клеток in vitro у растений, разделяют каллусы по морфологическим признакам на группы. Считается, что особенности метаболических процессов в каллусе внешне могут проявляться в его цвете: белый, оттенки желтого, зеленого, светло-коричневого и в конечном итоге – полностью коричневый [24]. Часто каллусы разного цвета могут отличаться и структурой: рыхлые и хрупкие, плотные с компактной структурой [25]. На основании активности ферментов, с использованием кластерного анализа, каллусы разделили на четыре группы. Оказалось, что в первую группу попали светлые каллусы (рис. 4а), в четвертую – наиболее темные каллусы (рис. 4г), а вторая и третья группы были промежуточными по степени потемнения между первой и четвертой (рис. 4б, в).
Рис. 4.
Внешний вид каллусов первой, второй, третьей и четвертой групп, выделенных в соответствии с проведенным кластерным анализом.

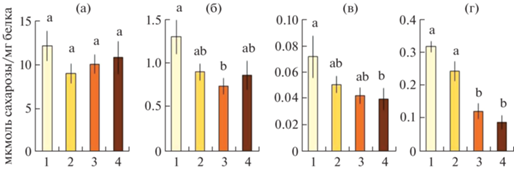
У каллусов из разных групп не обнаружено достоверных отличий в активности АпИнв – в среднем ее значение составило 10.5 мкмоль сахарозы/мг белка (рис. 5а). Активность растворимой формы кислой инвертазы ВакИнв снижалась в 1.5–1.7 раз при потемнении каллуса. Достоверные отличия обнаружены между первой и третьей группами каллусов (рис. 5б). В светлом каллусе наблюдали также более высокую активность цитоплазматических ферментов, метаболизирующих сахарозу. Активность ЦитИнв в светлом каллусе превосходила таковую в темном в 1.8 раз (рис. 5в). Активность СС у групп варьировала от 0.1 до 0.3 мкмоль сахарозы/мг белка. При этом активность СС в первой и второй группах была значимо выше, чем в третьей (в 2.2 и 2.3 раза, соответственно) и четвертой (в 4.1 и 4.2 раза, соответственно) группах (рис. 5г).
Рис. 5.
Активность апопластной (а), вакуолярной (б), цитоплазматической (с) инвертазы и сахарозосинтазы (д) в каллусе Pinus sylvestris после 30 сут. культивирования. Цифрами 1–4 по оси абсцисс обозначены группы каллусов: для первой группы n = 20, для второй n = 4, для третьей n = 25, для четвертой n = 9. Представлены средние значения и их стандартные ошибки, обозначенные барами; латинские буквы указывают на значимые отличия.
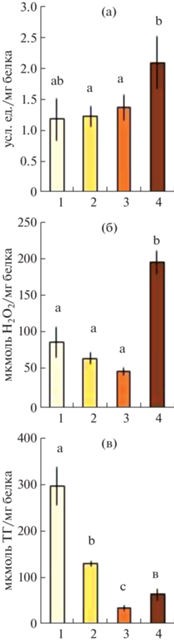
При потемнении каллусов активность СОД повышалась. Самая высокая активность СОД наблюдалась в четвертой группе (2.1 усл. ед./мг белка), а самая низкая – в первой и во второй (1.2 усл. ед./мг белка) (рис. 6а). В самом темном каллусе четвертой группы наблюдали и самую высокую активность КАТ (196 мкмоль H2O2/мг белка). В светлом каллусе (первая группа) и каллусе, занимающем промежуточное положение (вторая и третья группы), активность КАТ была меньше в 2.2, 2.9 и 4 раза, соответственно (рис. 6б). Активность ПО снизилась в 2.3 раза в каллусе, проявляющем первые признаки потемнения (вторая группа) по сравнению со светлым каллусом (первая группа). Именно в первой группе ее значения были максимальными (297 мкмоль ТГ/мг белка). При дальнейшем потемнении каллуса (третья и четвертая группы) активность ПО существенно снижалась по сравнению с первой группой – в 7.8 и в 4.6 раз, соответственно (рис. 6в).
Рис. 6.
Активность супероксиддисмутазы (а), каталазы (б) и пероксидазы (в) в каллусе Pinus sylvestris после 30 сут. культивирования. Цифрами 1–4 по оси абсцисс обозначены группы каллусов: для первой группы n = 20, для второй n = 4, для третьей n = 25, для четвертой n = 9. Представлены средние значения и их стандартные ошибки, обозначенные барами; латинские буквы указывают на значимые отличия.
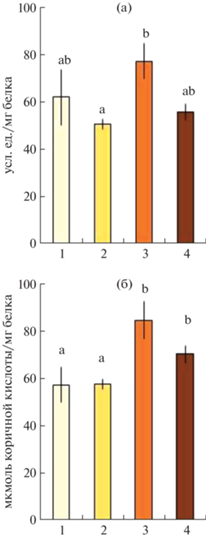
Активность ПФО несколько снижалась на начальных стадиях потемнения каллуса, затем возрастала, достигнув своего максимума в третьей группе – 78 усл. ед./мг белка. Между третьей и четвертой группой значимых отличий обнаружено не было (рис. 7а). Активность ФАЛ, аналогично активности ПФО, также возрастала от первой к третьей группе каллусов, достигнув в третьей группе своего максимума – 85 мкмоль коричной кислоты/мг белка. Между третьей и четвертой группой значимых отличий обнаружено не было (рис. 7б).
Рис. 7.
Активность полифенолоксидазы (а) и фенилаланинаммиаклиазы (б) в каллусе Pinus sylvestris после 30 сут. культивирования. Цифрами 1–4 по оси абсцисс обозначены группы каллусов: для первой группы n = 20, для второй – n = 4, для третьей – n = 25, для четвертой – n = 9. Представлены средние значения и их стандартные ошибки, обозначенные барами; латинские буквы указывают на значимые отличия.
Из полученных данных видно, что изучаемые ферменты работают комплексно. Сильная положительная корреляция обнаружена между активностью ФАЛ – ПФО (r = 0.84, P = 2 × 10–16). Между активностью СС – ПО (r = 0.51, P = 0.0004), СС – ЦитИнв (r = 0.45, P = 0.0005), СОД – КАТ (r = = 0.47, P = 0.0003) обнаружена положительная корреляция средней силы. Также положительно коррелировала активность ПО – ВакИнв (r = 0.35, P = 0.007) и ПО – ЦитИнв (r = 0.34, P = 0.008). Отрицательная корреляция обнаружена между активностью ПО – ФАЛ (r = –0.40, P = 0.002), ПО – ПФО (r = –0.27, P = 0.04), СС – СОД (r = –0.33, P = 0.01), СС – КАТ (r = –0.29, P = 0.03), СС – ФАЛ (r = –0.29, P = 0.03).
ОБСУЖДЕНИЕ
Проведенная нами биометрическая оценка каллуса P. sylvestris по ряду показателей позволила выделить деревья-доноры с высокой каллусообразующей способностью. Несмотря на широкий диапазон значений частоты инициации образования каллуса (15–100%), экспланты от всех исследуемых деревьев были способны к каллусообразованию. Масса образованного каллуса – важный показатель, указывающий на активность ростовых процессов. Не менее важным параметром является доля светлого каллуса. Высокие значения этих показателей указывают на генотипы, которые, вероятно, способны к длительному культивированию. Возможность использования каллусообразующей способности в качестве характеристики генотипа была продемонстрирована для Pinus sibirica, где в качестве эксплантов использовали почки и хвою [11]. Среди 32 проанализированных деревьев (16 генотипов, представленных двумя клонами), мы можем выделить два генотипа (1025 и 1026), которые отличаются от остальных деревьев по совокупности проанализированных параметров и, вероятно, обладают высоким репродуктивным потенциалом. В дальнейшем мы предполагаем использовать эти генотипы при получении соматических зародышей в культуре in vitro.
Анализ митоза в каллусе показал, что доля аберрантных клеток не превышает нормы спонтанного мутирования для P. sylvestris – 5% [26]. При сравнении полученных данных с результатами цитогенетической оценки семенного потомства деревьев P. sylvestris с Петрозаводской ЛСП I порядка [27] установлено, что частота патологий митоза была незначительно выше в культуре in vitro. Однако в клетках каллуса спектр нарушений на стадии метафазы был шире, а в ана-телофазе митоза доля клеток с мостами увеличилась в два раза, что может свидетельствовать об адаптации клеток к воздействию стрессовых условий in vitro за счет увеличения репарационных способностей [26]. Похожие закономерности описаны в ряде работ при изучении цитогенетических параметров в корневой меристеме семенного потомства P. sylvestris [21, 26]. Наличие прямого деления ядра может также указывать на стрессовое воздействие искусственных условий (высокие концентрации в питательной среде фитогормонов, макро- и микроэлементов, наличие антибиотиков и т.д.) на популяцию клеток. Цитогенетическое исследование длительно пролиферирующих эмбриогенных клеточных линий Larix sibirica показало существенное превышение уровня естественного мутагенеза, при этом патологии, связанные с повреждением хромосом (мосты, фрагментация, агглютинация), наблюдались редко [10].
Маркером начала соматического эмбриогенеза у хвойных растений является растяжение соматических клеток в длину [9]. Далее вытянутые клетки подвергаются асимметричному делению, что сходно с зиготическим эмбриогенезом у растений [8]. В результате цитологического исследования культуры клеток in vitro, полученных из вегетативных почек P. sylvestris, было установлено, что на 30 сутки культивирования каллус состоял как из изодиаметрических клеток, так и потенциально эмбриогенных длинных вакуолизированных клеток. Стоит отметить, что наличие таких клеток не всегда обеспечивает развитие эмбриогенного каллуса. Так, например, в результате цитологической оценки каллуса, полученного из соматических зародышей P. sibirica, было установлено, что образовавшиеся в культуре in vitro к концу инициации длинные клетки не изменялись [8]. При дальнейшем культивировании такие каллусы оставались неэмбриогенными и постепенно отмирали. Эмбриогенный каллус от неэмбриогенного можно отличить на основе морфологии и цвета [7]. Так, оцененные визуально как беловатые, полупрозрачные и мягкие каллусы P. sylvestris по данным цитологического анализа, в большинстве случаев, являлись неэмбриогенными [9]. Мы выявили каллусы (генотип 1025), которые на протяжении всего эксперимента оставались светлыми и состояли из различных типов клеток, что может указывать на их способность к дальнейшему развитию.
После 30 дней культивирования в каллусной ткани, предварительно разделив ее на светлую и темную части, определяли активность ферментов. Разделение каллусной ткани с использованием кластерного анализа на группы на основании активности ферментов привело к тому, что каллусы с одного генотипа и/или с одного клона, и/или даже с одного экспланта, оказались в разных группах: в первой – только белая, в четвертой – только темная, во второй и третьей группах встречалась каллусная ткань разного цвета. Потемнение каллуса сопровождалось снижением утилизации сахарозы в цитоплазме с участием ЦитИнв и СС, что свидетельствует о снижении синтетических процессов. Следует отметить, что для цитоплазматических ферментов обнаружена положительная корреляция в изменении их активности в процессе потемненения каллуса. Активность АпИнв поддерживалась на постоянном уровне, поставляя продукты – глюкозу и фруктозу – для дальнейших превращений. Гексозы, образующиеся при метаболизации сахарозы АпИнв, вовлекаются в гликолиз, пентозофосфатный путь, цикл Кребса, что приводит к образованию АФК и синтезу веществ фенольной природы [28–30]. Считается, что НАДН-дегидрогеназы в митохондриях и НАДФН-оксидазы плазматической мембраны являются основными источниками супероксид анион-радикала в растительной клетке [31]. СОД запускает реакцию нейтрализации супероксидного радикала с образованием перекиси водорода. Известно, что контролируемые количества перекиси водорода необходимы для поддержания последующих делений клеток и нормального состояния клеточных стенок [32]. Поддержание баланса между супероксидными радикалами и перекисью водорода происходит за счет согласованной работы СОД, КАТ и ПО [30, 33, 34]. Мы обнаружили, что потемнение каллуса сопровождалось существенным снижением активности ПО; более того, это единственный из изученных ферментов, активность которого достоверно отличалась у четырех групп каллусов. Баланс между клеточной пролиферацией и дифференцировкой – ключевой аспект развития многоклеточного организма. На примере апикальных меристем корня Arabidopsis выявлен фактор транскрипции UPBEAT1 (UPB1), который, регулируя экспрессию изоформ ПО, поддерживает баланс супероксидный радикал/перекись водорода между зонами пролиферации и дифференциации клеток [35]. На основании данных литературы и наших исследований, изменение активности ПО, вероятно, можно рассматривать как маркер снижения пролиферации каллусной ткани и начальных этапов ее потемнения. Однако данное предположение нуждается в экспериментальных подтверждениях. Возрастание активности КАТ происходило только в четвертой группе каллуса, что может быть связано с существенным возрастанием перекиси водорода в самом темном каллусе. Известно, что для КАТ, в отличие от ПО, характерно низкое сродство к перекиси водорода, и ее активность усиливается при существенном возрастании последней [36]. Между СОД и КАТ выявлена положительная корреляция, активность СОД также увеличивалась только в самом темном каллусе.
Обнаружено, что при потемнении каллуса возрастает активность ФАЛ – ключевого фермента фенилпропаноидного пути. Известно, что активность ФАЛ в каллусной ткани может зависеть от присутствия углеводов, что показано на древесных растениях [37]. В четвертой группе каллуса, несмотря на снижение активности цитоплазматических ферментов, метаболизация сахарозы в апопласте не отличалась от таковой у каллуса первой–третьей групп и, вероятно, могла в достаточном количестве обеспечивать субстратами шикиматный путь. ФАЛ, в свою очередь, образуя из фенилаланина транс-коричную кислоту – предшественницу большинства фенольных соединений [15], поставляет субстраты для реакций ПО и ПФО. Но если для ПО основным субстратом является перекись водорода, а фенольные соединения – доноры водорода для реакции [38], то для ПФО – сами фенольные соединения. ПФО катализирует реакцию окисления фенолов в присутствии кислорода до хинонов, ее высокая активность вызывает быстрое потемнение тканей [1].
Отметим, что наибольшее возрастание активности ФАЛ, ПФО и одновременное снижение активности ПО происходило от первой к третьей группе каллусов. Между третьей и четвертой группами статистически значимых изменений в активности данных ферментов не наблюдали. Известно, что в различных растительных тканях активность ФАЛ (катализирующей реакцию образования транс-коричной кислоты – предшественницы субстратов фенольной природы для ПО и ПФО) может возрастать до некоторого пикового уровня в зависимости от времени и физиологического состояния ткани [39]. Можно предположить, что в четвертой группе (темная каллусная ткань) преобладают процессы дегенерации тканей [2, 3, 40]: клетки отмирают, а степень потемнения возрастает [4]. С этим согласуются и полученные нами данные цитологического анализа – присутствие в темном каллусе в основном удлиненных клеток, в которых отсутствовало ядро.
Обобщая, отметим главное: выполнено комплексное исследование по биометрическим, цитогенетическим и биохимическим показателям каллусных культур P. sylvestris в процессе их потемнения. Показано, что активность ферментов АОС и углеводного обмена может служить биохимическими маркерами перехода к стадии потемнения каллусных культур. Вопрос поиска различных индикаторов смены стадий развития актуален, особенно при работе с клеточными культурами сосны. Дальнейшие исследования в этом направлении могут включать как поиск “успешных” генотипов, каллусные культуры которых длительно пролиферируют и не темнеют, так и попытки регулирования активности изученных ферментов добавлением в питательную среду субстратов/низкомолекулярных антиокcидантов и т.д., предотвращая, тем самым, потемнение каллуса.
Авторы выражают благодарность сотрудникам лаборатории биотехнологии растений Отдела комплексных научных исследований Карельского научного центра Российской академии наук, а также лично д.с.-х.н., заведующему лабораторией лесных биотехнологий Института леса Карельского научного центра Российской академии наук Б. В. Раевскому за помощь в сборе полевого материала.
Работа выполнена за счет средств федерального бюджета по государственному заданию Карельского научного центра Российской академии наук (Институт леса Карельского научного центра Российской академии наук и Отдел комплексных научных исследований Карельского научного центра Российской академии наук).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.