ВВЕДЕНИЕ
Спектроскопия гигантского комбинационного рассеяния (ГКР, SERS, surface-enhanced Raman scattering) – высокочувствительный метод определения молекулярных веществ, основанный на усилении интенсивности рамановского рассеяния на границах раздела металла и диэлектрика [1, 2]. Помимо усиления интенсивности рамановского рассеяния происходит усиление сигнала флуоресценции (SEF, surface-enhanced fluorescence) [3, 4]. Многократное усиление сигнала может быть использовано для создания биосенсоров с ультранизкими пределами обнаружения аналитов [5–10]. Специфичность биосенсоров и предел обнаружения аналитов значительно увеличиваются в вариантах с введением раман-активных меток или флуорофоров [6, 8]. Безметочные методы уступают вариантам с введением меток из-за схожести химической структуры аналитов со структурами других компонентов биологических жидкостей: например, белки состоят из одних и тех же аминокислот, соединенных в разной последовательности, а нуклеиновые кислоты – из ограниченного количества нуклеотидов. Спектральные методы не позволяют дискриминировать последовательность, в которой соединены аминокислоты и нуклеотиды в макромолекулах. В настоящее время значительное количество работ направлено на использование антител и аптамеров, которые узнают эпитоп поверхности биомолекулы, в SERS- и SEF-биосенсорах [6, 11, 12]. Аптамеры более технологичны по сравнению с антителами, поскольку их синтез дешевле, есть возможность введения разнообразных модификаций, их структуре не свойственна необратимая денатурация [13, 14].
Сравнение работоспособности сенсоров в биологических жидкостях, например, в плазме крови, показало, что требуется разбавление растворов для снижения уровня неспецифической сорбции на поверхность сенсоров [15]. Использование мембранной фильтрации снижает предел обнаружения вируса гриппа А с 1.7 РГА/мл до 2.2 · 10–5 РГА/мл [16] (РГА – единицы реакции гемагглютинации, отражающие способность вируса взаимодействовать с клетками).
В литературе описаны способы создания пористых поверхностей, на основе которых конструируются оптические сенсоры, работающие на эффектах SERS/SEF [17]. Поры могут выступать в роли концентраторов, которые пропускают анализируемую жидкость на поверхность сенсора [18, 19] или в качестве проточного SERS-чипа, в котором одновременно реализуется две функции – фильтрация и усиление оптического сигнала [20].
В данной работе предложен биосенсор на основе трековой мембраны с нанесенными наночастицами металлов для определения вирусов гриппа А и Б с использованием аптамеров для специфической адсорбции вирусов на поверхности мембраны и их мечения раман-активными и флуоресцентными красителями.
МАТЕРИАЛЫ И МЕТОДЫ
Неорганические соли приобретены в Sigma-Aldrich (США). Органические растворители были приобретены в MP Biomedicals (Франция). ДНК-аптамеры, модифицированные тиолом, (RHA0385-SH, (SH-dT)-5'-ttg3ttat4g3ag3cg5tt-3', и BV42-SH, SH-5'-aacgctcactc5aagaagaac22agtgagcgtt-3'), аминогруппой (RHA0385-амино, NH2-5'-ttg3ttat4g3ag3cg5tt-3') и Cyanine-3 (RHA0385-Су3, Су3-5'-ttg3ttat4g3ag3cg5tt-3', и BV42-Cy3, Су3-5'-aacgctcactc5aagaagaac22agtgagcgtt-3') синтезированы ООО Синтол (Россия). Малахитовый зеленый изотиоцианат приобретен у Thermo Fisher Scientific (США). Все растворы приготовлены в ультрачистой воде (удельное сопротивление менее 18.2 МОм · см).
Инактивированные вирусы
Вирус гриппа А подтипа H5N1 (A/chicken/Kurgan/3654-at/2005), вирус гриппа А подтипа H7N1 (A/chicken/Rostock/45/1934), вирус гриппа Б (B/Victoria/2/1987) и вирус болезни Ньюкасла были выращены в аллантоисной полости 10-дневных куриных яиц. Яйца инкубировались при 37°C, охлаждались до 4°C через 48 ч после инфицирования, и аллантоисная жидкость собиралась через 16 ч. Вируссодержащие аллантоисные жидкости были инактивированы путем добавления 0.05 об. % глутарового альдегида и законсервированы путем добавления 0.03 мас. % NaN3 и хранились при +4°C. Титр вирусов определяли с помощью реакции гемагглютинации (РГА) с использованием 0.5% суспензии куриных эритроцитов в 0.14 М NaCl. За значение титра РГА в пробе принималось максимальное разведение вируса, при котором наблюдается положительный результат агглютинации эритроцитов.
SERS-мембраны
На поверхность трековых мембран из полиэтилентерефталата (средний диаметр пор на поверхности 0.36 мкм, плотность пор составляла 2.6 · 108 см–2, мембраны получены в Лаборатории ядерных реакций им. Г.Н. Флерова ОИЯИ [21]) с использованием системы вакуумного термического напыления NANO 38 (Kurt J. Lesker Company, США) с автоматическим контролем толщины напылялись слои металлов (либо Ag толщиной 8 нм, либо комбинация Cr толщиной 1 нм и Ag толщиной 8 нм) при давлении в камере 8 ⋅ 10–7 Торр со скоростью напыления 0.4 Å/c. Затем проводилось нагревание мембраны на плитке HP-20D-Set (Daihan Scientific, Южная Корея) при температуре 120°C в течение 6 мин.
Синтез аптамера, модифицированного малахитовым зеленым
Раствор буры Na2B4O7·10H2O готовили растворением навески 1.9 г в 50 мл воды. 10 мг изоцианата малахитового зеленого растворили в 560 мкл диметилсульфоксида. Затем 14 мкл изоцианата малахитового зеленого смешивали с 7 мкл воды, 75 мкл раствора буры и 4 мкл 3 мМ раствора RHA0385-амино. После 18 ч инкубации при комнатной температуре меченый аптамер был отделен от непрореагировавшей краски центрифугированием с помощью колонки Vivaspin 500 с отсечкой по молекулярной массе 3000 а. е. м. (Sartorius, Великобритания) при 12 000 об./мин в течение 10 мин. Для промывки аптамера было добавлено 30 мкл 40% этилового спирта с последующим центрифугированием при 12 000 об./мин в течение 10 мин. Затем было добавлено 70 мкл изопропилового спирта с последующим центрифугированием при 12 000 об./мин в течение 10 мин. К оставшейся жидкости с осадком было добавлено 50 мкл изопропанола и 50 мкл воды. Конечная концентрация аптамера, модифицированного малахитовым зеленым (RHA0385-MG) – 80 мкМ.
SERS-сенсор для определения вируса гриппа А на мембранах, не допированных хромом
Для образования активной конформации аптамеры в концентрации 2 мкМ в буфере 1 (10 мМ трис-HCl, 10 мМ KNO3, 140 мМ NaNO3) нагревали 5 мин при 95°C и охлаждали при комнатной температуре. Вируссодержащую аллантоисную жидкость разбавляли в 1000 раз буфером 1 и добавляли RHA0385-MG (конечная концентрация 2.5 нМ). Аптамер RHA0385 специфически взаимодействует с вирусом гриппа А, не связываюсь с вирусами гриппа Б и болезни Ньюкасла [9, 22, 23]. После 5 мин инкубации смесь пропускали через мембрану с SERS-активным покрытием. Фрагмент мембраны диаметром 2 мм помещали на дно блока центробежной фильтрации центрифужной пробирки с ацетат-целлюлозной мембраной с размером пор 0.45 мкм. В экспериментах по модификации мембран аптамером, образцы были предварительно выдержаны в 20 нМ растворе RHA0385-SH в течение 5 мин. Затем 200 мкл образца вируссодержащей жидкости с RHA0385-MG центрифугировали через мембрану при 2400 об./мин 2 мин. Измерения сигнала SERS проводились в течение 8 с (10 повторов) с использованием рамановского спектрометра RamanLife RL532 SERS (ООО “ФОТОН-БИО”, РФ) с лазерным излучением с длиной волны 532 нм.
SERS-сенсор для определения вирусов гриппа А на мембранах, допированных хромом
Для образования активной конформации аптамеры в концентрации 2 мкМ в фосфатном буфере PBS нагревали 5 мин при 95°C и охлаждали при комнатной температуре. Вируссодержащую аллантоисную жидкость разбавляли в 20 ⋅ 109 раз PBS и добавляли RHA0385-Cy3 (конечная концентрация 200 нМ). После 5 мин инкубации смесь пропускали через мембрану с SERS-активным покрытием, предварительно выдержанную в 200 нМ растворе RHA0385-SH в течение 15 мин. Фрагмент мембраны диаметром 2 мм помещали на дно блока центробежной фильтрации центрифужной пробирки с ацетат-целлюлозной мембраной с размером пор 0.45 мкм. Затем 200 мкл образца вируссодержащей жидкости с RHA0385-Cy3, центрифугировали через мембрану при 2400 об./мин 2 мин. Измерения сигнала SERS проводились в течение 0.4 с (20 повторов) с использованием рамановского спектрометра RamanLife RL532 SERS (ООО “ФОТОН-БИО”, РФ) с лазерным излучением с длиной волны 532 нм.
SERS-сенсор для определения вирусов гриппа Б на мембранах, допированных хромом
Для образования активной конформации аптамеры в концентрации 2 мкМ в буфере 1 нагревали 5 мин при 95°C и охлаждали при комнатной температуре. Вируссодержащую аллантоисную жидкость разбавляли в 20 ⋅ 109 раз буфером 1 и добавляли BV42-Cy3 (конечная концентрация 200 нМ). Аптамер BV42 связывается как с вирусами гриппа А, так и с вирусами гриппа Б, обладая стуктурой i-мотива [24, 25]. После 5 мин инкубации смесь пропускали через мембрану с SERS-активным покрытием, предварительно выдержанную в 20 нМ растворе BV42-SH в течение 15 мин. Фрагмент мембраны диаметром 2 мм помещали на дно блока центробежной фильтрации центрифужной пробирки с ацетат-целлюлозной мембраной с размером пор 0.45 мкм. Затем 200 мкл образца вируссодержащей жидкости с BV42-Cy3, центрифугировали через мембрану при 2400 об./мин 2 мин. Измерения сигнала SERS проводились в течение 0.4 с (20 повторов) с использованием рамановского спектрометра RamanLife RL532 SERS (ООО “ФОТОН-БИО”, РФ) с лазерным излучением с длиной волны 532 нм.
Сканирующая электронная микроскопия
Сканирующую электронную микроскопию (СЭМ) проводили с помощью микроскопа SU 8020, оснащенного холодным полевым катодом (Hitachi, Япония). Чтобы улучшить разрешение и контрастность изображений, на образцы наносился слой сплава золото-палладий толщиной 5 нм. Некоторые изображения были сделаны без распыления проводящих металлических слоев.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
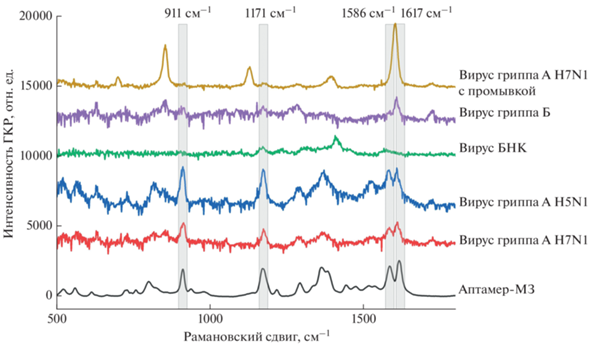
Мембраны из полиэтилентерефталата, покрытые наноструктурированным слоем серебра были описаны ранее в качестве поверхностей, усиливающих сигнал рамановского рассеяния [26]. В наших экспериментах мембраны позволяли увидеть SERS-спектр метки аптамера (малахитового зеленого) при достаточно низких концентрациях красителя – 2.5 нМ. Сигнал появлялся в образцах с вирусами гриппа А разных подтипов (H5N1 и H7N1), которые узнаются аптамером RHA0385-MG, и отсутствовал в образцах контрольных вирусов – вирусов гриппа Б и болезни Ньюкасла (рис. 1). При этом спектр малахитового зеленого отсутствовал при попытке сборки тройного комплекса RHA0385-SH – вирус гриппа А – RHA0385-MG.
Рис. 1.
SERS-спектры мембран с SERS-активным покрытием в присутствие вирусов гриппа А (подтипы H5N1 и H7N1), гриппа Б и болезни Ньюкасла (БНК), а также контрольные спектры мембраны с промывкой и аптамера RHA0385-MG.
По данным сканирующей электронной микроскопии наноструктурированная поверхность на мембране претерпевает значительные изменения при взаимодействии с биологической жидкостью (разбавленной аллантоисной жидкостью). Обработка поверхности аптамером RHA0385-SH не изменяет ее геометрию, но усиливает изменения при фильтрации биологической жидкости, приводя к полному снятию наноструктурированного слоя вирусом гриппа А (рис. 2). В отсутствие тиомодифицированного аптамера наноструктурированная поверхность нарушена, дополнительный этап промывки мембраны буфером смывает остатки слоя, при этом исчезает спектр малахитового зеленого и появляется спектр материала мембраны – полиэтелентерефталата.
Рис. 2.
Сканирующая электронная микроскопия образцов мембраны со слоем наноструктурированного серебра после фильтрации смеси вируса гриппа А H7N1 и RHA0385-MG (а), мембраны, предварительно обработанной RHA0385-SH с последующей фильтрацией смеси вируса гриппа А H7N1 и RHA0385-MG (б), исходной мембраны, обработанной RHA0385-SH без последующей фильтрации (в), мембраны, предварительно обработанной RHA0385-SH с последующей фильтрацией смеси неспецифического вируса (вируса болезни Ньюкасла) и RHA0385-MG (г).

Для увеличения стабильности наноструктурированного слоя был добавлен этап напыления хрома, что создает допированный хромом слой наночастиц серебра, с увеличенной адгезией к поверхности мембраны. Новый вариант мембраны стабильнее: покрытие сохраняется в присутствии биологических жидкостей и вируса гриппа А, в том числе, при модификации поверхности аптамером RHA0285-SH (рис. 3).
Рис. 3.
Сканирующая электронная микроскопия образцов мембраны со слоем наноструктурированного серебра с допированием хромом, предварительно обработанной RHA0385-SH с последующей фильтрацией смеси RHA0385-Cy3 с: буфером без биологической жидкости (а); вирусом гриппа А H7N1 в концентрации 3.7 · 1010 (б), 2.4 · 104 (в) и 3.8 · · 103 частиц/мл (г).

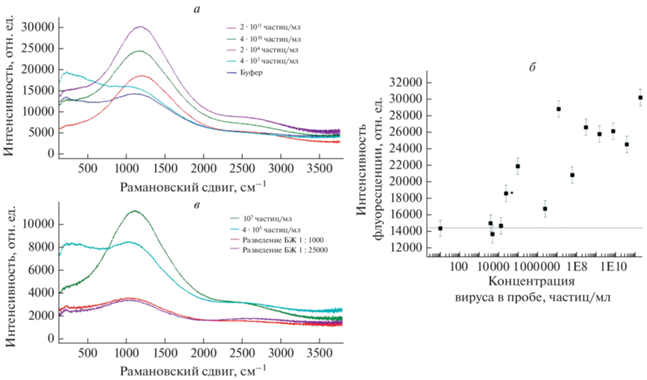
Стабилизация покрытия снизила интенсивность рамановских спектров как в случае бинарных (вирус гриппа А – RHA0285-метка), так и тройных комплексов RHA0385-SH – вирус гриппа А – RHA0385-метка. В данном случае динамичное покрытие было важным для усиления сигнала, возможно, за счет образования слоя наночастиц на поверхности вируса. Покрытие, допированное хромом, обладает эффектом усиления флуоресценции, например флуоресценции красителя Cyanine-3 (рис. 4), что было использовано для создания сенсоров. Была получена зависимость интенсивности флуоресценции от концентрации вируса с характерным увеличением сигнала в диапазоне концентраций вируса от 2 · 104 до 2 · 1011 частиц/мл. Предел обнаружения данного сенсора – 2 · 104 частиц/мл – превосходит тест-системы экспресс-анализа на основе антител (1 · 106–4 · 108 частиц/мл), но уступает методу ПЦР (3 · 102–1.2 · 103 частиц/мл) [27–29]. Низкий для тест-систем экспресс-анализа предел обнаружения и широкий диапазон определяемых количеств вируса гриппа А был достигнут благодаря использованию мембраны, которая удаляет значительную часть примесных биомолекул. Эффективность фильтрации вирусов гриппа А через полиэтилентерефталатную мембрану с таким же размером пор была оценена в нашей недавней работе, где показано, что SERS в коллоидных системах с образцами биологических жидкостей может быть улучшен за счет такой фильтрации [16].
Рис. 4.
Спектры флуоресценции образцов мембраны со слоем наноструктурированного серебра с допированием хромом, предварительно обработанной RHA0385-SH с последующей фильтрацией смеси RHA0385-Сy3 с разными концентрациями вируса гриппа А подтипа H7N1 (а). Зависимость флуоресцентного сигнала при 1180 см–1 от концентрации вируса гриппа А подтипа H7N1 (б). * Помечен наблюдаемый предел обнаружения вируса гриппа А. Спектры флуоресценции образцов мембраны со слоем наноструктурированного серебра с допированием хромом, предварительно обработанной BV42-SH с последующей фильтрацией смеси BV42-Сy3 с разными концентрациями вируса гриппа Б (в). В качестве контролей приведены спектры, полученные после фильтрации образцов биологической жидкости без вируса (БЖ), разбавленной идентично образцам с вирусом.
Для оценки возможности использования предложенной методики для других вирусов, был предложен сенсор для определения вируса гриппа Б. Сенсор сработал аналогичным образом: в присутствие вируса гриппа Б происходило увеличение флуоресценции по сравнению с биологической жидкостью без вируса (рис. 4в). Были определены титры вируса гриппа 107 и 4 · 105 частиц /мл. Таким образом, предложенный подход можно считать универсальным.
Исследование выполнено при поддержке Российского научного фонда (проект № 18-74-10019).