ЖЭТФ, 2019, том 156, вып. 3 (9), стр. 493-501
© 2019
ВЛИЯНИЕ ПРИМЕСЕЙ НА АДСОРБЦИОННЫЕ СВОЙСТВА
КИСЛОРОДА НА ПОВЕРХНОСТИ NiTi(110)
А. В. Бакулин*, С. Е. Кулькова
Институт физики прочности и материаловедения Сибирского отделения Российской академии наук
634055, Томск, Россия
Национальный исследовательский Томский государственный университет
634050, Томск, Россия
Поступила в редакцию 25 февраля 2019 г.,
после переработки 5 марта 2019 г.
Принята к публикации 5 марта 2019 г.
Методом проекционных присоединенных волн в рамках теории функционала электронной плотности изу-
чено влияние 3d-5d-элементов на энергию адсорбции кислорода на поверхности NiTi(110). Показано, что
практически все элементы за исключением нескольких элементов конца d-периодов, если они замещают
никель, ведут к увеличению энергии адсорбции, тогда как примеси замещения на титановой подрешетке,
наоборот, понижают эту энергию. На основе анализа электронных характеристик поверхности с приме-
сями установлено, что повышение/понижение энергии адсорбции кислорода на NiTi(110) коррелирует с
изменением ионного вклада в механизм связи кислорода с поверхностью.
DOI: 10.1134/S0044451019090128
оксидными слоями разной толщины и термодина-
мического анализа сделали вывод, что выход Ni на
поверхность сплава может быть предотвращен, если
1. ВВЕДЕНИЕ
она полностью окисляется. Известно, что титан при
Известно, что интерметаллические сплавы на ос-
взаимодействии с кислородом может образовывать
нове NiTi обладают уникальными механическими
на поверхности NiTi шкалу оксидов титана (Ti2O,
свойствами, среди которых эффект памяти формы
TiO, Ti2O3, Ti3O5, TiO2), которая зависит от спо-
и сверхпластичность. В этой связи они широко ис-
собов обработки поверхности [1]. В частности, в ра-
пользуются в различных отраслях современной ин-
боте [2] было показано, что в тонком оксидном слое
дустрии в качестве электрических переключателей,
с недостатком кислорода поверхностная сегрегация
соединительных элементов, предохранителей, теп-
никеля в основном осуществляется атомами, тогда
ловых датчиков, регуляторов температуры, антенн
как в толстых оксидных слоях — металлическими
для спутников и др. Штифты, различные фикса-
частицами. В нашей ранней работе [3] были изуче-
торы, дентальные и костные импланты, проволока
ны адсорбция кислорода на поверхности NiTi(110) и
из нитинола (название, полученное на основе сло-
атомная структура границы раздела сплав-оксид с
жения элементов сплава и лаборатории, где он был
использованием ab initio-метода, что позволило по-
получен) широко используются в медицине. Взаи-
лучить дополнительную информацию о сегрегации
модействие между материалом, из которого изго-
никеля. В частности, было показано, что в TiO об-
товлен имплант, и тканями человеческого организ-
разование одиночных дефектов Ni более предпочти-
ма является основной проблемой для медицинских
тельно, чем в TiO2, что подтверждает вывод, сде-
приложений. Считается, что биосовместимость NiTi
ланный в работе [2]. Кроме того, расчеты показа-
есть результат образования тонкой инертной плен-
ли существенное возрастание энергии формирова-
ки TiO2 на его поверхности, которая препятствует
ния дефекта в TiO2, что указывает на повышение
выходу никеля [1]. Авторы работы [2] на основе экс-
энергии активации никелевой диффузии в оксиде.
периментальных исследований проволок из NiTi с
В работе [4] рассматривались механизмы диффузии
никеля в NiTi и был сделан вывод о том, что вероят-
* E-mail: bakulin@ispms.tsc.ru
493
А. В. Бакулин, С. Е. Кулькова
ЖЭТФ, том 156, вып. 3 (9), 2019
ность диффузии никеля по собственной подрешетке
существенно возрастает при повышении температу-
Ti S
Ti S-1
ры, хотя шестипрыжковый механизм в направлении
Ni S
Ni S-1
[001] более предпочтителен при низких температу-
O
рах.
[001]
Улучшение биосовместимости и коррозионной
[110]
стойкости NiTi является важной задачей современ-
ного материаловедения. Последнее может быть до-
[110]
стигнуто модификацией поверхности сплава, по-
скольку только она или несколько поверхностных
слоев находятся в контакте с человеческими тка-
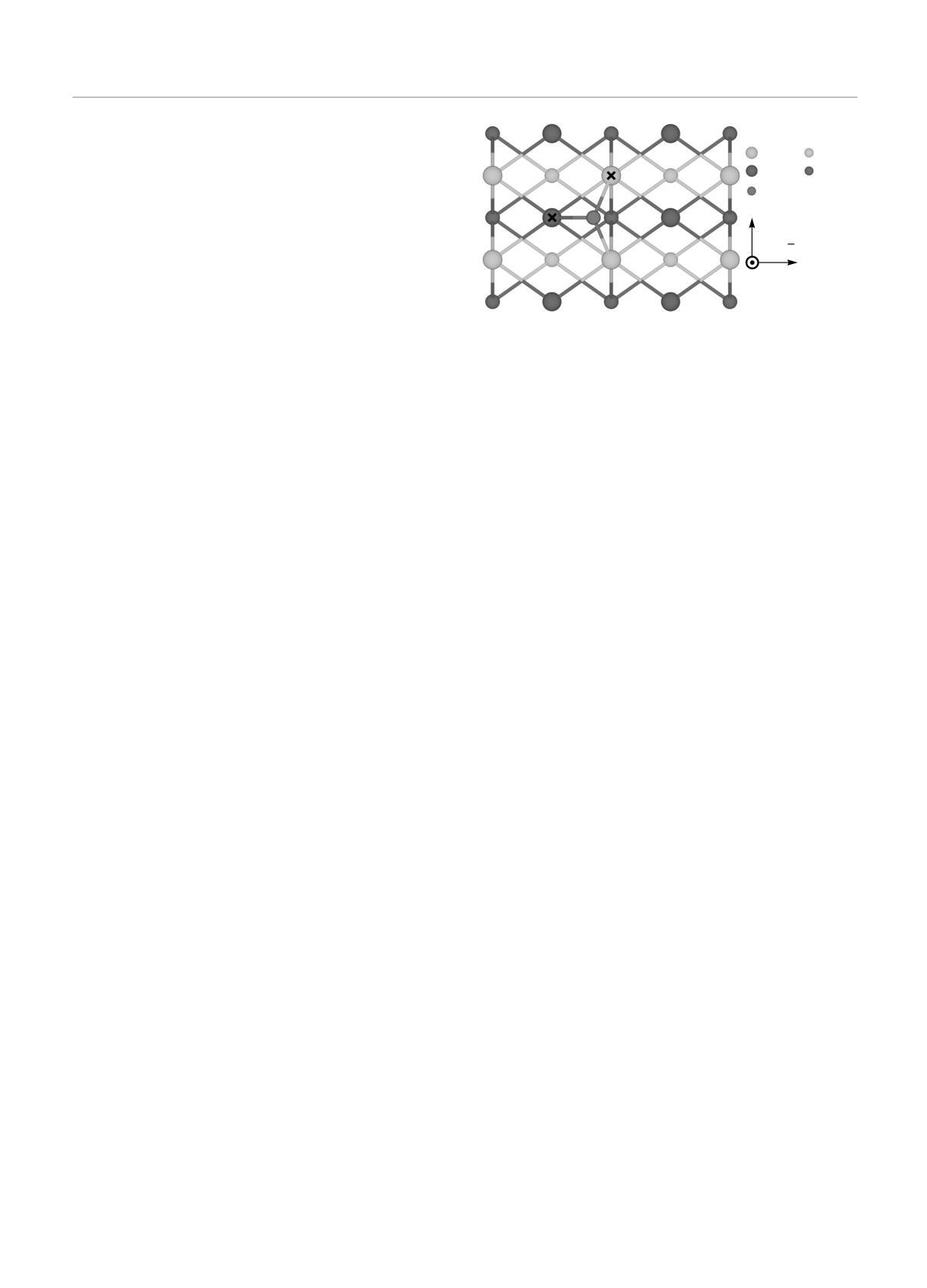
Рис. 1. (В цвете онлайн) Атомная структура поверхнос-
нями. Для модификации поверхности используют-
ти NiTi(110) с кислородом, адсорбированным в наиболее
ся магнетронное напыление и ионная импланта-
предпочтительной F1-позиции. Позиции примесного атома
ция биотолерантных химических элементов, кото-
на обеих подрешетках показаны крестиками
рые могут формировать тонкие покрытия на по-
верхности NiTi. Отметим, что легирование NiTi ис-
равна 600 эВ. Интегрирование по зоне Бриллюэна
пользуется также для управления мартенситным
при расчетах электронной структуры поверхности
превращением, с которым связан эффект памяти
NiTi(110)-(2 × 2) проводилось с использованием сет-
формы [5]. В то же время сегрегация примесей мо-
ки k-точек 5×5×1, полученной по схеме Монхорста -
жет существенно влиять на адсорбцию кислорода
Пака [11]. Отметим, что рассчитанный равновесный
на поверхности сплава, а также на стабильность и
параметр решетки B2-NiTi, равный a = 3.010Å, на-
прочность интерфейса TiO2/NiTi. Влияние приме-
ходится в хорошем согласии с экспериментальным
сей на адсорбцию кислорода на поверхности NiTi
значением 3.015Å [12].
и на адгезионные свойства границ раздела сплава
Энергия адсорбции атома кислорода рассчиты-
с оксидами и металлами практически не изучалось
валась по формуле
теоретическими методами. В этой связи целью на-
[
]
стоящей работы является сравнительное изучение
Eads = -1/2
EO/NiTiX - ENiTiX - EO2
,
(1)
влияния 3d-5d-элементов на адсорбцию кислорода
где EO/NiTiX и ENiTiX — полные энергии поверхнос-
на стехиометрической поверхности NiTi(110).
ти с кислородом и примесным атомом в поверхност-
ном слое и без кислорода, а EO2 — полная энергия
молекулы кислорода. Множитель 1/2 соответствует
2. МЕТОД РАСЧЕТА
адсорбции кислорода на двух поверхностях сплава.
Детали расчета адсорбции кислорода на чистой по-
Расчет атомной и электронной структур сте-
верхности приведены в работе [3].
хиометрической поверхности NiTi(110) с примеся-
ми в поверхностном слое и адсорбированным кис-
лородом проводился методом проекционных при-
3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
соединенных волн (PAW) в плоско-волновом бази-
се [6, 7], реализованным программным кодом VASP
Несколько слов необходимо сказать о результа-
[8, 9], с обобщенным градиентным приближением
тах расчета энергии адсорбции кислорода на чис-
для обменно-корреляционного функционала в фор-
той поверхности NiTi(110). Как было показано в
ме GGA-PBE [10]. Для моделирования поверхно-
нашей ранней работе [3], наиболее предпочтитель-
сти NiTi(110) использовался подход тонких пле-
ной позицией для адсорбции кислорода на поверхно-
нок, разделенных промежутком вакуума не менее
сти NiTi(110) является так называемая трехкратно
15Å. Число атомных слоев в пленке было равно
координированная F 1-позиция над треугольником,
11, при этом положения атомов трех внутренних
образованным двумя атомами титана и одним ато-
слоев фиксировались в позициях, соответствующих
мом никеля (рис. 1). Атом кислорода, помещенный
объемным, а атомы остальных слоев пленки могли
первоначально в мостиковую позицию между ато-
смещаться в трех направлениях. Релаксация атом-
мами титана и никеля, смещается при релаксации
ной структуры поверхности проводилась до дости-
в эту позицию. Отметим, что вывод о предпочти-
жения сил на атомах около 0.01 эВ/Å. Максималь-
тельности данной позиции отличается от получен-
ная энергия плоских волн из базисного набора была
ного ранее в работе [13]. В этой работе наиболее
494
ЖЭТФ, том 156, вып. 3 (9), 2019
Влияние примесей на адсорбционные свойства кислорода. . .
Eads, эВ
предпочтительной является мостиковая Ti-Ni-пози-
ция, поскольку атом кислорода лишь незначитель-
1.0
но смещается из нее (рис. 4b из работы [13]). Ин-
тересно, что энергия адсорбции в мостиковой по-
0.5
зиции между атомами никеля (4.30 эВ), получен-
ная в работе [13], лишь на 0.07 эВ по модулю ни-
0
же, чем в наиболее предпочтительной позиции. В то
же время энергия адсорбции в F 1-позиции значи-
-0.5
тельно выше (на 1.10 эВ), чем наибольшая энергия,
Me/Ti Me/Ni
полученная в [13]. Кроме того, энергия адсорбции
-1.0
3d
кислорода в мостиковой позиции между двумя ато-
Al
4d
мами титана лишь на 0.28 эВ меньше, чем в F 1-
-1.5
5d
позиции. Отметим, что данная позиция не рассмат-
3
4
5
6
7
8
9
10
11
13
ривалась в работе [13]. В целом различие в значени-
Группа
ях Eads для других позиций, которые изучались в
обеих работах, может быть связано как с использу-
Рис. 2. (В цвете онлайн) Изменение энергии адсорбции
емой в работах моделью поверхности, так и с оцен-
кислорода на поверхности NiTi(110) в зависимости от чис-
кой полной энергии молекулы кислорода. Извест-
ла d-электронов на внешней оболочке примеси, замещаю-
но, что энергия связи в молекуле кислорода в спин-
щей атомы титана или никеля вблизи позиции адсорбции
поляризованном расчете отличается от эксперимен-
та примерно на 1 эВ. Кроме того, энергия адсорбции
когда 3d-5d-элементы находятся в поверхностном
кислорода незначительно увеличивается с уменьше-
слое вблизи F 1-позиции, замещая один из двух ато-
нием концентрации кислорода на поверхности. Та-
мов титана или атом никеля. На рис. 2 видно, что
ким образом, мы установили, что кислород на по-
энергия адсорбции кислорода понижается для всех
верхности NiTi(110) предпочитает адсорбироваться
примесей, если они замещают титан, и, напротив,
в позициях, обогащенных титаном, что согласуется
практически все 3d-примеси кроме меди на никеле-
с выводом, сделанным для сплава TiAl [14], а так-
вой подрешетке ведут к увеличению энергии адсорб-
же с экспериментом [15]. Поскольку кислород пред-
ции кислорода. Тенденции в изменении Eads из-за
почитает образовывать ионную связь с металличе-
присутствия 4d- и 5d-примесей на Ni-подрешетке по-
скими поверхностями, он занимает такие позиции,
добны: примеси начала периодов до элементов 7-ой
которые позволяют получить необходимые электро-
группы, имеющих пять d-электронов на внешней
ны для заполнения его p-оболочки. Как следует из
оболочке, увеличивают энергию адсорбции, но с уве-
настоящих расчетов, кислороду легче получить эти
личением числа валентных электронов примесного
электроны от титана, чем от никеля, поскольку d-
атома наблюдается понижение энергии адсорбции.
оболочка последнего элемента практически полно-
Это понижение выражено в меньшей степени для
стью заполнена. Согласно оценкам переноса заряда
d-элементов конца периодов, таких как Cu, Ag и Au.
по методу Бадера [16], при адсорбции кислорода в
Такое поведение обусловлено размерным эффектом,
F1-позиции титан теряет 1.20e, тогда как к никелю,
поскольку кислород смещается сильнее от Ag и Au,
напротив, приходит заряд, равный 0.51e. Несколько
чем от других элементов, а в случае последнего на-
меньшие значения, 1.05e и 0.48e, получены методом
ходится в F 1-позиции в смежном треугольнике как
DDEC6 [17,18]. В результате формирования оксидов
на чистой поверхности. Необходимо отметить, что
титана на поверхности NiTi(110) происходит обедне-
примеси d-элементов начала периодов предпочита-
ние приповерхностной области титаном, что являет-
ют занимать подрешетку титана в объемном сплаве
ся причиной появления обогащенного никелем слоя,
NiTi, как и в TiAl [19], но уже для элементов 5-ой
как показано в работах [2, 3]. В дальнейшем влия-
группы эта предпочтительность менее выражена и
ние примесей рассматривается только в предпочти-
может зависеть от концентрации примеси. Другие
тельной F1-позиции, при этом предполагается, что
элементы, как следует из нашего рассмотрения [20],
примесный атом может находиться как на титано-
предпочитают занимать подрешетку Ni.
вой, так и на никелевой подрешетках, как показано
Чтобы объяснить тенденции в энергетике связи
на рис. 1.
кислорода с легированной поверхностью NiTi(110),
На рис. 2 приведены результаты расчетов энер-
необходимо проанализировать изменения в плотнос-
гии адсорбции кислорода на поверхности NiTi(110),
тях электронных состояний (ПЭС) поверхностных
495
А. В. Бакулин, С. Е. Кулькова
ЖЭТФ, том 156, вып. 3 (9), 2019
N, эл./эВ
N, эл./эВ
N, эл./эВ
O
EF
O
EF
O
EF
а
б
в
4
4
4
2
2
2
0
0
0
Ni
S
Ni
S
Ni
S
4
Ti
4
Ti
4
Ti
Nb
Rh
Al
2
2
2
0
0
0
Ni
S-1
Ni
S-1
Ni
S-1
4
4
4
Ti
Ti
Ti
2
2
2
0
0
0
Ni
C
Ni
C
Ni
C
4
4
4
Ti
Ti
Ti
2
2
2
0
0
0
–8
-4
0
4
-8
-4
0
4
-8
-4
0
4
E, эВ
E, эВ
E, эВ
N, эл./эВ
N, эл./эВ
N, эл./эВ
O
EF
O
EF
O
EF
4
г
4
д
4
е
2
2
2
0
0
0
Ni
Ni
Ni
S
S
S
4
Ti
4
Ti
4
Ti
Nb
Rh
Al
2
2
2
0
0
0
Ni
S-1
Ni
S-1
Ni
S-1
4
4
4
Ti
Ti
Ti
2
2
2
0
0
0
Ni
C
Ni
C
Ni
C
4
4
4
Ti
Ti
Ti
2
2
2
0
0
0
–8
-4
0
4
-8
-4
0
4
-8
-4
0
4
E, эВ
E, эВ
E, эВ
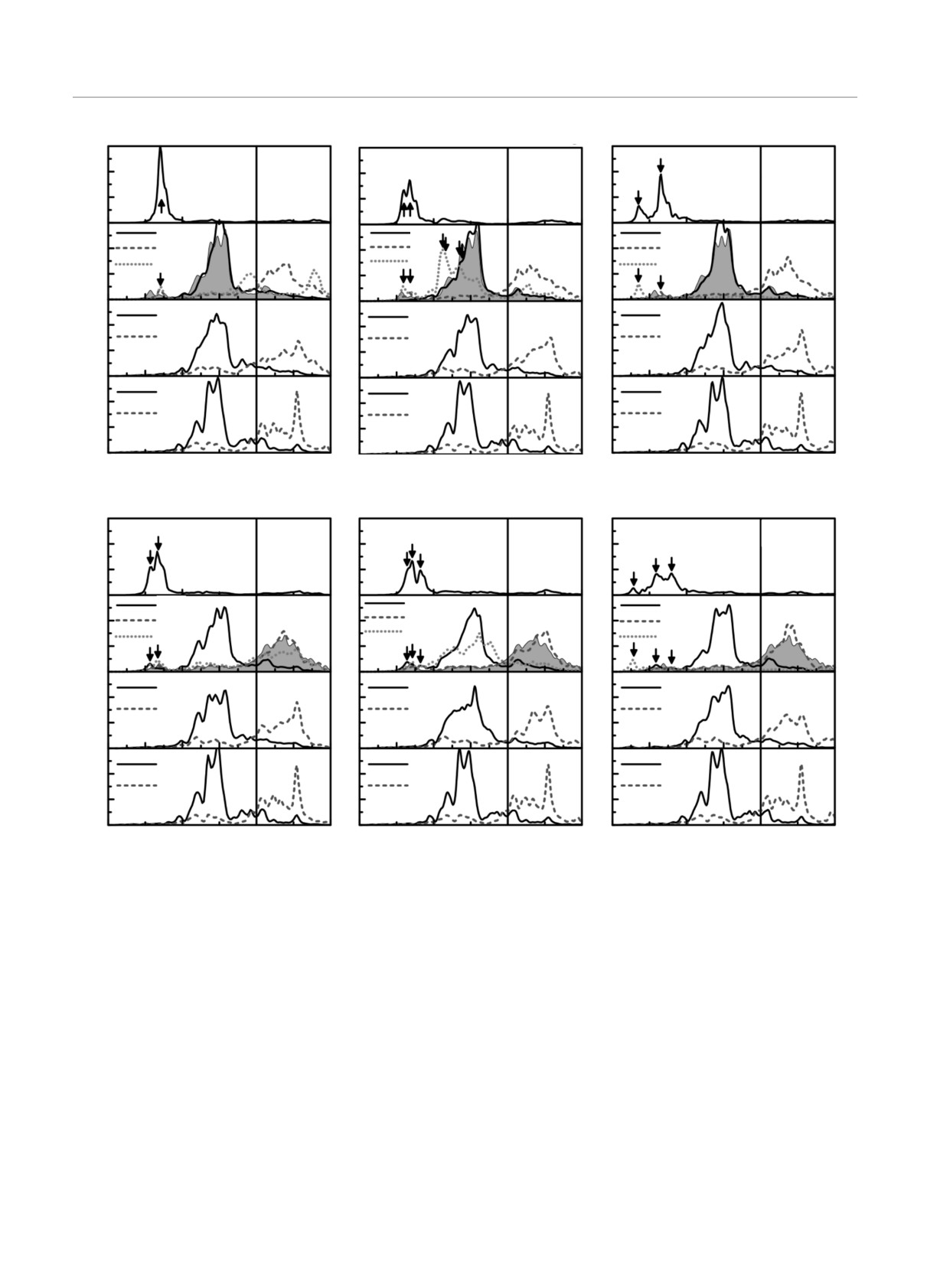
Рис. 3. (В цвете онлайн) Локальные ПЭС поверхностных и подповерхностных атомов при адсорбции кислорода на по-
верхности NiTi(110)-(2 ×
2) с примесями: Nb, Rh и Al на подрешетке Ni (а-в); Nb, Rh и Al на подрешетке Ti (г-е).
Символы S, S - 1 и C обозначают поверхностные, подповерхностные и объемные слои
атомов. На рис. 3а-в представлены соответствую-
атомов Ti и Nb при энергиях от -6 эВ до -4 эВ.
щие ПЭС атомов поверхностных (S) и подповерх-
Поскольку 2s-зона кислорода расположена значи-
ностных (S - 1) слоев, когда примеси Nb, Rh и Al
тельно ниже, при энергиях порядка -19 эВ, она
находятся на Ni-подрешетке, как показано на рис. 1.
не представлена на данном рисунке. Известно, что
Отметим, что для сравнения наряду с примесями
взаимодействие кислорода с металлами индуцирует
d-металлов, мы рассмотрели Al, который, как и Ti,
небольшие пики, отщепленные от дна их валентной
отличается высоким сродством к кислороду. Как
зоны. Так, небольшой пик Ti отщепленных состоя-
видно на рис. 3a, узкая валентная 2p-зона кислоро-
ний расположен при энергиях от -5.5 эВ до -4.5 эВ,
да лежит ниже дна валентных зон поверхностных
где как раз находится 2p-зона кислорода. Посколь-
496
ЖЭТФ, том 156, вып. 3 (9), 2019
Влияние примесей на адсорбционные свойства кислорода. . .
а
Недопированная
б
Nb/Ni
в
Rh/Ni
Al/Ni
г
д
Nb/Ti
е
Rh/Ti
ж
Al/Ti
Ti S
Ti S - 1
Ni S
Ni S - 1
Примесь
O
[110]
[001]
[110]
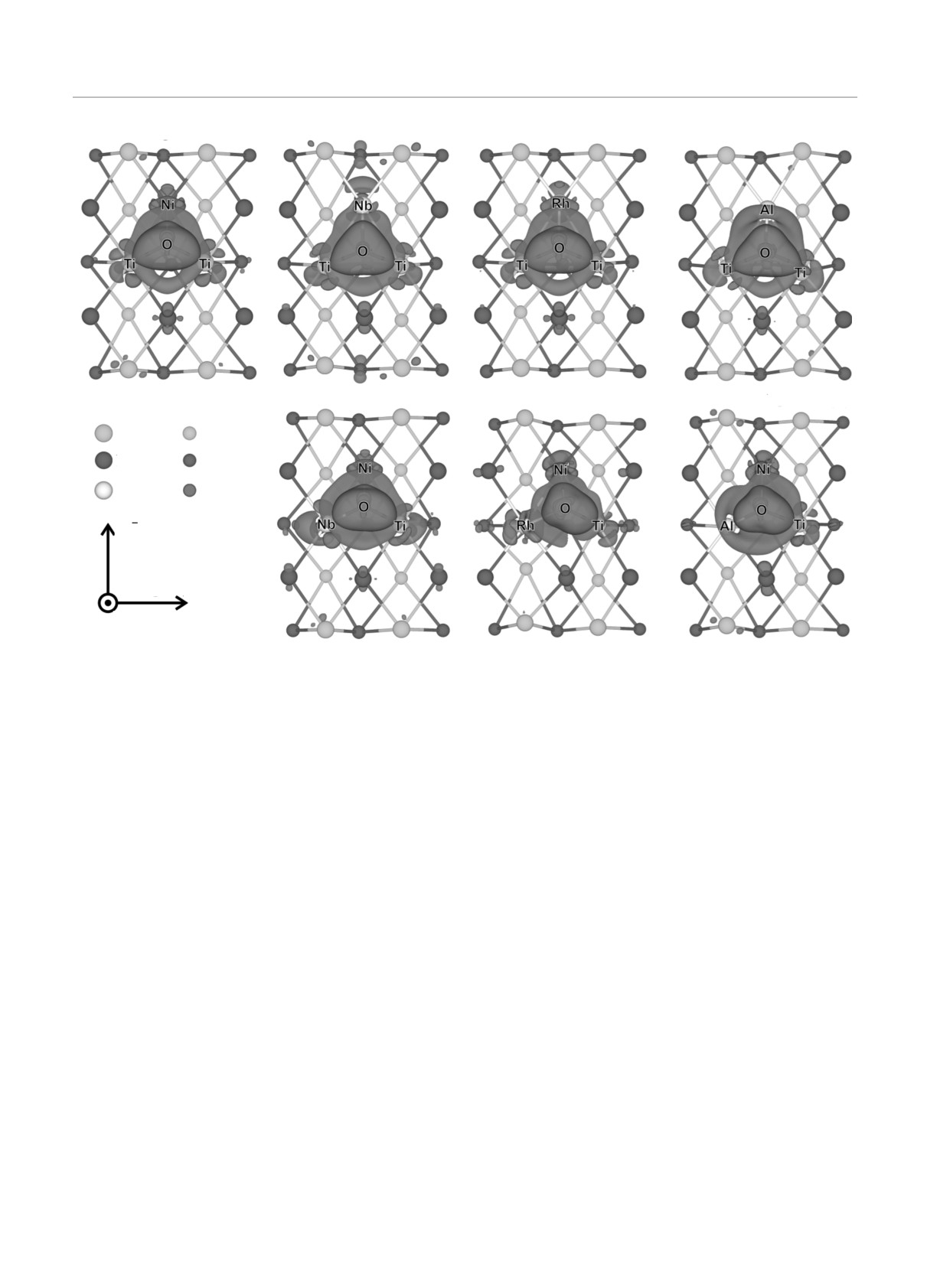
Рис. 4. (В цвете онлайн) Распределение разности зарядовой плотности (Δρ = ρO + ρTiNiX - ρO/TiNiX) для чистой поверх-
ности (а) и поверхности с примесями на подрешетках Ni (б-г) и Ti (д-ж). Области аккумуляции и ухода заряда показаны
красным и синим цветом. Показанные поверхности постоянной плотности заряда соответствуют заряду 0.025 эл./Å3
ку Nb имеет на один электрон больше, чем Ti, его
ность состояний кислорода. Отметим, что замещен-
валентная зона сдвигается от уровня Ферми (EF )
ный атом никеля, чья плотность дана серой залив-
в сторону отрицательных энергий, при этом отщеп-
кой, напротив, имеет в этом интервале энергий ши-
ленный пик Nb также находится практически при
рокий пик, центрированный при -2.0 эВ. Близкое
тех же энергиях, что и пик Ti. Напомним, что по-
расположение центров тяжести зон никеля и кисло-
явление низколежащих состояний и формирование
рода указывает на большую энергию гибридизации
псевдощели между ними и остальной зоной явля-
[21, 22], однако не все состояния Ni могут быть во-
ется указанием на изменение химической связи от
влечены во взаимодействие, а только неспаренные
металлической к ионно-ковалентной вследствие на-
d-электроны. В результате гибридизационные вкла-
чального этапа окисления поверхности. Как видно
ды O-Ni и O-Ti в энергию связи кислорода с чи-
на рис. 3а, валентная зона ниобия имеет выражен-
стой поверхностью практически одинаковые, на что
ную двугорбую структуру, при этом в пик ПЭС Nb
указывает расчет заселенности орбиталей (overlap
при энергии -0.4 эВ основной вклад дают связу-
population) на связях (0.47e для O-Ti и 0.48e для
ющие состояния, тогда как пик при энергии око-
O-Ni). В то же время ионность связи O-Ti зна-
ло 3.2 эВ обусловлен антисвязующими состояния-
чительно выше, чем О-Ni. Это наглядно видно на
ми. Поскольку имеется лишь небольшая плотность
рис. 4а, на котором приведено распределение разно-
состояний Ti и Nb до уровня Ферми, гибридиза-
сти зарядовых плотностей для нелегированной по-
ционный вклад в энергию связи кислорода с по-
верхности. Напомним, что электроотрицательность
верхностью мал, а при энергиях от уровня Фер-
(χ) атомов титана и никеля равна соответственно
ми до -4.0 эВ наблюдается лишь небольшая плот-
1.54 и 1.91. В то же время, на рис. 4б видно, что об-
497
8
ЖЭТФ, вып. 3 (9)
А. В. Бакулин, С. Е. Кулькова
ЖЭТФ, том 156, вып. 3 (9), 2019
ласть аккумуляции заряда вокруг кислорода силь-
N, эл./эВ
нее распространяется в сторону Nb (χ на 0.31 мень-
O
EF
ше, чем у Ni) по сравнению с соответствующей обла-
Rh
стью для Ni на чистой поверхности. Это позволяет
COHP(O-Rh)
4
сделать вывод о том, что ионность связи O-Nb так-
же выше, чем О-Ni. Отметим, что длина связи O-Nb
(2.14Å) больше, чем длина связи O-Ti (1.93Å), хотя
разница в ковалентных радиусах двух элементов со-
2
ставляет лишь 0.02Å, что указывает на более силь-
ное взаимодействие титана с кислородом. Как по-
казал расчет переноса заряда по двум схемам (Ба-
0
дера и DDEC6), к кислороду приходит больший на
0.1e заряд в присутствии ниобия на подрешетке ни-
-8
-4
0
4
келя. Отметим, что другие атомы никеля как по-
E, эВ
верхностного, так и подповерхностного слоев также
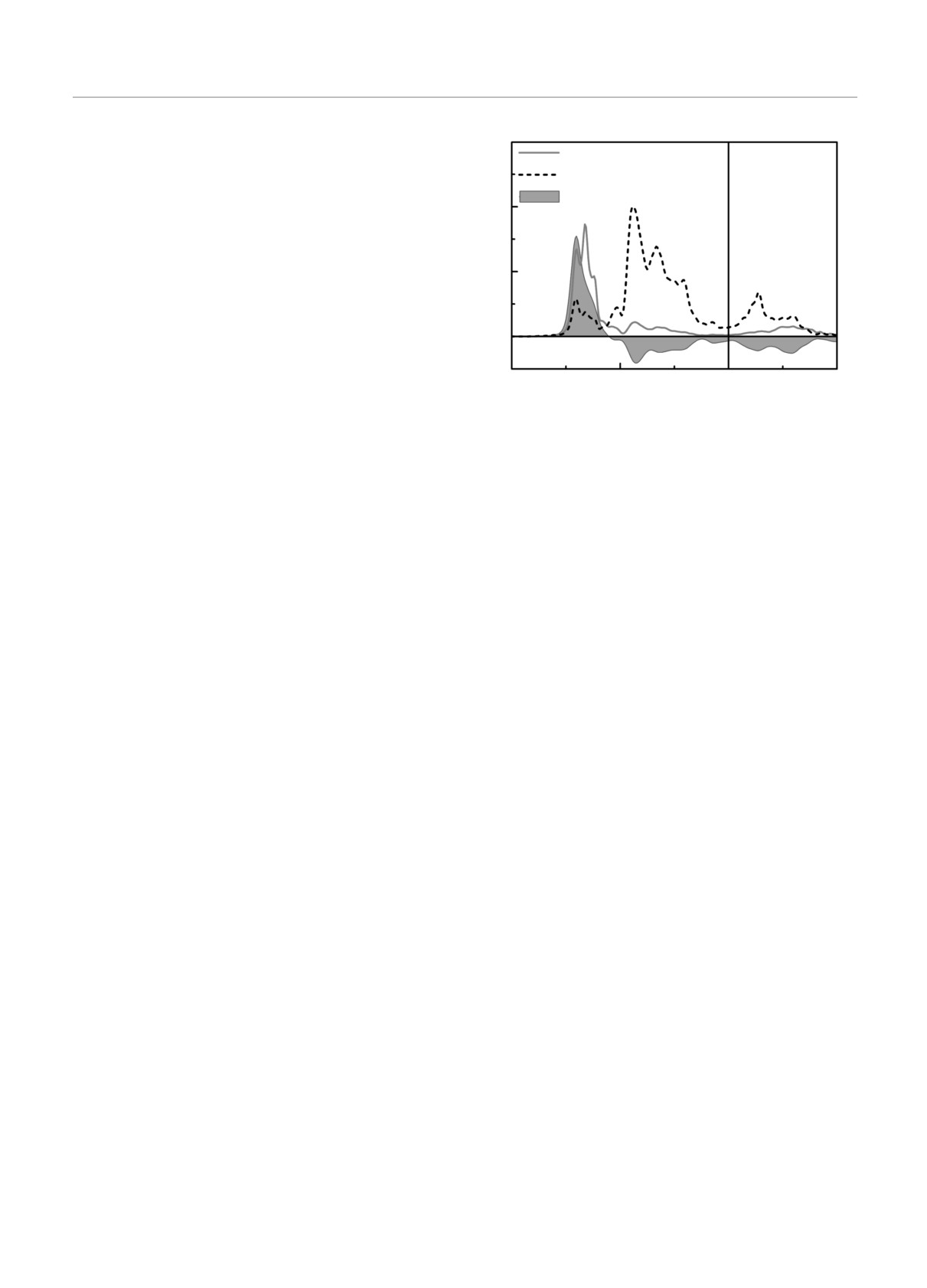
Рис. 5. (В цвете онлайн) Плотности электронных состоя-
вовлечены во взаимодействие с кислородом, однако
ний атомов кислорода и родия (подрешетка Ni) и COHP
оно является не прямым, а через гибридизацию с
для связи O-Rh, показанная заливкой
орбиталями поверхностных атомов титана или нио-
бия. Межатомное расстояние между кислородом и
ближайшими поверхностными атомами никеля со-
ставляет 3.13-3.68Å, что больше суммы их ионных
показывает, что состояния в интервале энергий от
радиусов и исключает прямое взаимодействие с кис-
-4.0 эВ до -1.0 эВ являются разрыхляющими, что
лородом. На рис. 3а видно, что ПЭС ближайшего к
видно на рис. 5, и не дают вклад в химическую
кислороду поверхностного атома никеля на легиро-
связь кислорода с родием. Отметим также, что за-
ванной поверхности лишь незначительно отличает-
селенность орбиталей на связи O-Rh понижается на
ся от ПЭС Ni на чистой поверхности. В целом при
7.7 % по сравнению с данной характеристикой на
замещении никеля ниобием химическая связь кисло-
связи О-Ni на чистой поверхности. Перенос заряда
рода с NiTi(110) становится сильнее по сравнению с
к кислороду от поверхности, легированной родием
чистой поверхностью, поскольку он взаимодейству-
(χ = 2.28) или элементами, расположенными спра-
ет с тремя атомами с практически незанятыми ва-
ва от него в периодической таблице, незначительно
лентными зонами, что способствует усилению ион-
уменьшается (рис. 4в). Оба фактора и определяют
ной составляющей в механизме связи (рис. 4б) и по-
понижение энергии адсорбции кислорода в данном
вышению энергии адсорбции кислорода (рис. 2).
случае.
Если на Ni-подрешетке находится Rh (рис. 3б), то
Наконец, рассмотрим ситуацию, когда никель за-
наблюдается более выраженное смещение центра тя-
мещается алюминием, который, как и титан, имеет
жести занятой части его валентной зоны от уровня
химическое сродство к кислороду. На рис. 3в вид-
Ферми, чем в случае Nb. Более того, основной пик
но, что появление Al в поверхностном слое ведет к
ПЭС родия смещен в сторону отрицательных энер-
формированию сильной связи O-Al. Известно, что
гий на 1.7 эВ относительно пика ПЭС никеля. Это
делокализованные s-, p-орбитали Al легче вовлека-
должно приводить к усилению гибридизации между
ются во взаимодействие с 2p-состояниями O, чем
s-, d-орбиталями Rh и 2p-зоной O, тем более, что у
локализованные d-состояния Ti. Это подтверждает-
Rh большее число неспаренных электронов. Видно,
ся появлением отщепленных низколежащих состоя-
что в интервале энергий от -4.0 эВ до -1.0 эВ со-
ний Al, пик которых расположен ниже по энергии
стояния кислорода становятся более выраженными
(-6.6 эВ), чем пик Ti (-5.3 эВ). Соответствующие
и имеются пики ПЭС при тех же энергиях, что и на
пики показаны стрелками на рис. 3в. В результате
ПЭС Rh. Отщепленный пик ПЭС родия также сме-
взаимодействия с металлами 2p-зона О расщепля-
щен сильнее в сторону отрицательных энергий, чем
ется и становится двугорбой с пиками при упомяну-
пик ПЭС титана, что приводит к расщеплению ос-
тых выше энергиях. Отметим, что длина связи O-Al
новного пика ПЭС кислорода при энергии -5.4 эВ.
примерно на 0.1Å меньше, чем O-Ti (1.87Å). Хотя
В целом тонкая структура локальных ПЭС Rh и
заселенность орбиталей на связи O-Al увеличивает-
O хорошо коррелирует. Однако детальный анализ
ся на 34.2 % по сравнению с заселенностью орбита-
COHP (crystal orbital Hamilton population) [23, 24]
лей на связи O-Ti, вклад в химическую связь за счет
498
ЖЭТФ, том 156, вып. 3 (9), 2019
Влияние примесей на адсорбционные свойства кислорода. . .
гибридизации 2p-состояний О с s-, p-орбиталями Al
примесей. Таким образом, независимо от занимае-
меньше, чем с s-, d-орбиталями Ti. Как показал ана-
мой подрешетки Rh понижает энергию адсорбции
лиз зарядового переноса по методу Бадера, к кисло-
кислорода.
роду в присутствии алюминия приходит заряд по-
Если Ti замещается Al, то ПЭС кислорода еще
рядка 1.3e. Следует заметить, что перенос заряда
существеннее понижается и становится более раз-
от титана слабо зависит от примеси. Таким образом,
мытой, при этом появляется практически отщеплен-
усиление ионного вклада (рис. 4г) частично компен-
ный пик при энергии -6.8 эВ, обусловленный его
сируется уменьшением гибридизационного вклада.
взаимодействием с алюминием. На рис. 3е видно,
При этом энергия адсорбции также повышается, как
что низколежащие Al-состояния распространяются
и в случае ниобия.
до -7.6 эВ. В то же время ПЭС никеля изменяется
В случае Nb на Ti-подрешетке (рис. 3г) ПЭС кис-
не столь существенно по сравнению с соответствую-
лорода понижается и незначительно расщепляется,
щей кривой на чистой поверхности, что указывает
что обусловлено смещением Ni-пика примерно на
на незначительное изменение О-Ni-гибридизации.
0.3 эВ относительно отщепленного пика, в который
Ионный вклад понижается в меньшей степени, чем
основной вклад дают Ti и Nb (показаны стрелками
в случае Rh на Ti-подрешетке, поскольку Al теряет
на рис. 3г). Число занятых состояний Nb уменьша-
практически столько же электронов, как и Ti (по-
ется (пик под уровнем Ферми, отмеченный выше на
рядка 1.25e). Отметим, что не весь заряд от данных
рис. 3а, менее выражен и смещен в сторону положи-
атомов приходит на кислород. Основной причиной
тельных энергий), а отщепленный пик Nb сдвинут
существенного понижения энергии адсорбции кис-
на 0.2 эВ от уровня Ферми по сравнению со слу-
лорода в этом случае является понижение гибри-
чаем, когда он находится на Ni-подрешетке. Дли-
дизационного вклада O-Al, как отмечалось выше.
на связи O-Nb равна 1.98Å, что существенно мень-
Отметим также, что ПЭС атомов подповерхностных
ше, чем в предыдущем случае. Это указывает на то,
слоев ранее не обсуждались, поскольку их измене-
что взаимодействие O-Nb усиливается. На рис. 4д
ние, как видно на рис. 3, выражено в меньшей сте-
видно, что область аккумуляции заряда вокруг кис-
пени, чем для поверхностных атомов.
лорода лишь незначительно отличается от соответ-
В заключение отметим, что тенденции в изме-
ствующей для чистой поверхности. В то же время
нениях локальных ПЭС поверхностных атомов кис-
усиление связи Nb как с Ti, так и с Ni приводит к
лорода и металлов остаются практически анало-
меньшему (примерно на 10.3 %) переносу заряда к
гичными при замещении изоэлектронными примеся-
кислороду. В целом уменьшение энергии адсорбции
ми. Повышение энергии адсорбции примесями кон-
кислорода обусловлено понижением ионного вклада
ца 3d-периода (рис. 2) объясняется большей химиче-
в химическую связь.
ской активностью данных элементов. Известно, что
В случае Rh на Ti-подрешетке (рис. 3д) его со-
как железо, так и кобальт образуют оксиды легче,
стояния, как отмечалось выше, находятся практи-
чем изоэлектронные им 4d-5d-металлы. То же самое
чески при тех же энергиях, что и состояния Ni.
следует отметить и в отношении 5d-элементов нача-
Последнее заставляет их конкурировать за взаимо-
ла периода, для которых расчеты показывают боль-
действие с кислородом. Видно, что число состояний
шее повышение энергии адсорбции, чем для 4d-эле-
кислорода в интервале энергий, где находятся ва-
ментов начала периода.
лентные зоны Rh и Ni, увеличивается, что должно
Необходимо отметить, что упомянутая выше та-
указывать на повышение гибридизационного вкла-
кая характеристика, как заселенность орбиталей,
да в энергию связи, однако согласно анализу COHP
часто используется для оценки гибридизационного
состояния выше -4.0 эВ являются разрыхляющими.
вклада в химическую связь, хотя она может быть
В то же время перенос заряда к кислороду уменьша-
недостаточно точной. Гибридизационный и ионный
ется на 0.10-0.15e в зависимости от метода оценки.
вклады в энергию связи кислорода с поверхностью
Как видно на рис. 4е, область аккумуляции заря-
NiTi(110) для рассмотренных примесей схематично
да распространяется сильнее в сторону Ti. Анализ
представлены на рис. 6. Увеличение заселенности
структурных параметров показывает, что примес-
орбиталей на 38.8 % для связи Ti-Nb и на 27.4 % для
ный атом смещается в сторону объема, что ведет к
Ti-Rh, когда примесь замещает никель, по сравне-
увеличению длины связи O-Rh (2.21Å), которая на
нию с данной характеристикой для связи Ti-Ni на
0.32-0.36Å больше, чем длина связи O-Ni или O-Ti.
чистой поверхности отражает тот факт, что большее
Отметим, что расстояние от кислорода до поверхно-
число электронов может вовлекаться во взаимодей-
сти также увеличивается с заполнением d-оболочки
ствие с кислородом. Действительно в случае ниобия
499
8*
А. В. Бакулин, С. Е. Кулькова
ЖЭТФ, том 156, вып. 3 (9), 2019
примеси на энергетику связи кислорода с поверхно-
1.0
Eads, эВ
Q, эл.
1.2
стью, если она находится в подповерхностном слое,
, эл.
0.8
поскольку в этом случае ее эффект существенно ме-
0.5
нее выражен. Считается, что увеличение энергии
0.4
адсорбции кислорода может служить указанием на
0
0
повышение коррозионной стойкости сплава, однако
такая корреляция нуждается в дальнейшем изуче-
-0.4
нии. Необходимо отметить, что, как было показа-
-0.5
но в нашей работе [26], примеси Zr, Nb, Mo, Hf, Ta,
-0.8
W способствуют повышению энергии образования
-1.0
-1.2
кислородных вакансий в TiO2. Последнее означа-
ет замедление окисления сплава вследствие подав-
Nb/Ni Rh/Ni Al/Ni
Nb/Ti Rh/Ti Al/Ti
ления диффузии кислорода через оксид к границе
Рис. 6. (В цвете онлайн) Изменение энергии адсорбции
раздела. Известно, что более медленный рост оксид-
кислорода на поверхности NiTi(110) при легировании по-
ной пленки является благоприятным для формиро-
верхности Nb, Rh и Al, а также изменения зарядового пе-
вания полностью стабилизированного оксида тита-
реноса к кислороду (ΔQ) и занятости перекрывания (ΔΘ)
на на поверхности NiTi [27], при этом появляется
орбиталей кислорода и атомов примеси
возможность релаксации напряжений на интерфей-
се сплав-оксид, что является важным для прочнос-
ти этих границ раздела.
на Ni-подрешетке наблюдается повышение как ги-
бридизационного, так и ионного вклада, что хоро-
4. ЗАКЛЮЧЕНИЕ
шо коррелирует с увеличением энергии адсорбции
Проведено сравнительное изучение влияния
(рис. 6). Хотя заселенность орбиталей поверхност-
3d-5d-элементов на энергию адсорбции кислоро-
ных атомов в случае Rh на Ni-подрешетке повыша-
да на стехиометрической поверхности NiTi(110)
ется на поверхности без кислорода, однако суммар-
методом проекционных присоединенных волн в
ное значение заселенности орбиталей на связях О-
рамках теории функционала электронной плотнос-
Ме изменяется лишь незначительно по сравнению с
ти. Установлено, что 3d-5d-примеси на подрешетке
чистой поверхностью. В то же время, как показа-
Ni за исключением нескольких элементов конца
но на рис. 6, ионный вклад также понижается на
d-периодов ведут к увеличению энергии адсорб-
легированной родием поверхности, что коррелиру-
ции, тогда как она понижается для примесей на
ет с понижением энергии адсорбции. Если примеси
подрешетке Ti. Показано, что уменьшение энергии
d-металлов находятся на Ti-подрешетке, то заселен-
адсорбции кислорода выражено в меньшей степе-
ность орбиталей на поверхности без кислорода так-
ни для примесей групп 3-5, если они занимают
же увеличивается, как и в предыдущем случае, на
наиболее предпочтительную подрешетку Ti. При-
32.8 % (Nb-Ni) и 11.1 % (Rh-Ni). При этом гибриди-
меси середины и конца d-периодов предпочитают
зационный вклад в энергию связи кислорода с по-
замещать Ni, при этом первые незначительно по-
верхностью увеличивается существенно в случае ни-
вышают энергию адсорбции, а вторые, напротив,
обия и незначительно понижается при легировании
ее понижают, но в значительно меньшей степени,
поверхности родием. Однако, как видно на рис. 6,
чем в случае их нахождения на подрешетке Ti. Для
уменьшение ионного вклада более существенно для
сопоставления рассмотрено влияние на энергию
рассмотренных примесей на Ti-подрешетке. В слу-
адсорбции p-элемента, такого как Al, который имеет
чае Al на обеих подрешетках тенденции в изменении
высокое сродство к кислороду. Установлено, что Al
гибридизационного и ионного вкладов совпадают.
на подрешетке Ni повышает, а на подрешетке Ti по-
Мы не обсуждаем результаты, полученные для
нижает энергию адсорбции кислорода. На примере
других примесей, поскольку установленные тенден-
примесей Nb, Rh и Al проведен анализ изменений
ции остаются справедливыми. Кроме того, заметим,
плотностей электронных состояний поверхностных
что мы не учитывали механический вклад в энер-
атомов, разности зарядовой плотности, зарядового
гетику связи кислорода с поверхностью аналогично
переноса, заселенности орбиталей на связях кисло-
тому, как это было сделано в нашей ранней работе
рода с металлами и других свойств по сравнению
[25], поскольку в данном случае он на порядок мень-
с соответствующими характеристиками для чистой
ше, чем химический. Также не обсуждается влияние
поверхности.
500
ЖЭТФ, том 156, вып. 3 (9), 2019
Влияние примесей на адсорбционные свойства кислорода. . .
Увеличение числа состояний при энергиях от
6.
P. E. Blöchl, Phys. Rev. B 50, 17953 (1994).
-4.0 эВ до 0.0 эВ, обнаруженное на ПЭС кислорода,
7.
G. Kresse and D. Joubert, Phys. Rev. B 59, 1758
не всегда свидетельствует о большем гибридизаци-
(1999).
онном вкладе в энергетику связи с поверхностью,
8.
G. Kresse and J. Hafner, Phys. Rev. B 48, 13115
поскольку гибридизированные состояния при этих
(1993).
энергиях могут являться разрыхляющими, как
показано в случае Rh. Изменение ионного вклада
9.
G. Kresse and J. Furthmüller, Comput. Mater. Sci.
при легировании поверхности хорошо коррелирует
6, 15 (1996).
с разницей в электроотрицательностях примесного
10.
J. P. Perdew, K. Burke, and M. Ernzerhof, Phys. Rev.
атома и атома им заменяемого: в случае Nb, име-
Lett. 77, 3865 (1996).
ющего электроотрицательность больше, чем у Ti,
он понижается, но повышается в случае замещения
11.
H. J. Monkhorst and J. D. Pack, Phys. Rev. B 13,
5188 (1976).
Ni с большей электроотрицательностью. Такая же
тенденция прослеживается для других примесей.
12.
E. A. Brandes and G. B. Brook, Smithells Metals
Резкое повышение энергии адсорбции в случае при-
Reference Book, seventh ed., Butterworth-Heinemen,
месей Ag и Au на подрешетке Ni по сравнению с Pd
London (1992).
и Pt обусловлено размерным фактором, а именно,
13.
M. Nolan and S. A. M. Tofail, Biomaterials 31, 3439
большим смещением атома кислорода в сторону от
(2010).
примеси и, как следствие, значительным усилением
его взаимодействия с двумя атомами титана. В
14.
А. В. Бакулин, С. Е. Кулькова, Ц. М. Ху и др.,
целом показано, что повышение/понижение энер-
ЖЭТФ 147, 292 (2015).
гии адсорбции кислорода на NiTi(110) коррелирует
15.
M. Pohl, T. Glogowski, S. Kühn et al., Mater. Sci.
с изменением ионного вклада в механизм связи
Eng. A 481-482, 123 (2008).
кислорода с поверхностью.
16.
W. Tang, E. Sanville, and G. Henkelman, J. Phys.:
Condens. Matter 21, 084204 (2009).
Финансирование. Работа частично выполне-
на при финансовой поддержке Российского фонда
17.
N. G. Limas and T. A. Manz, RSC Adv. 6, 45727
фундаментальных исследований (№18-03-00064_а),
(2016).
а также в рамках проекта III.23.2.8 Института физи-
18.
T. A. Manz and N. G. Limas, RSC Adv. 6, 47771
ки прочности и материаловедения Сибирского отде-
(2016).
ления Российской академии наук и программы по-
19.
А. В. Бакулин, С. Е. Кулькова, ЖЭТФ 154, 1136
вышения конкурентоспособности Томского государ-
(2018).
ственного университета. Численные расчеты выпол-
нены на суперкомпьютере SKIF-Cyberia в Томском
20.
S. E. Kulkova, A. V. Bakulin, Q. M. Hu et al., Mater.
государственном университете.
Today: Proc. 2S, 615 (2015).
21.
B. Hammer and J. K. Nørskov, Surf. Sci. 343, 211
(1995).
ЛИТЕРАТУРА
22.
В. Е. Егорушкин, С. Е. Кулькова, Н. В. Мельни-
1. S. A. Shabalovskaya, J. Anderegg, and J. Van Hum-
кова и др., ЖЭТФ 128, 403 (2005).
beeck, Acta Biomaterialia 4, 447 (2008).
23.
R. Dronskowski and P. E. Blöchl, J. Phys. Chem. 97,
2. H. Tian, D. Schryvers, D. Liu et al., Acta Biomate-
8617 (1993).
rialia 7, 892 (2011).
24.
S. Maintz, V. L. Deringer, A. L. Tchougreeff et al., J.
3. S. E. Kulkova, A. V. Bakulin, Q. M. Hu et al., Physica
Comput. Chem. 37, 1030 (2016).
B 426, 118 (2013).
25.
S. E. Kulkova, A. V. Bakulin, S. S. Kulkov et al.,
Phys. Scr. 90, 094010 (2015).
4. A. V. Bakulin, T. I. Spiridonova, and S. E. Kulkova,
Comput. Mater. Sci. 148, 1 (2018).
26.
F. P. Ping, Q. M. Hu, A. V. Bakulin et al., Intermet.
68, 57 (2016).
5. В. Г. Пушин, В. В. Кондратьев, В. Н. Хачин, Пе-
реходные явления и мартенситные превращения,
27.
G. S. Firstov, R. G. Vitchev, H. Kumar et al., Bioma-
УрО РАН, Екатеринбург (1998).
terials 23, 4863 (2008).
501