ЖЭТФ, 2021, том 160, вып. 2 (8), стр. 206-212
© 2021
ИЗУЧЕНИЕ ДИФФУЗИОННЫХ СВОЙСТВ КИСЛОРОДА В TiO2
А. В. Бакулинa,b*, Л. С. Чумаковаa, С. Е. Кульковаa,b**
a Институт физики прочности и материаловедения Сибирского отделения Российской академии наук
634055, Томск, Россия
b Национальный исследовательский Томский государственный университет
634050, Томск, Россия
Поступила в редакцию 16 февраля 2021 г.,
после переработки 16 февраля 2021 г.
Принята к публикации 2 марта 2021 г.
Методом проекционных присоединенных волн в рамках теории функционала электронной плотности
рассчитаны энергии образования кислородных вакансий и миграционные барьеры кислорода в TiO2 со
структурой рутила. Получены аналитические выражения для температурных коэффициентов диффу-
зии вдоль двух кристаллографических направлений с использованием метода Лэндмана и рассчитаны
значения энергии активации и предэкспоненциального множителя. Показано, что температурный коэф-
фициент диффузии находится в хорошем согласии с экспериментом и с результатами, полученными
ранее статистическим методом. Обсуждается влияние примесей на диффузионные свойства кислорода
в оксиде.
DOI: 10.31857/S004445102108006X
коэффициента диффузии, проведенные в α2-Ti3Al
[4], с миграционными барьерами, полученными ме-
тодом ab initio, находятся в хорошем согласии с экс-
1. ВВЕДЕНИЕ
периментом [5]. Как и в эксперименте [5], диффузия
Известно, что в титане и его сплавах при окис-
кислорода вдоль [0001] идет быстрее, чем в перпен-
лении на поверхности образуется пленка диоксида
дикулярном направлении. Рассчитанные значения
титана со структурой рутила. Добавление алюми-
энергии активации (1.99 эВ и 1.97 эВ) также нахо-
ния делает процесс окисления более сложным, по-
дятся в согласии с отмеченными выше эксперимен-
скольку алюминий, как и титан, имеет сродство к
тальными данными [5]. В работе [6] для расчета тем-
кислороду и образует оксид со структурой корунда
пературного коэффициента диффузии в TiAl был
α-Al2O3. Однако с увеличением содержания титана
адаптирован метод Лэндмана [7,8], который приме-
в сплаве Ti-Al на поверхности формируется пленка
нялся для изучения диффузии кислорода в титане
диоксида титана, поскольку термодинамические ха-
в работах [9, 10], а также для изучения диффузии
рактеристики двух оксидов предполагают большую
водорода в γ-TiAl [11]. Отметим, что практически
стабильность интерфейсов с TiO2 [1]. Наличие ва-
одновременно с работой [6] были опубликованы еще
кансий и дефектов в TiO2 может существенно вли-
две работы [12,13], в которых данный метод исполь-
ять на перенос кислорода. Ранее в нашей работе [2]
зовался для изучения диффузии кислорода в γ-TiAl.
была изучена диффузия кислорода в ряду алюми-
Несмотря на ряд различий в расчетах, связанных с
нидов титана TiAl3 - TiAl - Ti3Al в рамках стати-
использованием разного набора позиций внедрения
стического подхода [3]. Было показано, что увеличе-
кислорода, и стабильности некоторых позиций, ре-
ние содержания титана в сплаве ведет к изменению
зультаты данных работ в целом согласуются между
механизма диффузии, при этом диффузия кисло-
собой. В то же время в [6] было проведено сопостав-
рода вдоль оси c становится более предпочтитель-
ление значений коэффициента диффузии, рассчи-
ной, чем вдоль оси a, а температурный коэффици-
танных с использованием статистического подхода
ент диффузии существенно уменьшается. Расчеты
и модели Лэндмана. Было установлено, что в ме-
тоде Лэндмана учет новых позиций внедрения кис-
* E-mail: bakulin@ispms.tsc.ru
лорода и его диффузионных путей ведет к значи-
** E-mail: kulkova@ms.tsc.ru
206
ЖЭТФ, том 160, вып. 2 (8), 2021
Изучение диффузионных свойств кислорода.. .
тельному повышению диффузии вдоль оси a, тогда
жением диффундирующего атома. При последую-
как температурный коэффициент диффузии вдоль
щей одновременной релаксации всех пяти изобра-
оси c изменяется в меньшей степени. Анализ вкла-
жений каждый атом считался упруго связанным с
дов в коэффициент диффузии вдоль двух направле-
таким же атомом в соседних изображениях. Для на-
ний от разных путей миграции кислорода позволил
хождения седловой точки использовался алгоритм
установить, что повышение коэффициента диффу-
сопряженных градиентов, при этом учитывались
зии вдоль оси a связано с его большей зависимо-
дополнительные подталкивающие силы, ориентиро-
стью от путей с низкими миграционными барьера-
ванные вдоль пути диффузии. Необходимым крите-
ми. Заметим, что миграционные барьеры кислорода
рием нахождения седловой точки является обраще-
в диоксиде титана рассчитывались в нескольких ра-
ние в нуль касательных сил, действующих на диф-
ботах [14,15], при этом рассматривалась диффузия
фундирующий атом в этой точке. Считалось, что
как нейтральной, так и заряженной вакансии. Одна-
седловая точка обнаружена, если эта сила не пре-
ко температурный коэффициент диффузии кисло-
вышала 10-3 эВ/Å. Тестовые расчеты показали, что
рода в оксиде в данных работах не рассчитывался.
миграционные барьеры практически не изменяются
Таким образом, целью настоящей работы явля-
при увеличении энергии обрезания плоских волн от
ется изучение диффузионных свойств кислорода в
400 эВ до 550 эВ. Оценка миграционных барьеров
диоксиде титана со структурой рутила, в том числе
кислорода проводилась в суперячейке (2 × 2 × 3).
в присутствии дефектов.
Заметим, что увеличение размера ячейки незначи-
тельно отражается на энергетических барьерах при-
мерно 0.05-0.10 эВ.
2. МЕТОД РАСЧЕТА
Влияние примеси на энергию образования кисло-
родной вакансии (Ef ) оценивалось следующим об-
Расчеты электронной структуры TiO2 проводи-
разом:
лись методом проекционных присоединенных волн
(PAW) в плоско-волновом базисе [16, 17] с обобщен-
ΔEf = (ETi23XO47 - ETi23XO48 ) -
ным градиентным приближением для обменно-кор-
(1)
- (ETi24 O47 - ETi24O48 ),
реляционного функционала в форме GGA-PBE [18].
Максимальная энергия плоских волн из базисного
где ETi23XO47 (ETi24 O47 ) и ETi23XO48 (ETi24 O48 ) — пол-
набора была равна 400 эВ. Оптимизация электрон-
ные энергии легированного (нелегированного) окси-
ной структуры проводилась до тех пор, пока разни-
да соответственно с O-вакансией и без нее.
ца в полных энергиях для двух последующих итера-
ций не достигала 10-5 эВ. При расчете электронной
структуры оксида интегрирование по зоне Брил-
3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
люэна проводилось с использованием сетки k-то-
3.1. Температурный коэффициент диффузии
чек 9 × 9 × 15 [19]. Релаксация положений атомов
кислорода в TiO2
проводилась с использованием метода сопряженных
градиентов до достижения сил на атомах не более
На рис. 1 приведена атомная структура диокси-
0.01 эВ/Å. Равновесные параметры решетки TiO2 со
да титана и положение примеси, а также показаны
структурой рутила, полученные в настоящем рас-
миграционные пути вакансии кислорода. Рассчитан-
чете (a = 4.611
Å и c = 2.956
Å), отличаются от
ные значения миграционных барьеров для путей A и
экспериментальных значений 4.594Å и 2.959Å [20]
C равны 1.17 эВ и 2.12 эВ, что находится в хорошем
менее чем на 0.4 %. Примитивная ячейка диоксида
согласии с результатами ранних расчетов 1.2 эВ и
титана характеризуется пространственной группой
2.1 эВ [14], тогда как для пути B разница в значении
136 (P42/mnm), при этом атомы титана занимают
барьера составляет 0.3 эВ (1.20 эВ и 0.90 эВ [14]).
позиции Вайкоффа (Wyckoff positions) 2a, а атомы
Энергия образования кислородной вакансии в TiO2
кислорода — 4f.
равна 4.28 эВ, что находится в хорошем согласии со
Для оценки диффузионных барьеров кислорода
значением 4.30 эВ [22]. Имеются две позиции вакан-
в TiO2 применялся метод подталкивающих упру-
сии вблизи примеси X (рис. 1). Небольшая разница в
гих связей c восходящими изображениями (CI-NEB)
Ef была получена в случае элементов 3d-4d-перио-
[21]. Начальное положение пяти изображений вдоль
дов и IIIA-IVA-групп (рис. 1б ), но она более суще-
диффузионного пути задавалось путем линейной
ственна для 5d элементов. Видно, что Zr, Nb, Mo,
интерполяции между начальным и конечным поло-
Hf, Ta, W и Re увеличивают энергию образования
207
А. В. Бакулин, Л. С. Чумакова, С. Е. Кулькова
ЖЭТФ, том 160, вып. 2 (8), 2021
ния,
ψ(u), и фурье-образа матрицы смещений, p(k),
строится матрица-пропагатор:
R(k, u) = E - p(k) ◦
ψ(u),
(2)
где символом ◦ обозначено поэлементное произведе-
ние матриц, а E — единичная матрица.
Коэффициент диффузии D в направлении kr
рассчитывается по следующей формуле:
]
[(
)-1
1
∂ det R
δ2detR
Dr =
lim
(3)
2
k→0
∂u
δk2
r
u→0
В случае диффузии в рамках вакансионного ме-
ханизма коэффициент диффузии необходимо допол-
нительно умножать на концентрацию вакансий. В
нелегированном оксиде матрицы
ψ(u) и p(k) имеют
размерность 4 × 4, поскольку рассматривается толь-
ко вакансионный механизм диффузии по 4f-пози-
циям Вайкоффа. С учетом обозначения перескоков
между ближайшими позициями кислорода (рис. 1а)
изображение матрицы плотности времени ожидания
будет иметь следующий вид:
⎛
⎞
2Γ
C
4ΓA
4ΓA ΓB
⎜
K K K
⎟
⎟
⎜4K
2ΓC ΓB
4ΓA⎟
⎜
⎟
Рис. 1. (В цвете онлайн) Атомная структура TiO2 (а): ми-
⎜
⎟
K K K K
ψ(u) =
⎜
⎟,
(4)
грационные пути показаны стрелками, положение приме-
⎜
⎟
4ΓA ΓB
2ΓC
4ΓA
⎜
⎟
си — крестом, а кислородных вакансий — цифрами; изме-
⎜
⎟
⎜
K K K K
⎟
нение энергии образования O-вакансии в оксиде (б)
⎠
⎝ Γ
B
4ΓA
4ΓA
2ΓC
K K K K
O-вакансии. Известно, что примеси, увеличивающие
где K = 8ΓA + ΓB + 2ΓC + u, а частоты перескоков
Ef , ведут к понижению концентрации кислородных
Γi оценивались как
вакансий в оксиде и могут препятствовать диффу-
√
(
)
зии кислорода из оксида в сплав. В то же время вли-
Emi
Emi
Γi =
exp
-
,
(5)
яние примесей на миграционные барьеры кислорода
2md2i
kBT
в оксиде более сложное [23]. Только изоэлектронные
титану элементы (Hf и Zr), а также Mo увеличивают
где Emi - энергия миграции кислорода вдоль пути
миграционные барьеры.
i (i = A, B или C), m — масса атома кислорода
Расчет температурного коэффициента диффу-
2.66 · 10-26 кг, di — длина пути миграции i, kB —
зии является нетривиальной задачей. В литерату-
постоянная Больцмана, а T — температура.
ре в основном рассматривается диффузия кислоро-
Фурье-образ матрицы смещений строится следу-
да по междоузельному механизму, однако в оксидах
ющим образом:
диффузия кислорода может проходить по вакасион-
⎛
⎞
ному механизму. Для оценки температурного коэф-
A11
A12
A13
A14
фициента диффузии кислорода в TiO2 в рамках ва-
⎜
⎟
⎜
A21
A22
A23
A24⎟
кансионного механизма использовался метод Лэнд-
⎜
p(k) =
⎟,
(6)
⎜
⎟
мана [7, 8]. В данном методе с помощью преобразо-
⎝A31
A32
A33
A34⎠
вания Лапласа матрицы плотности времени ожида-
A41
A42
A43
A44
208
ЖЭТФ, том 160, вып. 2 (8), 2021
Изучение диффузионных свойств кислорода.. .
где
1
A11 = A22 = A33 = A44 =
(eil3k3 + e-il3k3 ),
2
1
A12 =
(1 + e-il3k3 + eil2k2 + eil2k2-il3k3 ),
4
1
A13 =
(1 + e-il3k3 + eil1k1 + eil1k1-il3k3 ),
4
(7)
A23 = eil1k1-il2k2 ,
A14 = 1,
1
A24 =
(1 + eil3k3 + eil1k1 + eil1k1+il3k3 ),
4
1
A34 =
(1 + eil3k3 + eil2k2 + eil2k2+il3k3 ).
4
Остальные компоненты матрицы
p(k) могут
быть найдены из соотношения pij (k) = p∗ji(k), где
звездочка означает комплексное сопряжение. Ком-
поненты вектора k — k1, k2, k3 — соответствуют его
проекциям на кристаллографические направления
[100], [010] и [001], поэтому l1 = l2 = a и l3 = c, где a
и c — параметры решетки оксида. Таким образом,
без учета концентрации вакансий коэффициенты
диффузии кислорода вдоль осей a и c в методе
Лэндмана описываются следующими формулами:
ΓA(2ΓA + ΓB)
D′a = a2
,
(8)
4ΓA + ΓB
D′c = c2(ΓA + ΓC),
(9)
где Γi — частота перескока атома кислорода вдоль
пути i (5).
Коэффициенты диффузии кислорода в TiO2
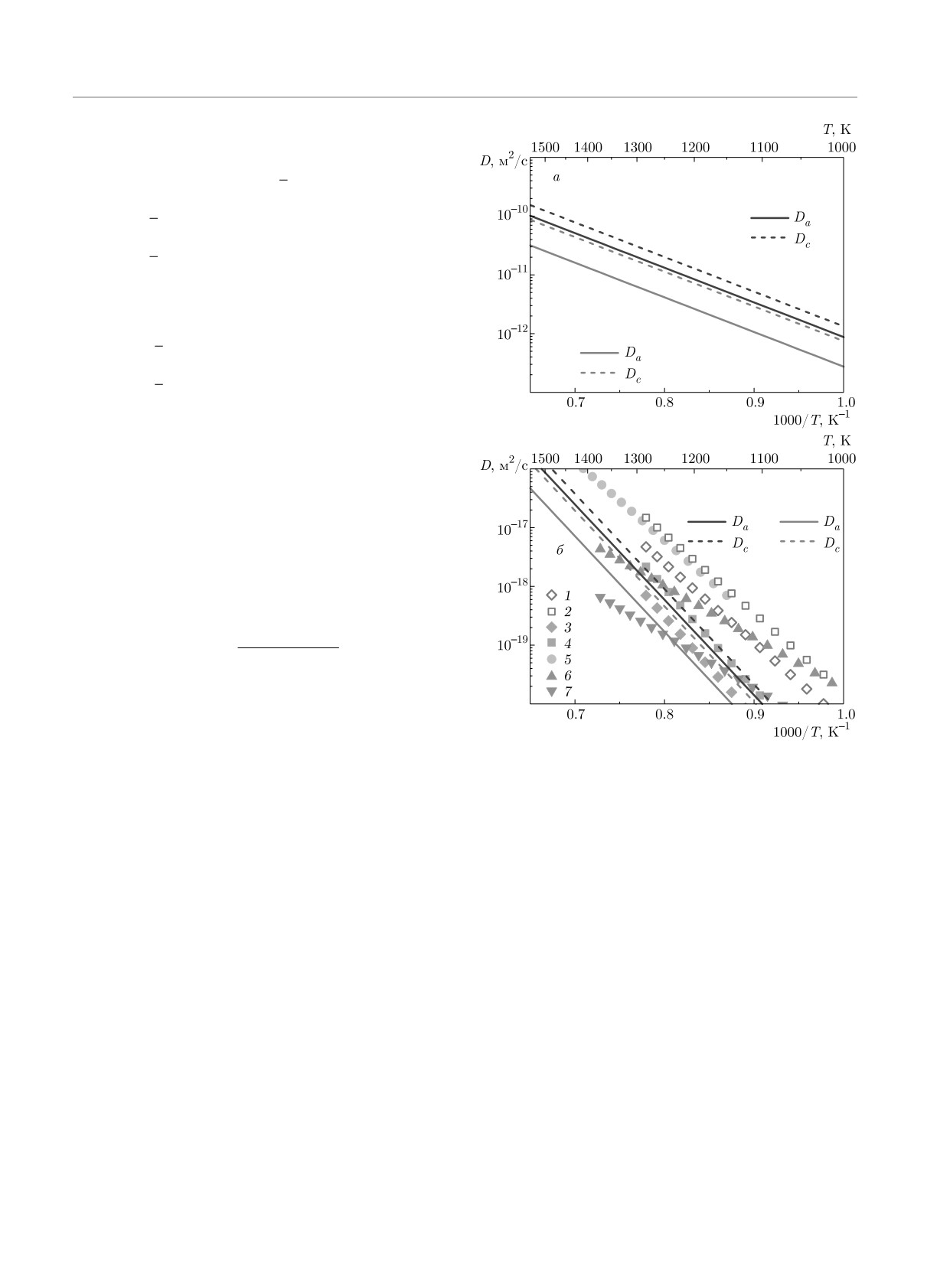
Рис. 2. (В цвете онлайн) Коэффициенты диффузии Da и
вдоль двух кристаллографических направлений,
Dc в TiO2, рассчитанные методом Лэндмана (сплошные
рассчитанные методом Лэндмана, приведены на
и штриховые красные линии), в сопоставлении с резуль-
рис. 2а. Здесь же представлены результаты ста-
татами, полученными в рамках статистического подхода
тистического подхода [23]. Видно, что оба метода
(сплошные и штриховые синие линии), без учета концен-
трации O-вакансий (а), а также с учетом концентрации
дают близкие результаты, при этом энергия актива-
O-вакансий в сравнении с экспериментальными данными
ции диффузии вдоль обоих кристаллографических
(б): 1 — [24] быстрый механизм Da, 2 — [24] быстрый ме-
направлений равна 1.18 эВ в методе Лэндмана и
ханизм Dc, 3 — [24] медленный механизм Da, 4 — [24]
1.17 эВ в статистическом подходе.
медленный механизм Dc, 5 — [25], 6 — [26] природный
рутил, 7 — [26] синтезированный рутил
3.2. Влияние концентрации вакансий на
коэффициент диффузии
Для оценки концентрации кислородных вакан-
вдоль осей a и c в оксиде с учетом концентрации О-
сий использовался подход, описанный в работе [27].
вакансий представлены на рис. 2б. Видно, что тео-
В рамках данного подхода концентрация вакансий
ретические коэффициенты диффузии находятся в
зависит от парциального давления кислорода, тем-
хорошем согласии с экспериментом [24] для медлен-
пературы, заряда вакансии и энергии Ферми. Ниже
ного диффузионного механизма, но они меньше экс-
приводятся результаты, полученные для фиксиро-
периментальных значений из работы [25]. Послед-
ванного парциального давления O2 (ln(P(O2)/P0) =
ние находятся в хорошем согласии с результатами
= -20). Рассчитанные коэффициенты диффузии
работы [24] для быстрого диффузионного механиз-
209
А. В. Бакулин, Л. С. Чумакова, С. Е. Кулькова
ЖЭТФ, том 160, вып. 2 (8), 2021
ма. Отметим, что экспериментальные результаты,
способ учесть наличие примесей заключается в ис-
полученные для природного и синтетического ру-
пользовании в расчетах средневзвешенных значений
тила [26], отличаются от результатов [24, 25] накло-
энергий образования вакансии и миграции:
ном кривых. Понижение энергии активации кисло-
]
2[
родной диффузии авторы [26] связывают с отжи-
Ef =
cimpEfdop(1) + (1 - cimp)Ef
+
undop
гом рутила в воде при высоких температурах. От-
3
]
1[
метим, что диффузия кислорода в рамках междо-
+
cimpEfdop(2) + (1 - cimp)Ef
,
(14)
undop
3
узельного механизма изучалась в работе [28], при
этом рассматривалась миграция дважды ионизиро-
[
]
ванного атома кислорода. Интересно, что диффу-
1
1
Em(A) = cimp
Emdop(A) +
Emundop(A)
+
зивность O2--иона удовлетворительно согласуется с
2
2
результатами [24] для быстрого диффузионного ме-
+(1 - cimp)Emundop(A),
ханизма. Это позволяет предположить, что медлен-
Em(B) = cimpEmdop(B) + (1 - cimp)Emundop(B),
(15)
ный и быстрый механизмы диффузии соответству-
[
]
ют вакансионному и междоузельному.
1
1
Em(C) = cimp
Emdop(C) +
Emundop(C)
+
Согласно настоящим расчетам коэффициенты
2
2
диффузии кислорода в TiO2 вдоль осей a и c в ме-
+(1 - cimp)Emundop(C),
тоде Лэндмана описываются следующими формула-
ми:
где Efdop(1) и Efdop(2) — энергии образования вакан-
в позиции 1 и 2
сии кислорода в легированном TiO2
Da = 0.178 · 10-6 exp(-3.23/kBT) м2/с,
(10)
(рис. 1а), Efundop — энергия образования O-вакансии
в нелегированном оксиде, Emdop(A), Emdop(B), Emdop(C)
Dc = 0.484 · 10-6 exp(-3.23/kBT) м2/с,
(11)
и Emundop(A), Emundop(B), Emundop(C) — энергии ми-
где kB — постоянная Больцмана, а T — температу-
грации кислорода в легированном и нелегированном
ра.
TiO2 соответственно вдоль путей A, B и C, cimp —
В статистическом подходе эти коэффициенты
концентрация примеси. Множители 2/3 и 1/3 в фор-
равны
муле (14) отражают тот факт, что вблизи примеси
находится в два раза больше позиций 1, чем позиций
Da = 5.68 · 10-6 exp(-3.22/kBT) м2/с,
(12)
2. Множитель 1/2 в выражениях (15) для энергии
миграции кислорода вдоль путей A и C обусловлен
Dc = 8.63 · 10-6 exp(-3.22/kBT) м2/с.
(13)
возможностью диффузии вблизи или вдали от при-
Коэффициент анизотропии диффузии Dc/Da в
месного атома, причем число путей этих двух типов
методе Лэндмана (2.7) существенно выше, чем в ста-
одинаково. В то же время перескок вдоль пути B
тистическом подходе (1.5), и удовлетворительно со-
всегда проходит вблизи примеси.
гласуется с экспериментальным значением 3.1 для
Результаты расчета влияния концентрации при-
медленного механизма диффузии [24].
меси на примере Cr и Nb на температурный коэф-
фициент диффузии в TiO2 представлены на рис. 3а.
Отметим, что приводятся результаты, полученные
3.3. Влияние примеси на коэффициент
для диффузии кислорода в поликристаллическом
диффузии
легированном диоксиде титана. Коэффициент диф-
Для учета влияния примеси в методе Лэндма-
фузии вычислялся как среднее геометрическое от
на необходимо увеличивать ячейки, чтобы достичь
коэффициентов диффузии вдоль трех взаимно пер-
нужной концентрации примеси, что увеличивает
пендикулярных направлений. Видно, что на ло-
размерность матриц
ψ(u) и p(k) и усложняет по-
гарифмической шкале зависимость коэффициента
лучение аналитических выражений для D. В этой
диффузии от примеси описывается линейным за-
связи использование статистического метода явля-
коном, что указывает на экспоненциальную зави-
ется более удобным для оценки влияния примесей
симость коэффициента диффузии от концентрации
на температурный коэффициент диффузии. В дан-
примеси. Нами были рассмотрены примеси, которые
ном подходе необходимо принять во внимание веро-
наиболее часто упоминаются в экспериментальных
ятность того, что О-вакансия и атом примеси нахо-
работах по изучению коррозионной стойкости леги-
дятся в первых соседях. Она пропорциональна кон-
рованного сплава TiAl. На рис. 3б приведены ко-
центрации вакансий и примесей. Наиболее простой
эффициенты диффузии кислорода в легированном
210
ЖЭТФ, том 160, вып. 2 (8), 2021
Изучение диффузионных свойств кислорода.. .
TiO2 как функция обратной температуры. Для на-
глядности на рис. 3в представлены значения коэф-
фициента диффузии при температуре 1150 К, кото-
рая показана на рис. 3б вертикальной линией. Вид-
но, что Nb, Ta, W и Si приводят к уменьшению кис-
лородной диффузивности, тогда как Al, Ga и Cr, на-
против, способствуют повышению диффузии кисло-
рода. Негативный эффект Cr на коррозионную стой-
кость TiAl и, наоборот, положительный эффект Nb,
W и Si был неоднократно подтвержден эксперимен-
тально, например, в работах [29,30] и ссылках к ним.
4. ЗАКЛЮЧЕНИЕ
Методом проекционных присоединенных волн
рассчитаны энергии образования кислородной ва-
кансии и миграционные барьеры кислорода в ле-
гированном и нелегированном TiO2 со структурой
рутила. Показано, что легирование оксида Zr, Hf,
Nb, Ta и W ведет к увеличению энергии образова-
ния кислородных вакансий, тогда как влияние Re
неоднозначно и зависит от позиции вакансии вблизи
примеси. В рамках метода Лэндмана получены ана-
литические выражения для температурного коэф-
фициента диффузии вдоль двух кристаллографи-
ческих направлений. Показано, что диффузия кис-
лорода вдоль оси c идет быстрее, чем вдоль a. В
целом результаты расчета коэффициентов диффу-
зии вдоль двух осей согласуются с полученными в
рамках статистического подхода, а также с экспе-
риментом [24] для медленного механизма диффу-
зии. Впервые изучено влияние ряда примесей пере-
ходных металлов и элементов IIIA и IVA групп на
температурный коэффициент диффузии кислорода
в диоксиде титана. Показано, что Nb, Ta, W и Si спо-
собствуют уменьшению кислородной диффузивно-
сти в оксиде. Положительный эффект данных при-
месей на коррозионную стойкость сплава TiAl на-
ходится в согласии с имеющимися эксперименталь-
ными данными. В целом температурный коэффи-
циент диффузии кислорода в нелегированном TiO2
ниже на 7-10 порядков в зависимости от температу-
ры, чем соответствующий в сплаве TiAl [6]. Таким
Рис. 3. (В цвете онлайн) Влияние концентрации примеси
образом, метод Лэндмана и статистический подход
замещения (Cr и Nb) на коэффициент диффузии кисло-
в сочетании с методами в рамках теории функци-
рода в поликристаллическом TiO2 (а); теоретический тем-
онала электронной плотности и теории переходно-
пературный коэффициент диффузии кислорода в легиро-
го состояния являются полезным инструментом для
ванном оксиде для концентрации примеси, равной 10 ат. %
решения задач, связанных с диффузией кислорода
(б); то же при температуре 1150 К (в)
как в оксидах, так и в сплавах.
211
А. В. Бакулин, Л. С. Чумакова, С. Е. Кулькова
ЖЭТФ, том 160, вып. 2 (8), 2021
Финансирование. Работа выполнена в рам-
14.
L. Zhu, Q. M. Hu, R. Yang et al. J. Phys. Chem.
ках государственного задания ИФПМ СО РАН
C 116, 24201 (2012).
(FWRW-2019-0031). Численные расчеты проводи-
15.
H. Iddir, S.
Öğüt, P. Zapol et al., Phys. Rev. B 75,
лись на суперкомпьютере СКИФ Cyberia в Томском
073203 (2007).
государственном университете.
16.
P. E. Blöchl, Phys. Rev. B 50, 17953 (1994).
17.
G. Kresse and D. Joubert, Phys. Rev. B 59, 1758
ЛИТЕРАТУРА
(1999).
1.
Z. Li and W. Gao, in Intermetallics Research Prog-
18.
J. P. Perdew, K. Burke, and M. Ernzerhof, Phys. Rev.
ress, ed. by Y. N. Berdovsky, Nova Sci. Publ., New
Lett. 77, 3865 (1996).
York (2008), p. 1.
2.
S. E. Kulkova, A. V. Bakulin, and S. S. Kulkov, Latv.
19.
H. J. Monkhorst and J. D. Pack, Phys. Rev. B 13,
5188 (1976).
J. Phys. Tech. Scil. 6, 20 (2018).
3.
Y. A. Bertin, J. Parisot, and J. L. Gacougnolle, J.
20.
S. C. Abrahams and J. L. Bernstei, J. Chem. Phys.
Less Common Met. 69, 121 (1980).
55, 3206 (1971).
4.
А. М. Латышев, А. В. Бакулин, С. Е. Кулькова и
21.
G. Henkelman, B. P. Uberuaga, and H. J?nsson, J.
др., ЖЭТФ 150, 1140 (2016).
Chem. Phys. 113, 9901 (2000).
5.
Y. Koizumi, M. Kishimoto, Y. Minamino et al., Phil.
22.
F. P. Ping, Q. M. Hu, A. V. Bakulin et al., Interme-
Mag. 88, 2991 (2008).
tallics 68, 57 (2016).
6.
А. В. Бакулин, С. С. Кульков, С. Е. Кулькова,
23.
A. V. Bakulin, B. M. Elfimov, E. V. Matiskina et al.,
ЖЭТФ 157, 688 (2020).
AIP Conf. Proc. 2310, 020026 (2020).
7.
U. Landman and M. F. Shlesinger, Phys. Rev. B 19,
24.
D. K. Moore, D. J. Cherniak, and E. B. Watson, Am.
6207 (1979).
Mineral. 83, 700 (1998).
8.
U. Landman and M. F. Shlesinger, Phys. Rev. B 19,
25.
W. D. Kingery, H. K. Bowen, and D. R. Uhlman, in
6220 (1979).
Introduction to Ceramic, John Wiley & Sons, New
9.
H. H. Wu and D. R. Trinkle, Phys. Rev. Lett. 107,
York (1976), p. 217.
045504 (2011).
26.
P. F. Dennis and R. Freer, J. Mater. Sci. 28, 4804
10.
H. Wu, Oxygen Diffusion Through Titanium and
(1993).
Other HCP Metals, University of Illinois, Urbana,
27.
J. He, M. W. Finnis, E. C. Dickey et al., Adv. Sci.
Illinois (2013).
Tech. 45, 1 (2006).
11.
D. Connétable, Int. J. Hydrogen Energy 44, 12215
28.
H. Jeong, E. G. Seebauer, and E. Ertekin, Phys.
(2019).
Chem. Chem. Phys. 20, 17448 (2018).
12.
E. Epifano and G. Hug, Comput. Mater. Sci. 174,
109475 (2020).
29.
Y. Shida and H. Anada, Oxid. Met. 45, 197 (1996).
13.
D. Connétable, A. Prillieux, C. Thenot et al., J.
30.
J. Dai, J. Zhu, C. Chen et al., J. Alloys Comp. 685,
Phys.: Condens. Matter 32, 175702 (2020).
784 (2016).
212