ВВЕДЕНИЕ
Производные холина (Ch) ацетилхолин (ACh) и L-карнитин (LCh), содержащие катион тетраалкиламмония (СН3)3RN+, можно отнести к большому классу четвертичных аммониевых соединений (QAC), катионных биоцидов с широким спектром антимикробной активности [1]. Анализ бактерицидного действия сочетаний многих QAC с различными носителями, представленный в обзорах [2–4], показал, что объединение фрагментов QAC с полимерными материалами представляет собой одну из наиболее перспективных стратегий получения антимикробных биоматериалов. Однако отмечается, что молекулярный механизм биоцидных эффектов до конца не изучен. Ранее [5–7] на примере ряда катионных поверхностно-активных веществ (кПАВ), относящихся к QAC, нами было установлено, что кПАВ каталитически ускоряют распад на радикалы гидропероксидов (ROOH), первичных продуктов окисления многих соединений. Это явление обусловлено образованием супрамолекулярных структур – смешанных мицелл кПАВ–ROOH, в которых облегчается гомолитический распад пероксидной связи. Способность кПАВ катализировать распад ROOH и генерировать радикалы сохраняется при их иммобилизации на целлюлозе и монтмориллоните. В [8–11] было продемонстрировано, что в органических средах ацетилхолин (ACh), известный нейромедиатор, подобно кПАВ ускоряет окисление углеводородов и липидов, и что ключевая реакция, определяющая влияние ACh на скорость окисления, – это каталитическое разложение ROOH в смешанных супрамолекулярных наноагрегатах с образованием радикалов:
Эндогенные QAC, производные холина, синтезируются в живых организмах и играют важную роль в их функционировании [12]. Холин (Ch, 2-гидроксиэтилтриметиламмония, [(CH3)3N+CH2CH2OH] X−) является предшественником ацетилхолина [13] и способствует нейропластичности нервной системы. Допустимый верхний уровень потребления Ch для взрослых составляет 3500 мг в день.
Ацетилхолин (ACh, [(CH3)3N+CH2CH2O (O)CCH3] X−, N-триметил-2-аминоэтанола ацетат,) – это ключевой медиатор в центральной и периферической нервной системах, он играет решающую роль в обучении, памяти, вегетативном контроле и мышечных сокращениях [14]. С возрастом биосинтез ACh замедляется, и его сопровождают многие нейродегенеративные заболевания. Биомедицинские исследования последних лет показывают, что ACh синтезируется и функционирует не только в нейрональной системе, но принимает участие в других физиологических и патологических процессах. Способность продуцировать ACh обнаружена для Т-клеток, реагирующих на вирусную инфекцию [15], однако молекулярный механизм включения ACh в иммунную защиту пока не обсуждается.
L-карнитин (LCh) представляет собой небелковую β-гидрокси-γ-триметиламиномасляную кислоту (CH3)3N+CH2CH(OH)–CH2–C(O)O–), которая синтезируется из незаменимых аминокислот лизина и метионина [16]. LCh способствует β-окислению длинноцепочечных жирных кислот, участвует в метаболизме аминокислот с разветвленной цепью и стабилизирует клеточные мембраны [16, 17]. В работах [18, 19] показано, что модификация глинистых минералов L-карнитином специфически повышает адсорбционные свойства материала и может быть полезной стратегией для повышения селективности органоглин при удалении определенных органических токсинов.
В настоящей работе исследовано влияние природных QAC, производных холина, на распад гидропероксидов третбутила (HTB) и кумила (HC) (схема 1 ), проведено сопоставление размерных характеристик микроагрегатов, образованных AСh, Ch и LCh с гидропероксидами в растворе хлорбензола, и скоростей генерирования радикалов в этих системах. Рассмотрена возможность производных холина, будучи иммобилизованными на твердом носителе, в сочетании с ROOH выступать в качестве гетерогенного катализатора радикального распада гидропероксидов на поверхности носителя.
Схема 1 . Производные холина, гидропероксиды и кверцетин.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Ацетилхолин хлорид (ACh), яичный фосфатидилхолин (РСh), гидропероксид третбутила (HTB), гидропероксид кумила (HC) и кверцетин (Q) (все “Fluka”), холин хлорид (Ch), (“PanReac AppliChem”), L-карнитин (LCh) (“Merck”), хлорбензол (“Sigma-Aldrich”) использовали без дополнительной очистки.
Растворы гидропероксидов (20 мМ) готовили в хлорбензоле, концентрацию пероксида определяли методом йодометрического титрования. Базовые растворы ACh, Ch, LCh (2 × 10–2 М) готовили в смеси хлороформ : метанол (2 : 1).
Скорость образования радикалов при каталитическом распаде гидропероксидов в смешанных агрегатах с производными холина (Wi) определяли методом ингибиторов с применением в качестве акцептора радикалов кверцетина, концентрацию которого в ходе реакции контролировали спектрофотометрически. Реакцию проводили непосредственно в кварцевой кювете (1 см) однолучевого спектрофотометра СФ-2000 (“ОКБ Спектр”) при комнатной температуре (22°С). В кювете сравнения содержался раствор гидропероксида (20 мМ) и производного холина (1 мМ) в хлорбензоле, что близко к критической концентрации мицеллообразования (ККМ) для ACh в присутствии ROOH [12]. Затем добавляли кверцетин и проводили измерение. Коэффициент молярной экстинкции для Q при максимуме поглощения 374 нм в хлорбензоле ε = 3 × 104 л моль–1 см–1, коэффициент ингибирования f = 2. Погрешность определения скорости инициирования не превышала 15%. Пример изменения спектров поглощения Q в ходе реакции и кинетических кривых уменьшения оптической плотности в максимуме поглощения при λmax = 374 нм представлен на рис. 1а и 1б.
Рис. 1.
а – Изменение спектров поглощения Q (3.5 × 10–5 М) в течение 30 мин в системе НС (20 мМ)–AСh (1 мМ) в хлорбензоле при 22°С; б – кинетические кривые изменения оптической плотности реакционной смеси в максимуме поглощения (374 нм) при различных концентрациях Q: 1.0 × 10–5 (1), 2.0 × 10–5 (2) и 3.5 × 10–5 М (3).

Средний размер микроагрегатов производное холина–гидропероксид определяли методом динамического светорассеяния (ДСР) с помощью анализатора Zetasizer NanoZS (“Malvern Instruments”, Великобритания), оснащенном 4 мВт He–Ne-лазером с длиной волны 633 нм, аналогично [11].
Путем адсорбции производных холина из их растворов в хлороформе (0.12 М) на поверхность микрокристаллической целлюлозы были получены потенциальные катализаторы радикального распада гидропероксидов. Их способность генерировать радикалы и инициировать радикальную полимеризацию исследовали методом изотермической калориметрии на приборе ДАК-1-1 (“ЭЗАН”, Россия) в модельной реакции радикальной полимеризации стирола при 60°С. Ампулы для калориметрических измерений, заполненные реакционной смесью, вакуумировали (давление не выше 10–4 Па) и запаивали. Погрешность определения скорости полимеризации не превышала 15%.
Возможность окислительной конденсации ненасыщенных липидов (яичного фосфатидилхолина) в присутствии гидропероксидов на поверхности кремниевых пластинок с адсорбированными ACh, Ch, LCh изучали методом сканирующей электронной микроскопии (СЭМ) на приборе Prisma E (“Thermo Scientific”, Чехия). Предварительно на пластинки напыляли 10 нм слой золота с помощью установки Quorum Q150R (“Quorum Technologies Ltd”, Великобритания).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
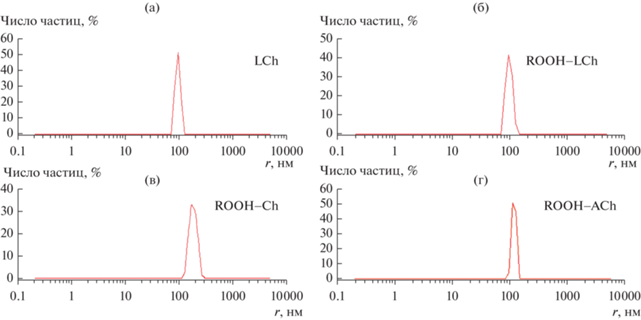
Исследование размерных характеристик систем, образующихся при смешении производных холина с гидропероксидами кумила (рис. 2) и трет-бутила в хлорбензоле, методом ДСР показало, что во всех случаях имеет место образование наночастиц. Ch и AСh диспергируются только в сочетании с ROOH (рис. 2в, 2г), а LCh способен и в отсутствие ROOH (рис. 2а) образовывать микроагрегаты с характерным размером 100 нм, который практически не изменяется при добавлении ROOH (рис. 2б).
Рис. 2.
Распределение по размерам частиц, образующихся при диспергировании 1 мМ LCh в хлорбензоле (а) и производных холина в 20 мМ растворе HC: LCh (б), Ch (в), AСh (г).
Скорости образования радикалов (Wi), измеренные методом ингибиторов по скорости расходования кверцетина, представлены в табл. 1. Видно, что при одинаковых начальных концентрациях реагентов скорость генерирования радикалов при распаде обоих гидропероксидов уменьшается в ряду: ACh > Ch $ \gg $ LCh.
Таблица 1.
Скорости инициирования радикалов Wi в системах производное холина (R4N+)–ROOH*
| Система | Ацетилхолин (AСh) |
Холин (Ch) |
Карнитин (LCh) |
Без катализатора | |
|---|---|---|---|---|---|
| Wi × 109, M/c | 1 мМ (R4N+), 20 мМ HC | 3.4 ± 0.5 | 1.9 ± 0.3 | <0.01 | ∼0 |
| 1 мМ (R4N+), 20 мМ HTB | 1.4 ± 0.2 | 0.13 ± 0.02 | <0.01 | ∼0 | |
Согласно [20], инициирование радикалов при участии гидропероксидов в жидкой фазе происходит преимущественно в реакциях второго порядка (I), которые протекают с меньшими энергиями активации по сравнению с мономолекулярным распадом пероксидной связи:
где Y может представлять ROOH, RH или >C=C<. Бимолекулярный распад 0.02 М НС (Y = = ROOH) с константой скорости k = 7.2 × × 104 exp(–81000/RT) M–1 c–1 [20] при 22°С может генерировать радикалы со скоростью Wi = 1.3 × × 10–13 М/с. Таким образом, ACh и Ch существенно увеличивают скорость радикального распада гидропероксида.Стоит отметить, что LCh практически не диспергируется в н-декане даже в присутствии гидропероксида, тогда как Ch, подобно ACh, совместно с ROOH образуют наноагрегаты размером 150–200 нм. Из табл. 1 видно, что в сочетании с HC все производные холина демонстрируют более высокие значения Wi по сравнению с HTB. В работе [11] было проведено детальное сопоставление Wi в смесях AСh с HC и HTB в н-декане и хлорбензоле при смешении реагентов и изменений Wi с течением времени, которое показало, что Wi относительно меньше в ароматическом растворителе. При смешении реагентов Wi было больше в системе ACh–HC, но в течение недели в этой системе происходило медленное уменьшение Wi, а в системе AСh–HTB, наоборот, имело место возрастание Wi в несколько раз. Все результаты, полученные для производных холина, согласуются с представлениями о катион-π-взаимодействии катионов R4N+ с ароматическими фрагментами в биологических сайтах связывания [21–23]: ароматические фрагменты в хлорбензоле и в гидропероксиде кумила способствуют связыванию с R4N+, но нарушают ориентацию, оптимальную для радикального распада гидропероксидов.
L-карнитин, в отличие от других производных холина, является внутренней солью, в которой аммонийный катион R4N+ нейтрализуется собственным карбоксильным анионом, т.е. LCh не требует внешнего противоиона и, очевидно, отличается от AСh и Сh по механизму формирования микроагрегатов с ROOH. Вероятно, LCh образует структуры, труднодоступные для включения ROOH, что отражается в величине скорости инициирования радикалов.
Ранее [11] нами было показано, что ACh, адсорбированный на твердой поверхности, сохраняет способность каталитически ускорять радикальный распад гидропероксидов и инициировать радикально-цепные процессы окисления и полимеризации. Гидрофильные производные холина хемосорбируются на целлюлозе (табл. 2), с которой они могут связываться не только как R4N+, но и за счет водородных связей. Гетерогенные катализаторы, полученные путем хемосорбции Ch, AСh и LСh на микрокристаллической целлюлозе, были испытаны в качестве катализаторов распада HC в модельной реакции радикальной полимеризации стирола. На рис. 3а, 3б представлены кинетические кривые конверсии и приведенной скорости полимеризации (W/[M], где М – мономер) в радикальной полимеризации стирола в присутствии 50 мМ HC и 4 мас. % катализаторов ACh/Cel, Ch/Cel и LCh/Cel при 60°С. Видно, что добавки катализаторов ACh/Cel и Ch/Cel увеличивают начальные скорости полимеризации, а LCh/Cel практически не оказывает действия на начальную скорость и конверсию стирола. Влияние LCh проявляется только в 5%-ном снижении максимальной приведенной скорости (рис. 3б, кривая 3).
Таблица 2.
Величина адсорбции (Γ) производных холина на поверхности микрокристаллической целлюлозы, а также экспериментальные скорости полимеризации (W/[M0])* стирола и расчетные скорости инициирования цепей (Wi) в присутствии катализаторов
| Катализатор | ACh | Ch | LCh | Без катализатора |
|---|---|---|---|---|
| Адсорбция ПАВ, Γ × 104, моль/г | 7.9 | 20.8 | 19.4 | – |
| (W/[M0]) × 106, с–1 | 5.7 | 5.65 | 4.4 | 4.3 |
| Wi × 108, моль л–1 с–1 | 7.3 | 7.2 | 4.4 | 4.1 |
Рис. 3.
Зависимость конверсии С от времени (а) и приведенной скорости полимеризации (W/[M]) от конверсии (б) в процессе полимеризации стирола, инициированной 0.05 М гидропероксида кумила, с добавками 4 мас. % гетерогенных катализаторов: 1 – без катализатора; 2 – ACh/Cel; 3 – LCh/Cel; 4 – Ch/Cel. Т = 60°С.
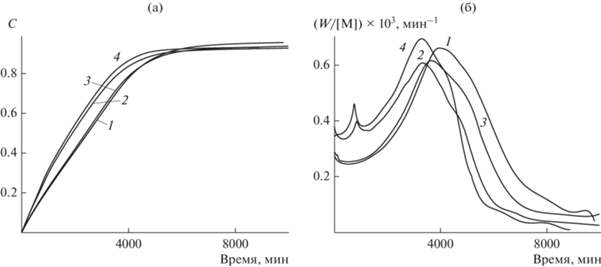
Начальная скорость полимеризации в присутствии ACh/Cel и Ch/Cel выше в ~1.33 раза по сравнению с полимеризацией в отсутствие катализатора. На кривых зависимости W/[M] от конверсии (рис. 3б) наблюдаются 2 максимума: первый при конверсии 0.25, второй – 0.74–0.79. Если второй максимум связан с гель-эффектом и дальнейшим падением скорости в результате квадратичного обрыва цепи, то первый обусловлен, вероятно, дополнительным гетерогенным инициированием с поверхности твердого носителя с иммобилизованными AСh и Ch и дальнейшим падением скорости за счет экранирования макромолекулами и продолжением полимеризации в объеме, которой соответствует кривая без катализатора (1).
Согласно теории, уравнение для скорости радикальной полимеризации при небольших конверсиях имеет вид [20, 24]:
где Wi – скорость инициирования, a = kp/(2kt)0.5 – отношение констант скорости роста (kp) и обрыва (kt) цепи, которое определяется активностью мономера (М) и ведущего цепную реакцию макрорадикала. Как следует из уравнения (1), наряду с Wi параметр a в значительной степени определяет величину скорости полимеризации. Для стирола при 60°С a = 0.021 (л моль–1 с–1)0.5 [24], и скорость инициирования можно вычислить по уравнению (2):Несмотря на то что Ch и LCh лучше адсорбируются на поверхности твердого носителя, измерения скорости полимеризации и оценка скорости инициирования, полученные в присутствии гетерогенных катализаторов, показали: Ch и ACh близки по активности в генерировании радикалов, а иммобилизованный LCh практически не оказывает каталитического действия на распад ROOH. Скорость полимеризации в присутствии LCh/Cel очень близка к скорости полимеризации, инициированной только термическим распадом НС. Эти данные свидетельствуют о различиях в механизме адсорбции LCh в сравнении с ACh и Ch. Возможно, LCh образует сетку на поверхности порошка, недоступную для гидропероксида, и поэтому не влияет на его распад.
Сходные результаты были получены при изучении инициирования окислительной конденсации ненасыщенных липидов на плоской поверхности кремниевых пластинок с адсорбционным монослоем производных холина (рис. 4).
Рис. 4.
СЭМ-изображения участков кремниевых пластинок с иммобилизованными на них ACh (а), Ch (б) и LCh (в), выдержанных в растворе 20 мМ НС и 1 мМ РСh, и с первичным адсорбционным слоем AСh (г).

Такие пластинки с иммобилизованными на них ACh, Ch и LCh погружали на 2 ч в хлороформный раствор НС (20 мМ) и ненасыщенного липида – яичного фосфатидилхолина (РСh, 1 мМ), в состав которого входит около 60% остатков линолевой кислоты. Анализ методом сканирующей электронной микроскопии показал, что в среде, содержащей РСh и НС, на поверхности пластинок, предварительно обработанных холином и ацетилхолином, выросли “холмики” сшитых фосфолипидов (рис. 4а, 4б), а на пластинке с иммобилизованным L-карнитином “холмики” не обнаружены (рис. 4в). Эти результаты позволяют предположить, что окислительная полимеризация ненасыщенных липидов и липопротеинов на адсорбционных слоях ACh и Ch в условиях окислительного стресса, когда в крови повышается содержание пероксидов и других активных форм кислорода, может приводить к зарождению и развитию атеросклероза, и эксперименты с окислительной конденсацией фосфатидилхолина в присутствии гидропероксида на поверхности кремниевой пластинки с хемосорбированными ACh и Ch можно рассматривать как первый шаг в моделировании атеросклероза.
ЗАКЛЮЧЕНИЕ
Полученные данные свидетельствуют о способности Сh и ACh катализировать распад ROOH на радикалы в смешанных супрамолекулярных наноагрегатах, образующихся в органических средах, и при адсорбции на целлюлозе и других поверхностях с отрицательным зарядом. Возможно, генерирование радикалов при взаимодействии QAC с гидропероксидами и последующие радикальные реакции в условиях окислительного стресса и стимулирующие окислительный стресс являются одним из механизмов бактерицидного действия QAC. Использование нетоксичных QAC холина и/или ацетилхолина в сочетании с гидропероксидами в качестве инициаторов радикалов открывает пути к получению интересных полимерных композитов.
LCh является внутренней солью и, в отличие от AСh и Сh, не требует наличия противоионов. LCh и в отсутствие ROOH способен в среде хлорбензола образовывать наноагрегаты (100 нм). LCh представляет собой менее активный катализатор радикального распада ROOH в органических средах и практически не влияет на распад ROOH при иммобилизации на твердом носителе. Вероятно, благодаря этому свойству именно LCh стабилизирует клеточные мембраны [16, 17] и повышает адсорбционные свойства и селективность органоглин, отмеченные в [18, 19], при удалении определенных органических токсинов.
