ВВЕДЕНИЕ
В последнее время неизменно возрастает необходимость терапии тяжелых форм респираторных заболеваний, которые могут быть вызваны в том числе и осложнениями при протекании различных вирусных заболеваний, например, COVID-19. На сегодняшний день большинству пациентов, поступающих в стационар с диагнозом “пневмония тяжелого течения”, до определения этиологии заболевания назначается антибактериальная терапия в упреждающем режиме. Для ее проведения используется ряд антимикробных молекул (АМ): фторхинолоны (III и IV поколения), амоксициллин/клавулановая кислота, цефалоспорины III (цефотаксим, цефтриаксон), цефтаролинфосамил, меропенем [1, 2]. К сожалению, все применяемые в клинической практике препараты не лишены недостатков, таких как ограниченная растворимость, низкая биодоступность и высокая вероятность возникновения побочных эффектов [3, 4]. Таким образом, увеличивается актуальность разработки новых лекарственных форм антибактериальных препаратов, которые позволят усовершенствовать эффективность терапии и улучшить фармакокинетические и фармакодинамические параметры лекарств за счет изменения их физико-химических свойств. Особый интерес представляют системы доставки на основе нековалентных комплексов производных β-циклодекстринов (ЦД) с антибактериальными препаратами.
Перспективными носителями для лекарственных молекул, прекрасно зарекомендовавшими себя в медицине, являются ЦД, которые представляют собой семейство циклических олигосахаридов, состоящих из остатков D-глюкопиранозы [5]. ЦД получили широкое распространение в фармацевтической промышленности, поскольку они способны увеличивать растворимость препаратов и снижать их токсичность путем формирования нековалентных комплексов включения по механизму “гость−хозяин”. Помимо этого, комплексообразование с ЦД способствует улучшению стабильности лекарственных молекул и позволяeт создавать формуляции с заданными фармакокинетическими характеристиками [6, 7]. Важными преимуществами ЦД являются их доступность, небольшая стоимость и крайне низкая токсичность для живых организмов [8]. Среди представителей класса ЦД наибольшее применение в медицинской практике находит гидроксипропил-ЦД (ГПЦД), поскольку он обладает лучшей растворимостью среди производных ЦД [7].
Для изучения эффективности систем доставок АМ в данной работе были исследованы представители двух классов антибиотиков: цефтриаксон и левофлоксацин, которые активно используются для лечения различных видов инфекций.
Цефалоспорины – второй по величине класс β-лактамных антибиотиков, обладающих широким спектром активности против как грамположительных, так и грамотрицательных бактерий [9]. Механизм действия цефалоспоринов основан на инактивации бактериальной транспептидазы, фермента, который отвечает за синтез клеточной стенки микроорганизма. Наиболее востребованным представителем данного класса антибиотиков является цефтриаксон (ЦТ), который представляет собой полусинтетический препарат третьего поколения. Преимуществом ЦТ является его способность проникать через гематоэнцефалический барьер, что значительно расширяет спектр его применения и выделяет на фоне других лекарственных молекул [9]. Несмотря на высокую эффективность ЦТ, его применение может быть ограничено ввиду низкой стабильности, что обусловлено склонностью амидной связи β-лактамного кольца к гидролизу. Это создает трудности при хранении и непосредственной подготовки к применению препарата. Более того, единственным способом введения ЦТ является парентеральное, что значительно усложняет терапию.
Еще одним важным классом антибактериальных препаратов являются фторхинолоны, которые повсеместно применяются в клинической практике, поскольку обладают широким спектром активности, который включает грамотрицательные и грамположительные аэробные и анаэробные бактерии [10]. Фторхинолоны отличаются высокой химической и биологической стабильностью и разнообразием способов введения. Их бактериальная активность реализуется за счет избирательного ингибирования ДНК-гиразы (топоизомеразы II типа) и топоизомеразы IV, что влечет за собой остановку процесса репликации ДНК микроорганизмов и, как следствие, их деления, при этом ДНК клеток млекопитающих не затрагивается ввиду высокой специфичности фторхинолонов к бактериальным ферментам [3]. Левофлоксацин (ЛВ) является препаратом III поколения фторхинолонов и характеризуется большей антибактериальной активностью в сравнении с представителями фторхинолонов более ранних поколений. Несмотря на все преимущества фторхинолонов, продолжительный курс лечения и высокие дозировки препарата могут быть причиной возникновения побочных эффектов [11].
Таким образом, актуальной задачей является минимизация побочных эффектов и увеличение стабильности, биодоступности АМ путем создания высокоэффективных систем доставки.
Для успешного применения комплексов АМ-ЦД в медицинской практике необходимо изучить параметры их взаимодействия с человеческим сывороточным альбумином (ЧСА), поскольку ЧСА является превалирующим белком в плазме крови человека [12]. Его основной функцией является транспорт различных молекул, например, гормонов, жирных кислот и лекарственных молекул [13, 14]. Связывание с белками является одной из важнейших физико-химических характеристик препаратов, поскольку именно белки отвечают за доставку биологически активных молекул к очагу инфекции [15].
В данной работе получены и исследованы комплексы ЦД с препаратами разных классов ЛВ и ЦТ, изучено влияние комплексообразования с ЦД на эффективность и термодинамические параметры связывания АМ с ЧСА. Полученные результаты важны для оценки возможностей влияния систем доставки на фармакокинетические и фармакодинамические свойства лекарственных молекул и, как следствие, улучшения эффективности терапии тяжелых дыхательных инфекций.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
2-Гидроксипропил-β-циклодекстрин, левофлоксацин, цефтриаксона натриевая соль, человеческий сывороточный альбумин – Sigma-Aldrich (США), таблетки для приготовления натрий-фосфатного солевого буферного раствора – ЭкоСервис (Россия), соляная кислота – Реахим (Россия).
Методы
Получение комплексов лекарственный препарат – гидроксипропил-β-циклодекстрин: к раствору антибактериального препарата (АМ) с концентрацией 2 и 10 мМ для ЛВ и ЦТ соответственно в натрий фосфатном буфере (рН 7.4) или солянокислом буфере (рН 2.0) добавляли раствор ГПЦД в количестве, необходимом для получения комплексов с мольным соотношением АМ : ГПЦД от 1 : 0.25 до 1 : 5. Комплексы инкубировали в течение часа при температуре 37°С.
Получение комплексов человеческого сывороточного альбумина с лекарственной формой: к раствору ЧСА в фосфатном буфере (pH 7.4) добавляли требуемое количество раствора АМ или комплекса АМ−ГПЦД с тем же pH и доводили объем раствора буфером до 1 мл. Концентрация ЧСА поддерживалась постоянной во всех образцах и была равна 0.02 мМ, мольный избыток АМ и АМ−ГПЦД варьировался в интервале от 0.3 до 7. Комплексы инкубировали при перемешивании в течение 1 ч в температурном диапазоне от 25°С до 37°С.
УФ-спектры регистрировали на приборе AmerSharm Biosciences UltraSpec 2100 pro (США) трижды в диапазоне 200–400 нм в кварцевой кювете Hellma 100-QS с оптическим путем 10 мм. Растворы лекарственных препаратов готовили в натрий-фосфатном водном солевом буфере, концентрации веществ составляли ~10–6–10–5 М, исследования проводили при 25°С.
ИК-спектры регистрировали на ИК-спектрометре Фурье Tensor 27 Bruker (Германия), оснащенном MCT-детектором, охлаждаемым жидким азотом, с термостатом Huber (США). Образец объемом 40 мкл помещали на кристалл однократного отражения (ZnSe) термостатируемой ячейки (НПВО, BioATR-II, Bruker, Германия). Измерения проводили при постоянной скорости продувки сухим воздухом (Jun-Air, Германия). ИК-спектры фона и образцов регистрировали трижды в интервале от 3000 до 950 см–1 с разрешением 1 cм–1, далее производили 70-кратное сканирование и усреднение в программе Opus 7.0. При исследовании комплексов АМ−ГПЦД в качестве фона регистрировали ИК-спектр ГПЦД в заданной концентрации. Растворы АМ и АМ−ГПЦД готовили в натрий-фосфатном или солянокислом буферном растворе для рН 7.4 и 2.0 соответственно, спектры регистрировали при 25°С.
Расчет констант по Уравнению Скэтчарда: для определения Kdis применялось уравнение линеаризации в координатах Скэтчарда:
Спектры ЯМР 1Н и NOESY регистрировали в D2O (Cambridge Isotope Laboratories, Inc. (D, 99.9%)) на приборе Bruker Avance 400 (рабочая частота 400 МГц) с 5 мм QNP-датчиком при 299 K. В качестве внутреннего стандарта в спектрах использовали сигнал тяжелой воды (δH 4.75 м.д.). Спектры NOESY регистрировали с использованием стандартной последовательности импульсов noesyph и временем смешения (спин-лока) 600 мс.
Спектры эмиссии флуоресценции регистрировали на флуоресцентном спектрометре Varian Cary Eclipse (Agilent Technologies, США) при длине волны возбуждения 289 нм в интервале от 290 нм до 550 нм.
Определение констант Штерна–Фольмера: тушение флуоресценции белка малыми молекулами описано с помощью уравнения Штерна–Фольмера (1), которое учитывает вклад как статического, так и динамического тушения:
(1)
${{F}_{0}}{\text{/}}F = 1 + {{K}_{{{\text{SV}}}}}\left[ Q \right] = 1 + {{k}_{q}}{{\tau }_{o}}\left[ Q \right]$Определение термодинамических параметров системы альбумин-лекарственная форма: константа связывания ЧСА с лекарственной формой (${{K}_{a}}$) и число сайтов связывания (n) были определены с помощью уравнения (2) при температуре 298, 302, 306 и 310 К.
(2)
${\text{lg}}\frac{{{{F}_{0}} - F}}{F} = {\text{lg}}{\kern 1pt} {{K}_{a}} + n{\kern 1pt} {\text{lg}}\left[ Q \right]$Термодинамические параметры, такие как изменение свободной энергии Гиббса ($\Delta G$), изменение энтальпии ($\Delta H$), изменение энтропии ($\Delta S$), реакции были определены с помощью уравнения Вант–Гоффа:
где R – универсальная газовая постоянная.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На процесс комплексообразования АМ с ЦД существенно влияет ионное состояние молекулы лекарства. Так, взаимодействие однозарядных молекул с ЦД протекает успешнее, чем многозарядных, в частности цвиттер-ионов [16]. ЦТ и ЛВ содержат в своих структурах несколько ионогенных функциональных групп [15, 17], которые чувствительны к рН раствора (рис. 1), что может обуславливать различные механизмы взаимодействия с ЦД в зависимости от условий среды.
При физиологическом значении рН крови человека (7.4) левофлоксацин существует в виде цвиттер-иона, а цефтриаксон имеет в своей структуре один положительный и два отрицательных заряда, данные ионные формы характеризуются большей полярностью по сравнению с незаряженными молекулами. При рН 2.0, моделирующем кислую среду желудочного сока, АМ переходят в протонированные формы, причем ЛВ находится преимущественно в виде однозарядного катиона, а ЦТ – в виде двухзарядного, в котором положительные заряды находятся на атоме азота пятичленного кольца и аминогруппе (рис. 1)
Также стоит отметить, что по сравнению с ЛВ молекула ЦТ имеет более гидрофильную природу, поскольку содержит в своей структуре большое число электроотрицательных атомов, которые обуславливают полярность связей и всей молекулы в целом. Напротив, архитектура ЛВ представлена по большей части системой конденсированных колец, которые не вносят вклад в полярность молекулы, что делает ее достаточно гидрофобной.
УФ-спектроскопия
Эффективность взаимодействия лекарственных молекул с ГПЦД в данной работе была исследована несколькими методами. Стандартным классическим методом исследования подобных систем является УФ-спектроскопия [18], так как метод характеризуется простотой проведения эксперимента, разнообразием возможных объектов исследования и минимальными расходами реагентов. Растворы индивидуальных веществ ЛВ и ЦТ имеют спектры поглощения в УФ-области, поскольку содержат в своей структуре хромофорные группы: карбонильные атомы и ароматические системы. Максимум полосы поглощения для ЛВ находится при длине волны 287 нм, обусловленный π–π* переходами ароматического остова фторхинолона, УФ-спектр ЦТ характеризуется двумя максимумами интенсивности при 238 и 282 нм (рис. 2). Данные полосы являются аналитически значимыми для количественного анализа содержания вещества в образце, но не дают детальную информацию о структуре изучаемых соединений.
Рис. 2.
(а) УФ-спектры цефтриаксона в концентрации 40–100 мкМ. (б) УФ-спектры левофлоксацина в концентрации 4–20 мкМ. (в) Калибровочные зависимости цефтриаксона, полученные при длинах волн 238 и 282 нм. (г) Калибровочная зависимость левофлоксацина, полученная при длине волны 287 нм (Т = 25°С, рН 7.4, натрий-фосфатный буфер).
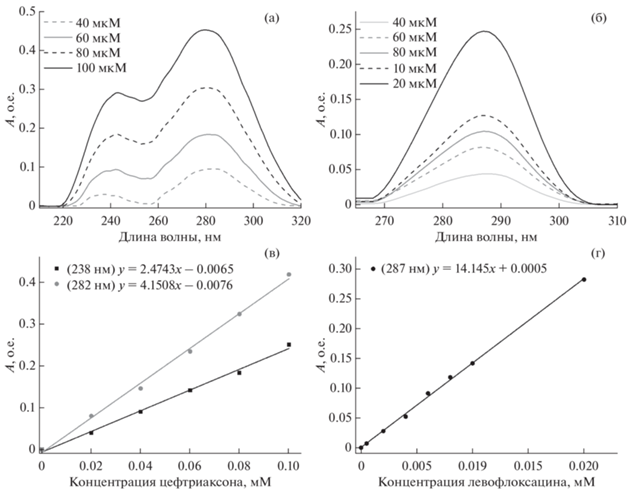
Комплексообразование лекарственных препаратов с ГПЦД приводит к увеличению интенсивности максимумов полос поглощения в спектрах АМ в среднем на 10–15%, что указывает на наличие взаимодействий между ГПЦД и исследуемыми молекулами. Аналогичные изменения в УФ-спектрах отмечены в литературе и другими авторами при исследовании комплексов ЦД-лекарство [18, 19]. Однако предположить молекулярный механизм комплексообразования и структуры комплексов на основании результатов УФ-спектроскопии не представляется возможным.
ИК-спектроскопия
Одним из наиболее информативных методов изучения структуры веществ в растворе является ИК-спектроскопия Фурье, которая позволяет следить за изменением микроокружения отдельных функциональных групп исследуемой молекулы, и как следствие, дает возможность оценить участие данных фрагментов молекулы во взаимодействии с лигандами.
В ИК-спектре ЦТ наблюдается ряд характеристических полос поглощения, наиболее интенсивными из которых являются: 1768 см–1 (соответствующая валентным колебаниям связей С=О β-лактамного кольца), 1420 см–1 (соответствующая деформационным колебаниям –СН3 фрагмента метокси группы), 1042 см–1 (соответствующая валентным колебаниям С–О связей метокси группы) и 1588 см–1 (соответствующая валентным колебаниям связи С=N метилоксимной группы) (рис. 3а) [4]. В интенсивность полосы 1588 см–1 вносит вклад колебания связи С=О карбоксильной группы и связи С=N метилоксимной группы, однако, вклад последней является существенно более значительным согласно литературным данным [20].
Рис. 3.
(а) ИК-спектр цефтриаксона, c = 10 мМ (рН 7.4). (б) ИК-спектр левофлоксацина, с = 3 мМ (рН 7.4). (в) ИК-спектр гидроксипропил-β-циклодекстрина, с = 34 мМ (рН 7.4). (г) Изотермы сорбции цефтриаксона с гидроксипропил-β-циклодекстрином при рН 2.0 и 7.4 (1588 см–1) (Т = 25°С, натрий-фосфатный или солянокислый буфер).
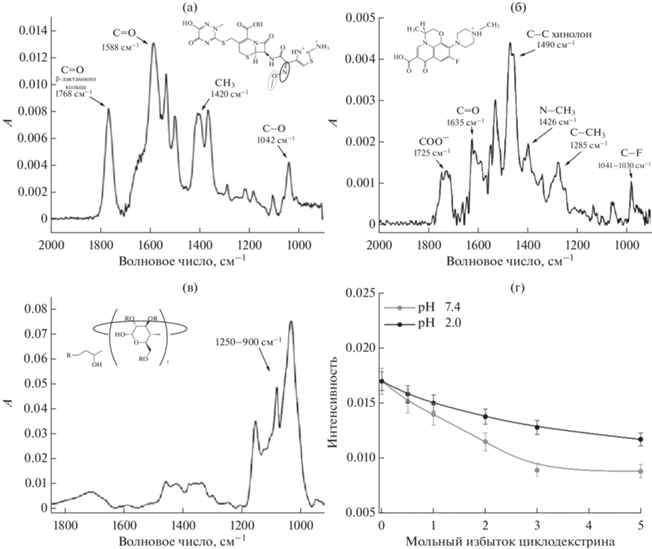
В структуре ЛВ также можно выделить ряд функциональных фрагментов, способных поглощать в ИК-области: ароматическая структура хинолона (1490 см–1), гетероцикл (1426 см–1), карбоксильная (1725 см–1) и карбонильная группы (1635 см–1) (рис. 3б) [19, 21].
В ИК-спектре ГПЦД наиболее аналитически значимыми являются полосы поглощения, которые характеризуются длиной волны 1250–900 см–1. Таким образом, методом ИК-спектроскопии могут быть исследованы системы лекарственных молекул с ГПЦД, поскольку не происходит значительного перекрывания релевантных полос в ИК-спектрах индивидуальных веществ (рис. 3в).
Поскольку при изучении свойств лекарственной молекулы требуется детальное рассмотрение ее свойств в условиях внутренних тканей и органов человеческого организма, для проведения экспериментов были выбраны два значения рН 2.0 и 7.4, которые моделируют физиологические условия в желудке и кровотоке соответственно. Для оценки изменений интенсивности основных полос в ИК-спектрах АМ при взаимодействии с ГПЦД, в эксперименте предварительно регистрировали фоновый раствор ГПЦД с концентрацией, равной концентрации ГПЦД в образце. Установлено, что как в кислых, так и в слабощелочных средах (рН 2.0 и рН 7.4) взаимодействие лекарственных молекул с ГПЦД приводит к уменьшению интенсивности основных полос поглощения в ИК-спектрax препаратов. В случае ЛВ, данное изменение имеет более выраженный характер и относится к области 1550–1440 см–1, что отвечает колебаниям ароматического фрагмента хинолона. Такой эффект указывает на вовлечение ароматического остова ЛВ во взаимодействиe с ГПЦД, по-видимому, за счет погружения данного фрагмента внутрь полости ГПЦД, что характерно для других комплексов фторхинолонов с ЦД [22, 23].
В случае комплекса ЦТ−ГПЦД наиболее существенные изменения в ИК-спектре ЦТ наблюдаются для полосы поглощения 1588 см–1, относящиеся к колебаниям связей С=N метилоксимной группы и С=О (СООН).
Динамика изменений основных максимумов для двух препаратов (изотермы сорбции) говорит о том, что более успешно взаимодействие с ГПЦД протекает в случае с ЛВ (рис. 3г).
Для количественной характеристики процесса комплексообразования были рассчитаны Kdis комплексов при линеаризации полученных кривых в координатах Скэтчарда (табл. 1). Важно отметить, что значения Kdis комплексов лежат в диапазоне 10–2–10–3 М, которые характерны для аналогичных систем [24–26]. Важно отметить, что в координатах Скэтчарда график пересекает ось абсцисс в единице, что указывает на существование одного сайта связывания АМ–ЦД, т.е. комплекс преимущественно образуется в мольном соотношении 1 : 1.
Таблица 1.
Значения Kdis (М) комплексов лекарственных препаратов с ГПЦД в разных средах, 37°С
| рН | ЛВ + ГПЦД | ЦТ + ГПЦД |
|---|---|---|
| 2.0 | (1.0 ± 0.3) × 10–3 | (2.2 ± 0.3) × 10–2 |
| 7.4 | (2.3 ± 0.3) × 10–3 | (3.3 ± 0.4) × 10–2 |
Величины Кdis для систем ЦТ с ГПЦД отражают относительно невысокую стабильность комплексов, что характерно и для других препаратов цефалоспоринового ряда, для которых было изучено взаимодействие с производными ЦД [4, 27]. Возможно, такой эффект связан с высокой растворимостью цефалоспроиновых антибиотиков.
При исследовании влияния структуры АМ на эффективность связывания с ГПЦД важно отметить, что в случае ЛВ образуются более прочные комплексы. Такой результат, по-видимому, связан с тем, что ЦД образуют комплексы преимущественно за счет включения “гостя” в свою гидрофобную полость со стороны карбоксильной группы, при этом гетероцикл находится снаружи ЦД [23]. В отличие от ЦТ фторхинолон ЛВ содержит гидрофобный ароматический фрагмент в своей структуре (рис. 1) и обладает меньшей растворимостью, что является более предпочтительным для формирования комплекса типа “гость–хозяин” с ГПЦД.
При сравнении Kdis комплексов ЛВ−ГПЦД (табл. 1) при двух значениях рН наблюдается тенденция уменьшения их стабильности при увеличении числа заряженных групп на лекарственной молекуле [16]. Так, при рН 2.0 (катионная форма ЛВ) величина Kdis в два раза ниже, чем при рН 7.4 (цвиттер-ионная форма ЛВ). Аналогичная тенденция установлена и для ионных форм ЦТ. При этом разница констант диссоциации комплексов ЦТ–ГПЦД в разных рН менее выражена, чем в случае комплексов ЛВ–ГПЦД, что может быть связано с иным механизмом взаимодействия и менее эффективным комплексообразованием для более растворимой молекулы ЦТ.
Таким образом, успешность процесса комплексообразования АМ с ГПЦД сильно зависит от структуры АМ и условий среды. Для однозаряженных форм наблюдается более низкое значение Kdis.
Механизм комплексообразования АМ с ГПЦД
В случае комплекса ЛВ−ГПЦД методом ИК-спектроскопии было показано, что основным центром связывания ЛВ является ароматический фрагмент лекарственной молекулы. По-видимому, комплекс образуется за счет погружения гидрофобного фрагмента ЛВ внутрь полости ГПЦД, что характерно для других фторхинолонов [19, 22]. Результаты спектроскопии 1H ЯМР также подтверждают предложенный механизм взаимодействия ЛВ с ГПЦД (табл. 2). Показано, что комплексообразование ЛВ с ГПЦД приводит к изменениям положений пиков в исходном 1H ЯМР спектре ЛВ: сигнал, соответствующий протону в 8 положении ароматического кольца (№ 2 в табл. 2), смещается в область слабых полей на 0.12 м.д. Это может свидетельствовать о взаимодействии данной области молекулы с электронакцепторными группами ГПЦД, которыми можно считать метиленовые группы внутренней полости ЦД. Также наблюдаются изменения для сигналов гетероцикла ЛВ: сигнал протонов N-метильной группы смещается в область сильных полей на 0.9 м.д., а также наблюдается уширение сигнала в области 3.2–3.5 м.д., отвечающего протонам метиленовых групп пиперазинового фрагмента. Такие изменения свидетельствуют о взаимодействии данного фрагмента молекулы ЛВ с электрондонорными группами (гидроксильными группами) ГПЦД. Таким образом, можно говорить о комплексообразовании комплекса ЛВ−ГПЦД посредством погружения ароматического остова ЛВ в гидрофобную полость ЦД, и его стабилизации за счет взаимодействия пиперазинового фрагмента АМ с внешней полостью ЦД, по-видимому, за счет образования водородных связей, что согласуется с данными молекулярного моделирования аналогичных взаимодействий [28].
Таблица 2.
Химические сдвиги протонов в 1Н ЯМР спектрах АМ, ЦД и комплексов АМ−ЦД, м.д. D2O, 400 МГц
 |
 |
||||
|---|---|---|---|---|---|
| № протона | химический сдвиг, м.д., (мультиплетность) | № протона | химический сдвиг, м.д., (мультиплетность) | ||
| ЛВ | ЛВ в комплексе ЛВ−ГПЦД | ЦТ | ЦТ в комплексе ЦТ−ГПЦД | ||
| 1 | 8.32 (с) | 8.32 (с) | 1 | 7.00 (с) | 7.00 (с) |
| 2 | 7.30 (д) | 7.42 (д) | 2 | 5.77 (д) | 5.78 (д) |
| 3 | 3.48 (д) | 3.48 (д) | 3 | 5.18 (д) | 5.21 (д) |
| 4 | 2.91 (с) | 2.82 (с) | 4 | 3.97 (с) | 3.97 (с) |
| 5 | 1.41 (д) | 1.41 (д) | 5 | 3.61 (с) | 3.62 (с) |
Для комплекса ЦТ–ГПЦД важно отметить, что в ИК-спектре активной молекулы обнаруживается не только изменение интенсивности полосы поглощения валентных колебаний С=N метилоксимной группы и С=О (СООН) 1588 см–1, но и явные изменения ее формы (рис. 4). Дополнительные спектральные исследования этих изменений могут раскрыть неизвестные ранее детали взаимодействия ЦТ с ГПЦД.
Рис. 4.
Деконволюция полосы поглощения 1588 см–1 в ИК-спектре цефтриаксона (а) и комплекса цефтриаксон-ГПЦД (б) (мольное соотношение 1 : 0.25), с = 34 мМ, рН 7.4. Исходный спектр цефтриаксона до деконволюции (1), мажорные компоненты 1650 (2) и 1585 см–1 (3), минорные компоненты 1534 (4) и 1500 см–1 (5). (в) Зависимость интегральных долей мажорных компонент 1650 (1) и 1585 см–1 (2) в зависимости от мольного избытка ГПЦД в комплексе ЦТ−ГПЦД (Т = 25°С, натрий-фосфатный буфер).
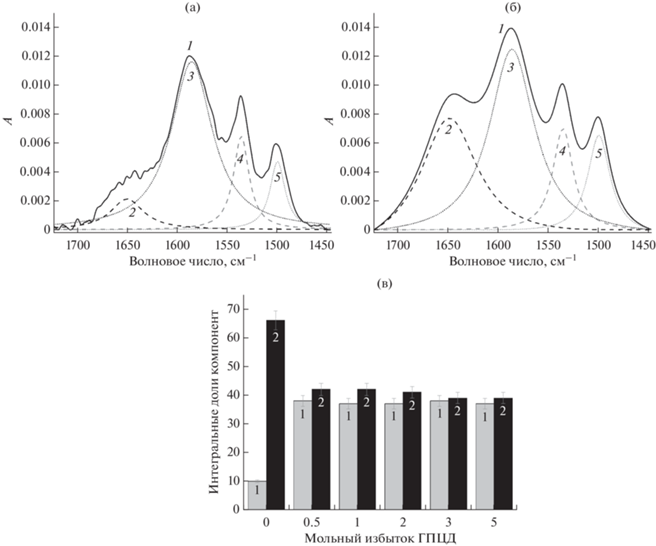
При деконволюции данной полосы в ИК-спектре ЦТ (рис. 4а) обнаружены две мажор-ные (1650 и 1585 см–1) и две минорные (1534 и 1500 см–1) компоненты. Для комплекса ЦТ−ГПЦД наблюдается перераспределение интегральных долей основных компонент (рис. 4б): увеличение доли компоненты 1650 см–1 за счет уменьшения доли компоненты 1585 см–1. При этом перераспределение долей происходит резко (рис. 4в), уже при мольном избытке ГПЦД равном 0.25, что указывает на значительное изменение микроокружения С=N и С=О (СООН) групп в присутствии ГПЦД в процессе комплексообразования.
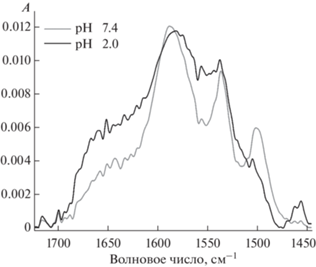
Анализ данных позволяет предположить, что изменение микроокружения С=N и С=О (СООН) групп связанo с образованием водородных связей с ГПЦД. Для подтверждения этой гипотезы был проведен независимый эксперимент по определению влияния кислотности среды на форму полосы поглощения 1588 см–1 (рис. 5). Обнаружено, что при рН 2.0 плечо при 1650 см–1 проявляется значительно ярче, чем при рН 7.4. Таким образом, компонента 1650 см–1 соответствует протонированному состоянию ЦТ. Мы предполагаем, что образование комплекса ЦТ–ГПЦД, по-видимому, происходит за счет образования водородных связей между C=N и С=О (СООН) группами ЦТ и гидроксильными группами ГПЦД.
Рис. 5.
ИК-спектры цефтриаксона при рН 7.4 и 2.0 (с = 7.5 мМ) (Т = 25°С, натрий-фосфатный или солянокислый буфер).
Данные спектроскопии 1H ЯМР для комплекса ЦТ−ГПЦД не позволяют сделать достоверное заключение о механизме взаимодействия, поскольку в спектрах 1Н происходит перекрывание основных сигналов ЦТ и ГПЦД, что препятствует возможности зафиксировать какие-либо изменения (табл. 2). Поэтому для данного комплекса был получен двумерный спектр (рис. 6).
В спектре ЯМР 1Н NOESY протоны Н1 ЦД (5.23 и 5.06 м.д.) имеют кросс-пики с протонами метильной группы триазин-диона (3.62 м.д.) и метиленовыми группами ЦТ. Также протоны метильной группы заместителя в ЦД (1.141 м.д.) имеют кросс-пики с протонами оксимного метила ЦТ (3.97 м.д.). По данным ЯМР спектроскопии, ЦТ взаимодействует с протонами Н1 и –СН3 заместителя ЦД. По-видимому, ЦТ не погружается в полость ЦД, а располагается вблизи тора ЦД, что подтверждает данные ИК-спектроскопии.
Для терапии тяжелых форм пневмонии, вызванной перенесенным заболеванием вируса COVID-19, используется внутривенное введение ЦТ и ЛВ. По этой причине актуальной задачей является не только изучение взаимодействия АМ-ЦД, но и исследование влияния ЦД на связывание АМ с белками плазмы крови, в частности ЧСА. Поскольку ЧСА функционирует при физиологическом значении рН, необходимо исследовать взаимодействие альбумин – лекарственная форма в нейтральных условиях.
Исследование влияния комплексообразования препаратов с ЦД на эффективность их взаимодействия с ЧСА
Изучение взаимодействие комплексов АМ-ЦД с ЧСА осуществлялось методом флуоресцентной спектроскопии, которая широко используется для исследования биологических систем, поскольку характеризуется высокой чувствительностью и позволяет анализировать несколько веществ в одной системе [29].
Основной вклад в флуоресценцию ЧСА вносят остатки аминокислот: триптофана (Trp), тирозина (Tyr) и фенилаланина (Phe). При этом остаток Trp вносит наибольший вклад в эмиссию флуоресценции белка [30]. При длине волны возбуждения 280 нм максимум спектра эмиссии ЧСА наблюдается при 345 нм. Данная полоса является чувствительной к взаимодействию белка с лекарственными препаратами [15].
В аналогичных условиях в спектре эмиссии ЛВ присутствует пик с максимумом 456 нм, что свидетельствует о том, что при pH 7.4 ЛВ находится в цвиттер-ионной форме [31]. Вторая исследуемая лекарственная молекула ЦТ не имеет флуоресценции при λвозб 280 нм. Таким образом, спектры эмиссии препаратов не перекрываются со спектром эмиссии ЧСА, что позволяет беспрепятственно следить за состоянием альбумина.
Взаимодействие лекарственных молекул с белком может способствовать усилению или ослаблению (тушению) интенсивности излучения альбумина. Снижение интенсивности, как правило, обусловлено статическим и/или динамическим тушением, молекулярными перегруппировками, процессами переноса энергии и т.д [32].
Установлено, что постепенное увеличение концентрации ЛВ и ЦТ в присутствии ЧСА приводит к уменьшению флуоресценции белка, что свидетельствует об изменении микроокружения Trp214 и комплексообразовании между АМ и альбумином. Аналогичные тенденции наблюдаются и для трехкомпонентных систем АМ−ГПЦД−белок. Стоит отметить, что при взаимодействии ЧСА с ЛВ и комплекса с ЛВ−ГПЦД положение максимума эмиссии белка смещается в длинноволновую область на $ \sim $10 нм. Это может свидетельствовать о том, что остаток Trp214 оказывается в менее гидрофобном окружении [33, 34]. Таким образом, при взаимодействии ЧСА с ЛВ и его комплексом с ГПЦД происходят изменения в структуре белка. Поскольку в случае ЦТ и ЦТ–ГПЦД не происходит аналогичных изменений в спектре белка, можно предположить, что более гидрофобная молекула ЛВ взаимодействует с ЧСА сильнее, чем ЦТ.
Тушение флуоресценции белка малыми молекулами может иметь статическую и/или динамическую природу. Как статическое, так и динамическое тушение могут быть описаны с помощью уравнения Штерна–Фольмера (1), однако только в случае статического тушения оно может быть преобразовано в уравнение (2). Для выяснения механизма тушения флуоресценции (и расчета термодинамических параметров систем) данные тушения эмиссии флуоресценции ЧСА, полученные при разных температурах, были проанализированы в координатах Штерна–Фольмера (рис. 7).
Рис. 7.
(а) Зависимости Штерна−Фольмера, выражающие эффект тушения человеческого сывороточного альбумина F0/F (345 нм) от концентрации левофлоксацина (1), цефтриаксона (3) и комплекса левофлоксацина (2) и цефтриаксона (4) с гидроксипропил-β-циклодекстрином (соотношение 1 : 1) при 33°C. (б) Зависимости Штерна−Фольмера, выражающие эффект тушения человеческого сывороточного альбумина F0/F (345 нм) от температуры для комплексов левофлоксацина с гидроксипропил-β-циклодекстрином (соотношение 1 : 1) (натрий-фосфатный буфер).

Важно отметить, что для всех типов рассматриваемых лекарственных форм (АМ и АМ–ГПЦД) наблюдается положительное отклонение от линейной зависимости при высоких концентрациях АМ. Такой эффект свидетельствует о том, что тушение флуоресценции вызвано несколькими механизмами при высоких мольных избытках препаратов относительно альбумина (рис. 7б) [35, 36]. Для выяснения наиболее вероятного механизма, который вызывает тушение флуоресценции белка, анализировался начальный участок зависимости, из которого были рассчитаны значения KSV при различных температурах (табл. 3). Температурный диапазон был подобран таким образом, чтобы в нем не происходило структурной деградации молекул ЧСА [37].
Таблица 3.
Температурная зависимость констант тушения Штерна–Фольмера для систем ЧСА + АМ и ЧСА + АМ−ГПЦД
| Температура, К | ${{K}_{{{\text{SV}}}}} \times {{10}^{{ - 3}}},~\,\,{{{\text{M}}}^{{ - 1}}}$ | ${{k}_{q}} \times {{10}^{{ - 12}}},~\,\,{{{\text{M}}}^{{ - 1}}}{\text{ }}{{{\text{c}}}^{{ - 1}}}$ | |
|---|---|---|---|
| ЧСА + ЛВ | 298 | 75 ± 6 | 13 ± 1 |
| 302 | 58 ± 4 | 10.5 ± 0.7 | |
| 306 | 49 ± 2 | 8.6 ± 0.4 | |
| 310 | 34 ± 2 | 5.9 ± 0.3 | |
| ЧСА + (ЛВ−ГПЦД) | 298 | 58 ± 5 | 10.1 ± 0.9 |
| 302 | 49 ± 4 | 8.6 ± 0.8 | |
| 306 | 41 ± 3 | 7.3 ± 0.6 | |
| 310 | 33 ± 3 | 5.8 ± 0.5 | |
| ЧСА + ЦТ | 298 | 59 ± 5 | 10.8 ± 0.9 |
| 302 | 50 ± 2 | 8.9 ± 0.5 | |
| 306 | 37.5 ± 0.8 | 6.6 ± 0.2 | |
| 310 | 24.2 ± 0.8 | 4.29 ± 0.14 | |
| ЧСА + (ЦТ−ГПЦД) | 298 | 58 ± 5 | 10.1 ± 0.9 |
| 302 | 51 ± 2 | 8.9 ± 0.4 | |
| 306 | 37.3 ± 0.8 | 6.52 ± 0.14 | |
| 310 | 24.3 ± 0.8 | 4.25 ± 0.14 |
Уменьшение значений KSV при увеличении температуры дает основания полагать, что механизм тушения флуоресценции при низких концентрациях лекарства носит статический характер. Еще одним доказательством превалирующего вклада статического тушения может служить значениe константы скорости тушения kq (табл. 3), рассчитанной из значений KSV и τ0 = 5.71 × 10–9 с, которая является постоянной величиной [38] для каждой температуры. Наблюдаемое значение kq значительно превышает бимолекулярную константу скорости тушения 2 × 1010 М–1 с–1, что говорит о превалирующем вкладе статического тушения [33, 37].
Изучение влияния комплексообразования препаратов с ЦД на термодинамические параметры взаимодействия лекарств с ЧСА
Поскольку при низких концентрациях АМ тушение флуоресценции имеет статическую природу, уравнение (1) может быть преобразовано в уравнение (2), с помощью которого были определены константы связывания (Kа) и стехиометрическиe коэффициенты (n). Для всех систем АМ-ЧСА было показано уменьшение Kа и n с увеличением температуры (табл. 4). Для более детального понимания влияния комплексообразования антибактериальных препаратов с ГПЦД на взаимодействие с ЧСА были рассчитаны термодинамические параметры данной реакции.
Таблица 4.
Термодинамические параметры взаимодействия ЧСА с АМ и АМ−ГПЦД
| Температура, К | n | ${{K}_{a}} \times {{10}^{{ - 5}}},~\,\,{{{\text{M}}}^{{ - 1}}}$ | ΔG, кДж/моль | ΔH, кДж/моль | ΔS, Дж/моль/К | |
|---|---|---|---|---|---|---|
| ЧСА + ЛВ | 298 | 1.34 ± 0.07 | 23.4 ± 0.5 | −36.30 ± 0.06 | −57.7 ± 0.8 | −71.3 ± 2.4 |
| 302 | 1.33 ± 0.02 | 17.9 ± 0.3 | −36.14 ± 0.06 | |||
| 306 | 1.32 ± 0.03 | 13.1 ± 0.4 | −35.84 ± 0.06 | |||
| 310 | 1.33 ± 0.05 | 9.9 ± 0.2 | −35.57 ± 0.05 | |||
| ЧСА + (ЛВ–ГПЦД) | 298 | 1.51 ± 0.08 | 110 ± 1.2 | −40.01 ± 0.02 | −217.6 ± 0.9 | −596 ± 4 |
| 302 | 1.41 ± 0.04 | 34 ± 0.5 | −37.7 ± 0.04 | |||
| 306 | 1.33 ± 0.03 | 12.6 ± 0.2 | −35.7 ± 0.04 | |||
| 310 | 1.24 ± 0.03 | 3.5 ± 0.5 | −32.9 ± 0.03 | |||
| ЧСА + ЦТ | 298 | 1.42 ± 0.03 | 50.6 ± 0.5 | −38.28 ± 0.17 | −193.5 ± 0.8 | −520 ± 2 |
| 302 | 1.39 ± 0.02 | 15.5 ± 0.3 | −35.82 ± 0.04 | |||
| 306 | 1.32 ± 0.03 | 5.0 ± 0.1 | −34.03 ± 0.07 | |||
| 310 | 1.23 ± 0.03 | 2.30 ± 0.03 | −31.75 ± 0.15 | |||
| ЧСА + (ЦТ–ГПЦД) | 298 | 1.45 ± 0.03 | 50.1 ± 0.5 | −38.23 ± 0.17 | −193.3 ± 0.8 | −521 ± 2 |
| 302 | 1.38 ± 0.02 | 15.8 ± 0.3 | −35.84 ± 0.04 | |||
| 306 | 1.31 ± 0.03 | 4.9 ± 0.1 | −34.09 ± 0.07 | |||
| 310 | 1.24 ± 0.03 | 2.33 ± 0.03 | −31.85 ± 0.15 |
Основными силами, участвующими в процессе комплексообразования, могут быть образование водородных связей, электростатические, гидрофобные и вандерваальсовы взаимодействия [38, 39]. Данные взаимодействия вносят положительный или отрицательный вклад в ΔH и ΔS в соответствии с таблицей 5 [39].
Считая, что в температурном диапазоне от 298 К до 310 К зависимость ΔH и ΔS от температуры пренебрежимо мала, с помощью уравнений (3)−(5) были рассчитаны ΔH, ΔS и ΔG реакции комплексообразования (табл. 4). Было показано, что комплексообразование АМ с ЧСА протекает самопроизвольно в исследуемом температурном интервале. Отрицательные значения ΔH и ΔS позволяют предположить, что комплексообразование протекает преимущественно за счет сил Ван-дер-Ваальса и образования водородных связей. Стоит отметить, что ΔH и ΔS для комплекса ЦТ + ЧСА значительно меньше (в $ \sim $3.2 и $ \sim $7.2 раз соответственно), чем для ЛВ + ЧСА, что, по всей видимости, свидетельствует о различном механизме взаимодействия альбумина с этими лекарствами. Связывание лекарственных молекул с ЧСА происходит в основном в субдоменах IIA (сайт I) и IIIA (сайт II) [14]. При этом гидрофобная полость в сайте II меньше, чем в сайте I [40]. В литературе показано, что в отличие от ЛВ, который одинаково прочно связывается в субдомене IIA и IIIA [41], ЦТ, будучи довольно крупной молекулой, связывается в сайте II значительно менее прочно, чем в сайте I [42, 43].
Значительное уменьшение значений ΔH и ΔS (в $ \sim $3.6 и $ \sim $8.6 раз соответственно) при связывании ЛВ в комплекс с ГПЦД вероятно обусловлено увеличением числа водородных связей, образующихся при взаимодействии гидроксильных групп ГПЦД с молекулой альбумина. Стоит отметить, что для системы ЧСА + (ЛВ−ГПЦД) наблюдается значительное уменьшение константы связывания при увеличении температуры (в $ \sim $30 раз), чего не происходило в системе ЧСА + ЛВ. Такой эффект может свидетельствовать об изменении механизма взаимодействия между ЧСА и ЛВ при комплексообразовании ЛВ−ГПЦД. По всей видимости, ЛВ−ГПЦД, имеющий значительно больший размер, чем свободный ЛВ, при увеличении скорости движения молекул не может полностью проникнуть в гидрофобные карманы ЧСА и взаимодействует преимущественно с гидрофильными группами на поверхности альбумина.
Таблица 5.
Ожидаемое значение вклада различных типов взаимодействий в ΔH и ΔS [39]
| $\Delta H$ | $\Delta S$ | |
|---|---|---|
| Гидрофобные взаимодействия | Положительное | Положительное |
| Вандерваальсовы взаимодействия | Отрицательное | Отрицательное |
| Образование водородных связей в среде с низкой диэлектрической проницаемостью | Отрицательное | Отрицательное |
| Ионные взаимодействия (нейтрализация заряда) |
Незначительное отрицательное или положительное | Положительное |
| Протонирование | Отрицательное | Отрицательное |
Стоит отметить, что для систем ЧСА + ЦТ и ЧСА + (ЦТ−ГПЦД) значения ${{K}_{a}}$, n и другие термодинамические параметры практически совпадают. По всей видимости, при связывании с альбумином комплекс ЦТ−ГПЦД разрушается, и ЦТ взаимодействует с белком в свободном виде. Таким образом, наибольшее влияние на связывание с белком ГПЦД будет оказывать для гидрофобных лекарственных препаратов, характеризующихся Kdis не менее 10−3 М.
ВЫВОДЫ
В работе исследованы комплексы ГПЦД с двумя лекарственными препаратами ЛВ и ЦТ, которые используются для лечения бактериальных респираторных инфекций, в различных средах, моделирующих физиологические условия. Установлено, что Kdis для АМ−ГПЦД находятся в диапазоне 10−2−10−3 М. Наиболее низкие значения Kdis были получены при рН 2.0 для однозарядных форм АМ. Наиболее эффективное комплексообразование характерно для более гидрофобной молекулы ЛВ с ароматическим фрагментом, который погружается в полость ГПЦД. Комплекс ГПЦД с более гидрофильной лекарственной молекулой ЦТ, по-видимому, образуется на поверхности ГПЦД при участии Н1 и метильной группы заместителя олигосахарида.
Методом флуоресцентной спектроскопии изучен процесс комплексообразования АМ с ЧСА. Показано, что взаимодействие ЧСА с АМ приводит к тушению флуоресценции, которое носит статический характер при небольших избытках АМ (CАМ/CЧСА ≤ 3). На основании полученных зависимостей тушения флуоресценции от мольного избытка АМ рассчитаны термодинамические параметры комплексообразования. Установлено, что взаимодействие АМ с ЧСА происходит преимущественно за счет вандерваальсовых взаимодействий и за счет образования водородных связей и характеризуется константами ассоциации порядка ~105–106 при 37°C. Связывание ЛВ в комплекс с ГПЦД приводит к уменьшению константы в ~3 раза. При этом образование трехкомпонентных систем, содержащих ЦТ, никак не сказывалось на Ka и других термодинамических параметрax. Таким образом, добиться изменения во взаимодействии лекарственных систем с ЧСА можно лишь при условии, что они характеризуются Kdis не менее 10−3 М.

