СИСТЕМАТИЧЕСКОЕ ПОЛОЖЕНИЕ MLE
Белок MLE относится к хеликазам, обширному классу ферментов, представленному во всех клеточных формах жизни и у многих вирусов [1–3]. На основании анализа аминокислотной последовательности, структуры и функций выделяют шесть суперсемейств хеликаз (SF1–6), которые, в свою очередь, делятся на семейства [4]. MLE входит в состав семейства хеликаз с DExH-боксом, входящего в суперсемейство SF2. Представители суперсемейства SF2 содержат консервативное каталитическое “ядрo”, состоящее из двух глобулярных RecA-подобных доменов, сходных с доменами бактериальной рекомбиназы А, каждый из которых состоит из пяти β-структур, окруженных пятью α-спиралями. В последовательности RecA-подобных доменов выделяют от 7 до 12 наиболее консервативных аминокислотных мотивов [1]. Еще совсем недавно семейство хеликаз с DExH-боксом объединяли в одну группу с DEAD-бокс-хеликазами и называли их хеликазами с DExD/H-боксом, однако со временем обнаружили принципиальные различия как в аминокислотной последовательности, так и в биохимических свойствах этих белков, что привело к выделению двух отдельных семейств в составе SF2: DEAD-бокс (альтернативное название DExD, или DDX) и DEAH/RHA (DExH, DHX). Свои названия эти два семейства получили по аминокислотной последовательности консервативного мотива II, представленного у этих белков последовательностями Asp-Glu-x-Asp и Asp-Glu-x-His, где x – остаток любой аминокислоты. Мотив II – главный сайт связывания и гидролиза NTP, который взаимодействует с их β- и γ-фосфатными группами, координируя ион Mg2+.
Несмотря на структурное сходство, выявлены и существенные различия в ключевых аминокислотных остатках консервативных мотивов белков семейств DDХ и DHХ. Как следствие, хеликазы DHХ могут гидролизовать любые нуклеотиды, в то время как хеликазы DDХ – только ATP. Это свойство хеликаз связано с дополнительным консервативным Q-мотивом, расположенным непосредственно перед мотивом I в последовательности хеликаз DDХ. Q-мотив образует контакт с остатком аденина, что и обеспечивает специфичность узнавания ATP. У хеликаз DHХ Q-мотив отсутствует. Другое отличие хеликаз DDХ и DHX состоит в том, что хеликазы DDX осуществляют непроцессивное локальное расплетание молекулы нуклеиновой кислоты без транслокации. Хеликазы же семейства DHX с умеренной процессивностью расплетают нуклеиновые кислоты, перемещаясь вдоль молекулы в 3'→5'-направлении (есть исключение), часто этим хеликазам для связывания с субстратом нужен “свободный” одноцепочечный 3'-конец.
СТРОЕНИЕ MLE, БИОХИМИЧЕСКАЯ АКТИВНОСТЬ in vitro
Хеликаза MLE консервативна у высших эукариот и все ее ортологи имеют одинаковое строение. Ортологи MLE найдены у человека и других млекопитающих (Bos taurus, Mus musculus), а также у других высших эукариот: Caenorhabditis elegans, Arabodopsis thaliana [5–7], но не обнаружены у птиц [8, 9]. В настоящее время все эти белки-ортологи имеют общее название DHX9. Далее мы будем использовать название MLE для белка Drosophila melanogaster, а DHX9 – для обозначения его ортологов у других организмов. Обнаружен высокий уровень гомологии DHX9 у разных организмов: гомология между белками разных видов млекопитающих составляет 90% и более. У белков D. melanogaster и человека идентичны 50% аминокислотных остатков, а 85% – подобны. Поликлональные антитела к MLE D. melanogaster распознают DHX9 в экстракте клеток HeLa [5]. Белки DHX9 человека и белки C. elegans и A. thaliana имеют 42 и 27% идентичных аминокислотных остатков соответственно [10]. Все эти белки имеют сходные размеры (1270 аминокислотных остатков у человека и 1293 – у D. melanogaster) и одинаковую доменную структуру [10–13].
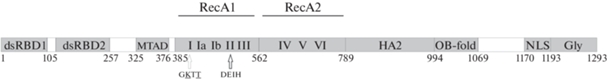
Строение белка MLE представлено на рис. 1. В центральной части молекулы расположено характерное для хеликаз DHX каталитическое ядро, содержащее восемь консервативных мотивов, организованных в два хеликазных RecA-подобных домена. В первом домене располагаются мотивы I–III, а во втором – IV–VI. Связывание NTP и нуклеиновой кислоты происходит в углублении между доменами. Остатки глутаминовой и аспарагиновой кислоты в мотиве II, представленном последовательностью DEIH, как сказано выше, координируют катион Mg2+ и взаимодействуют с β- и γ-фосфатными группами NTP. Также во взаимодействии с NTP и его гидролизе участвуют мотивы I и VI. Мутация mleGET (замена одного аминокислотного остатка К413E в мотиве I) приводит к полной потере АТРазной активности белка. Мотив III отвечает за хеликазную активность, т.е. за связь гидролиза NTP с расплетанием нуклеиновой кислоты, а мотивы Ia, Ib, IV и V – за связывание нуклеиновой кислоты. Сразу за RecA-подобными доменами локализован ассоциированный с хеликазой домен НА2. На N-конце белка находятся два домена связывания дцРНК (dsRB-D1, dsRBD2), а затем небольшой (примерно 50 аминокислотных остатков) домен трансактивации MTAD [11]. За каталитическим ядром располагается район связывания олигосахарида/олигонуклеотида (OB-fold), затем следует сигнал ядерной локализации и глицин-богатая C-концевая область (Gly). Особенностью С-концевой области MLE является 9-кратный несовершенный повтор последовательности GGGYGNN [14], где тирозин занимает каждое седьмое положение в пределах повтора. Такое псевдогептадное расположение тирозина может указывать на формирование амфипатической спирали с гидрофобной поверхностью, которая может участвовать в межмолекулярных взаимодействиях [15]. Домены dsRBD2, НА2 и OB-fold необходимы для хеликазной активности MLE in vitro, в то время как ds-RBD1 и С-концевой глицин-богатый домены для этого не важны. Однако эти домены необходимы для определения специфичности связывания MLE с нуклеиновыми кислотами и белками in vivo. В частности, dsRBD1 определяет связывание MLE с X-хромосомой самцов, а С-концевой домен обеспечивает ядерную локализацию [15].
Рис. 1.
Доменная структура белка MLE. Районы, соответствующие определенным доменам, обозначены серым цветом. Линкерные участки обозначены белым цветом. Представлены два домена связывания дцРНК – dsRBD1 и d-sRBD2, минимальный домен трансактивации MTAD, каталитическое ядро, состоящее из доменов RecA1 и RecA2 и хеликаза-ассоциированного домена HA2, область связывания олигосахарида/олигонуклеотида OB-fold, сигнал ядерной локализации NLS, глицин-богатый С-концевой домен Gly. Консервативные мотивы в составе каталитического ядра обозначены римскими цифрами, мотив DExН представлен последовательностью DEIH. Подчеркнуты консервативные аминокислотные остатки в мотиве I: K413 и T415, замены которых приводят к мутациям, mleGET и mlenapts соответственно.
Белок без dsRBD1 и С-концевого домена был кристаллизован в присутствии аналога ATP и оцРНК [12]. Выявлены многочисленные взаимодействия доменов dsRBD2 и OB-fold с каталитическим ядром, образованным доменами RecA1, RecA2 и HA2. “Оборачиваясь” вокруг каталитического ядра, они формируют вместе с ним кольцевую структуру неправильной формы. Направляемая доменами dsRBD2 и OB-fold оцРНК проходит по каналу внутри кольцевой структуры.
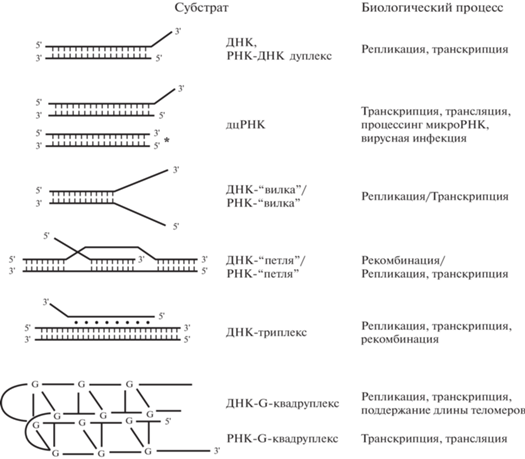
Биохимическая активность MLE D. melanogaster и DHX9 человека подробно изучена in vitro. Показана способность DHX9 расплетать самые разнообразные субстраты (рис. 2), в том числе G-квадруплексы в ДНК и РНК [5, 10, 15, 16]. Экспериментально обнаружены две особенности MLE in vitro, не характерные для других хеликаз DHX, а именно, исключительно высокая аффинность к полиуридиновым последовательностям, а также зависящая от домена dsRBD2 способность расплетать дуплексы РНК с “тупыми” концами (без выступающего одноцепочечного 3'-конца) [12].
Рис. 2.
Схематическое изображение образованных ДНК и РНК структур, которые способны расплетать in vitro MLE и ее ортолог у млекопитающих. Указаны биологические процессы, в которых образуются эти структуры. Звездочкой отмечены дуплексы РНК с “тупыми” концами, способность расплетать которые показана только для MLE D. melanogaster. Схема с модификациями, введенными нами, цитирована по [10, лицензия Creative Commons Attribution License].
Таким образом, хеликаза MLE in vitro способна без участия N-и C-концевых доменов расплетать вторичные структуры в молекулах нуклеиновых кислот, перемещаясь в 3' → 5'-направлении. При этом in vivo домены на N- и C-концах молекулы MLE обеспечивают взаимодействие с разными белковыми факторами и определяют специфичность функций этой хеликазы.
ФУНКЦИИ MLE В ДОЗОВОЙ КОМПЕНСАЦИИ
MLE экспрессируется на всех стадиях развития самцов и самок D. melanogaster и имеет ядерную локализацию. Исторически сложилось так, что в большей части научных исследований хеликазу MLE рассматривали как компонент комплекса дозовой компенсации, специфичного для D. melanogaster. За последние три десятилетия опубликовано множество работ, посвященных дозовой компенсации, и подробное рассмотрение этой темы выходит за рамки данного обзора. Здесь представлены только общие сведения о составе и функциях комплекса дозовой компенсации, более подробно будут рассмотрены другие функции MLE.
Комплекс дозовой компенсации у D. melanogaster (MSL – male specific lethal) – это РНП-комплекс, формирующийся только у самцов и необходимый для их жизнеспособности. Комплекс MSL необходим для выравнивания уровней экспрессии генов в одной Х-хромосоме самцов и двух Х-хромосомах самок. В состав комплекса помимо MLE входят еще четыре белка – MSL1, MSL2, MSL3 и MOF (males absent on the first), и одна из двух длинных некодирующих РНК, roX1 или roX2 (RNA on the X 1 или 2) [17–21]. MSL1, MSL2, MSL3 и MOF связаны белок-белковыми взаимодействиями и формируют гетерооктамер, а MLE входит в состав комплекса через взаимодействие с РНК roX.
Встраивание одной из РНК roX в MSL необходимо для его функционирования [22, 23]. РНК roX1 и roX2 отличаются по размеру и последовательности, но имеют общие консервативные мотивы вблизи 3'-конца: обогащенные уридином последовательности, названные roX-box. Эти последовательности необходимы для формирования вторичных структур стебель–петля. MLE связывается с одноцепочечной последовательностью петли и расплетает РНК-дуплекс спирального стебля, открывая тем самым сайты связывания белка MSL2 [18, 24–27]. Таким образом MLE интегрирует РНК roX в комплекс MSL [28–30].
Из перечисленных компонентов комплекса MSL только MSL2 и roX экспрессируются специфично у самцов и отсутствуют у самок D. melanogaster [31, 32]. У самцов функциональный комплекс MSL собирается на X-хромосоме в так называемых высокоаффинных участках (High Affinity Sites, HAS), а затем распространяется по всей длине Х-хромосомы [2, 33]. В разных исследованиях выявлено от нескольких десятков до полутора сотен высокоаффинных сайтов, самыми сильными из них являются гены roX1 и roX2. Последовательности HAS содержат GA-богатый мотив длиной 21 п.н., названный MRE (MSL Recognition Element). Цистеин-богатый домен белка MSL2 способен связываться с MRE, что частично определяет связывание комплекса MSL c X-хромосомой.
Анализ ряда мутаций MLE позволил установить, что замена K413E (мутация mleGET), нарушающая АТРазную и хеликазную активности белка, приводит к тому, что комплекс MSL, в состав которого входит такой белок, остается связанным с высокоаффинными сайтами и не распространяется по всей длине X-хромосомы. Это нарушает дозовую компенсацию и приводит к летальности самцов на стадии поздней личинки. Для более точного исследования функции MLE в распространении комплекса по X-хромосоме подобраны мутации, избирательно блокирующие хеликазную активность при сохранении АТРазной: аминокислотные замены в мотиве III и делеция мотива V. Комплекс MSL, содержащий такой дефектный белок MLE, сохраняет способность активировать экспрессию гена, расположенного в непосредственной близости к высокоаффинному сайту, но при этом не происходит распространения комплекса на большие расстояния, как и в случае с mleGET. Это означает, что для распространения комплекса MSL по всей длине X-хромосомы необходима хеликазная активность MLE [2, 33, 34].
Итак, хеликаза MLE необходима для включения РНК roX в комплекс MSL и распространения этого комплекса по всей длине X-хромосомы самцов, что, в свою очередь, необходимо для дозовой компенсации.
Классические представления о механизмах дозовой компенсации у D. melanogaster связывают уравнивание экспрессии одной дозы генов Х-хромосомы у самцов и двух доз генов Х-хромосомы у самок с двукратной активацией экспрессии Х-хромосомы у самцов [17–19]. Действительно, MOF является ацетилтрансферазой гистонов, специфично ацетилирующей H4K16. Обогащение Х-хромосомы самцов H4K16ac за счет активности MOF в составе комплекса MSL приводит к деконденсации хроматина и способствует активации транскрипции [35]. Показано, что усиление экспрессии X-сцепленных генов осуществляется как на стадии рекрутирования РНК-полимеразы II (PolII), так и на последующих стадиях инициации транскрипции и выхода РolII из состояния паузы [18, 19]. Однако в изучении феномена дозовой компенсации у D. melanogaster остается много вопросов. Исследователи сходятся на том, что в специфическое распознавание Х-хромосомы самцов и достижение адекватных уровней экспрессии Х-сцепленных и аутосомных генов вовлечено много факторов, взаимодействующих с комплексом MSL или действующих независимо от него. Последнее заключение связано с тем, что у триплоидных по Х-хромосоме самок D. melanogaster (метасамки), несмотря на отсутствие у них функционального комплекса MSL, наблюдается дозовая компенсация, при которой X-сцепленные гены экспрессируются на том же уровне, что и у диплоидных самок, а экспрессия аутосомных генов снижается [36]. Не известно, каким образом обеспечивается точное двукратное усиление экспрессии генов Х‑хромосомы самцов. В ряде исследований показано, что комплекс MSL не обеспечивает полной компенсации, усиливая экспрессию не вдвое, а менее чем в 1.5 раза [17, 19, 37–39]. При этом повышение уровня H4K16ac может привести к активации генов X-хромосомы более чем в 2 раза. Согласно последним данным, в ограничение активации до двукратного уровня вовлечен белок Mtor. который связывается с комплексом MSL [40]. Кроме того, в дозовую компенсацию вовлечены факторы, участвующие в формировании гетерохроматина, ремоделировании хроматина и РНК-интерференции [17].
Существует также альтернативная гипотеза, которая представляет дозовую компенсацию у D. melanogaster как компенсацию глобального анеуплоидного эффекта, вызванного Х-моносомией [36, 41–45]. Моносомия Х-хромосомы может привести к увеличению количества не использованных транскрипционных активаторов у самцов по сравнению с самками, что, в свою очередь, может привести к повышению экспрессии генов других хромосом. Согласно этой гипотезе, усиленное ацетилирование Х-хромосомы комплексом MSL позволяет секвестрировать лишние активаторы хроматина с аутосом, предотвращая тем самым их гиперактивацию. В этом случае результаты анализа экспрессии генов у MSL-мутантов интерпретируются как общее увеличение экспрессии аутосомных генов, а не снижение экспрессии Х-сцепленных генов. Для проверки этой гипотезы необходимы исследования, в которых нормализация глобального транскриптомного анализа будет основана на внешнем эталоне [18].
Дисбаланс в геноме млекопитающих и человека при анеуплоидии имеет сильнейший физиологический эффект, чаще всего приводящий к эмбриональной летальности [46–48], анеуплоидия характерна также для раковых клеток, ее находят более чем в 90% солидных опухолей [49, 50]. Поскольку у млекопитающих DHX9 участвует в эмбриогенезе как самцов, так и самок, изначально предполагалось, что она не имеет отношения к дозовой компенсации. Однако поскольку DHX9 вовлечена в канцерогенез (что будет рассмотрено ниже), ее влияние на регуляцию анеуплоидного эффекта в клетках опухолей представляется вполне возможным. Эти вопросы представляют не только фундаментальный, но и прикладной интерес для медицины.
ВЗАИМОДЕЙСТВИЕ MLE С РНК-ПОЛИМЕРАЗОЙ II
Хеликаза MLE обладает способностью активировать транскрипцию, физически взаимодействуя с PolII [11, 51, 52]. За эту функцию отвечает минимальный домен трансактивации (MTAD) – небольшой консервативный домен (~50 аминокислотных остатков), предшествующий каталитическому ядру хеликазы. Особенно важны для взаимодействия с PolII остатки триптофана в консервативных положениях MTAD (у D. melanogaster это W328, W335 и W338). MLE с делецией участка 326–378, включающей всю последовательность MTAD, равно как и MLE с заменой трех консервативных остатков триптофана на остатки аланина, не взаимодействует с PolII. Эта функция MLE консервативна в эволюции, она показана также для DHX9 человека и нематоды C. elegans [11]. MTAD MLE может взаимодействовать как с гиперфосфорилированной (элонгирующей), так и (преимущественно) с гипофосфорилированной (инициаторной) формами PolII. Исследования in vivo показали, что MLE с делецией MTAD не спасает летальный фенотип самцов с нуль-аллелем mle, что указывает на необходимость MTAD для функционирования MLE в комплексе MSL. Интересно, что MLE с заменами консервативных остатков триптофана, как и MLE дикого типа, имеет ядерную локализацию, а MLE с делецией MTAD находится и в ядре, и в цитоплазме, несмотря на присутствие интактного сигнала ядерной локализации на С-конце белка. Природа этого явления на данный момент не ясна. В экспериментах с репортерными трансгенами показана способность MTAD активировать транскрипцию не только с промотора roX, известной мишени комплекса MSL, но и транскрипцию с промотора гена теплового шока hsp70, на которую MSL не влияет. Показано, что MLE D. melanogaster, как и ее ортолог у млекопитающих, может активировать транскрипцию независимо, а не как компонент комплекса дозовой компенсации [11].
Чтобы получить представление о возможной роли MLE в регуляции транскрипции in vivo, проведено картирование сайтов связывания MLE на политенных хромосомах из слюнных желез личинок D. melanogaster на стадии L3 у обоих полов [53]. Обнаружено, что паттерн распределения MLE в составе комплекса MSL на Х-хромосоме самцов не зависит от стадии развития и, соответственно, от активного или неактивного статуса района связывания. В то же время отмечено, что MSL-независимое распределение MLE на аутосомах идентично у обоих полов, зависит от транскрипционного статуса района и напоминает паттерн распределения элонгирующей формы PolII. MLE связывается практически со всеми “пуффами развития”, экдизоновыми пуффами, типичными для анализируемых стадий, а также со многими “интербэндами”. MLE присутствует в пуффах и на Х-хромосомах самок. После кратковременного теплового шока белок MLE можно обнаружить во многих пуффах, появляющихся при тепловом шоке. В частности, сильный сигнал наблюдался в районах 87C, 93D и 95D, но никогда в районе 87A. Два соседних района 87A и 87C, как известно, развиваются благодаря активности кластера генов hsp70 [54]. Однако в отличие от района 87A, район 87C содержит не только кластер hsp70, но и αγ-элемент, с которого синтезируется некодирующая РНК теплового шока (hshRNA), обладающая неизвестными на данный момент функциями [55]. Поскольку в условиях, не зависящих от теплового шока, MLE у обоих полов не связывается с районом 87C, предполагается, что hshRNA, которая принадлежит к тому же классу некодирующих РНК, что и roX, может быть специфической мишенью MLE.
Таким образом, независимо от других белков комплекса MSL, MLE взаимодействует с наиболее заметными транскрипционно-активными районами хромосом и, вероятно, проявляет повышенную аффинность к транскриптам определенных генов [53].
Показано также, что DHX9 участвует в регуляции транскрипции генов человека, привлекая PolII непосредственно на промотор генов-мишеней. DHX9 специфически связывается с определенными последовательностями ДНК в промоторных областях этих генов [56–58]. Кроме того, DHX9 может активировать транскрипцию, связываясь одновременно с PolII (через MTAD) и с такими факторами транскрипции, как CBP/p300 и BRCA1 (через домены dsRBD) [59, 60]. В ряде случаев DHX9 может репрессировать транскрипцию. Связываясь с активатором транскрипции TonEBP, DHX9 ингибирует его активность посредством неизвестного механизма, привлекая, возможно, в область транскрипции другие белки [61].
ФУНКЦИИ MLE В СПЛАЙСИНГЕ И РЕДАКТИРОВАНИИ пре-мРНК
Первую функцию MLE, не имеющую отношения к дозовой компенсации, выявили еще в 1991 году, но ее механизм долгое время оставался неизвестным [62]. Обнаружено, что мутация mlenapts вызывает “паралитический” фенотип как у самок, так и у самцов при повышенной температуре. Этот фенотип обусловлен снижением экспрессии белка Na+-каналов, что приводит, в свою очередь, к блокаде потенциала действия. Дальнейшее изучение показало, что транскрипт гена para, кодирующего белок Na+-каналов, в норме подвергается редактированию, при котором аденин дезаминируется с образованием инозина (который в дальнейшем при трансляции ведет себя как гуанин) [63, 64]. Для редактирования необходимо образование двухцепочечной структуры в РНК, включающей редактируемый экзон и следующий за ним интрон. На фоне мутации mlenapts, которая приводит к замене T415S в мотиве I, повышение температуры приводит к тому, что более 80% транскриптов para представлены аберрантными мРНК, в которых пропущен редактируемый экзон. В то же время, нуль-мутация mle не имеет паралитического фенотипа. Считается, что в норме MLE дикого типа расплетает двухцепочечную структуру в районе редактируемого экзона. Повышение температуры вызывает изменение конформации мотива I с заменой T415S, что приводит к снижению каталитической активности MLE. При этом мутантный белок остается связанным с дцРНК, которую он не может расплести, а донорный сайт сплайсинга редактируемого экзона остается заблокированным. В этом случае сплайсинг происходит “в обход” заблокированного донорного сайта с пропуском экзона. Поскольку нуль-мутация mle такого эффекта не вызывает, можно предположить, что при полном отсутствии MLE расплетание вторичной структуры пре-мРНК гена para выполняет какая-то другая хеликаза [63].
Регуляция сопряженного с редактированием сплайсинга para – единственный изученный на данный момент пример участия MLE в регуляции сплайсинга пре-мРНК конкретного гена у D. melanogaster. Однако масс-спектрометрический анализ белков, которые MLE соосаждает из экстракта клеток S2 [65], показал, что самая многочисленная функциональная группа (19 белков) представлена белками, участвующими в сплайсинге. Нокдаун MSL не влияет на взаимодействие с 15 из этих белков, указывая на то, что MLE в сплайсинге участвует в форме, свободной от комплекса MSL. Кроме того, большая часть обнаруженных взаимодействий (16 из 19) была РНК-зависимой: при обработке РНКазой взаимодействия между белками исчезали. Эти данные согласуются с представлениями о том, что MLE в процессе сплайсинга осуществляет расплетание и ремоделирование вторичных структур, образующихся в пре-мРНК. Взаимодействие с тремя из обнаруженных белков изучили отдельно и подтвердили с помощью коиммунопреципитации и Вестерн-блот-анализа. Эти три белка, Pep (Protein on ecdysone puffs, CG6143), Hrb87F (heterogeneous nuclear ribonucleoprotein at 87F, CG12749) и Hrb98DE (heterogeneous nuclear ribonucleoprotein at 98DE, CG9983), – гетерогенные ядерные рибонуклеопротеины, участвующие в процессинге РНК и депонировании белка гетерохроматина (HP1a). Они коиммунопреципитируют с MLE РНК-зависимо и независимо от MSL-комплекса. Pep и Hrb87F взаимодействуют с белком HP1a, который участвует в сайленсинге генов и формировании гетерохроматина, а также в регуляции многочисленных генов эухроматина [66]. Белок Hrb98DE является близким гомологом белка Hrb87F (эти белки идентичны на 80%) и оба они гомологичны гяРНП A1 (hnRNP A1). Эти белки участвуют преимущественно в регуляции альтернативного сплайсинга мРНК и, по-видимому, взаимозаменяемы [65, 67, 68]. Показано, что DHX9 человека входит в состав пресплайсосомы [69], связывается как с мРНК, так и с пре-мРНК [70], взаимодействует с белком-регулятором сплайсинга MBNL1 [71], а также с белком SMN, компонентом мяРНП (snRNP) [72]. Кроме того, DHX9, функционируя согласованно с ADAR2, координирует редактирование и сплайсинг пре-мРНК рецептора глутамата [73]. Как и в случае гена para, редактирование и сплайсинг пре-мРНК рецептора глутамата являются конкурирующими процессами: ферменту ADAR2 для осуществления редактирования требуется транскрипт, содержащий вторичную структуру стебель–петля, которая секвестрирует 5'-сайт сплайсинга. Считается, что DHX9 расплетает этот двухцепочечный участок пре-мРНК после редактирования и тем самым делает возможным последующий правильный сплайсинг. Таким образом, участие MLE в регуляции сплайсинга консервативно в эволюции и не имеет отношения к дозовой компенсации.
В упомянутом выше масс-спектрометрическом исследовании [65], помимо взаимодействия MLE с белками сплайсосомы, выявлено еще несколько десятков взаимодействий MLE с белками, участвующими в метаболизме нуклеиновых кислот. В том числе, найдены взаимодействия с несколькими РНК-хеликазами, факторами, регулирующими трансляцию, белками, ремоделирующими хроматин. Дальнейшее изучение функций MLE происходило в следующих направлениях: исследование конкретных функций MLE в РНК-интерференции [74], ремоделировании хроматина и регуляции экспреcсии экдизонзависимых генов [65, 75], о чем пойдет речь далее.
MLE И РНК-ИНТЕРФЕРЕНЦИЯ
В число белков, взаимодействующих с MLE, входят Ago2 и Dicer2 [65]. Обнаружено также, что помимо своих главных мишеней – РНК roX, MLE связывается в клетках S2 D. melanogaster c целым рядом пре-мРНК и мРНК, локализуясь преимущественно в интронах и в 3'-UTR (untranslated regions), образующих вторичные структуры [76]. Возникло предположение, что MLE участвует в раcплетании котранскрипционно генерируемых шпилек РНК [74]. Для проверки этой гипотезы проанализированы линии D. melanogaster, полученные в рамках проекта Transgenic RNAi Project (TRiP) и Венского исследовательского центра дрозофилы (VDRC). Эти линии несут распределенные по всему геному D. melanogaster индуцибельные трансгены, экспрессирующие шпилечные РНК, специфичные для определенных кодирующих генов [77–80]. На политенных хромосомах MLE специфически выявляется в местах транскрипции этих трансгенов, и связывание MLE не зависит от размера шпильки или ее геномного расположения. Параллельный анализ трансгенов Notch и Egfr (epidermal growth factor receptor) показал, что MLE необходима для функциональной интерференции РНК in vivo. Нуль-мутация mle в гомозиготном состоянии резко снижает эффективность интерференции РНК в трансгенных мухах, что приводит к спасению фенотипа индуцированных мутаций. По предположению авторов, связывание MLE со шпильками РНК может быть важным для их переноса в цитоплазму, и MLE может участвовать в формировании комплекса RISC. Альтернативная гипотеза заключается в том, что MLE может устранять неправильное сворачивание только что транскрибированных шпилек РНК, что позволяет им участвовать в интерференции РНК. Возможно, что MLE вмешивается в редактирующую активность фермента ADAR. Дезаминирование аденина до инозина может привести к снижению комплементарности и нестабильности дцРНК, что ограничивает синтез эффективных siРНК. MLE может физически блокировать связывание ADAR со шпильками РНК или же расплетать структуры, участвующие в рекрутировании ADAR. Все рассмотренные гипотезы не являются взаимоисключающими. В то же время, данные об участии DHX9 млекопитающих в интерференции РНК противоречивы [81–83].
ВЗАИМОДЕЙСТВИЕ MLE С КОМПЛЕКСАМИ РЕМОДЕЛИРОВАНИЯ ХРОМАТИНА
Взаимодействие MLE с белками Mi-2, MEP-1 и p66 не зависит от MSL, а обработка иммунопреципитатов РНКазой ослабляет, но не разрушает полностью эти взаимодействия [65]. Таким образом, MLE можно рассматривать как функционального партнера комплексов NuRD и dMEC. NuRD – это комплекс, который увеличивает плотность гистонов/нуклеосом на определенных последовательностях ДНК по всему геному и отвечает за изменения в организации нуклеосом в соседних локусах [84]. Как это часто бывает с комплексами ремоделирования хроматина, NuRD и dMEC могут участвовать как в репрессии, так и в активации генов [85]. У D. melanogaster комплекс NuRD, выделенный из эмбрионов, содержит девять субъединиц. В состав комплекса входят такие белки, как деацетилаза гистонов RPD3, белок с цинковым пальцем MEP-1 и ДНК-связывающая АТРаза CHD4/Mi-2, обладающая хеликазной активностью [85]. MEP-1 и Mi-2 также образуют отдельный комплекс dMEC [86]. Субъединица Mi-2, общая для обоих комплексов, необходима для экспрессии генов теплового шока [87], она играет важную роль в поддержании структуры хромосом, поскольку влияет на функцию когезина [88]. Участки связывания MLE и Mi-2 в геноме существенно перекрываются, при этом большая часть общих сайтов совпадает с энхансерами (54%), промоторами и сайтами стартов транскрипции (TSS) – 37%. Вопрос о функциональной значимости взаимодействий MLE с компонентами комплексов NuRD и dMEC остается открытым [65].
MLE взаимодействует также с субъединицами комплекса SWI/SNF (Brm, PB, Bap170) [75]. Функциональная значимость этого взаимодействия изучена на примере регуляции транскрипции SWI/SNF-зависимого позднего гена экдизонового каскада ftz-f1. Ген ftz-f1 кодирует ядерный рецептор, играющий важную роль в процессе онтогенеза D. melanogaster. Транскрипция этого гена в начале метаморфоза происходит с участием паузированной РolII, ограничена узким периодом времени и подвержена сложной многоступенчатой регуляции. Важную роль в адекватной экспрессии гена ftz-f1 играет физическое сближение промотора и энхансера, расположенного в первом интроне. Привлечение SWI/SNF на промотор и энхансер гена важно для их взаимодействия. При нокдауне субъединицы SWI/SNF, привлекающей комплекс на ген, связь промотора с энхансером ослабевает. При этом в начале метаморфоза ген ftz-f1 начинает экспрессироваться преждевременно, а его транскрипция остается на низком уровне [89–91]. Изучение связывания MLE с геном ftz-f1 в процессе его активации показало, что профиль связывания MLE повторяет профиль связывания комплекса SWI/SNF. MLE сильнее всего связан с промотором и энхансером, и это связывание усиливается в процессе активации транскрипции. Нокдаун MLE в модельной системе в клетках S2 и мутация mle в гомозиготном состоянии in vivo вызывают эффект, сходный с описанным для SWI/SNF: происходит преждевременная, но при этом недостаточная активация гена ftz-f1 [75]. Чтобы исключить возможное влияние комплекса MSL, в эксперименте использовали личинок и предкуколок исключительно женского пола. Итак, MLE совместно с комплексом SWI/SNF связывается c регуляторными элементами гена ftz-f1 и влияет на его транскрипцию. Предположительно, MLE в процессе экспрессии данного гена расплетает сложные аберрантные структуры (РНК-вилки, РНК-петли, РНК-G-квадруплексы и др.), которые образуются в процессе транскрипции с участием паузированной РolII, а также при сближении промотора и энхансера и одновременном прохождении транскрипции.
УЧАСТИЕ MLE В РЕГУЛЯЦИИ ЭКСПРЕССИИ РАННИХ ГЕНОВ ЭКДИЗОНОВОГО КАСКАДА
Поскольку, как описано выше, MLE связывается с экдизоновыми пуффами на политенных хромосомах личинок D. melanogaster, а также взаимодействует с белком Pep, который характеризуется таким же распределением, закономерно возник вопрос об участии MLE в экдизоновом генном каскаде. (Влияние MLE на транскрипцию гена позднего ответа ftz-f1 описано выше [75].) Также изучено влияние MLE на экспрессию трех ранних генов этого каскада: Eip74EF, BR-C и Eip75B [65]. В этих экспериментах, чтобы избежать косвенных эффектов, связанных с функцией MLE в комплексе MSL, анализ проводили на личинках женского пола. У мутантных по mle самок содержание транскриптов генов Eip74EF и BR-C снижалось незначительно, но статистически значимо, тогда как уровень Eip75B оказался несколько повышенным. Этот результат предполагает вклад MLE в регуляцию экдизон-индуцируемой транскрипции. Возможно, в экдизоновых пуффах MLE, как и Pep, связан с комплексом гяРНП [92].
ВЗАИМОДЕЙСТВИЕ MLE С ENY2 – КОМПОНЕНТОМ ТРАНСКРИПЦИОННОГО КОМПЛЕКСА SAGA
В двугибридных скринингах библиотек кДНК D. melanogaster и человека обнаружено, что MLE/DHX9 взаимодействует с консервативным белком ENY2 [93, 94]. ENY2 D. melanogaster входит в состав транскрипционного комплекса SAGA и ряда других белковых комплексов, участвует в организации транскрипционных доменов хроматина, активации и элонгации транскрипции, экспорте мРНК из ядра и регуляции пространственного расположения генов в ядре [95–100]. ENY2 – это небольшой белок с массой ~10 кДа. Белки dENY2 D. melanogaster и hENY2 человека содержат 56.4% идентичных и 37.3% подобных аминокислотных остатков. В обоих случаях во взаимодействии MLE с dENY2 и DHX9 c hENY2 участвует глицин-богатый С-концевой домен, консервативный в хеликазах человека и D. melanogaster (в районах, взаимодействующих с ENY2, идентичны 40% аминокислотных остатков). Обнаруженное у D. melanogaster взаимодействие подтверждено с помощью реакций коиммунопреципитации и генетических экспериментов. Анализ сайтов колокализации MLE и ENY2 на политенных хромосомах D. melanogaster показал, что они не совпадают с сайтами локализации комплекса MSL и обнаруживаются в сайтах активного хроматина на всех хромосомах самцов и самок [93].
Таким образом, показано, что MLE D. melanogaster может участвовать в широком спектре биологических процессов, посредством взаимодействия с ENY2-содержащими комплексами.
ФУНКЦИИ DHX9 У МЛЕКОПИТАЮЩИХ
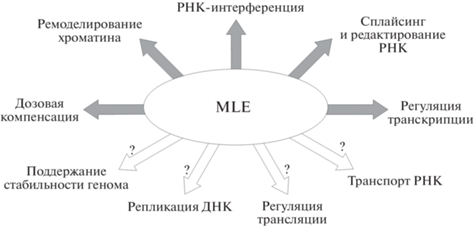
Помимо перечисленных функций, DHX9 млекопитающих участвует также в репликации ДНК и поддержании геномной стабильности [101], в регуляции трансляции [102, 103] и в транспорте РНК [104, 105]. Схематическое изображение участия MLE и ее ортолога у млекопитающих в процессах, ассоциированных с метаболизмом нуклеиновых кислот, представлено на рис. 3.
Рис. 3.
Схема участия MLE и ее ортолога в различных внутриклеточных процессах, связанных с метаболизмом нуклеиновых кислот. Стрелками со знаком вопроса обозначены процессы, участие MLE в которых не изучено, в то время как есть данные об участии DHX9 млекопитающих в этих процессах.
Очень важна связь DHX9 человека и других млекопитающих с канцерогенезом. Уровень экспрессии DHX9 повышается в клетках злокачественных опухолей нескольких типов, что рассматривается как плохой прогностический признак [106, 107]. Нокдаун DHX9 в панели культур раковых клеток человека приводит к гибели большей части из них [108]. В то же время, в других типах клеток DHX9 активирует транскрипцию генов онкосупрессоров, что предполагает двоякую роль этой хеликазы в канцерогенезе [56, 109].
Ряд вирусов, в том числе ВИЧ-1 [110], вирус гепатита С [111], цитомегаловирус [112], аденовирусы [113] и др., используют DHX9 для репликации, транскрипции, трансляции своих РНК. Одновременно с этим, DHX9 участвует в противовирусном иммунном ответе [114, 115].
DHX9 человека вовлечен также в патогенез аутоиммунных заболеваний: этот белок является аутоантигеном у 6–23% пациентов с системной красной волчанкой. Количество больных, в сыворотке которых выявляются аутоантитела к DHX9, существенно варьирует в разных популяциях и на разных стадиях развития заболевания. На ранних стадиях аутоантитела к DHX9 выявляются с более высокой частотой и могут быть использованы в клинической практике в качестве диагностического маркера системной красной волчанки [116, 117].
ЗАКЛЮЧЕНИЕ
Итак, поскольку MLE у D. melanogaster и DHX9 у млекопитающих способны взаимодействовать с различными ядерными и цитоплазматическими белками и связываться с разными формами нуклеиновых кислот, эти хеликазы считаются одними из ключевых регуляторов экспрессии генов. Посредством разных доменов MLE и DHX9 способны взаимодействовать с разными белками и участвовать в работе разных белковых комплексов, что и определяет многообразие функций этих хеликаз. Многие функции MLE и ее ортолога консервативны в эволюции. Некоторые функции избыточны, их важность становится очевидной только в сочетании с потерей функции других хеликаз. Так, отсутствие DHX9 в геномах домашних кур и уток делает их более чувствительными к вирусным инфекциям по сравнению с млекопитающими. При этом особенно это выражено у кур, у которых отсутствует также хеликаза RIG-1 (DDX58) [8, 9].
Несмотря на интенсивные исследования, остается много неясного в том, как функционируют MLE и ее ортологи in vivo, как определяется и изменяется специфичность связывания субстратов, процессивность и т.д. в клетках разных тканей, в процессах онтогенеза, в патологических процессах. Преимущество D. melanogaster в качестве модельного объекта для изучения функций MLE состоит в том, что потеря функции MLE не приводит к эмбриональной летальности у D. melanogaster, что позволяет исследовать функции этого белка на дальнейших стадиях развития, а также установить, какие белки могут компенсировать отсутствие MLE в клетках разных тканей, частично выполняя ее функции.
Поскольку потенциально ортолог MLE представляет собой мишень для противоопухолевой и противовирусной терапии и вовлечен в развитие аутоиммунных заболеваний, дальнейшее изучение функций этого белка может иметь большую практическую ценность для медицины.
Работа поддержана Российским научным фондом (№ 22-14-00270).
В работе не использовали людей и животных в качестве объектов исследования.
Авторы сообщают об отсутствии конфликта интересов.