ВВЕДЕНИЕ
Феррит меди в настоящее время широко исследуется в силу его высокопроводящих и магнитных свойств [3, 4], а также разнообразных каталитических применений [5–8]. Так, феррит меди высокоактивен как катализатор в реакции гидролиза и гидротермолиза амминборана – процессе получения водорода при температуре окружающей среды [1, 2]. Несмотря на то что такие катализаторы известны давно, вопрос о формировании состава и структуры смешанного оксида с заданными каталитическими свойствами мало изучен. Одним из эффективных способов получения наноразмерных частиц медь–железо смешанного оксида со структурой кубической шпинели является метод послойного горения глицин-нитратных предшественников [9, 10]. Присутствие меди в структуре кубической шпинели CuFe2O4 сложно подтвердить РФА без дополнительных исследований, поскольку Fe3O4 и Cu1–xFe2+xO4 обладают близкими параметрами решетки. В отличие от РФА и других методов фазового анализа метод дифференцирующего растворения (ДР) позволяет анализировать как кристаллические, так и аморфные многоэлементные многофазовые вещества. Уникальное свойство метода ДР – отсутствие необходимости в эталонах соответствующих индивидуальных фаз как постоянного, так и переменного состава [11, 12], что обусловливает возможность анализа веществ неизвестного состава, к которым фактически относятся все твердые неорганические объекты химического анализа.
В настоящее время задачи фазового анализа в основном решают рентгеновским методом. Однако на основе базы данных о кристаллической структуре твердых веществ при отсутствии эталонных образцов реальных химических веществ можно получить лишь качественные сведения о фазовом составе объектов. Совместное использование методов рентгенографии и ДР позволяет получать существенно более полные сведения о составе многоэлементных фаз, их кристаллической структуре и количественном содержании в исследуемых объектах.
Цель настоящей работы – определение фазового состава серии образцов ферритов меди методом ДР. Полученные результаты ДР сопоставлены с данными РФА, что позволило детализировать информацию по составу кристаллических фаз, определить долю аморфной фазы и, главное, установить содержание меди в структуре шпинели.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследования – образцы смешанных оксидов со структурой шпинели. Образцы готовили методом послойного горения на воздухе таблеток, спрессованных из высушенного порошка глицин-нитратного предшественника, как описано в [1, 9], затем прокаливали при температуре 300, 700 и 1100°С в течение 4 ч. Элементный состав исследуемых катализаторов приведен в табл. 1.
Таблица 1.
Элементный состав образцов феррита меди с различной термообработкой
| t, °С | C, мас. % | |
|---|---|---|
| Fe | Cu | |
| Непрокаленный | 48.9 | 23.2 |
| 300 | 49.4 | 24.5 |
| 700 | 45.4 | 21.8 |
| 1100 | 47.6 | 23.3 |
Аппаратура и методика растворения. ДР анализируемых проб катализаторов проводили с помощью стехиографа в проточном динамическом режиме растворения при увеличении концентрации и температуры растворителя. Используя режим стехиографического титрования, растворение начинали с 0.01 М водного раствора HCl, затем последовательно переходили к 1.2 M растворам HCl, 3 M и 4 M HF при постепенном повышении температуры от 20 до 80°С. В принятых условиях образцы растворяются полностью, но продолжительность растворения на каждом этапе была разной, что связано с принципами метода ДР [13]. Анализировали фракцию со средним размером частиц ≤40 мкм. Навеску пробы ≈10 мг наносили на липкий вкладыш одноразового использования, изготовленный из полимерной пленки с липкой поверхностью. Поток образующегося раствора пробы направляли в детектор-анализатор стехиографа ‒ атомно-эмисионный спектрометр с индуктивно связанной плазмой [14]. Элементный состав потока определяли каждые 5 с по спектральным линиям элементов: Cu – 324.7 нм, Fe – 238.2 нм, с чувствительностью на уровне 10–3 мкг/мл и погрешностью 5 отн. %. Эти линии выбраны с учетом отсутствия их спектрального наложения. Информацию о концентрации элементов в процессе растворения и возникающие на экране монитора кинетические кривые растворения элементов наблюдали и фиксировали, корректируя в реальном времени их ход в режиме стехиографического титрования. После окончания эксперимента кинетические кривые растворения элементов трансформировали в стехиограммы. Приведенные ниже средние значения участков стехиограмм рассчитаны по нескольким десяткам расчетных точек. Анализ вида стехиограмм в изменяющихся условиях, симбатность появления катионов в растворе и результаты математической обработки кривых позволяют сделать выводы о составе фазы (соотношении катионов в фазе) и ее количестве в образце. Поскольку кислород указанным методом не определяется, стехиометрические формулы соответствующих фаз представлены в их фрагментарной форме – без кислорода.
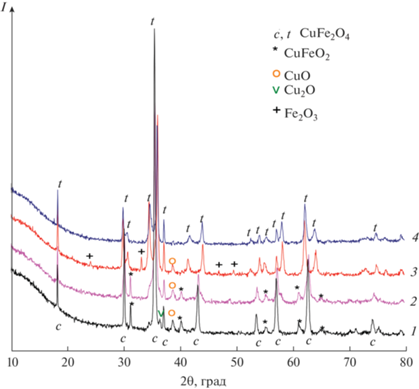
РФА проводили с использованием дифрактометра D_8 (Bruker) в монохроматизированном CuKα-излучении (графитовый монохроматор на отраженном пучке). Эксперименты проводили на воздухе методом сканирования по точкам с шагом 10°–80° 2θ и временем накопления 3 с в каждой точке. Для идентификации фаз использовались следующие данные: кубическая шпинель CuFe2O4 [PDF250283], Fe3O4 [PDF 261136], CuO [PDF 45-937], Сu2O [PDF 5-667], Сu [PDF 4-836], Fe2O3, CuFeO2 [ICSD 98488].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Катионное распределение меди в структуре кубической шпинели CuFe2O4 существенно влияет на каталитические свойства синтезируемых образцов феррита меди. Безэталонный метод ДР позволяет определять изменение катионного состава образцов смешанных оксидов на поверхности и в объеме частиц образца. В табл. 2 представлены результаты определения фазового состава всех исследуемых образцов двумя методами.
Таблица 2.
Фазовый состав образцов смешанного оксидного катализатора с различной термообработкой по данным РФА и ДР
| t, °С | Фазовый состав | |
|---|---|---|
| РФА | ДР | |
| Непрокаленный | Cu1–xFe2+xO4 (куб.): a = 8.386 Å, D = 915 Å CuFeO2 CuO Cu2O |
65.1% Cu0.29±0.02Fe 9.7% Fe 9.3% CuFe 14.4% CuFe0.4±0.02* 1.4% Cu |
| 300 | Cu1–xFe2+xO4 (куб.): a = 8.370 Å, D = 300 Å CuFeO2 CuO |
62.0% Cu0.29±0.06Fe 13.2% Fe 10.1% CuFe 14.5% CuFe0.24±0.02* 0.2% Cu |
| 700 | Cu1–xFe2+xO4 (тетр.): a = b = 5.817 Å, c = 8.708 Å, D = 460 Å Fe2O3 CuO |
93.6% Cu0.41±0.02Fe 3.2% Fe 3.2% Cu |
| 1100 | Cu1–xFe2+xO4 (тетр.): a = b = 5.834 Å, c = 8.659 Å, D = 620 Å | 97.4% Cu0.42±0.05Fe 1.3% Cu 1.3% Fe |
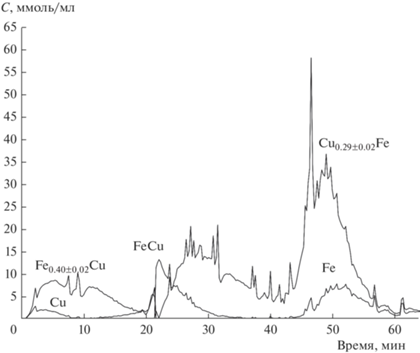
При анализе образцов сначала исследовали отличия в растворении Fe2O3 и Fe3O4 с целью установить области их растворения в условиях стехиометрического титрования, описанных выше. Установлено, что Fe3O4, приготовленный методом осаждения [1], преимущественно растворяется в области средней концентрации соляной кислоты (рис. 1), Fe2O3 – в 4 М растворе HF (рис. 2). Известно, что шпинели являются устойчивыми соединениями и для их растворения необходимы жесткие условия: высокие температура и кислотность растворителя [15]. Поэтому в условиях стехиометрического титрования фаза медь–железо смешанного оксида со структурой шпинели растворяется в более кислотной области (3 M HCl, 4 M HF и температура 80°C). Начальная стадия растворения в HCl (0.01 М) была необходима для анализа аморфных и дефектных оксидных фаз, твердых растворов, а также легкорастворимых соединений меди, которые могут формироваться в восстановительных условиях горения.
Рис. 1.
Кинетическая кривая растворения Fe образца Fe3O4 в потоке кислот при увеличении температуры с 20 до 80°C.

Рис. 2.
Кинетическая кривая растворения Fe образца Fe2O3 в потоке кислот при увеличении температуры с 20 до 80°C.

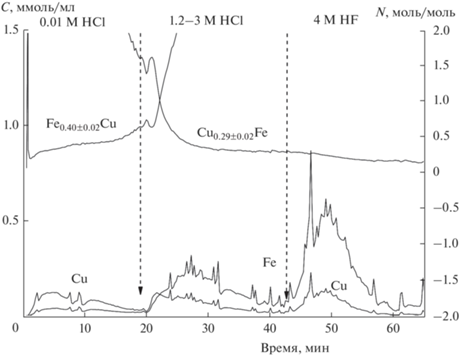
Непрокаленный образец. По данным РФА, образец содержит фазу шпинели Cu1–xFe2+xO4 с кубическим искажением решетки (a = 8.386 Å) со средним размером частиц 915 Å и примесные медьсодержащие фазы (рис. 3). На рис. 4 приведены кинетические кривые растворения Cu, Fe, а также стехиограммы Cu : Fe и Fe : Cu в зависимости от времени растворения навески пробы. Временной профиль полученных стехиограмм свидетельствует о гетерофазности образца. Анализ кривых растворения образца в HCl и HF показал присутствие CuFe-фазы, о чем свидетельствует одновременное начало и завершение растворения Cu, Fe. Переменный временной профиль стехиограммы Cu : Fe свидетельствует о пространственно неоднородном распределении меди в оксиде железа Cu0.29±0.02Fe. В этой формуле приведены средние значения стехиометрических индексов с учетом погрешности метода и неоднородного распределения компонентов по объему. Большее соотношение Cu : Fe в начальный период растворения CuFe-фазы в HCl может быть обусловлено обогащением поверхностных слоев этой фазы катионами меди либо формированием высокодисперсных и прочносвязанных с поверхностью CuFe-фазы частиц CuOx. Принимая во внимание, что основной фазой в исходном продукте горения является смешанная CuFe-фаза со стехиометрией Cu/Fe = = 0.29, можно утверждать, что обнаруженная РФА фаза кубической шпинели имеет стехиометрию Cu0.67Fe2.33O4. Такой состав и метод приготовления этих образцов позволяют ожидать наличия восстановленных ионов Fe2+ и Cu+ в структуре шпинели [1]. При этом растворение шпинели наблюдается одновременно с растворением свободного железа (рис. 5). Растворение железа обусловлено жесткими условиями (4 M HF и температура 80°C), что позволяет отнести его к фазе Fe2O3, которая, как уже отмечалось, характеризуется более высокой устойчивостью. Таким образом, формирование феррита меди при послойном горении образца сопровождается параллельным процессом образования фазы Fe2O3, пространственно распределенной в объеме фазы шпинели. Также методом ДР в образце обнаруживаются частицы с катионным составом Cu/Fe = 1, которые предположительно находятся на поверхности фазы шпинели. Обнаружение фазы CuFeO2 подтверждается и данными РФА. Растворение образца в 0.01 M HCl при 20–50°C соответствует линейному участку на стехиограмме Fe : Cu (Fe : Cu = 0.40 ± 0.02), что свидетельствует о взаимодействии железа и меди с образованием, вероятнее всего, твердого раствора Cu–Fe, предположительно ренгеноаморфной. На рис. 5 представлены трансформированные из кинетических кривых растворения Cu и Fe кинетические кривые растворения обнаруженных фаз.
Рис. 4.
Кинетические кривые растворения Cu, Fe и стехиограммы Cu : Fе, Fе : Cu непрокаленного образца.
Образец, прокаленный при 300°C. По данным РФА, образец состоит из фазы шпинели Cu1–xFe2+xO4 с тетрагональным искажением решетки (a = 8.370 Å) со средним размером частиц 300 Å и фаз CuFeO2, CuO (рис. 3). Низкотемпературное прокаливание продукта горения при 300°С практически не влияет на кинетику растворения Cu, Fe а также вид стехиограмм Cu : Fe и Fe : Cu. По данным ДР, содержание основной CuFe-фазы со стехиометрией Cu0.67Fe2.33O4 составило 62.0%. Помимо этого, окисление образца при 300°С приводит к уменьшению содержания железа с 0.4 до 0.24 в твердом растворе Cu–Fe (Fe/Cu = 0.24 ± ± 0.02). Одновременно наблюдается увеличение содержания свободного железа (табл. 2).
Образцы, прокаленные при 700 и 1100°C. По данным РФА, эти образцы представляют собой фазу шпинели Cu1–xFe2+xO4 с тетрагональным искажением решетки: a = b = 5.817, c = 8.708 Å, средний размер частиц 460 Å в случае 700°C и a = b = 5.834, c = 8.659 Å, средний размер частиц 620 Å в случае 1100°C (рис. 3). На рис. 6 приведены кинетические кривые растворения меди и железа, а также стехиограмма Cu : Fe в зависимости от времени растворения образца, прокаленного при 700°C. Рассмотрим подробнее эту стехиограмму. В начале растворения временной профиль стехиограммы Cu : Fe стремится к бесконечности, что служит доказательством присутствия на поверхности частиц образца медьсодержащей фазы; далее можно выделить линейный участок с постоянным мольным отношением Cu : Fe = 0.41 ± 0.02, что свидетельствует об образовании смешанной CuFe-фазы. На конечном этапе растворения образца (50–70 мин) мольное отношение Cu : Fe < 0.41, что указывает на одновременное растворение фаз смешанного оксида и железа. После вычитания вкладов фазы феррита меди с указанным составом из суммарных кинетических кривых растворения меди и железа получили, что в составе катализатора 93.6% составляет фаза Cu0.41Fe, на поверхности которой содержится 3.2% меди предположительно в виде оксида и 3.2% Fe2O3 (рис. 7).
Рис. 6.
Кинетические кривые растворения Cu, Fe и стехиограмма Cu : Fе образца, прокаленного при 700°C.
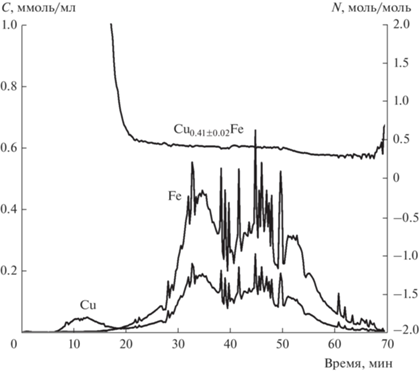
Рис. 7.
Кинетические кривые растворения фаз, обнаруженных в составе образца, прокаленного при 700°C.

Прокаливание образца при 1100ºС приводит к снижению содержания примесных фаз, увеличению содержания основной шпинельной фазы Cu0.42±0.05Fе до 97.4% и увеличению содержания меди в структуре шпинели. Результаты ДР хорошо согласуются с данными РФА, а также дополняют их: обнаружена фаза Fe2O3 в виде пространственной неоднородности в шпинельной фазе 1.3%.
ЗАКЛЮЧЕНИЕ
Применение метода ДР позволило определить стехиометрию смешанного оксида медь–железо, оценить содержание железо- и медьсодержащих примесей, а также, предположительно, твердых растворов на основе CuO с железом. Выявлены особенности пространственного распределения основных и примесных фаз в объеме образцов и на их поверхности. Такие сведения представляют существенный интерес при соотнесении состава и структуры образцов с их свойствами как катализаторов.