ВВЕДЕНИЕ
Исследование соединений биометаллов (железо, медь, цинк, марганец, кобальт и др.) с карбоновыми и оксикарбоновыми кислотами, аминокислотами (АК), пептидами важно с точки зрения химии, биологии, медицины и имеет научное и прикладное значение. В последнее время вырос интерес к изучению систем со смешанолигандным комплексообразованием, которое преобладает в биологических и экологических условиях. Большинство процессов, протекающих в организме, включает в себя взаимодействие ионов металла с несколькими лигандами. Так, известно, что при транспортировке металлов большую роль играют смешанолигандные комплексы (СЛК) с участием двух аминокислот [1]. Большое значение придается изучению координационных соединений меди(II) с α-аминокислотами, поскольку они участвуют в транспорте меди в ткани, клетки и жидкости организма.
Однороднолигандные комплексы меди(II) с аминокислотами и карбоновыми кислотами (лимонная, щавелевая, янтарная, фумаровая, яблочная и др.), а также карбоксилатные соли меди(II) изучены достаточно полно [2‒5]. Широкое применение в медицинской практике находит янтарная кислота HOOC(CH2)2COOH (H2Suc). Она рекомендуется в качестве общеукрепляющего средства, применяется в медицине как активное бактерицидное вещество, ее соли могут быть использованы в фармакологии, ветеринарии, медицине и пищевой промышленности в качестве лекарственных средств или биологически активных добавок. Сукцинаты d-металлов можно получить взаимодействием янтарной кислоты с гидроксидами и карбонатами металлов, взаимодействием сукцината натрия с солями d-металлов [6]. Из твердой фазы сукцинат меди(II) получен реакцией основного карбоната меди с янтарной кислотой [7]. Для сукцината меди CuSuc ⋅ 0.5H2O [8] определена константа растворимости KS = 2.9 × 10–6. Добавление аминокислоты (серин, глицин, аланин) к этой соли увеличивает ее растворимость, расчетные данные для системы сукцинат меди(II)‒аминокислота предсказывают образование СЛК. Это изменение растворимости сукцината меди авторы связывают с представлением о потенциальном увеличении биодоступности иона Cu2+. В работе [9] дана информация о термическом поведении сукцинатов переходных металлов MC4H4O4 ⋅ nH2O (M = = Mn2+, Fe2+, Co2+, Ni2+, Cu2+, Zn2+). Конечным продуктом термического разложения указанных сукцинатов являются Mn3O4, Fe2O3, Co3O4, NiO, CuO и ZnO соответственно.
Получены и смешанолигандные соли меди(II) с янтарной кислотой, аминокислотами и другими лигандами. Динуклеарная соль [Cu2(C4H4O4)(phen)2(H2O)2](NO3)2 (${{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}{\text{O}}_{4}^{{2 - }}$ ‒ сукцинат-ион, phen ‒ 1,10-фенантролин) содержит мостиковый сукцинат-анион, ионы меди имеют квадратно-плоскостную геометрию [10]. Из раствора синтезирована соль состава [(phen)2Cu(μ‑L)Cu(phen)2]L ⋅ 12.5H2O (L2‒ ‒ анион янтарной кислоты), которая состоит из сукцинатных мостиковых комплексных катионов [(phen)2Cu(μ-L)Cu(phen)2]2+, некоординированных сукцинатных анионов и молекул воды, связанных водородной связью [11]. Изучено применение при терапии опухоли соединения меди(II) с L-серином (HOCH2CH(NH2)CO2H) и глицином (NH2CH2CO2H, HGly) [12]. Эта работа показала, что смешанолигандные соединения меди(II) с α-аминокислотами перспективны для поиска новых противоопухолевых соединений. В работе [13] дан обзор химии соединений меди(II) со многими аминокислотами: глицином, аланином, гистидином, лизином, тирозином, серином и др.
К настоящему времени в литературе имеется достаточно данных по константам устойчивости сукцинатных комплексов меди(II) в растворах, однако они довольно противоречивы. В работе [5] методом капиллярного электрофореза определены константы равновесий в системе Cu2+‒янтарная кислота (H2L): lg β(CuL) = 2.89 ± 0.02, lg K(CuHL+) = 5.4 ± 0.5, lg β$\left( {{\text{CuL}}_{2}^{{2 - }}} \right)$ = 3.88 ± 0.05, lg R$\left( {{\text{CuHL}}_{2}^{ - }} \right)$ = 7.2 ± 0.3, приведены также литературные данные по константам равновесий в указанной системе.
Изучены смешанолигандные комплексы меди(II) с аминокислотами, карбоновыми кислотами и другими лигандами. В работах [1, 14] при рН > 7 для растворов с соотношением компонентов 1 : 1 : 1 определено образование комплексов состава CuAspSer– (lgβ111 = 24.5) и CuAspVal– (lg β111 = 19.9) (Asp ‒ аспарагиновая кислота, Ser, Val ‒ серин, валин); в системе Cu(Gly)2–Hist при изменяющейся концентрации гистидина (pH 5–6; 200–300 нм) cпектрофотометрически установлено образование разнолигандных комплексов. Полярографически показано образование СЛК [Cu(Val–)(Gly–)] (β111 = 4.6 × 1015) и [Cu(Val–)(Leu–)] (β111 = 7.2 × 1015) в тройных системах Cu2+‒валинат-ион (Val–)‒глицинат-ион, Cu2+‒валинат-ион‒лейцинат-ион (Leu–) соответственно [15].
Исходя из литературных данных можно заметить, что разнолигандные комплексные соединения меди(II) на основе карбоновых и аминокарбоновых кислот при образовании в растворе чаще всего имеют состав 1 : 1 : 1, при выделении в твердом виде их состав и строение могут быть иными и меняться в широких пределах.
Изучение смешанолигандного комплексообразования важно в научном плане для решения вопросов совместимости лигандов, их взаимного влияния в координационной сфере комплекса, устойчивости СЛК, изменения химических и биологических свойств СЛК по сравнению с однороднолигандными комплексами. В практическом плане на примере изучения реакций взаимодействия ионов биометаллов с лигандами, содержащими те же функциональные группы, что и какой-либо рассматриваемый биологический объект, возможно моделирование физиологических процессов.
Цель данной работы – исследование комплексообразования (состав и устойчивость комплексов) в двойных (Cu2+‒Suc2–(Lm–)) и тройных (Cu2+‒Suc2–‒Lm–) системах, содержащих сукцинат-ион и ионы Lm– некоторых аминокислот (аминоуксусной, аспарагиновой, глутаминовой), а также определение константы растворимости синтезированного сукцината меди(II) состава CuC4H4O4 ⋅ 2H2O.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для изучения взаимодействия в системах, содержащих медь(II), янтарную кислоту и (или) некоторые аминокислоты L-ряда, использовали растворы CuCl2, янтарной, аминоуксусной, глутаминовой NH2(CH2)2CH(CO2H)2 (H2Glu) и аспарагиновой NH2CH2CH(CO2H) кислот, приготовленных из реактивов марок “х. ч.” и “ч. д. а”. Растворы кислот низких концентраций получали путем разбавления исходных растворов, приготовленных из навесок кислот. Концентрацию кислот уточняли pH-потенциометрически. Во всех исходных и рабочих растворах поддерживали постоянную ионную силу I = 0.3, создаваемую хлоридом натрия. Измерение рН в растворах осуществляли на рН-метре-673, стеклянный электрод которого калибровали по буферным растворам с pH в интервале 3.56‒6.86 при 25°C. Спектральные измерения проводили на спектрофотометре модели UV-2800, фотоэлектроколориметре КФК-2-УХЛ 4.2 при толщине поглощающего слоя l = 10 мм. Для термического анализа синтезированной соли CuSuc · 2H2O использовали прибор марки Netzsch STA 449 C.
Для изучения смешанолигандного комплексообразования меди(II) с биологически активными лигандами (янтарной кислотой и аминокислотами) предварительно определяли общие константы протонизации кислот Bi при выбранной ионной силе I = 0.3, а также состав и константы устойчивости однороднолигандных комплексов меди(II). Константы протонизации кислот определяли pH-потенциометрическим методом, титруя растворы кислот бескарбонатной щелочью при перемешивании смеси очищенным азотом.
Состав комплекса [CuSuc] (1 : 1) был установлен методом изомолярных серий (рН 2.20), заряд и устойчивость (lg β1 = 2.64) – методом функциональной зависимости D–pH [16], представленной на рис. 1 и в табл. 1. Растворы серии В готовили сливанием растворов лиганда и металла и переменных количеств растворов NaOH, HCl и NaCl, чтобы общий объем составлял 6 мл (I = 0.3). Растворы серии А готовили аналогично, но вместо раствора лиганда брали равный объем 0.3 моль/л раствора NaCl. Во избежание выпадения осадка сукцината меди(II) измерения в растворах проводили в интервале pH 1.5‒4.5.
Рис. 1.
Изменение оптической плотности в системе Cu2+–H2Suc от pH ($C_{{{\text{Cu}}}}^{0}$ = $C_{{{\text{Suc}}}}^{0}$ = 5 × 10–2 моль/л; VМ = VL = 2 мл; Vобщ = 6 мл; I = 0.3; λэф = 750 нм): 1 – D; 2 – DM.

Таблица 1.
Данные по измерению оптической плотности, pH и определению заряда и устойчивости комплекса в системе Cu2+–H2Suc (С0(CuCl2) = С0(H2Suc) = = 5 × 10–2 моль/л; VМ = VL = const = 2 мл; Vобщ = 6 мл; I = 0.3; λэф = 750 нм; D∞ = 0.321; Kh(Cu2+) = 2.95 × 10–8; lgВ1 = 5.08, lgВ2 = 8.97)
| Серия | D | DМ | pH | lg β1 |
|---|---|---|---|---|
| А | 0.200 | 2.50 | ||
| В | 0.252 | 2.16 | 2.42 | |
| А | 0.200 | 2.10 | ||
| В | 0.248 | 2.00 | 2.70 | |
| А | 0.200 | 1.90 | ||
| В | 0.245 | 1.85 | 2.67 | |
| А | 0.200 | 1.85 | ||
| В | 0.242 | 1.82 | 2.70 | |
| А | 0.200 | 1.80 | ||
| В | 0.238 | 1.73 | 2.68 | |
| А | 0.200 | 2.50 | ||
| В | 0.252 | 2.10 | 2.59 |
Реакцию образования комплекса состава 1 : 1 можно представить уравнением:
Определение констант устойчивости однороднолигандных комплексов меди(II) с аминокислотами проводили методом Бьеррума. В табл. 2 для примера приведены данные pH-потенциометрического титрования в системе CuCl2‒Gly и результаты расчета lg β1 для комплекса [CuGly]+. Расчет величины lg β1 для комплексов CuL, где L – анион аминокислоты, проводили в интервале pH 3.5‒6, где доминируют указанные комплексы. Частицы MHnL, согласно диаграммам выхода комплексных частиц с аминокислотами [1, 18, 19], доминируют в интервале pH 1‒4.
Таблица 2.
Данные pH-потенциометрического титрования в системe Сu2+–HGly (5 мл 5 × 10–3 моль/л раствора HGly и 5 мл 5 × 10–3 моль/л раствора CuCl2; ∆pH = ‒0.37; СNaOH = 1.07 × 10‒2 моль/л)
| № | VNaOH, мл |
pHизм | lg β1 | № | VNaOH, мл |
pHизм | lg β1 |
|---|---|---|---|---|---|---|---|
| 1 | 0.0 | 3.70 | 8.10 | 16 | 1.5 | 4.87 | 8.18 |
| 2 | 0.1 | 3.74 | 8.11 | 17 | 1.6 | 4.95 | 8.20 |
| 3 | 0.2 | 3.80 | 8.08 | 18 | 1.7 | 4.98 | 8.19 |
| 4 | 0.3 | 3.90 | 8.09 | 19 | 1.8 | 5.04 | 8.24 |
| 5 | 0.4 | 4.00 | 8.13 | 20 | 1.9 | 5.08 | 8.21 |
| 6 | 0.5 | 4.09 | 8.12 | 21 | 2.0 | 5.14 | 8.23 |
| 7 | 0.6 | 422 | 8.12 | 22 | 2.1 | 5.18 | 8.22 |
| 8 | 0.7 | 4.28 | 8.13 | 23 | 2.2 | 5.25 | 8.26 |
| 9 | 0.8 | 4.34 | 8.12 | 24 | 2.3 | 5.28 | 8.27 |
| 10 | 0.9 | 4.42 | 8.12 | 25 | 2.4 | 5.34 | 8.29 |
| 11 | 1.0 | 4.49 | 8.13 | 26 | 2.5 | 5.40 | 8.31 |
| 12 | 1.1 | 4.56 | 8.13 | 27 | 2.6 | 5.46 | 8.35 |
| 13 | 1.2 | 4.64 | 8.11 | 28 | 2.7 | 5.51 | 8.40 |
| 14 | 1.3 | 4.71 | 8.12 | 29 | 2.8 | 5.56 | 8.37 |
| 15 | 1.4 | 4.81 | 8.16 | 30 | 2.9 | 5.70 | 8.44 |
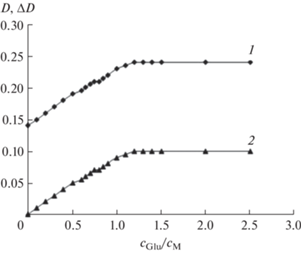
Состав и устойчивость разнолигандных комплексов [CuGlySuc]–, [CuAspSuc]2– и [CuGluSuc]2– определяли методом кривых насыщения при pH ~ 4 (отсутствие частиц CuHnL). Для примера на рис. 2 приведена кривая насыщения в системе (Cu2+–H2Suc)‒H2Glu, указывающая на образование комплекса состава 1 : 1 : 1, а в табл. S1 и S2 ‒ данные для расчета константы устойчивости β111 СЛК в системах (Cu2+‒H2Suc)‒H2Glu и (Cu2+‒H2Glu)‒H2Suc.
Рис. 2.
Изменение оптической плотности в растворах (кривая насыщения) системы (Cu2+–H2Suc)‒H2Glu (CCu = CSuc = 8.34 × 10–3 моль/л; CGlu ≠ const; pH 4.13; λэф = 750 нм): 1 – D; 2 – ∆D.
Синтез сукцината меди(II) проводили из водного раствора хлорида меди(II) и янтарной кислоты, частично нейтрализованной гидроксидом натрия, чтобы выделение осадка проходило при pH ~ 4. Мольное соотношение компонентов составляло 1 : 1. Сукцинат меди(II) – это мелкокристаллическое вещество голубого цвета, которое малорастворимо в воде. В соли содержание меди находили иодометрически, воды, оксида металла и сукцинат-иона – гравиметрически и термогравиметрически. Результаты анализа синтезированной соли представлены ниже.
| Сu2+ | Suc2‒ | H2O | CuO | |
| Найдено, %: | 29.9, | 54.5, | 16.4, | 37.3. |
| Для CuSuc · 2H2O | ||||
| вычислено, %: | 29.47, | 53.82, | 16.71, | 36.89. |
По данным растворимости сукцината меди(II) в 0.3 моль/л растворах (H, Na)Cl (табл. 3) с учетом равновесий и их констант равновесия
Таблица 3.
Данные по растворимости (0.3 моль/л растворы (Н, Na)Cl) и расчета KS соли CuSuc · 2H2O
| CCu, моль/л | pH | – lg KS |
|---|---|---|
| 2.66 × 10–4 | 5.17 | 7.53 |
| 2.41 × 10–4 | 5.24 | 7.57 |
| 2.66 × 10–4 | 5.23 | 7.49 |
| 2.81 × 10–4 | 5.21 | 7.47 |
| 3.46 × 10–4 | 4.78 | 7.59 |
| 4.53 × 10–4 | 4.52 | 7.62 |
| 6.00 × 10–4 | 4.30 | 7.63 |
| 6.80 × 10–4 | 4.17 | 7.69 |
| 7.86 × 10–4 | 4.08 | 7.69 |
рассчитана константа растворимости соли CuSuc · 2H2O (lgKS = –7.59 ± 0.06) по формуле:
где CCu – концентрация иона металла в насыщенном растворе; функция протонизации сукцинат-аниона f = 1 + B1[H+] + B2[H+]2 (B1, B2 – общие константы протонизации янтарной кислоты для I = 0.3); ω = 1 + Kh1/h ‒ функция гидролиза иона Cu2+, Kh1 – константа гидролиза иона Cu2+ по первой ступени; h = [H+]. Концентрацию ионов Cu2+ в насыщенных растворах сукцината меди(II) определяли иодометрически.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Экспериментально определенные константы протонизации глутаминовой, аспарагиновой и янтарной кислот (I = 0.3) согласуются с данными [20], пересчитанными на I = 0.3 по уравнению Дэвиса (табл. 4).
Таблица 4.
Данные определения (I = 0.3, 25°C) и пересчета логарифма общих констант протонизации кислот lg Bi
| Кислота | Величина lg Bi | |
|---|---|---|
| I = 0.1 [20]; I = 0.3 (пересчет) | эксперимент (I = 0.3) | |
| Янтарная | 5.28, 9.28; 5.17, 9.12 | 5.08, 8.97 |
| Аминоуксусная | 9.62,12.0; 9.53, 11,89 | ‒ |
| Глутаминовая | 9.67, 13.95; 9.56, 13.77 | 9.52, 13.70 |
| Аспарагиновая | 9.62, 13.32; 9.51, 13.17 | 9.45, 13.12 |
Расчеты констант протонизации лигандов, констант устойчивости однороднолигандных комплексов по данным pH-потенциометрии, метода D‒pH проведены на ЭВМ [17]. При pH-потенциометрическом определении констант устойчивости меди(II) с аминокислотами методом Бьеррума установлено, что кривые титрования соответствующих кислот с солью металла лежат ниже кривых титрования самих кислот, что связано с вытеснением комплексообразователем протонов из доминирующих в системе (pH 3.5–6) форм лигандов:
Доминирование частиц HGly, HGlu– и HAsp– в указанном интервале pH подтверждается диаграммами выхода кислот.
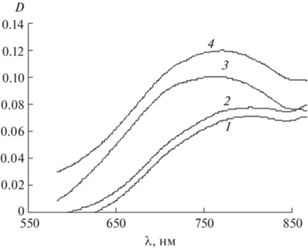
Электронные спектры поглощения одинарных, двойных и тройных систем указывают на образование СЛК (рис. 3). Повышение оптической плотности, смещение максимумов поглощения в коротковолновую область в системах с однородными и разными лигандами по сравнению с исходным водным раствором хлорида меди(II) свидетельствуют об образовании комплексных частиц ‒ однородно- и разнолигандных комплексов. Замещение молекул воды в координационной сфере иона Cu2+ на более прочно связываемые лиганды (лучшие доноры электронных пар) увеличивает разность энергий расщепленных d-подуровней комплексообразователя, и его d‒d-полоса поглощения смещается в сторону более коротких длин волн (гипсохромный эффект). Образование смешанолигандных комплексов в растворе связано со сродством d-катиона Cu2+ (d9) к донорным атомам как азота, так и кислорода выбранных лигандов – некоторых аминокислот и янтарной кислоты.
Рис. 3.
Спектры поглощения систем: 1 – СuCl2; 2 – СuCl2–H2Suc; 3 – СuCl2–HGly; 4 – СuCl2–H2Suc–HGly (CM = CL = 9.26 × 10–3; pH ~ 3).
Авторы работы [5] приводят для комплекса [CuSuc] следующие литературные значения lg β1: 2.70, 2.59, 2.50, 2.60, 2.61, 2.85, 2.98, 3.20, 3.22. В работе [2] показано, что при ионной силе 0.1 и всех выбранных соотношениях металл : лиганд образуются комплексные частицы CuHSuc+ (lg β11 = 1.99) и CuSuc (lg β1 = 3.02, 2.98). Определенная нами методом D–pH величина lg β1 = = 2.64 ± 0.15 имеет меньшее значение при большей ионной силе (I = 0.3).
Из данных по кривым насыщения систем (Cu2+–H2Suc)‒АК и (Cu2+–АК)‒H2Suc (табл. S1, S2 ) рассчитаны константы устойчивости β111 смешанолигандных комплексов по методике, изложенной в [21]. Для равновесия с участием сукцинатных комплексов меди(II) состава 1 : 1 и 1 : 1 : 1
Для равновесия
Таблица 5.
Данные определения состава и констант устойчивости однородно- и разнолигандных комплексов меди(II) (I = 0.3, 25°C)
| Состав комплекса |
Методы определения констант устойчивости | Литературные данные |
||
|---|---|---|---|---|
| pH-метрия, lg β1 | фотометрия | |||
| lg β1, lg β111 | ε∞ (750 нм), л моль‒1 см‒1 |
|||
| [CuSuc] | 2.64 ± 0.15 | 19.3 | 3.02, 2.98, I = 0.1; 2.89 [2, 5] | |
| [CuGlyc]+ | 8.13 ± 0.17 | – | 8.1, I = 0.1 [20] | |
| [CuGlu] | 8.49 ± 0.36 | – | 7.85, I = 0.02 [20] | |
| [CuAsp] | 8.56 ± 0.37 | – | – | |
| [CuGlycSuc]– | – | 12.88 ± 0.24 | 21.6 | |
| [CuGluSuc]2– | – | 13.07 ± 0.25 | 28.8 | |
| [CuSucGlu]2– | – | 12.97 ± 0.21 | 28.8 | |
| [CuAspSuc]2– | – | 13.21 ± 0.48 | 42.0 | |
Из табл. 5 видно, что константы устойчивости однороднолигандных комплексов меди с глицинат-, глутаминат- и аспарагинат-анионами (lg β1 составляет 8.05, 8.49 и 8.56 соответственно), как и константы устойчивости смешанолигандных комплексов меди(II) с сукцинат-ионом и ионами аминокислот (lg β111 соответственно составляет 12.88, 13.07, 13.21), не сильно изменяются в указанных рядах, что может быть связано с близостью строения и кислотно-основных свойств изучаемых АК (так, для глицинат-, глутаминат- и аспарагинат-анионов величина lg B1 составляет соответственно 9.53, 9.56 и 9.51).
Относительная стабильность разнолигандных комплексов по сравнению с устойчивостью соответствующих однороднолигандных комплексов, а также совместимость разных лигандов (A, B) во внутренней сфере СЛК состава MAB могут быть оценены различными способами [22‒25], а именно: с помощью параметра ∆lg K, имеющего вид ∆lg K(MAB) = lg β(MAB) ‒ lg β(MA) ‒ lgβ(MB), и константы сопропорционирования (lgKS, lgX), связанной с общими константами устойчивости комплексов соотношением lg KS = lg β(MAB) – 1/2lg β(MA2) – 1/2lg β(MB2). При совместимости лигандов величина lgKS для устойчивых комплексов должна быть больше нуля, в ином случае разнолигандный комплекс MAB подвергается диспропорционированию на комплексы MA2 и MB2, т.е. оказывается неустойчивым независимо от величины его константы устойчивости lg β(MAB) [26]. Можно показать, что в изучаемой нами системе при соотношении компонентов 1 : 1 : 1 в комплексе[CuGlySuc]– (lg β111 = 12.88, табл. 5) лиганды совместимы, так как при lg β$\left( {{\text{CuSuc}}_{2}^{{2 - }}} \right)$ = = 3.88 [5] и lgβ(CuGly2) = 14.73 [3] величина lgKS равна 3.58. Стабильность разнолигандных комплексов также интерпретируется с помощью статистического метода [25]. Константа стабилизации ∆lg β получается из разности измеренной константы стабильности для СЛК и константы, рассчитанной на основе статистических данных: ∆lg β = lg βизм ‒ lg βстат. Значение константы образования смешанолигандного комплекса состава MAB, ожидаемое по статистике, рассчитывается по уравнению: lg βстат = 1/2(lg β(MA2) + lg β(MB2)) + lg2. Совместимость лигандов во внутренней сфере СЛК состава [CuGlySuc]– подтверждается и величиной Δlg β = lg βизм(CuGlySuc) ‒ lg βстат(CuGlySuc) = = 12.88 ‒ 9.60 = 3.28. Значительное отличие lg βизм от lg βстат может быть связано с тем, что последняя величина не учитывает координации молекул растворителя в комплексе и сродства лигандов к иону металла. Отличие указанных выше величин наблюдается в ряде работ. Так, константы стабилизации ∆lg β комплексов Cu(IMA)L, где IMA ‒ имидазол-4-уксусная кислота, L ‒ фенилаланин, аланин (заряды комплексных частиц опущены), составляют 2.73 и 1.39 соответственно [24]. Используя данные работы [27], можно рассчитать константы стабилизации ∆lg β комплексов NiAdeAsp (4.39) и NiAdeGlu (3.98), где Ade ‒ аденин; Asp, Glu ‒ аспарагиновая и глутаминовая кислоты L-ряда. Дополнительное повышение стабильности СЛК (по сравнению со статистическими данными) может иметь место при взаимодействии между двумя лигандами, связанными с одним и тем же комплексообразователем, например, за счет образования водородной связи. Некоторые авторы считают, что при формировании разнолигадных комплексов из простых происходит стабилизация, которая выражается, вероятно, в выгодном перераспределении электронной плотности между лигандами и комплексообразователем в комплексе [18].
Найденные константы устойчивости СЛК меди(II) с янтарной кислотой и аминокислотами (табл. 5) использовали для построения диаграммы выхода частиц в зависимости от pH в изученных системах при мольном соотношении компонентов 1 : 1 : 1 (рис. 4). Расчет равновесного состава раствора и построение диаграммы выполнены с помощью программы HySS2009 [28] с учетом равновесий (1)‒(12) и соответствующих констант равновесий.
| Равновесие | Логарифм константы равновесия |
| Suc2‒ + H+ ↔ HSuc‒, | (1), lg B1S = 5.08, |
| Suc2‒ + 2H+ ↔ H2Suc, | (2), lg B2S = 8.97, |
| Gly– + H+ ↔ HGly, | (3), lg B1G = 9.53, |
| Gly– + 2H+ ↔ H2Gly+, | (4), lg B2G = 11.89, |
| Cu2+ +H+ + Suc2– ↔ CuHSuc+, | (5), lg R = 7.04 [5], |
| Cu2+ + Suc2‒ ↔ CuSuc, | (6), lg β1S = 2.89 [5], |
| Cu2+ + 2Suc2‒ ↔ CuSuc$_{2}^{{2 - }},$ | (7), lg β2S = 3.88 [5], |
| Cu2+ + Gly– ↔ CuGly+, | (8), lg β1G = 8.13, |
| Cu2+ + 2Gly– ↔ CuGly2, | (9), lg β2G = 14.73 [3], |
| Cu2+ + Suc2‒ + Gly– ↔ CuSucGly–, | (10), lg β111 = 12.88, |
| Cu2+ + H2O ↔ CuOH+ + H+, | (11), lg Kh = ‒7.53, |
| H2O ↔ H+ + OH–, | (12), lg Kw = ‒13.8. |
Рис. 4.
Диаграмма выхода частиц от pH в системе Cu2+‒H2Suc‒HGly: 1 – Cu2+, 2 ‒ CuSucGly–, 3 – CuGly+, 4 – CuHSuc+, 5 – CuSuc, 6 – CuOH+ (CCu = = CSuc = CGly = 8.34 × 10–3 моль/л).
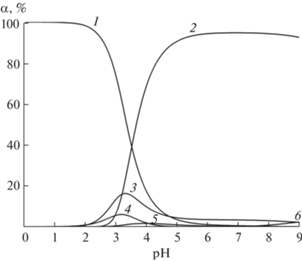
Как видно из рис. 4, смешанолигандные частицы CuSucGly– оказываются доминирующими формами в широком диапазоне pH. Совместимость во внутренней сфере СЛК меди(II) кислород- и азотсодержащих донорные атомы лигандов обеспечивает его высокий выход по сравнению со всеми другими комплексными частицами.
ЗАКЛЮЧЕНИЕ
Определены общие константы протонизации янтарной кислоты и аминокислот (H2Glu, H2Asp) при ионной силе 0.3, а также состав и константы устойчивости однороднолигандных комплексов меди(II) с анионами янтарной, аминоуксусной, глутаровой и аспарагиновой кислот состава 1 : 1 (lg β1 составляет 2.64, 8.13, 8.49 и 8.56 соответственно).
Состав (1 : 1 : 1) разнолигандных комплексов [CuGlySuc]–, [CuGluSuc]2–, [CuAspSuc]2– и их константы устойчивости (соответственно lg β111 составляет 12.88, 13.07, 13.21) определены методом кривых насыщения.
Электронные спектры поглощения растворов одинарной, двойной и тройной систем в видимой части спектра подтверждают образование смешанолигандных комплексов.
Для синтезированного сукцината меди(II) CuC4H4O4 · 2H2O по данным растворимости (I = 0.3) рассчитана константа растворимости lgKS = –7.59 ± ± 0.06.
Полученные данные по устойчивости СЛК меди(II) с янтарной кислотой и аминокислотами могут быть полезным материалом для исследователей, проводящих работы в биологических средах.
Рассчитанная диаграмма долевого распределения частиц в системе Cu2+‒H2Suc‒АК указывает на области их доминирования, что позволяет использовать диаграмму для направленного синтеза соединений из раствора.