ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 1, с. 3-10
УДК 547.341;47.725
СИНТЕЗ, ОСОБЕННОСТИ СТРОЕНИЯ
И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ ЭФИРОВ
(2Z)-2-[(2,4-ДИНИТРОФЕНИЛ)ГИДРАЗОНО]БУТАНДИОВОЙ
КИСЛОТЫ
© 2019 г. П. П. Муковозa, *, Е. С. Данковцеваa, В. П. Муковозa, П. А. Слепухинb,c,
И. Н. Ганебныхb,c, А. Н. Сизенцовd, Е. А. Даниловаe
a Всероссийский научно-исследовательский институт фитопатологии,
ул. Институт 5, Большие Вяземы, Московская обл., 143050 Россия
*e-mail: mpp27@mail.ru
b Институт органического синтеза имени И. Я. Постовского
Уральского отделения Российской академии наук, Екатеринбург, Россия
c Уральский федеральный университет имени первого Президента Б. Н. Ельцина, Екатеринбург, Россия
d Оренбургский государственный университет, Оренбург, Россия
e Ивановский государственный химико-технологический университет, Иваново, Россия
Поступило в Редакцию 17 мая 2018 г.
После доработки 17 мая 2018 г.
Принято к печати 24 мая 2018 г.
Взаимодействием эфиров
(2Z)-2-гидроксибут-2-ендиовой кислоты c
2,4-динитрофенилгидразином
получены эфиры (2Z)-2-[(2,4-динитрофенил)гидразоно]бутандиовой кислоты. Обсуждаются особенности
строения синтезированных соединений на основании данных ИК, ЯМР
1H спектроскопии, масс-
спектрометрии и рентгеноструктурного анализа.
Ключевые слова: эфиры (2Z)-2-гидроксибут-2-ендиовой кислоты, эфиры (2Z)-2-[(2,4-динитрофенил)
гидразоно]бутандиовой кислоты, 1,2,4-трикарбонильные соединения
DOI: 10.1134/S0044460X19010013
Известно, что 1,2,4-трикарбонильные соедине-
(щавелевоуксусной) кислоты
[3-5] с арилгид-
ния (ацилпировиноградные кислоты, их эфиры или
разинами отсутствуют.
амиды) взаимодействуют с гидразинами или
Нами изучена реакция эфиров (2Z)-2-гидрокси-
арилгидразинами с образованием биологически
бут-2-ендиовой (2-оксобутандиовой) кислоты 1а-е
активных веществ [1]. Реакция может протекать по
(преобладающий енольный таутомер
1A и
различным направлениям и в зависимости от
минорная оксоформа
1Б
[5]) c
2,4-динитро-
условий и реакционной способности субстратов
фенилгидразином, в результате которой вместо
приводит либо к эфирам пиразол-3-карбоновых
ожидаемых производных пиразола были выделены
кислот, либо к пиразол-3-карбоновым кислотам,
эфиры (2Z)-2-[(2,4-динитрофенил)гидразоно]бутан-
либо к гидразидам этих кислот. Однако перво-
диовой кислоты 2а-е (схема 1).
начальная нуклеофильная атака гидразина по
наиболее активной карбонильной группе C2=O во
Соединения 2а-е представляют собой желтые
всех случаях заканчивается гетероциклизацией
кристаллические вещества, не растворимые в воде
1,2,4-трикарбонильных соединений с участием
и хорошо растворимые в большинстве органи-
ацильной карбонильной группы C4=O, что приводит
ческих растворителей. Строение соединений 2а-е
к образованию производных пиразола
[1,
2].
установлено на основании данных ИК, ЯМР 1H
Сведения о реакциях таких 1,2,4-трикарбонильных
спектроскопии, масс-спектрометрии и рентгено-
соединений, как эфиры
2-оксобутандиовой
структурного анализа.
3
4
МУКОВОЗ и др.
Схема 1.
H2N
NH
O
O
NO2
OAlk
OAlk
AlkO
AlkO
+
1a_е
O O
O O
H
NO2
A
Б
AlkO
O
O
O
O
H N+
_H2O
N
AlkO
N
NO2
2a_е
Alk = Me (а), Et (б), Pr (в), i-Pr (г), Bu (д), t-Bu (e).
В ИК спектрах соединений 2а-е присутствует
эфирных звеньев. Более низкая частота
сравнительно низкочастотная полоса поглощения
поглощения оксогруппы C1=O (одной из двух
вторичной аминогруппы
(3281-3228 см-1), две
сложноэфирных карбонильных
групп)
и
полосы поглощения сложноэфирных карбониль-
сравнительно низкочастотная полоса поглощения
ных групп C4=O (1732-1702 см-1) и C1=O (1703-
NH-группы свидетельствуют об их участии в
1681 см-1), а также полосы поглощения кратных
образовании водородных связей, характерных для
связей ароматического кольца (1620-1594, 1593-
формы 2A (схема 2).
1576, 1523-1509, 1457-1436 см-1). Полосы погло-
щения при 1508-1495 (асимметричные колебания)
В ИК спектрах соединений 2а-е не наблюдается
и
1345-1326 см-1 (симметричные колебания)
уширенных низкочастотных полос поглощения
подтверждают присутствие нитрогрупп в молекуле.
енольных гидроксильных групп в области 3500-
Сравнительно низкая частота поглощения асим-
2500 см-1, что свидетельствует об отсутствии в
метричных колебаний нитрогрупп 1508-1495 см-1
кристаллическом состоянии в составе молекулы
(стандартные значения в ароматических нитро-
енольных фрагментов, характерных для формы 2Б.
соединениях 1550-1515 см-1 [6]) свидетельствует
Наличие в ИК спектрах соединений 2а-е только
об их участии в образовании прочных внутри- или
одной полосы поглощения NH-группы свидетель-
межмолекулярных контактов. Поглощение при
ствует об отсутствии в кристаллическом состоянии
1277-1187 см-1 (эфирная полоса) подтверждает
в составе молекулы енгидразиновых фрагментов,
наличие в молекуле соединений
2а-е сложно-
характерных для формы 2В.
Схема 2.
AlkO
O
OAlk
OAlk
OAlk
AlkO
AlkO
O
O
O
N H
O
N H
O
N H
N
O
H
N O
H
N
O
+
N+
N
N+
O
O
O
NO2
NO2
NO2
2A
2Б
2В
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
СИНТЕЗ, ОСОБЕННОСТИ СТРОЕНИЯ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ ЭФИРОВ
5
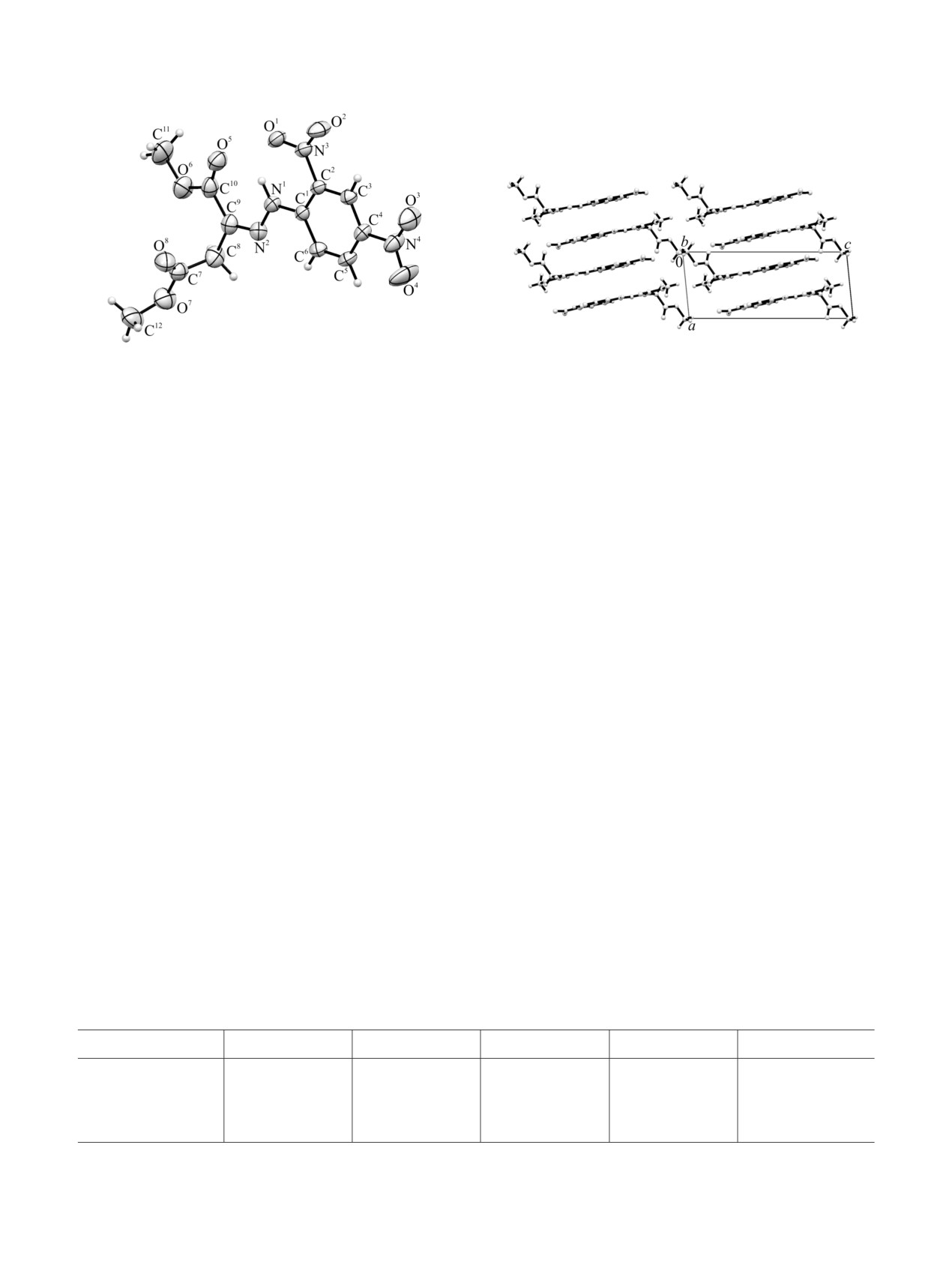
Рис. 2. Фрагмент кристаллической упаковки соединения
Рис. 1. Общий вид молекулы соединения 2а в кристалле.
2а.
Спектральные методы не позволяют однозначно
молекуле соединения 2а выведен из плоскости
установить строение соединений 2а-е в твердой
гидразонного фрагмента. Плоскость сложноэфирного
фазе, поэтому для подтверждения их структуры
AlkOOC4-фрагмента почти перпендикулярна гидра-
были выращены кристаллы соединения
2а и
зоновому звену и составляет с ним угол 85°.
изучены методом РСА. Общий вид молекулы
В кристалле молекулы соединения 2а образуют
представлен на рис. 1. По данным РСА, молекула
слоистую укладку (рис. 2), при которой кислород и
соединения 2а существует в виде (2Z)-изомера 2A,
азот 2-NO2-групп соседних молекул формируют
азометиновая C2=N группа и сложноэфирная
укороченный π-контакт с расстоянием O1···N3 [1-x,
карбонильная группа C1=O расположены в цис-
1-y,
1-z]
3.009 Å (на
0.06 Å меньше суммы
положении по отношению друг к другу.
радиусов Ван-дер-Ваальса). Среди других меж-
Заметного выравнивания одинарных и двойных
молекулярных контактов можно также отметить
связей указанных фрагментов не наблюдается, что
укороченный T-образный полярный контакт между
свидетельствует как об их незначительном
кислородом нитрогруппы и sp2-углеродом
сопряжении, так и об отсутствии енолизации
сложноэфирной группы, не включенной в систему
карбонильной группы сложноэфирного AlkOOC1-
сопряжения С7···О4 [-x, -y, 1-z] 3.043 Å, на 0.177 Å
фрагмента. Так, длины двойных связей N2=C9 и
меньше суммы радиусов Ван-дер-Ваальса (рис. 3) и
O5=C10 равны 1.288(2) и 1.200(3) Å соответственно,
межмолекулярную водородную связь С5-H5···O2
а длины одинарных связей N1-N2, N1-C1 и C9-C10
[x, y-1, z] с участием нитрогруппы и протона
составляют 1.348(2), 1.373(2) и 1.499(3) Å соответ-
арильного заместителя (табл. 1). В результате обе
ственно, что близко к классическим значениям
нитрогруппы молекулы оказываются вовлечены в
(N=C 1.28 Å, C=O 1.21 Å, N-N 1.37 Å, N-C 1.36 Å
формирование
значимых
межмолекулярных
и C-C 1.54 Å) [7]. Группа NH гидразона образует
контактов, определяя конфигурацию ближайшего
вилочковую внутримолекулярную водородную
окружения молекулы. Участие нитрогрупп в
связь с 2-NO2-группой и карбонильной группой
межмолекулярных контактах, а также наличие
сложноэфирного AlkOOC1-фрагмента (табл.
1).
пространственной
близости
карбонильного
Данная связь, формируя 2 шестичленных цикла,
акцептора к NH-протону хелатного фрагмента,
фиксирует плоскую конфигурацию полиеновой
вероятно, является причиной снижения частоты
части молекулы. Следует отметить, что вследствие
поглощения асимметричных колебаний νas(NO2) в
стерических требований AlkOOC4-фрагмент в
ИК спектрах соединений 2а-е.
Таблица 1. Длины водородных связей в кристалле соединения 2а
D-H
d(D-H), Å
d(H···A), Å
DHA, град
d(D···A), Å
A
N1-H1
0.91(3)
2.01(2)
124(2)
2.624(2)
O1
N1-H1
0.91(3)
1.95(2)
133(2)
2.660(2)
O5
С5-Н5
0.93(3)
2.38(2)
171(2)
3.305(2)
О2 [x, y-1, z]
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
6
МУКОВОЗ и др.
3-[2-(2,4-динитрофенил)гидразоно]-4-оксогексан-
1,6-диовой кислоты сигналы протонов метиле-
новой группы C2H2 и NH-протонов регистрируются
в близких областях: 3.90-4.12 и 11.83-11.88 м. д.
[8] или 3.84-3.87 и 11.86-11.90 м. д. Соответ-
ственно [9, 10]. Сигналы метиновых протонов,
протонов енольных гидроксигрупп, а также NH-
протонов енгидразиновых звеньев в спектрах ЯМР
1H не зарегистрированы, что подтверждает
отсутствие в растворах неполярных растворителей
соединений 2а-е возможной енольной формы 2Б и
енгидразиновой формы 2В.
Рис.
3. Укороченный T-образный полярный С···О
контакт в кристалле соединения 2а.
Строение соединений 2а-е подтверждается дан-
ными масс-спектрометрии высокого разрешения. В
масс-спектрах, снятых в режиме электрораспы-
В растворах неполярных растворителей, также
ления, из раствора в ацетонитриле, присутствуют
как и в твердом состоянии, соединения
2а-е
характеристические сигналы протонированных
существуют в форме гидразонов
2A, что
молекул [M + H]+.
подтверждается данными ЯМР. В спектрах ЯМР
Взаимодействие соединений 1 с динитрофенил-
1Н (CDCl3) соединений
2а-е присутствуют
гидразином, вероятно, начинается с нуклео-
стандартные сигналы протонов алкильных групп
фильного присоединения H2N-группы реагента по
двух сложноэфирных звеньев, причем сигналы
наиболее реакционной карбонильной группе C2=O
протонов AlkOOC1-фрагмента наблюдаются в
оксоформы
1Б и через стадию образования
более слабом поле (на
0.03-0.23 м. д.) по
интермедиата X заканчивается элиминированием
сравнению с сигналами протонов AlkOOC4-фраг-
молекулы воды с образованием соединений
2
мента. Смещение сигналов протонов алкоксизвена
(схема 3). Влияние неподеленных электронных пар
AlkOOC1-фрагмента в слабое поле свидетельствует
кислорода алкоксильных звеньев на электро-
об участии сложноэфирной карбонильной группы
фильные центры C1 и C4 исключает нуклео-
C1=O соединений 2а-е в образовании водородных
фильную атаку реагента по сложноэфирным
связей и хорошо согласуется с данными ИК
карбонильным группам, а также способность
спектров и РСА. Кроме отмеченных сигналов, в
соединений 2 к гетероциклизации с образованием
спектрах ЯМР 1Н соединений 2а-е присутствуют
пиразольного гетероцикла, как это имеет место при
реперный синглет двух протонов метиленовой
взаимодействии других
1,2,4-трикарбонильных
группы C3H2 (3.58-3.89 м. д.) и сигнал NH-протона
соединений (ацилпировиноградных кислот, их
(11.73-14.28 м. д.), соответствующие изомеру 2A.
эфиров или амидов) с арилгидразинами.
Следует отметить, что в спектрах ЯМР
1H
структурно близких эфиров 3-[(2,4-динитрофенил)-
Нами изучена противомикробная активность
гидразоно]-4,6-диоксоалкановых кислот или эфиров
соединений 2a-е по отношению к тест-штаммам
Схема 3.
AlkO O
AlkO O
OAlk
OAlk
H2N
NH
O
O
O
NO2
OAlk
HO
AlkO
N H
N H
+
H
N
N
O
_H2O
O O
NO2
N+
O-
NO2
NO2
NO2
1Б
X
2
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
СИНТЕЗ, ОСОБЕННОСТИ СТРОЕНИЯ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ ЭФИРОВ
7
Таблица 2. Противомикробная и фунгицидная активность соединений 2a-е
МИК, мкг/мл
Соединение
St. aureus
B. licheniformis В
S. typhimurium
E. coli
Bipolaris
Fusarium sp.
P-209
7038
14028S WT
M17
soraciniana
2a
125
250
250
-
31
250
2б
1000
1000
1000
-
16
125
2в
250
1000
1000
-
125
-
2г
63
1000
500
1000
63
500
2д
500
250
-
-
125
-
2е
63
500
250
-
31
500
Этакридина лактат
500
1000
1000
2000
Фурацилин
125
500
125
500
Фитолавин
16
63
Превикур
8
31
грамположительных бактерий золотистого
культуры Fusarium sp. соединения
2a, б, е
стафилококка (Staphylococcus aureus P-209) и
обладают фунгицидной активностью, сопоста-
Bacillus licheniformis ВКПМ В
7038,
вимой с активностью фитолавина. В отношении
грамотрицательных бактерий кишечной палочки
тест-культуры Bipolaris soraciniana соединения 2a,
(Escherichia coli M17) и сальмонеллы
б, г, е проявили умеренную фунгицидную
(Salmonella typhimurium
14028S WT), а также
активность, не превышающую активность препа-
фунгицидная (противогрибковая) активность по
ратов сравнения фитолавина и превикура. В
отношению к тест-культурам фитопатогенных
отношении тест-культуры Alternarium sp.
грибов Fusarium sp., Alternarium sp. и Bipolaris
соединения
2a-е фунгицидной активности не
soraciniana (табл.
2).
Установлено, что в
проявили.
Наибольшую противомикробную
отношении тест-штамма Staphylococcus aureus
активность в отношении грамположительных тест-
соединения 2a, г, е обладают противомикробной
штаммов проявили соединения 2a, г-е, имеющие
активностью, превышающей или сопоставимой с
разветвленную алкильную группу в составе
активностью фурацилина, а соединения
2в, д
сложноэфирного фрагмента. Наибольшую
обладают противомикробной активностью,
фунгицидную активность в отношении тест-
превышающей или сопоставимой с активностью
культуры фитопатогенных грибов Fusarium sp.
этакридина лактата. В отношении тест-штамма
проявили соединения 2a, б, е, имеющие этильную
Bacillus licheniformis соединения 2a, д, е обладают
группу в составе сложноэфирного фрагмента.
противомикробной активностью, превышающей
Сравнительно высокая биологическая активность
или сопоставимой с активностью фурацилина, а
исследованных соединений, вероятно, обусловлена
соединения 2б, в, г обладают противомикробной
наличием нитрогрупп в составе арилгидразонового
активностью, сопоставимой с активностью
фрагмента, способных восстанавливаться в клетках
этакридина лактата. В отношении тест-штамма
патогенов до ароматических аминов, токсичных
Salmonella typhimurium активность соединений 2a,
для микроорганизмов. Следует отметить, что
г, е сопоставима с активностью фурацилина и
структурно близкие соединениям 2 эфиры 3-[2-(2,4-
превышает активность этакридина лактата.
динитрофенил)гидразоно]-4-оксогексан-1,6-диовой
Соединения 2б и 2в проявляют противомикробную
кислоты, имеющие в составе молекулы динитро-
активность, сопоставимой с активностью
фенилгидразоновый фрагмент, также проявили
этакридина лактата. В отношении тест-штамма
высокую противомикробную активность в
Escherichia coli умеренную противомикробную
отношении тест-штамма Staphylococcus aureus [11].
активность, превышающую активность этакридина
лактата, проявило только соединение 2г, остальные
Таким образом, взаимодействие эфиров (2Z)-2-
синтезированные соединения активности не
гидроксибут-2-ендиовой кислоты c 2,4-динитро-
проявили. Установлено, что в отношении тест-
фенилгидразином, приводит не к производным
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
8
МУКОВОЗ и др.
пиразола, а к линейным структурам - эфирам (2Z)-
0.1674 (по всем отражениям), R1 = 0.0506, wR2 =
2-[(2,4-динитрофенил)гидразоно]бутандиовой
0.1409 [по отражениям с I > 2σ(I)]. Δρе =
0.262/-
кислоты. Установлено, что изученные соединения
0.213 е/Å3. Полный набор рентгеноструктурных
в различной степени обладают противомикробной
данных соединения 2а депонирован в Кембрид-
или фунгицидной активностью, что, вероятно,
жском банке структурных данных (CCDC 1441915).
связано с наличием нитрогрупп в составе молекул
синтезированных соединений.
Противомикробную и фунгицидную активность
соединений 2a-е определяли методом серийных
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
разведений с использованием 3-кратной повтор-
ИК спектры кристаллов записаны на ИК Фурье-
ности. Противомикробную активность в отношении
спектрометре Bruker Alpha, приставка НПВО
грамположительных тест-штаммов золотистого
(нарушенное полное внутреннее отражение,
стафилококка (Staphylococcus aureus P-209) и
материал элемента НПВО - ZnSe, угол падения
Bacillus licheniformis ВКПМ В
7038, а также
луча 45°). Спектры ЯМР 1H (CDCl3, ДМСО-d6)
грамотрицательных тест-штаммов кишечной
синтезированных соединений получены на ЯМР
палочки (Escherichia coli M17) и сальмонеллы
Фурье-спектрометре Bruker AVANCE II (400 МГц),
(Salmonella typhimurium 14028S WT) определяли в
внутренний стандарт
- ТМС. Масс-спектры
мясопептонном бульоне при бактериальной
записаны на квадрупольно-времяпролетном масс-
нагрузке 5×109 микробных единиц в 1 мл раствора.
спектрометре MaXis Impact HD (Bruker Daltonik
Минимальную ингибирующую концентрацию
GmbH) в режиме электрораспылительной
(МИК) устанавливали по отсутствию признаков
ионизации для растворов в ацетонитриле при
роста тест-культуры на питательном субстрате.
скорости подачи образца 240 мкл/ч с параметрами
Последняя пробирка с отсутствием признаков
по умолчанию в методе инфузионного анализа
роста соответствовала МИК. Для подтверждения
малых молекул. Рентгеноструктурное исследо-
ингибирующего
эффекта
синтезированных
вание проведено с использованием оборудования
соединений на тест-штаммы
микроорганизмов
Центра коллективного пользования САОС
проводился высев из каждой пробирки на плотные
Института органического синтеза Уральского
питательные среды. В качестве эталонных
отделения РАН. Эксперимент осуществлен на
препаратов сравнения использовали фурацилин и
автоматическом 4-кружном дифрактометре с CCD-
этакридина лактат. Фунгицидную активность
детектором Xcalibur 3 по стандартной процедуре
соединений 2a-е в отношении тест-культур грибов
(ω-сканирование с шагом
1° на монохромати-
Fusauium sp., Alternarium sp., Bipolaris soraciniana
зированном МоKα-излучении). Дифракционные
определяли на плотной питательной среде Сабуро.
данные для соединения 2а получены при 295(2) K.
Синтезированные соединения растворяли в ДМСО,
Введена эмпирическая поправка на поглощение.
разводя
полученный раствор стерильным
Структуры определены прямым статистическим
физиологическим раствором в концентрациях от
методом и уточнены полноматричным МНК по F2
1000 мкг/мл до 8 мкг/мл. В пробирки с расплав-
в анизотропном приближении для всех неводо-
ленной и охлажденной до 56°C средой вносили
родных атомов. Атомы водорода С-Н связей
исследуемые препараты, после чего их тщательно
помещены в геометрически рассчитанные
смешивали со средой. Среду засеивали смывом
положения и уточнены в изотропном прибли-
тест-культур Fusauium sp., Alternarium sp. и
жении, позиции протонов ОН-групп уточняли
Bipolaris soraciniana в стерильном физиоло-
независимо. Все расчеты проведены в програм-
гическом растворе. Соответствующие тест-
мной оболочке Olex
[12] c использованием
культуры получали, внося на стерильную пита-
программного пакета SHELX
[13]. Основные
тельную среду Сабуро коллекционные образцы
кристаллографические параметры соединения 2а:
Fusauium sp., Alternarium sp., Bipolaris soraciniana
кристалл триклинный, пространственная группа P-1,
и выращивали их в течение двух недель при
a = 6.6752(5) Å, b = 8.0816(5) Å, c = 15.2864(12) Å,
температуре
18-22°С. Для контроля роста
α = 82.164(6)°, β = 81.802(6)°, γ = 67.286(7)°, μ =
культуры использовали питательную среду без
0.129 мм-1. На углах 2.70° < θ < 30.50° собрано
препаратов, учет результатов проводили через 48 ч.
6588 отражений, из них независимых 4034 (Rint =
В качестве препаратов сравнения использовали
0.0180), в том числе 2684 с I > 2σ(I). Оконча-
фитолавин и превикур. Статистическую обработку
тельные параметры уточнения: R1 = 0.0798, wR2 =
данных проводили по критерию Стьюдента,
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
СИНТЕЗ, ОСОБЕННОСТИ СТРОЕНИЯ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ ЭФИРОВ
9
используя программу XL 2012. Эффект считали
1345 [νs(NO2)], 1209 [νas(=C-OС3Н7, эфир)], 1144,
достоверным при (p < 0.001).
1169, 1032,
1008
[νскелетные(C-C)], 927, 901,
848
[δнепл(CH, Ar)], 756 [δмаятн(C3Н2)], 720 [νскелетные(C-C)].
Исходные соединения
1а-е получены по
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 0.95 т (3H,
методике [5].
C4OOCH2CH2CH3,
J
=
7.4 Гц),
1.02 т
(3H,
Общая методика синтеза эфиров
(2Z)-2-
C1OOCH2CH2CH3, J = 7.7 Гц), 1.63-1.75 м (4H,
гидроксибут-2-ендиовой кислоты
(2а-е). К
2C1(4)OOCH2CH2CH3), 3.69 c (2H, C3H2), 4.02 т (2H,
раствору
3.96 г
(20 ммоль)
2,4-динитрофенил-
C4OOCH2CH2CH3, J
=
7.4 Гц),
4.17 т
(2H,
гидразина в смеси 40 мл уксусной кислоты и 60 мл
C1OOCH2CH2CH3, J = 7.7 Гц), 8.05-9.20 м (3Н,
этанола добавляли раствор 20 ммоль соединений
С6Н3), 13.82 с (1H, NH). Масс-спектр, m/z: 397.1355
1а-е в
10 мл уксусной кислоты и доводили
[M + H]+ (вычислено для С16H21N4O8: 397.1354).
реакционную смесь до кипения. Растворитель
Диизопропиловый эфир (2Z)-2-[(2,4-динитро-
упаривали, остаток сушили и перекристаллизо-
фенил)гидразоно]бутандиовой кислоты
(2г).
вывали из этанола или этилацетата, получали
Выход 3.01 г (38%), т. пл. 152-155°С. ИК спектр, ν,
соединения 2а-е.
см-1:
3232 (NH),
3103,
3088 (СH, Ar),
2970
Диметиловый эфир (2Z)-2-[(2,4-динитрофенил)-
[νas(CH3)],
2932
[νas(СН)],
2869
[νs(CH3)],
1702
гидразоно]бутандиовой кислоты (2a). Выход 2.18 г
(C4=O), 1681 (C1=O), 1610, 1586, 1512 (С=C, Ar),
(32%), т. пл. 177-179°С. ИК спектр, ν, см-1: 3247
1501 [νas(NO2)], 1463 [δas(СН3)], 1441 (С=C, Ar),
(NH), 3119, 3087 (СHAr),
2967
[νas(CH3)],
1732
1386,
1364
[δs(СН3)2СН, гем-диметил],
1329
(C4=O), 1696 (C1=O), 1603, 1584, 1521 (С=C, Ar),
[νs(NO2)], 1187 [νas(=C-OСН(СН3)2, эфир)], 1166,
1508 [νas(NO2)], 1443 (С=C, Ar), 1339 [νs(NO2)],
1139, 1068 [νскелетные(C-C)], 909, 864 [δнепл(CH, Ar)],
1277 [νas(=C-OСН3, эфир)], 1213, 1112, 1096, 1052,
766 [δмаятн(C3Н2)], 707 [νскелетные(C-C)]. Спектр ЯМР
1003 [νскелетные(C-C)], 933, 841 [δнепл(CH, Ar)], 740
1Н (CDCl3), δ, м. д.: 1.29 т [6H, C4OOCH(CH3)2, J =
[δмаятн(C3Н2)], 701 [νскелетные(C-C)]. Спектр ЯМР 1Н
7.1 Гц], 1.32 т [6H, C1OOCH(CH3)2, J = 7.2 Гц], 3.89
(CDCl3), δ, м. д.: 3.79 c (3H, C4OOCH3), 3.86 с (2H,
c (2H, C3H2), 4.30 м [1H, C4OOCH(CH3)2], 4.53 м
C3H2), 3.94 c (3H, C1OOCH3), 8.17-9.15 м (3Н,
[1H, C1OOCH(CH3)2], 8.10-9.25 м (3Н, С6Н3), 14.13
С6Н3), 11.73 с (1H, NH). Масс-спектр, m/z: 341.0729
с (1H, NH). Масс-спектр, m/z: 397.1354 [M + H]+
[M + H]+ (вычислено для С12H13N4O8: 341.0728).
(вычислено для С16H21N4O8: 397.1354).
Диэтиловый эфир (2Z)-2-[(2,4-динитрофенил)-
Дибутиловый эфир
(2Z)-2-[(2,4-динитро-
гидразоно]бутандиовой кислоты (2б). Выход 3.46 г
фенил)гидразоно]бутандиовой кислоты
(2д).
(47%), т. пл. 147-149°С. ИК спектр, ν, см-1: 3228
Выход 2.46 г (29%), т. пл. 122-124°С. ИК спектр, ν,
(NH), 3091, 3054 (СH, Ar), 2977 [νas(CH3)], 2953
см-1:
3267 (NH),
3096,
3067 (СH, Ar),
2962
[νas(CH2)], 1718 (C4=O), 1701 (C1=O), 1609, 1578,
[νas(CH3)],
2954
[νas(CH2)],
2868
[νs(CH3)],
1705
1516 (С=C, Ar), 1503 [νas(NO2)], 1465 [δas(СН3)],
(C4=O), 1697 (C1=O), 1594, 1576, 1513 (С=C, Ar),
1449 (С=C, Ar), 1332 [νs(NO2)], 1263 [νas(=C-OС2Н5,
1495 [νas(NO2)], 1457 [δas(СН3)], 1438 (С=C, Ar),
эфир)],
1225,
1137,
1110,
1062,
1028,
1013
1326 [νs(NO2)], 1194 [νas(=C-OС4Н9, эфир)], 1181,
[νскелетные(C-C)],
920,
834
[δнепл(CH, Ar)],
747
1160, 1103, 1061, 1025, 1003 [νскелетные(C-C)], 914
[δмаятн(C3Н2)], 711 [νскелетные(C-C)]. Спектр ЯМР 1Н
[δнепл(CH, Ar)], 777 [δмаятн(C3Н2)], 695 [νскелетные(C-C)].
(CDCl3), δ, м. д.: 1.28 т (3H, C4OOCH2CH3, J =
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 0.96 т (3H, C4OO
7.2 Гц), 1.33 т (3H, C1OOCH2CH3, J = 7.5 Гц), 3.65 c
(СН2)3СН3, J = 7.5 Гц), 1.05 т [3H, C1OO(СН2)3СН3,
(2H, C3H2), 4.22 к (2H, C4OOCH2CH3, J = 7.2 Гц),
J = 7.5 Гц], 1.35-1.45 м [4H, 2C1(4)OO(СН2)2СН2СН3],
4.27 к (2H, C1OOCH2CH3, J = 7.5 Гц), 8.11-9.15 м
1.60-1.70 м [4H, 2C1(4)OOСН2СН2СН2СН3], 3.64 c
(3Н, С6Н3), 14.28 с (1H, NH). Масс-спектр, m/z: 369.1043
(2H, C3H2), 4.00-4.25 м [4Н, 2C1(4)OOСН2(СН2)2СН3],
[M + H]+ (вычислено для С14H17N4O8: 369.1041).
8.00-9.17 м (3Н, С6Н3), 13.95 с (1H, NH). Масс-
спектр, m/z: 425.1668 [M + H]+ (вычислено для
Дипропиловый эфир
(2Z)-2-[(2,4-динитро-
С18H25N4O8: 425.1667).
фенил)гидразоно]бутандиовой кислоты
(2в).
Выход 4.28 г (54%), т. пл. 141-143°С. ИК спектр, ν,
Ди-трет-бутиловый эфир (2Z)-2-[(2,4-динитро-
см-1:
3260 (NH),
3096,
3067 (СH, Ar),
2973
фенил)гидразоно]бутандиовой кислоты
(2е).
[νas(CH3)],
2968
[νas(CH2)],
2876
[νs(CH3)],
1709
Выход 1.95 г (23%), т. пл. 172-177°С. ИК спектр, ν,
(C4=O), 1689 (C1=O), 1601, 1582, 1523 (С=C, Ar),
см-1:
3281 (NH),
3105,
3099 (СH, Ar),
2975
1506 [νas(NO2)], 1469 [δas(СН3)], 1457 (С=C, Ar),
[νas(CH3)],
2861
[νs(CH3)],
1724 (C4=O),
1703
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
10
МУКОВОЗ и др.
(C1=O), 1620, 1593, 1509 (С=C, Ar), 1497 [νas(NO2)],
4. Губен И. Методы органической химии. М.: ОНТИ,
1436 (С=C, Ar), 1327 [νs(NO2)], 1228 [νas(=C-OC(СН3)3,
1935. Т. 3. Вып. 2. С. 532.
5. Муковоз П.П. Автореф. дис
канд. хим. наук.
эфир)],
1163,
1091,
1053
[νскелетные(C-C)],
855
Ярославль, 2010. 23 с.
[δнепл (CH, Ar)], 751 [δмаятн(C3Н2)], 719 [νскелетные(C-C)].
6. Беллами Л. Инфракрасные спектры сложных
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 2.10 c [3H,
молекул. М.: ИЛ, 1963. С. 590.
C4OOC(СН3)3], 2.22 c [3H, C1OOC(СН3)3], 3.58 с
7. International Tables for Crystallography. 2006. Vol. C.
(2H, C3H2), 8.00-9.05 м (3Н, С6Н3), 12.41 с (1H,
Ch. 9.5. P. 790.
NH). Масс-спектр, m/z:
425.1669
[M
+ H]+
8. Муковоз П.П., Горбунова А.В., Слепухин П.А.,
(вычислено для С18H25N4O8: 425.1667).
Ельцов О.С., Ганебных И.Н. // ЖОрХ. 2017. Т. 53.
Вып. 7. С. 1006; Mukovoz P.P., Gorbunova A.V.,
КОНФЛИКТ ИНТЕРЕСОВ
Slepukhin P.A., El’tsov O.S., Ganebnykh I.N. // Russ. J.
Авторы заявляют об отсутствии конфликта
Org. Chem. 2017. Vol. 53. N 7. P. 1017. doi 10.1134/
S1070428017070090
интересов.
9. Муковоз П.П., Козьминых В.О., Слепухин П.А.,
СПИСОК ЛИТЕРАТУРЫ
Ганебных И.Н., Ельцов О.С., Горбунова А.В.,
Козьминых Е.Н. // ЖОрХ. 2016. Т. 52. Вып. 5. С. 652;
1. Перевалов С.Г., Бургарт Я.В., Салоутин В.И.,
Mukovoz P.P., Koz’minykh V.O., Slepukhin P.A.,
Чупахин О.Н. // Усп. хим. 2001. Т. 70. № 11. С. 1039;
Ganebnykh I.N., El’tsov O.S., Gorbunova A.V.,
Perevalov S.G., Burgart Ya.V., Saloutin V.I., Chupa-
Koz’minykh E.N. // Russ. J. Org. Chem. 2016. Vol. 52.
khin O.N. // Russ. Chem. Rev. 2001. Vol. 70. N 11.
N 5. P. 636. doi 10.1134/S1070428016050043
P. 921. doi 10.1070/RC2001v070n11ABEH000685
10. Муковоз П.П., Козьминых В.О. // Вестн. Южно-
2. Янборисов Т.Н., Жикина И.А., Андрейчиков Ю.С.,
Уральск. гос. унив. 2009. Вып. 23(156). С. 4.
Милютин А.В., Плаксина А.Н. // Хим.-фарм. ж. 1998.
11. Муковоз П.П., Козьминых В.О., Коробова И.В.,
Т.
32.
№ 9. С. 26; Yanborisov T.N., Zhikina I.A.,
Сизенцов А.Н. // Приволжск. хим.-технол. вестн.
Andreichikov Yu.S., Milyutin A.V., Plaksina A.N. //
2016. Вып. 1. С. 1.
Pharm. Chem. J. 1998. Vol. 32. N 9. P. 480. doi
10.1007/BF02539222
12. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
ward J.A.K., Puschmann H. // J. Appl. Cryst. (A). 2009.
3. Ямашкин С.А., Жукова Н.В. // ХГС. 2008. Т. 44. № 2.
С.
163; Yamashkin S.A., Zhukova N.V.
// Chem.
Vol. 42. P. 339. doi 10.1107/S0021889808042726
Heterocycl. Compd. 2008. Vol. 44. N 2. P. 115. doi
13. Sheldrick G.M. // J. Acta Crystallogr. (A). 2008. Vol. 64.
10.1007/s10593-008-0038-0
P. 112. doi 10.1107/S0108767307043930
Synthesis, Structure, and Biological Activity
of (2Z)-2-[(2,4-Dinitrophenyl)hydrazono]butanedioic Acids Esters
P. P. Mukovoza*, E. S. Dankovtsevaa, V. P. Mukovoza, P. A. Slepukhinb,c, I. N. Ganebnykhb,c,
A. N. Sizentsovd, and E. A. Danilovae
a All-Russian Research Institute of Phytopathology, ul. Institute 5, Bol’shiye Vyazemy, Moscow oblast, 143050 Russia
*e-mail: mpp27@mail.ru
b I.Ya. Postovskii Institute of Organic Synthesis of the Ural Branch of the Russian Academy of Sciences, Yekaterinburg, Russia
c Ural Federal University, Yekaterinburg, Russia
d Orenburg State University, Orenburg, Russia
e Ivanovo State University of Chemical Technology, Ivanovo, Russia
Received May 17, 2018
Revised May 17, 2018
Accepted May 24, 2018
Reaction of (2Z)-2-hydroxybut-2-enoic acid esters with 2,4-dinitrophenylhydrazine yielded (2Z)-2-[(2,4-
dinitrophenyl)hydrazono]butanedioic acid esters. The structural features of the synthesized compounds were
discussed on the basis of IR, 1H NMR spectroscopy, mass spectrometry and X-ray diffraction analysis data.
Keywords:
(2Z)-2-hydroxybut-2-enoic acid esters, (2Z)-2-[(2,4-dinitrophenyl)hydrazono]butanedioic acids
esters, 1,2,4-tricarbonyl compounds
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019