ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 1, с. 25-30
УДК 547.593.2:547.594.3:547.595.6:547.856
ВЗАИМОДЕЙСТВИЕ 5-АМИНО-3-(ЦИАНОМЕТИЛ)-
1H-ПИРАЗОЛ-4-КАРБОНИТРИЛА
С ГИДРОКСИЦИКЛОГЕКСАНОНАМИ
© 2019 г. А. М. Семеноваa,b, Р. В. Оганесянa, В. В. Доценкоa,c, *,
Е. А. Чигоринаd, Н. А. Аксеновc, И. В. Аксеноваc, Е. Е. Нетребаe
a Кубанский государственный университет, ул. Ставропольская 149, Краснодар, 350040 Россия
*e-mail: victor_dotsenko_@mail.ru
b Северо-Кавказская государственная гуманитарно-технологическая академия,
Медицинский институт, Черкесск, Россия
c Северо-Кавказский федеральный университет, Ставрополь, Россия
d Научно-исследовательский центр «Курчатовский институт» - ИРЕА, Москва, Россия
e Таврическая академия Крымского федерального университета имени В. И. Вернадского, Симферополь, Россия
Поступило в Редакцию 5 июля 2018 г.
После доработки 5 июля 2018 г.
Принято к печати 13 июля 2018 г.
Взаимодействие 5-амино-3-(цианометил)-1H-пиразол-4-карбонитрила с
3-арил-5-гидрокси-5-метил-2,4-
ди(этоксикарбонил)циклогексанонами в среде уксусной кислоты дает ранее не описанные производные
4,5,6,7,8,9-гексагидропиразоло[1,5-a]хиназолина.
Ключевые слова: β-циклокетолы, аминопиразол, циклоконденсация, пиразоло[1,5-a]хиназолин
DOI: 10.1134/S0044460X19010049
Доступные по реакции ароматических
аминоазолов с 1,3-биэлектрофилами (см. [13, 14]),
альдегидов с ацетоуксусным эфиром 2,4-ди[RC(O)]-
найдены лишь единичные примеры подобных
3-арил-5-гидрокси-5-метилциклогексаноны
1 (β-
реакций с участием β-циклокетолов. Так, нам
циклокетолы), будучи циклическими
1,3-дикар-
удалось обнаружить единственное и недавнее
бонильными соединениями, представляют собой
упоминание о реакции циклокетола с 5-амино-3-
перспективные реагенты для тонкого органи-
гидразинопиразолом, ведущее к образованию
ческого синтеза. Согласно данным обзорных работ
6,7,8,8a-тетрагидропиразоло[5,1-b]хиназолин-9(5H)-
[1, 2], β-циклокетолы могут служить отправной
она 7 [15] (схема 1). При этом стоит отметить, что
точкой для получения замещенных карбоциклов,
приведенных в работе [15] аналитических данных
2-оксабицикло[2.2.2]октанов,
енаминокетонов,
(масс-спектрометрии и ИК спектроскопии), очевидно,
-эфиров и др. В то же время следует отметить, что
недостаточно для подтверждения структуры
реакции гетероциклизации на основе β-цикло-
заявленного продукта.
кетолов изучены недостаточно. Так, в литературе
Продолжая исследования в области химии
описано получение изохинолинов
2
[3-7],
производных димера малононитрила
[16-19] и
индазолов 3 [1, 8-10], бензо[c]изоксазолов 4 [1, 9,
реакций конденсации на основе
3(5)-амино-
10],
[1,2,4]триазоло[3,4-b]хиназолинов
5
[11] и
пиразолов [20, 21], мы изучили взаимодействие 3-
пиразоло[3,4-c]изохинолинов
6
[12] в условиях
арил-5-гидрокси-5-метил-2,4-ди(этоксикарбонил)-
конденсации циклокетолов с различными 1,2- и 1,3-
циклогексанонов 1a, б с 5-амино-3-(цианометил)-
бинуклеофильными агентами (схема 1).
1H-пиразол-4-карбонитрилом 7 (схема 2). Амино-
Последние два превращения представляют особый
пиразол 7 легко образуется по реакции димера
интерес, поскольку, несмотря на достаточно
малононитрила
8 с гидразингидратом
[22] и
большое внимание к реакциям конденсации
благодаря наличию ряда амино- и цианогрупп
25
26
СЕМЕНОВА и др.
Схема 1.
Ph
O
R Ar
R
O
N
N
NH
HO
NH2
NH
O
N
N
H2N
N
H3C
N
Ph
N
H3C
N N
O
N
HO
R
Ar
R
5
6
R Ar
R Ar
O
R
R
Ar
R
NH
XH
NCCH2C(X)NH2
O
2
O
R
O
NH
X
H3C
X = NH (3), O (4)
H3C
X = O, S, Se, C(CN)2
N
H3C
O
X
HO
HO
HO
CN
3, 4
1
2
HN N
[15]
H2NHN
NH2
R
Ar
O
Ar R
O
N
O
N
O
N
H3C
CH3
N
N
HO
OH
7
может вступать в реакции конденсации с обра-
В ИК спектрах соединений
9а, б обнару-
зованием функциональных производных [23-25].
живаются две полосы поглощения, соответству-
β-Кетоэфиры (и β-циклокетолы в частности) ранее
ющие валентным колебаниям сопряженной и
в реакцию с аминопиразолом
7 не вводили.
несопряженной нитрильных групп (2226-2230 и
Учитывая тот факт, что вероятные продукты пира-
2261-2262 см-1 соответственно), а также двух
золохиноксалинового ряда представляют интерес
карбонильных групп
- сложноэфирной
(1717-
для фармакологии
[26-28], изучение данного
1720 см-1) и амидной (1678-1688 см-1). Положение
взаимодействия представляется перспективным.
последней полосы свидетельствует против
изомерной структуры 10 (схема 2), поскольку для
Нами установлено, что циклокетолы
1a, б
«азолидной» С=О группы в аналогичных
реагируют с 5-амино-3-(цианометил)-1H-пиразол-4-
структурах характерно поглощение в более
карбонитрилом 7 в среде кипящей АсОН с образо-
высокочастотной области (~1710 см-1) [29]. Кроме
ванием ранее не описанных производных
того, полученные результаты хорошо соотносятся
4,5,6,7,8,9-гексагидропиразоло[1,5-a]хиназолина
с литературными данными для родственных пира-
9a, б с невысокими выходами (15-22%, схема 2).
золо[1,5-a]пиримидиновых структур с фрагментом
Строение соединений 9a, б как производных
С(O)NH [21, 30]. В спектрах ЯМР 1Н обнару-
гексагидропиразоло[1,5-a]хиназолина подтверждается
живаются сигналы протонов только одной
данными ИК и ЯМР
1Н и
13С (DEPTQ)
сложноэфирной группы, а также характерные
спектроскопии, а также результатами 2D ЯМР
уширенные сигналы протонов C(O)NH при 13.29-
экспериментов (NOESY, 1Н-13С HSQC, HMBC).
13.44 м. д. NOESY эксперимент не обнаружил
Полный набор гетероядерных корреляций для
корреляций между сигналом протонов NH и
соединения 9а представлен в таблице.
метиленового звена в карбоциклическом фраг-
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
ВЗАИМОДЕЙСТВИЕ 5-АМИНО-3-(ЦИАНОМЕТИЛ)-1H-ПИРАЗОЛ-4-КАРБОНИТРИЛА
27
Схема 2.
NH2
NC CN
NC
NH2NH2.H2O
NH
NH3
NH2
N
CN
CN
8
7
R
OEt
O
R
AcOH,
O
NH
H3C
N
CN
HO
N
OEt
O
H2N
CN
CN
9a, б
O
OEt
HN
+
H3C
N
R
O
HO
CN
1a, б
7
OEt
O
N
O
N
H3C
N
CN
HO
H
CN
10
R = OMe (a), NO2 (б).
менте, чего следовало бы ожидать в случае
подтверждено комплексом спектральных данных.
образования структуры 10.
Учитывая
как
многообразие
доступных
аминоазольных и аминоазиновых субстратов, так и
Еще одной примечательной особенностью
доступность
2,4-диацил(алкоксикарбонил)-5-гид-
строения соединений
9а, б является неэквива-
рокси-5-метилциклогексанонов,
обнаруженное
лентность метиленовых протонов во фрагменте
превращение открывает перспективное
и
OCH2CH3, которая возникает, вероятно, вследствие
практически не изученное направление в химии
образования внутримолекулярной водородной
конденсированных производных хиназолина.
связи между НО- и COOEt-группами. Вследствие
Оптимизация условий синтеза, возможностей и
этого, наблюдаемые в спектрах ЯМР 1Н сигналы
ограничений данной реакции составят предмет
протонов OCH2 вместо ожидаемого квартета
наших дальнейших исследований.
представляют собой сложную АВХ3-систему.
Протоны метиленового звена С9Н2 регистрируются
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
двумя дублетами с 2J ≈ 17.0 Гц.
Таким образом, нами впервые показано, что β-
Спектры ЯМР регистрировали на приборе
циклокетолы вступают в реакцию с предста-
Bruker Avance III HD 400MHz [400 (1Н) и 101 МГц
вителем ряда
3(5)-аминопиразола
-
5-амино-3-
(13С)] в растворе ДМСО-d6. ИК спектры
(цианометил)-1H-пиразол-4-карбонитрилом, образуя
регистрировали на ИК Фурье-спектрометре Bruker
функционализированные производные гексагидро-
Vertex 70 с приставкой НПВО на кристалле алмаза,
пиразоло[1,5-a]хиназолина. Строение последних
спектральное разрешение
±4 см-1. Элементный
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
28
СЕМЕНОВА и др.
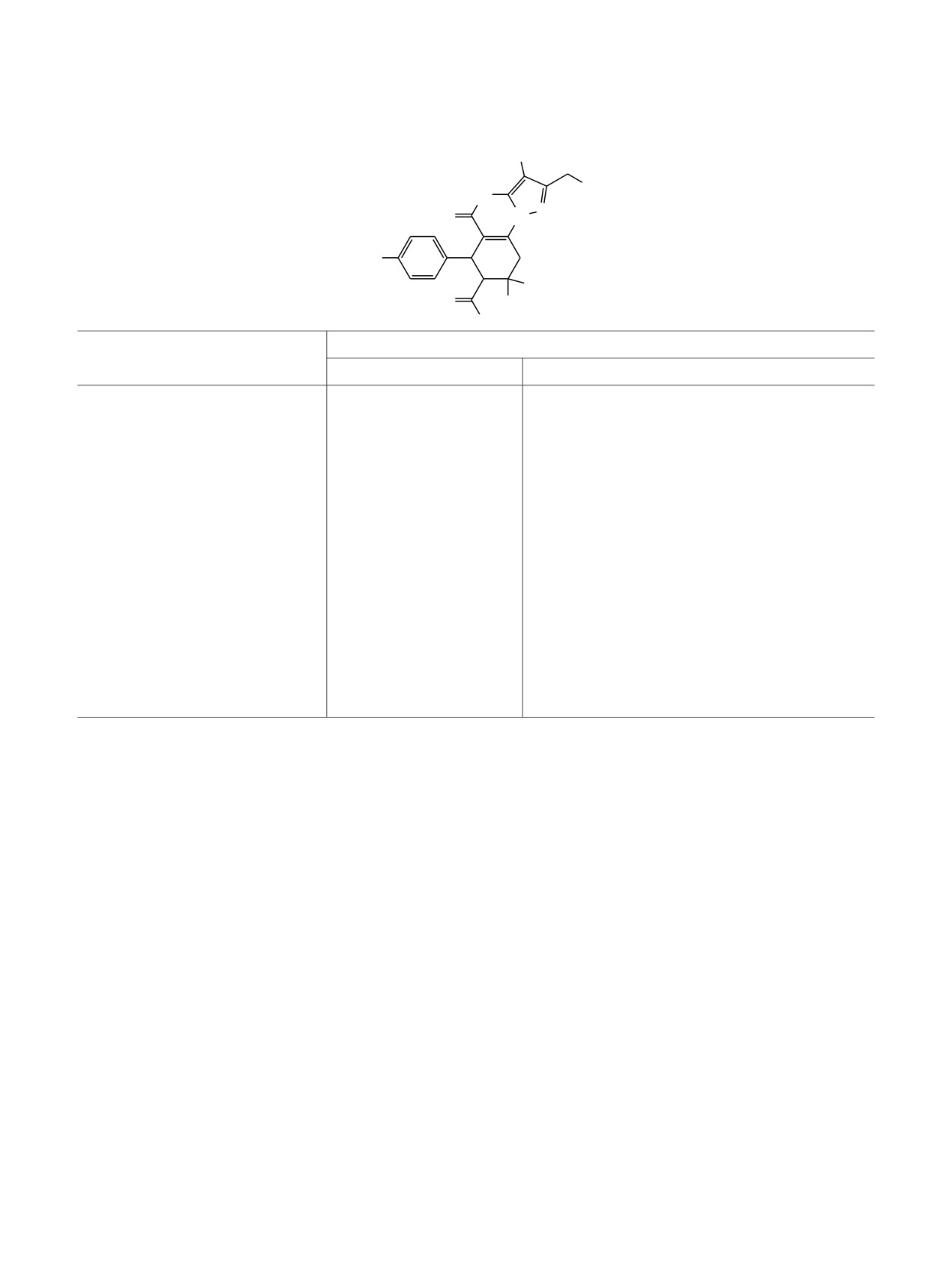
Основные корреляции в спектрах ЯМР HSQC и HMBC 1H-13C соединения 9а
NC
CN
HN
N
O
N
9a
MeO
CH3
O
OH
OEt
δС, м. д.
δН, м. д.
1H-13C HSQC
1H-13C HMBC
1.09
14.1*
59.8
1.28
27.6*
41.5, 58.5*, 68.1
2.65-2.71
41.5, 58.5*
27.6, 40.1, 58.6*, 68.2, 108.5, 135.6, 148.0, 171.4
3.22
41.5
68.3, 108.7, 148.0
3.69
54.9*
157.5
3.94-4.15
59.8
14.1*, 171.4
4.27
40.2*
58.6*, 108.6, 128.7*, 135.6, 148.0, 153.8, 171.4
4.34
16.7
73.2, 116.2, 153.7
4.86
-
-
6.76
113.3*
113.3*, 135.6, 157.5
7.04
128.7*
40.2*, 113.3*, 128.7*, 157.5
13.29
-
-
анализ на C, H, N проводили на приборе Carlo Erba
охлаждали. Осадок отфильтровывали и промывали
1106. Контроль за чистотой полученных соеди-
EtOH. Выход 22%, белый аморфный порошок. ИК
нений осуществляли методом ТСХ на пластинах
спектр, ν, см-1: 3476 (O-H), 3182, 3076 (N-H), 2262,
Сорбфил-А, элюент
- ацетон-гексан
(1:1),
2226 (C≡N), 1720 (C=Oэфир), 1688 (C=Оамид), 1649,
проявитель - пары иода, УФ детектор.
1593 (С=С). Спектр ЯМР 1Н, , м. д.: 1.09 т (3Н,
СН3СН2О, 3J = 7.1 Гц), 1.28 с (3Н, С8СН3), 2.65-
Исходные 3-(4-R-фенил)-5-гидрокси-5-метил-2,4-
2.71 наложение двух дублетов (2Н, Н9 + Н7), 3.22 д
ди(этоксикарбонил)циклогексаноны 1a, б получали
(1Н, Н9, 2J = 17.1 Гц), 3.69 с (3Н, СН3О), 3.94-4.15
по известной методике [31]. 5-Амино-3-(циано-
м (2Н, СН3СН2О, АВХ3-система), 4.27 д (1Н, Н6,
метил)-1H-пиразол-4-карбонитрил 7 получали из
3J = 10.2 Гц), 4.34 c (2Н, CH2CN), 4.86 уш. с (1Н,
димера малононитрила известным способом [22].
ОН), 6.76 д (2H, H3 + H5, Ar, 3J = 8.4 Гц), 7.04 д (2H,
Этиловый эфир
8-гидрокси-6-(4-метокси-
H2 + H6, Ar, 3J = 8.4 Гц), 13.29 уш. с (1Н, NH).
фенил)-8-метил-5-оксо-3-циано-2-(цианометил)-
Спектр ЯМР 13С DEPTQ, C, м. д. (здесь и далее
4,5,6,7,8,9-гексагидропиразоло[1,5-a]хиназолин-7-
звездочкой обозначены сигналы в противофазе):
карбоновой кислоты (9а). Смесь 380 мг (1 ммоль)
14.5* (СН3СН2О), 16.7 (CH2CN), 27.6* (C8CH3),
диэтилового эфира
5-гидрокси-5-метил-3-(4-мет-
40.2* (C6), 41.5 (C9), 54.9* (СН3О), 58.6* (C7), 59.8
оксифенил)циклогексанон-2,4-дикарбоновой кислоты
(СН3СН2О), 68.2 (C8), 73.2 (C3), 108.5 (C5a), 111.9
1а, 5 мл ледяной АсОН и 150 мг (1 ммоль)
(CN), 113.3* (C3, C5 Ar), 116.2 (CH2CN), 128.7* (C2,
пиразола 7 кипятили 4 ч (контроль по ТСХ), затем
C6 Ar), 135.6 (C1 Ar), 148.0 (C9a), 148.1 (С3а), 153.7
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
ВЗАИМОДЕЙСТВИЕ 5-АМИНО-3-(ЦИАНОМЕТИЛ)-1H-ПИРАЗОЛ-4-КАРБОНИТРИЛА
29
(С2), 153.8 (C5), 157.5 (C4 Ar), 171.4 (СО2Et).
3. Озолс А.И., Пелчер Ю.Э., Калме З.А., Попелис Ю.Ю.,
Найдено, %: C 62.60; H 5.07; N 15.11. C24H23N5О5.
Туровскис И.В., Дубурс Г.Я. // ХГС. 1996. Т. 32. № 1.
С. 59; Ozols A.I., Pelcher Yu.Ê., Kalme Z.A., Popelis Yu.Yu.,
Вычислено, %: C 62.46; H 5.02; N 15.18.
Turovskis I.V., Duburs G.Ya. // Chem. Heterocycl.
Этиловый эфир
8-гидрокси-8-метил-6-(4-
Compd. 1996. Vol. 32. N. 1. P. 52. doi 10.1007/
нитрофенил)-5-оксо-3-циано-2-(цианометил)-
BF01169354
4,5,6,7,8,9-гексагидропиразоло[1,5-a]хиназолин-7-
4. Дяченко В.Д., Сукач С.М., Дяченко А.Д. // ХГС. 2015.
карбоновой кислоты (9б) получали аналогично из
Т.
51.
№ 1. С. 51; Dyachenko V.D., Sukach S.M.,
1.34 г (3.4 ммоль) диэтилового эфира 5-гидрокси-5-
Dyachenko A.D. // Chem. Heterocycl. Compd. 2015.
метил-3-(4-нитрофенил)циклогексанон-2,4-дикарбо-
Vol. 51. N 1. P. 51. doi 10.1007/s10593-015-1658-9
новой кислоты 1б и 0.5 г (3.4 ммоль) пиразола 7;
5. Дяченко В.Д., Карпов Е.Н. // ЖОрХ. 2014. Т. 50.
№ 12. С. 1806; Dyachenko V.D., Karpov E.N. // Russ. J.
время реакции - 7 ч. Выход 15%, бежевый амор-
Org. Chem. 2014. Vol. 50. N 12. P. 1787. doi 10.1134/
фный порошок. ИК спектр, ν, см-1: 3476 (O-H),
S1070428014120136
3231, 3179, 3074 (N-H), 2261, 2230 (C≡N), 1717
6. Сукач С.М., Дяченко В.Д. // ЖОрХ. 2015. Т. 51. № 7.
(C=Oэфир), 1678 (C=Оамид), 1645, 1589 (С=С), 1522
С. 1037; Sukach S.M., Dyachenko V.D. // Russ. J. Org.
[νas(NO2)], 1348 [νs(NO2)]. Спектр ЯМР 1Н, , м. д.:
Chem. 2015. Vol. 51. N 7. P. 1020. doi 10.1134/
1.04 т (3Н, СН3СН2О, 3J = 7.1 Гц), 1.29 с (3Н,
S1070428015070210
С8СН3), 2.70 д (1Н, Н9, 2J = 17.3 Гц), 2.76 д (1Н, Н7,
7. Дяченко В.Д., Сукач С.М. // ХГС. 2010. Т. 46. № 12.
3J =10.3 Гц), 3.27 д (1Н, Н9, 2J = 17.3 Гц), 3.91-4.05
С.
1795; Dyachenko V.D., Sukach S.M.
// Chem.
м (2Н, СН3СН2О, АВХ3-система),
4.33 c
(2Н,
Heterocycl. Compd. 2010. Vol. 46. N 12. P. 1467. doi
CH2CN), 4.43 д (1Н, Н6, 3J = 10.3 Гц), 5.02 уш. с
10.1007/s10593-011-0693-4
(1Н, ОН), 7.43 д (2H, H2 + H6, Ar, 3J = 8.6 Гц), 8.09 д
8. Гейн В.Л., Носова Н.В., Потемкин К.Д., Алиев З.Г.,
(2H, H3 + H5, Ar, 3J = 8.6 Гц), 13.44 уш. с (1Н, NH).
Кривенько А.П. // ЖОрХ. 2005. Т. 41. № 7. С. 1039;
Спектр ЯМР
13С DEPTQ,
C, м. д.:
14.1*
Gein V.L., Nosova N.V., Potemkin K.D., Aliev Z.G.,
(СН3СН2О), 16.7 (CH2CN), 27.4* (C8CH3), 41.1*
Kriven’ko A.P. // Russ. J. Org. Chem. 2005. Vol. 41.
N 7. P. 1016. doi 10.1007/s11178-005-0287-7
(C6), 41.4 (C9), 57.5* (C7), 60.1 (СН3СН2О), 68.1
9. Сорокин В.В., Григорьев А.В., Рамазанов А.К.,
(C8), 73.5 (C3), 107.1 (C5a), 111.8 (CN),
116.1
Кривенько А.П. // ХГС. 1999. Т. 35. № 6. С. 757;
(CH2CN), 123.2* (C2, C6 Ar), 129.2* (C3, C5 Ar),
Sorokin V.V., Grigoryev A.V., Ramazanov A.K.,
146.0 (C1 Ar), 147.99 (C9a или С3а), 148.02 (C3a или
Krivenko, A.P. // Chem. Heterocycl. Compd.
1999.
С9а), 148.2 (C4 Ar), 152.1 (С2), 153.9 (C5),
170.8
Vol. 35. N 6. P. 671. doi 10.1007/BF02251624
(СО2Et). Найдено, %: C 57.95; H 4.30; N 17.71.
10. Смирнова Н.О., Плотников О.П., Виноградова Н.А.,
C23H20N6О6. Вычислено, %: C 57.98; H 4.23; N 17.64.
Сорокин В.В., Кривенько А.П. // Хим.-фарм. ж. 1995.
Т. 29. № 1. С. 44; Smirnova N.O., Plotnikov O.P.,
ФОНДОВАЯ ПОДДЕРЖКА
Vinogradova N.A., Sorokin V.V., Kriven'ko A.P. //
Pharm. Chem. J. 1995. Vol. 29. N 1. P. 49. doi 10.1007/
Работа выполнена при финансовой поддержке
BF02219464
Министерства образования и науки Российской
11. Поплевина Н.В., Кузнецова А.А., Кривенько А.П. //
Федерации (проект № 4.5547.2017/8.9, В.В. Доценко
ХГС. 2010. Т. 46. № 9. С. 1420; Poplevina N.V.,
и И.В. Аксенова; проект № 4.1196.2017/4.6, Н.А.
Kuznetsova A.A., Krivenko A.P. // Chem. Heterocycl.
Аксенов) с использованием оборудования «Эколого-
Compd. 2010. Vol. 46. N 9. P. 1148. doi 10.1007/
аналитического центра Кубанского госуниверситета
s10593-010-0644-5
(уникальный идентификатор RFMEFI59317Х0008).
12. Дяченко В.Д., Сукач С.М. // ЖОХ. 2012. Т. 82. № 2.
С. 310; Dyachenko V.D., Sukach S.M. // Russ. J. Gen.
КОНФЛИКТ ИНТЕРЕСОВ
Chem. 2012. Vol. 82. N 2. P. 305. doi 10.1134/
S1070363212020211
Авторы заявляют об отсутствии конфликта
13. Anwar H.F., Elnagdi M.H. // Arkivoc. 2009. P. 198. doi
интересов.
10.3998/ark.5550190.0010.107
14. Abu Elmaati T.M., El-Taweel F.M. // J. Heterocycl.
СПИСОК ЛИТЕРАТУРЫ
Chem. 2004. Vol. 41. N 2. P 109. doi 10.1002/
1. Кривенько A.П., Сорокин В.В. Замещенные цикло-
jhet.5570410201
гексанолоны. Саратов: Саратовск. унив., 1999. С. 20.
15. Etman H.A., Sadek M.G., Khalil A.G.M. // Res. J.
2. Исмиев А.И., Магеррамов А.М., Сукач В.А., Вовк М.В. //
Pharm. Biol. Chem. Sci. 2015. Vol. 6. N 2. P. 247.
Ж. орг. фарм. хим. 2016. Т. 14. № 4 (56). С. 16.
16. Доценко В.В., Исмиев А.И., Хрусталева А.Н., Фро-
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
30
СЕМЕНОВА и др.
лов К.А., Кривоколыско С.Г., Чигорина Е.А., Сниж-
22. Carboni R.A., Coffman D.D., Howard E.G. // J. Am.
ко А.П., Громенко В.М., Бушмаринов И.С., Аскеров Р.К.,
Chem. Soc. 1958. Vol. 80. N 11. P. 2838. doi 10.1021/
Пехтерева Т.М., Суйков С.Ю., Папаянина Е.С.,
ja01544a061
Мазепа А.В., Магеррамов А.М. // ХГС. 2016. Т. 52.
23. Metwally N.H., Abdallah M.A., Almabrook S.A. // J.
№ 7. С. 473; Dotsenko V.V., Ismiev A.I., Khrustale-
Heterocycl. Chem. 2017. Vol. 54. N 1. P. 347. doi
va A.N., Frolov K.A., Krivokolysko S.G., Chigorina E.A.,
10.1002/jhet.2590
Snizhko A.P., Gromenko V.M., Bushmarinov I.S.,
24. Ragab E.A., Metwally N.H., Mohamed M.S. // Synth.
Askerov R.K., Pekhtereva T.M., Suykov S.Yu.,
Commun.
2017. Vol.
47. N
2. P.
148. doi
Papayanina E.S., Mazepa A.V., Magerramov A.M. //
10.1080/00397911.2016.1257722
Chem. Heterocycl. Compd. 2016. Vol. 52. N 7. P. 473.
doi 10.1007/s10593-016-1918-3
25. Elkholy A., Al-Qala, F., Elnagdi M.H. // Arkivoc. 2008.
17. Доценко В.В., Кривоколыско С.Г., Чернега А.Н.,
P. 124.
Литвинов В.П. // Изв. АН. Сер. Хим. 2003. № 4.
26. Metwally N.H., Mohamed M.S. // Synth. Commun.
С. 918; Dotsenko V.V., Krivokolysko S.G., Chernega A.N.,
2018. Vol.
48. N
7.
P.
721. doi
10.1080/
Litvinov V.P. // Russ. Chem. Bull. 2003. Vol. 52. N 4.
00397911.2017.1399208
P. 969. doi 10.1023/A:1024420930528
27. Garg M., Chauhan M., Singh P.K., Alex J.M., Kumar R. //
18. Tverdokhleb N.M., Khoroshilov G.E., Dotsenko V.V. //
Eur. J. Med. Chem. 2015. Vol. 97. P. 444. doi 10.1016/
Tetrahedron Lett. 2014. Vol. 55. P. 6593. doi 10.1016/
j.ejmech.2014.11.051
j.tetlet.2014.10.046
28. Yet L. Privileged Structures in Drug Discovery:
19. Доценко В.В., Чигорина Е.А., Кривоколыско С.Г. //
Medicinal Chemistry and Synthesis. New York: John
ХГС. 2017. Т.
53.
№ 5. С. 626; Dotsenko V.V.,
Wiley & Sons, 2018. P. 9.
Chigorina E.A., Krivokolysko S.G. // Chem. Heterocycl.
29. Elnagdi M.H., Sallam M.M.M., Ilias M.A.M. // Helv.
Compd. 2017. Vol. 53. N. 5. P. 626. doi 10.1007/s10593-
Chim. Acta. 1975. Vol. 58. N 7. P. 1944. doi 10.1002/
017-2103-z.
hlca.19750580710
20. Ledenyova I.V., Didenko V.V., Dotsenko V.V.,
Shikhaliev K.S. // Tetrahedron Lett. 2014. Vol. 55. N 6.
30. Zayed E.M., Ghozlan S.A.S., Ibrahim A.A.H. // Monatsh.
P. 1239. doi 10.1016/j.tetlet.2014.01.010
Chem. 1984. Vol. 115. N 4. P. 431. doi 10.1007/
BF00810004
21. Kolosov M.A., Beloborodov D.A., Orlov V.D., Dotsen-
ko V.V. // New J. Chem. 2016. Vol. 40. N 9. P. 7573.
31. Finar I.L. // J. Chem. Soc. 1961. N 2. P. 674. doi
doi 10.1039/c6nj00336b
10.1039/JR9610000674
Reaction of 5-Amino-3-(cyanomethyl)-1H-pyrazole-4-carbonitrile
with Hydroxycyclohexanones
A. M. Semenovaa,b, R. V. Oganesyana, V. V. Dotsenkoa,c, *,
E. A. Chigorinad, N. A. Aksenovc, I. V. Aksenovac, and E. E. Netrebae
a Kuban State University, ul. Stavropol’skaya 149, Krasnodar, 350040 Russia
*e-mail: victor_dotsenko_@mail.ru
b North Caucasian State Humanitarian and Technological Academy, Medical Institute, Cherkessk, Russia
cNorth Caucasus Federal University, Stavropol, Russia
d National Research Center “Kurchatov Institute” - IREA, Moscow, Russia
e Taurida Academy of V.I. Vernadsky Crimean Federal University, Simferopol, Russia
Received July 5, 2018
Revised July 5, 2018
Accepted July 13, 2018
The reaction of 5-amino-3-(cyanomethyl)-1H-pyrazole-4-carbonitrile with 3-aryl-5-hydroxy-5-methyl-2,4-di
(ethoxycarbonyl)cyclohexanones in acetic acid medium furnished previously unknown 4,5,6,7,8,9-hexahyd-
ropyrazolo[1,5-a]quinazoline derivatives.
Keywords: β-cycloketols, aminopyrazole, cyclocondensation, pyrazolo[1,5-a]quinazoline
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019