ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 1, с. 31-38
УДК 547.89
СИНТЕЗ N-ЗАМЕЩЕННЫХ ТИАЗАЦИКЛОАЛКАНОВ
ЦИКЛОТИОМЕТИЛИРОВАНИЕМ ПЕРВИЧНЫХ
АЛИФАТИЧЕСКИХ АМИНОВ И АМИНОПРОИЗВОДНЫХ
МАЛЕОПИМАРОВОЙ КИСЛОТЫ
© 2019 г. Г. Р. Хабибуллина*, Е. С. Федотова, Е. В. Третьякова, Т. В. Тюмкина,
Л. В. Парфенова, А. Г. Ибрагимов
Институт нефтехимии и катализа Российской академии наук, пр. Октября 141, Уфа, 450075 Россия
*e-mail: ink@anrb.ru
Поступило в Редакцию 24 мая 2018 г.
После доработки 24 мая 2018 г.
Принято к печати 4 июня 2018 г.
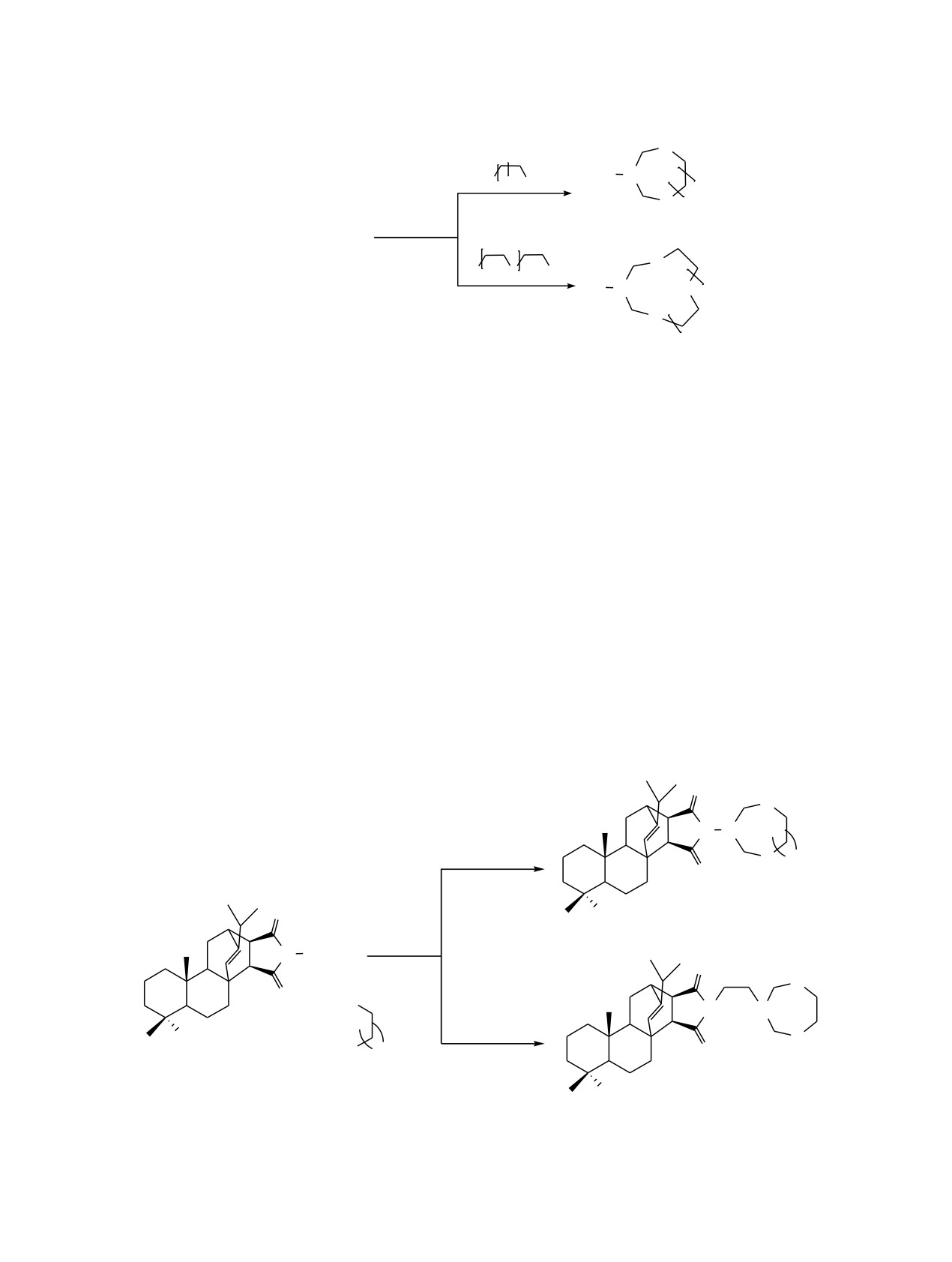
Трехкомпонентной циклоконденсацией первичных алифатических аминов и аминопроизводных
метилового эфира малеопимаровой кислоты с формальдегидом и карбоцепными (1,2-этан-, 1,3-пропан-,
1,4-бутан-, 1,5-пентан-, 1,6-гександитиолы) α,ω-дитиолами или 3,6-диокса-1,8-октандитиолом осуществлен
синтез N-замещенных тиазациклоалканов.
Ключевые слова: трехкомпонентная циклоконденсация, малеопимаровая кислота, α,ω-дитиолы,
циклотиометилирование, (окса)тиазациклоалканы
DOI: 10.1134/S0044460X19010050
Трехкомпонентная реакция ароматических
кольцо малеопимаровой кислоты азотсодержащих
аминов [1] и аминокислот [2, 3] с формальдегидом
фрагментов приводит к появлению цитотокси-
и α,ω-дитиолами проходит с образованием дитиа-
ческой, бактерицидной и нематоцидной актив-
зациклоалканов. Аминоспирты, в отличие от аро-
ности [14-16].
матических аминов и аминокислот, вступают в
В продолжение проводимых нами исследований
реакцию с длинноцепными α,ω-дитиолами с образо-
в области синтеза практически важных N,S,O-
ванием макрогетероциклов [4]. Сведения о реакции
гетероциклов, а также с целью разработки
алифатических аминов с формальдегидом и α,ω-
препаративного способа получения N-замещенных
дитиолами практически отсутствуют
[5], а
тиаза- и оксатиазациклоалканов нами изучена
возможность модификации природных соединений
реакция циклотиометилирования первичных алифа-
со свободной аминогруппой, например, амино-
тических аминов и аминопроизводных метилового
производных малеопимаровой кислоты, в реакции
эфира малеопимаровой кислоты с формальдегидом
циклотиометилирования ранее не была изучена.
и карбо(гетеро)цепными α,ω-дитиолами.
Интерес к N-замещенным тиазациклоалканам
Установлено, что алифатические амины
[н-
обусловлен проявлением у них антибактериальной
бутил- (1), трет-бутил- (2), циклогексиламин (3)]
[6] и противогрибковой активности [7], а также
вступают в реакцию с формальдегидом и 1,2-
комплексообразующих свойств по отношению к
этандитиолом в среде хлороформа (20°С, 3 ч) по
благородным металлам
[8]. Малеопимаровая
типу
[1+2+1]-гетероциклизации с образованием
кислота и ее производные привлекают внимание в
N-алкилзамещенных 1,5,3-дитиазепанов 4a, 5, 6 с
качестве объектов для разработки фармаколо-
выходами 73-89% (схема 1).
гически важных агентов [9], таких как иммунные
регуляторы [10], гепатопротекторы [11], фунги-
С увеличением длины алкильной цепи в α,ω-
циды
[12], противовоспалительные и противо-
дитиолах (1,3-пропан-, 1,4-бутан-, 1,5-пентан-, 1,6-
язвенные средства [13]. Введение в ангидридное
гександитиолы) выход продуктов реакции с
31
32
ХАБИБУЛЛИНА и др.
Схема 1.
S
n
R
N
n
HS
SH
S
20оC, 3 ч
46
R NH2
+ 2CH2O
CHCl3
S
13
2
HS
O
SH
2
R
N
O
S
7
R = n-Bu, n = 1 (4a), 2 (4б), 3 (4в), 4 (4г), 5 (4д); tert-Bu, n = 1 (5); c-Hex, n = 1 (6).
бутиламином и формальдегидом снижается от 70
октандитиолом проходит с образованием 6-бутил-
до 25%. Для повышения выхода целевого продукта
1,11-диокса-4,8-дитиа-6-азациклотридекана
7 с
на примере реакции н-бутиламина с формальде-
выходом 75% (схема 1).
гидом и 1,3-пропандитиолом подобраны катализаторы
Наряду с первичными алифатическими аминами
на основе переходных и редкоземельных металлов.
в реакцию циклотиометилирования с CH2O и α,ω-
Из числа испытанных в данной реакции
дитиолами были вовлечены аминопроизводные
катализаторов: SmCl3·6H2O (85%), Sm(NO3)3·6H2O
метилового эфира малеопимаровой кислоты.
(80%), CuCl2·2H2O
(74%), NiCl2·6H2O
(70%),
Гидразид метилового эфира малеопимаровой кислоты
CoCl2·6H2O
(70%)
наибольшую активность
8 получен по описанной ранее методике [17].
проявил SmCl3·6H2O (20°С, 3 ч). В оптимальных
Реакция гидразида метилового эфира малео-
условиях (5 мол% SmCl3·6H2O, СНСl3, 20°C, 3 ч,
пимаровой кислоты 8 с CH2O и карбоцепными α,ω-
соотношение исходных реагентов 1:2:1) осущест-
дитиолами (1,2-этан-, 1,4-бутандитиол) протекает в
влен синтез
1,5,3-дитиазациклоалканов
4б-д с
смеси CHCl3-EtOH при 20°С в течение 25 ч с
выходами 85-52% (схема 1).
образованием N-замещенных дитиазациклоалканов
Следует отметить, что реакция циклотиомети-
9a, б с выходами 86 и 67% соответственно (схема 2).
лирования бутиламина с CH2O и 3,6-диокса-1,8-
В данных условиях реакция продукта конденсации
Схема 2.
O
S
N
N
n
R = NH2
S
O
8
16
17
15
O
CO2CH3
12
9a, б
23
20oC, 25 ч
20
1113
21
N
R
14
22
24
CHCl3EtOH
O
1
9
2
10
8
S
3
5
O
7
HS
4
6
N
N
18
+ 2CH2O
+
R = CH2CH2NH2
CO2CH3
n
S
19
25
HS
O
10
CO2CH3
11
n = 1 (а), 3 (б).
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
СИНТЕЗ N-ЗАМЕЩЕННЫХ ТИАЗАЦИКЛОАЛКАНОВ
33
Схема 3.
O
S
S
O
S
2
N
N
3'
N
N
S
S
O
S
O
4г
7
9a
метилового эфира малеопимаровой кислоты с
новым системам
[1]. Различия электронного
этилендиамином 10 с CH2O и 1,2-этандитиолом
состояния около атома азота семичленного
приводит к образованию N-замещенного дитиаза-
гетероцикла в соединениях 9а и 11 оценены по
циклоалкана 11 с выходом 47% (схема 2). Амино-
данным двумерного гетероядерного 1H-15N HMBC
имид 10 с количественным выходом получен в
эксперимента (схема 3). Так, для соединения 11
результате взаимодействия метилового эфира
сигнал атома N3' проявляется при 329.9 м. д., в то
малеопимаровой кислоты с этилендиамином при
время как сигнал соответствующего атома азота в
кипячении в метаноле.
спектре соединения 9а значительно смещен до
296.5 м. д. Сигнал второго атома азота N2
Строение всех синтезированных соединений
наблюдается при 165.5 м.д. Ранее приведенные
подтверждено с помощью данных спектроскопии
нами значения химических сдвигов для N-
ЯМР 1H и 13C, масс-спектрометрии. Так, характе-
замещенных
1,5,3-дитиазепанов
[2] близки к
ристичными для соединений
4-6 сигналами в
полученным в данной работе для соединений 4г
спектрах ЯМР 1H, 13C являются сигналы метиле-
(333.9 м. д.) и 7 (333.8 м. д., значения приведены
новой группы между гетероатомами в области δH =
относительно нитрометана).
3.97--4.39 м. д. и δC = 53.6-59.4 м. д. Близкие по
значению химические сдвиги для данного NCH2S-
Таким образом, реакция циклотиометилирования
фрагмента δH = 3.95 м. д. и δC = 57.3 м. д. Наблю-
первичных алифатических аминов, а также амино-
даются также для макрогетероциклa 7. В спектрах
производных метилового эфира малеопимаровой
ЯМР 1H и
13C соединения
6a наличие двух
кислоты с СН2О и карбо(гетеро)цепными α,ω-дити-
дублетов с δH = 4.47 и δH = 4.56 м. д., синглета с
олами является эффективным способом получения
δН = 2.96 м. д., а также сигналов с δС = 58.3 м. д.
целевых N-замещенных 1,5,3-дитиазациклоалканов
и δС = 37.9 м. д. наряду с сигналами каркаса
в мягких условиях с хорошими выходами.
малеопимаровой кислоты [17] свидетельствует об
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
образовании
1,5,3-дитиазепанового гетероцикла.
Различие химических сдвигов метиленовых протонов
Исходные амины и α,ω-дитиолы с содержанием
описано ранее для 1,5,3-дитиазепановых гетеро-
основного вещества не менее 98%, формальдегид
циклов с заместителями, содержащими асимметри-
(37%-ный формалин) являются коммерчески
ческий центр
[2,
4], в которых происходит
доступными реактивами (Acros) и использовались
смещение равновесия в сторону конформации
без дополнительной очистки. Аминопроизводные
кресло-кресло вследствие изменения инверсионного
метилового эфира малеопимаровой кислоты 8 и 10
барьера при атоме азота. Пики молекулярных
получали согласно методикам, описанным в
ионов в масс-спектрах MALDI TOF/TOF 569.433
работах
[17,
18]. ИК спектры снимали на
[M + Na]+ и 585.401 [M + K]+ соединения 9a и
спектрометре Bruker Vertex 70v. Спектры ЯМР 1Н
597.248 [M + Na]+ 613.202 [M + K]+ соединения 11
и
13С регистрировали на спектрометре Bruker
подтверждают предложенную структуру. В масс-
Avance 400 (400.13 и 100.62 МГц соответственно).
спектрe MALDI TOF/TOF соединения 9б присут-
Гомо- (COSY, NOESY) и гетероядерные (HSQC,
ствует пик с m/z 546.981 [M - (CH2)2]+. Следует
HMBC) двумерные спектры ЯМР снимали на
отметить, что в отличие от соединения
9а
спектрометре Bruker Ascend
500
(500.17 и
дитиазепановый цикл в соединении 11 в спектре
125.78 МГц соответственно),
растворитель
-
ЯМР 1Н проявляется в виде двух синглетов
CDCl3. Гетероядерные двумерные спектры 1Н-15N
аналогично обычным N-замещенным дитиазепа-
HMBC регистрировали при частоте 50.69 МГц,
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
34
ХАБИБУЛЛИНА и др.
используя в качестве стандарта нитрометан.
аналогично с использованием 5 мол% SmCl3·6H2O
Элементный состав С, Н и N определяли на СHN-
в качестве катализатора.
анализаторе (модель 1106, Сarlo Erba, Италия).
3-Бутил-1,5,3-дитиазепан (4a). Выход 0.16 г
Анализ продуктов реакции методом ГЖХ
(89%), бесцветное масло, Rf
0.86 (ацетон:
выполняли на хроматографе Chrom-5 c пламенно-
хлористый метилен = 1:1). ИК спектр, ν, cм-1: 633
ионизационным детектором, неподвижная фаза SE-30
(C-S), 675 (C-S-C), 733, 834, 925, 1083 (C-N), 1156
(5%) на носителе Chromaton N-AW-HMDS (наса-
(C-N), 1271, 1318, 1332, 1383 (CH3), 1424, 1458
дочная стальная колонка
2400
×
3 мм, прог-
(CH3), 1673, 2868 (CH3), 2927 (CH2). Спектр ЯМР
раммирование температуры 50-270°С, 8 град/мин,
1Н (500 МГц), δ, м. д. (J, Гц): 0.87 т (3H, CH3, 3J =
газ-носитель - гелий). Хромато-масс-спектральный
7.5), 1.28 секстет (2H, CH2CH3, 3J = 7.5), 1.38 м (2Н,
анализ выполняли на хроматографе Shimadzu GC
CH2CH2CH3), 2.60 т (2Н, NCH2CH2, 3J = 7.5), 2.98 с
2010 с масс-спектрометрическим детектором
[4H, S(CH2)2S], 4.11 с (4Н, NCH2S). Спектр ЯМР
GCMS-QP2010 Ultra (Shimadzu, Япония) с
13C (125 МГц), δC, м. д.: 14.0 (CH3), 20.5 (CH2CH3),
капиллярной колонкой Supelco 5ms (60 м × 0.25 мм ×
29.1
(CH2CH2CH3),
35.9
[S(CH2)2S],
50.7
0.25 мкм), газ-носитель
- гелий. Температура
(NCH2CH2), 59.4 (NCH2S). Mасс-спектр, m/z (Iотн,
инжектора и интерфейса
-
260°С, ионного
%): 191 (7) [M]+, 158 (7) [M - HS]+, 130 (10) [M -
источника - 200°С, метод ионизации - электрон-
CH2SCH3]+,
98
(100)
[M - H(SCH2)2]+,
57
(66)
ный удар (70 эВ). Масс-спектры в режиме MALDI-
[CH3CH2CH2]+. Найдено, %: C 50.38; H 9.02; N 7.27.
TOF регистрировали на масс-спектрометре
C8H17NS2. Вычислено, %: C 50.21; H 8.95; N 7.32; S
AUTOFLEX III MALDI TOF Bruker, в качестве
33.52.
матриц использовали α-циано-4-гидроксикоричную
и синапиновую кислоты. Масс-спектры ESI
3-Бутил-1,5,3-дитиазокан (4б). Выход 0.17 г
получали
на
жидкостном
хромато-масс-
(85%), бесцветное масло, Rf
0.90 (ацетон:
спектрометре LCMS-2010 EV (Shimadzu) Центра
этилацетат:гексан = 1:2:2). ИК спектр, ν, cм-1: 654
коллективного пользования «Химия» Уфимского
(C-S), 737 (C-S-C), 841, 892, 912, 1007, 1073 (C-N),
института химии РАН в режиме регистрации
1161 (C-N), 1244, 1319, 1380 (CH3), 1420, 1459
положительных и отрицательных ионов при
(CH3), 1676, 2823, 2863 (CH2), 2955 (CH3). Спектр
потенциале капилляра 4.5 и -3.5 кВ. Температура
ЯМР 1Н (500 МГц), δ, м. д. (J, Гц): 0.92 т (3H, CH3,
нагревателя - 200°С, температура испарителя -
3J = 7.2), 1.34 секстет (2H, CH2CH3, 3J = 7.2), 1.42-
230°С, скорость потока распыляющего газа (азот) -
1.44 м (2Н, CH2CH2CH3), 1.85 м [2Н, (SCH2)CH2],
1.5 л/мин. Температуру плавления определяли на
2.64-2.65 м [6Н, NCH2CH2, (SCH2)2CH2], 4.00 с (4Н,
приборе РНМК
80/2617 (столик Кофлера).
NCH2S). Спектр ЯМР 13C (125 МГц), δC, м. д.: 14.0
Удельные углы вращения определяли на
(CH3),
20.4 (CH2CH3),
29.6 (CH2CH2CH3),
30.4
поляриметре PerkinElmer-341. ТСХ проводили на
[SCH2)2CH2], 30.8 [(SCH2)2CH2], 51.4 (NCH2CH2),
пластинах Sorbfil ПТСХ-АФ-А, хроматограммы
56.9 (NCH2S). Mасс-спектр, m/z (Iотн, %): 205 (5) [M]+,
проявляли в иодной камере. Индивидуальные
98 (93) [СH3(CH2)3N(CH)CH2]+, 73 (9) [S(CH2)2CH]+,
вещества получали хроматографированием на
57 (100) [СH3(CH2)3]+. Найдено, %: C 52.50; H 9.41;
силикагеле марки КСК (50-160 мкм).
N 6.77. C9H19NS2. Вычислено, %: C 52.63; H 9.32; N
6.82; S 31.23.
Общая методика циклотиометилирования
алифатических аминов с формальдегидом и α,ω-
3-Бутил-1,5,3-дитиазонан (4в). Выход 0.17 г
дитиолами. Смесь 1 ммоль алифатического α,ω-
(77%), бесцветное масло, Rf 0.95 (ацетон:этил-
дитиола (или 0.16 мл 3,6-диокса-1,8-октандитиола)
ацетат:гексан = 1:2:3). ИК спектр, ν, cм-1: 649 (C-S),
и формалина (37%, 2 ммоль, 0.15 мл) в 1 мл
733 (C-S-C), 841, 902, 924, 1074 (C-N), 1100, 1161
хлороформа перемешивали при комнатной
(C-N), 1239, 1265, 1311, 1378 (CH3), 1456 (CH3),
температуре
(~20°С) в течение
30 мин, затем
1679, 2858 (CH2),
2928 (CH2). Спектр ЯМР 1Н
охлаждали до 0°С. После добавления 1 ммоль
(500 МГц), δ, м. д. (J, Гц): 0.92 т (3H, CH3, 3J = 7.2),
первичного амина смесь перемешивали в течение
1.32-1.35 м
(2H, CH2CH3),
1.42-1.43 м
(2Н,
3 ч при 20°С в хлороформе, затем экстрагировали
CH2CH2CH3), 1.67 c [4Н, (SCH2CH2)2], 2.55 c [4Н,
хлороформом. Органическую фазу сушили MgSO4.
SCH2CH2)2], 2.62 т (2Н, NCH2CH2, 3J = 7.2), 4.00 с
После удаления растворителя остаток хромато-
(4Н, NCH2S). Спектр ЯМР 13C (125 МГц), δC, м. д.:
графировали. Синтез соединений 4б-д проводили
14.0 (CH3), 20.4 (CH2CH3), 29.3 [SCH2CH2)2], 29.7
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
СИНТЕЗ N-ЗАМЕЩЕННЫХ ТИАЗАЦИКЛОАЛКАНОВ
35
(CH2CH2CH3),
31.5
[S(CH2)2S], 51.4 (NCH2CH2),
этилацетат = 1:2). ИК спектр, ν, cм-1: 651 (C-S), 825
56.8 (NCH2S). Mасс-спектр, m/z (Iотн, %): 219 (5)
(C-C), 879, 909, 949, 1039 (C-N), 1134 (CH3), 1196
[M]+, 131 (5) [СH3(CH2)3NCH2SCH2]+, 98 (100) [СH3
(C-N), 1254 (CH3), 1324, 1364 (CH3), 1418, 1467
(CH2)3N(CH)CH2]+, 87 (23) [CH2NCH2SCH]+, 57 (82)
(CH2), 1658, 2873 (CH3), 2927 (CH2), 2970 (CH3).
[CH3(CH2)3]+. Найдено, %: C 54.58; H 9.57; N
Спектральные характеристики идентичны описан-
6.44.C10H21NS2. Вычислено, %: C 54.74; H 9.65; N
ным в работе [19].
6.38; S 29.23.
3-Циклогексил-1,5,3-дитиазепан
(6). Выход
3-Бутил-1,5,3-дитиазекан (4г). Выход 0.15 г
0.16 г (73%), бесцветное масло, Rf 0.88 (гексан:
(64%), бесцветное масло, Rf 0.88 (ацетон:этил-
этилацетат = 1:1). ИК спектр, ν, cм-1: 676 (C-S),
ацетат:гексан = 1:2:3). ИК спектр, ν, cм-1: 652 (C-S),
774, 865, 925, 1099 (C-N), 1119, 1225, 1270, 1418,
745 (C-S-C), 841, 902, 1074 (C-N), 1100, 1164 (C-N),
1447 (CH2), 1670, 2852 (CH2), 2928 (CH2). Масс-
1234, 1261, 1317, 1377 (CH3), 1457 (CH3), 1680,
спектр (MALDI TOF/TOF), m/z (Iотн, %): 218.403
2856 (CH2), 2927 (CH2). Спектр ЯМР 1Н (400 МГц),
(100) [M + H]+. Mасс-спектр, m/z (Iотн, %): 217 (57)
δ, м. д. (J, Гц): 0.91 т (3H, CH3, 3J = 7.2), 1.31
[M]+, 184 (34) [M - HS]+, 156 (27) [M - CH2SCH3]+,
секстет (2H, CH2CH3, 3J = 7.2), 1.39-1.51 м [4Н,
124
(91)
[M - H(SCH2)2]+,
82
(100)
[(CH2)5C]+.
CH2CH2CH3, (SCH2CH2)2CH2], 1.58 квинтет [4Н,
Данные ЯМР 1Н, 13С идентичны описанным в
(SCH2CH2)2CH2, 3J = 7.2), 2.53 т [4Н, (SCH2CH2)2CH2),
работе [20].
3J = 7.2), 2.61 т (2Н, NCH2CH2, 3J = 7.2), 3.98 с (4Н,
NCH2S). Спектр ЯМР 13C (100 МГц), δC, м. д.: 14.0
6-Бутил-1,11-диокса-4,8-дитиа-6-азациклотри-
(CH3), 20.4 (CH2CH3), 28.2 [(SCH2CH2)2CH2], 29.7
декан (7). Выход 0.21 г (75%), бесцветное масло, Rf
(CH2CH2CH3),
29.8
[(SCH2CH2)2CH2],
31.8
0.90 (ацетон:гексан = 1:1). ИК спектр, ν, cм-1: 647
[(SCH2CH2)2CH2], 51.4 (NCH2CH2), 56.9 (NCH2S).
(C-S), 732 (C-S-C), 843, 888, 1032 (C-N), 1196 (C-N),
Спектр ЯМР 15N, N, м. д.: 333.9 уш. c [1N, N(CH2)2].
1242 (C-O-C), 1270 (C-O-C), 1321 (CH2), 1350,
Mасс-спектр, m/z (Iотн, %): 233 (10) [M]+, 114 (14)
1457 (CH3), 1676, 2861 (CH2), 2926 (CH2). Спектр
[С(CH2)2NCH2SCH2]+, 96 (100) [CH3(CH2)3N(СH)C]+,
ЯМР 1Н (400 МГц), δ, м. д. (J, Гц): 0.81 т (3H, CH3),
71 (12) [CH3(CH2)3N]+, 57 (24) [CH3(CH2)3]+. Найдено,
1.21 секстет (2H, CH2CH3, 3J = 6.0), 1.40 квинтет
%: C 56.78; H 9.77; N 6.07.C11H23NS2. Вычислено,
(2Н, CH2CH2CH3, 3J = 7.2), 2.54 т (2Н, NCH2CH2,
%: C 56.60; H 9.93; N 6.00; S 27.47.
3J = 7.2), 2.63 т (4Н, SСH2СH2О, 3J = 5.6), 3.51 с
(4Н, SСH2СH2О), 3.52 с [4Н, О(СH2)2О], 3.95 с (4Н,
3-Бутил-1,5-дитиа-3-азациклоундекан
(4д).
NCH2S). Спектр ЯМР 13C (100 МГц), δC, м. д.: 13.9
Выход 0.13 г (52%), бесцветное масло, Rf 0.93
(CH3),
20.3 (CH2CH3),
29.5 (CH2CH2CH3),
30.9
(ацетон:этилацетат:гексан = 1:2:4). ИК спектр, ν, cм-1:
(SCH2CH2О), 51.1 (NCH2CH2), 57.3 (NCH2S), 70.2
651 (C-S), 733 (C-S-C), 753, 841, 902, 1073 (C-N),
(ОCH2CH2О), 71.3 (SCH2CH2О). Спектр ЯМР 15N, N,
1100, 1161 (C-N), 1258, 1318, 1377 (CH3), 1458
м. д.: 333.9 уш. c [1N, СH2N(CH2)2]. Масс-спектр
(CH3), 1680, 2854 (CH2), 2926 (CH2). Спектр ЯМР
(MALDI TOF/TOF), m/z (Iотн, %): 280.454 [M + H]+.
1Н (400 МГц), δ, м. д. (J, Гц): 0.89 т (3H, CH3, 3J =
Масс-спектр (ESI), m/z (Iотн, %): 280 (100) [M + H]+.
7.2), 1.25-1.34 м (2H, CH2CH3), 1.35-1.38 м [4Н,
Найдено, %: C 51.70; H 9.11; N 4.95. C12H25NО2S2.
(SCH2CH2CH2)2], 1.40--1.44 м (2Н, CH2CH2CH3),
Вычислено, %: C 51.57; H 9.02; N 5.01; S 22.95.
1.54-1.57 м
[4Н, (SCH2CH2CH2)2],
2.51 т
[4Н,
(SCH2CH2CH2)2, 3J = 7.2], 2.60 т (2Н, NCH2CH2, 3J =
Общая методика гетероциклизации амино-
7.2),
3.97 с
(4Н, NCH2S). Спектр ЯМР
13C
производных метилового эфира малеопима-
(100 МГц), δC, м. д.: 14.0 (CH3), 20.3 (CH2CH3),
ровой кислоты с формальдегидом и карбо-
28.5 (SCH2CH2CH2),
29.6 (CH2CH2CH3),
30.1
цепными α,ω-дитиолами. Смесь 0.25 ммоль α,ω-
(SCH2CH2CH2),
31.9
(SCH2CH2CH2),
51.4
дитиола и 0.5 ммоль формалина (37%-ный раствор,
(NCH2CH2), 56.8 (NCH2S). Mасс-спектр, m/z (Iотн,
0.05 мл) в 4 мл хлороформа перемешивали при
%): 247 (2) [M]+, 131 (16) [СH3(CH2)3NCH2SCH2]+,
комнатной температуре (~ 20°С) в течение 30 мин,
116 (30) [NCH2S(CH2)4]+, 98 (30) [СH3(CH2)3N(CH)CH2]+,
затем по каплям добавляли 0.25 ммоль гидразида 8
87
(61)
[CH2NCH2SCH]+,
41
(93)
[NCH2CH]+.
или аминоимида
10 метилового эфира малео-
Найдено, %: C 58.46; H 10.28; N 5.61. C12H25NS2.
пимаровой кислоты, растворенного в смеси EtOH-
Вычислено, %: C 58.24; H 10.18; N 5.66; S 25.92.
CHCl3 (1:1). Смесь перемешивали в течение 25 ч
3-трет-Бутил-1,5,3-дитиазепан
(5).
Выход
при комнатной температуре
(~20°С), затем
0.14 г (78%), бесцветное масло, Rf 0.92 (гексан:
упаривали на роторном испарителе. Остаток
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
36
ХАБИБУЛЛИНА и др.
хроматографировали. Соединение 11 промывали
32.53 (C15), 35.11 (C12), 35.34 (C7), 36.68 (C3), 37.72
горячей водой.
(C1), 38.06 (C10), 40.86 (C8), 43.36 (C21), 47.15 (C4),
49.48 (C5), 50.39 (C25), 51.03 (C22), 54.56 (C9), 65.98
Метил-12-изопропил-6,9а-диметил-2-[1',5',3'-
(C2',4'), 124.47 (C14), 146.87 (C13), 175.91 (C24), 177.21
дитиазепан-3'-ил]-1,3-диоксогексадекагидро-3b,11-
(C23), 179.28 (C18). Масс-спектр (MALDI TOF/TOF),
этенонафто[2,1-e]изоиндол-6-карбоксилат
(9a).
m/z: 546.981 [M - (CH2)2]+. Найдено, %: C 64.59; H
Выход 0.12 г (86%), бесцветные кристаллы, т. пл.
19
8.17; N 4.93. C31H46N2О4S2. Вычислено, %: C 64.77;
215-218°С, [α]
-45.5 (c = 0.088, CHCl3), Rf 0.58
H 8.07; N 4.87; S 11.16.
(этилацетат:циклогексан = 1:1). ИК спектр, ν, см-1:
747 (C-S-C), 1076 (C-N), 1140, 1193, 1366 (CH3),
Метил-2-(2-аминоэтил)-12-изопропил-6,9a-ди-
1709 (C=O), 2867 (CH3), 2922 (CH2), 2949 (CH2),
метил-1,3-диоксогексадекагидро-3b,11-этенонафто-
3012 (=CH). Спектр ЯМР 1Н (500 МГц), δ, м. д. (J,
[2,1-e]изоиндол-6-карбоксилат (10). К раствору
Гц): 0.58 с (3H, CH320), 0.93 м (1H, CH21ax), 0.97 д
0.43 г (1 ммоль) метилового эфира малеопимаровой
(3H, CH316, J = 8.0), 0.99 д (3H, CH317, J = 8.0), 1.14
кислоты [21] в 15 мл метилового спирта добавляли
с (3H, CH319), 1.17-1.76 м (12H, CH21eq,2,3,6,7ax,11,
0.07 г (1.2 ммоль) этилендиамина. Реакционную
СН5,9), 2.19-2.22 м (1H, CH15), 2.38 д (1H, СН21, J =
смесь кипятили 2 ч, затем выливали в 50 мл воды.
8.5), 2.49 д. т (1H, CH27eq, J = 3.0, 8.0), 2.75 д. д (1H,
Осадок отфильтровывали, промывали водой до
СH22, J = 3.0, 5.5), 2.96 с (4H, CH26',7'), 3.06 с (1H,
нейтральной реакции и сушили на воздухе. Выход
CH12), 3.67 с (3H, CH325), 4.47 д (2H, CHaНb2',4', 2J =
0.44 г (96%), т. пл. 130-132oC. ИК спектр, ν, см-1:
13.8), 4.56 д (2H, CHaНb2',4', 2J = 13.8), 5.43 с (1H,
740, 1076 (C-N), 1140, 1193, 1366 (CH3),
1709
CH14). Спектр ЯМР 13C (125 МГц), δC, м. д.: 15.67
(C=O), 2867 (CH3), 2922 (CH2), 2949 (CH2), 3012
(C20), 16.74 (C19), 17.02 (C2), 19.90 (C16), 20.71 (C17),
(=CH), 3350 (NH2). Спектр ЯМР 1Н (500 МГц), δ, м. д.
21.73 (C6), 27.43 (C11), 32.63 (C15), 35.09 (C12), 35.90
(J, Гц): 0.47 с (3H, CH320), 0.79 м (1H, CH21ax), 0.84 д
(C7), 36.72 (C3), 37.74 (C10), 37.90 (C6',7'), 38.04 (C1),
(3H, CH316, J = 6.8), 0.92 д (3H, CH317, J = 7.0), 1.03
40.98 (C8), 42.96 (C21), 47.11 (C4), 49.48 (C5), 50.26
с (3H, CH319), 1.09-1.69 м (12H, CH21eq,2,3,6,7ax,11,
(C25), 51.99 (C22), 54.19 (C9), 58.30 (C2',4'),
124.28
СН5,9), 2.05-2.07 м (1H, CH15), 2.32 д (1H, СН21, J =
(C14), 147.20 (C13), 174.90 (C24), 176.04 (C23), 179.16
8.5), 2.37 д. т (1H, CH27eq, J = 3.0, 14.0), 2.65 д. д
(C18). Спектр ЯМР 15N (50.69 МГц), δN, м. д.: 296.5
(1H, СH22, J = 3.0, 8.5), 2.94 с (1H, CH12), 3.29 уш. с
уш. с (1N, N3'), 165.5 уш. с (1N, N2). Масс-спектр
(2Н, CH2), 3.55 с (3H, CH325), 3.56 уш. с (2Н, CH2),
(MALDI TOF/TOF), m/z (Iотн, %): 569.433 (100) [M +
5.29 с (1H, CH14), 6.67 уш. с (2Н, NH2). Спектр
Na]+, 585.401 (26) [M + K]+. Найдено, %: C 63.86; H
ЯМР 13C (125 МГц), δC, м. д.: 15.57 (C20), 16.66
7.68; N 5.05. C29H42N2О4S2. Вычислено, %: C 63.70;
(C19), 16.95 (C2), 19.85 (C16), 20.59 (C17), 21.67 (C6),
H 7.74; N 5.12; S 11.73.
27.43 (C11), 32.53 (C15), 35.16 (C12), 35.57 (C7), 36.61
(C3), 37.58 (C1), 38.03 (C10), 39.99 (C8), 40.62 (C21),
Метил-12-изопропил-6,9а-диметил-2-[1',5',3'-
41.49 (СН2), 44.87 (СН2), 47.00 (C4), 49.41 (C5),
дитиазонан-3'-ил]-1,3-диоксогексадекагидро-
51.84 (C25), 52.20 (C22), 54.13 (C9), 124.20 (C14),
3b,11-этенонафто[2,1-e]изоиндол-6-карбоксилат
147.06 (C13), 177.47 (C24), 178.59 (C23), 179.98 (C18).
(9б). Выход 0.10 г (67%), бесцветное масло, Rf 0.78
Масс-спектр (MALDI TOF/TOF), m/z (Iотн,
%):
(изопропанол:циклогексан = 1:2). ИК спектр, ν, см-1:
457.507 (100) [M + H]+, 497.535 (50) [M + K]+.
756 (C-S-C), 813 (C-C), 912 (C-H), 1020, 1103
Найдено, %: C 70.80; Н 8.69; N 6.00. C27H40N2O4.
(C-N), 1140, 1192, 1297 (CH2), 1370 (CH3), 1455
Вычислено, %: C 71.02; H 8.83; N 6.13.
(CH2), 1714 (C=O), 2866 (CH3), 2927 (CH2). Спектр
ЯМР 1Н (500 МГц), δ, м. д. (J, Гц): 0.58 с (3H,
Метил-12-изопропил-6,9a-диметил-2-[2-(1,5,3-
CH320), 0.93 м (1H, CH21ax), 0.99 д (3H, CH316, J =
дитиазепан-3-ил)этил]-1,3-диоксогексадекагидро-
8.0), 1.00 д (3H, CH317, J = 8.0), 1.14 с (3H, CH319),
3b,11-этенонафто[2,1-e]изоиндол-6-карбоксилат
1.25-1.78 м (16H, CH21eq,2,3,6,7ax,11,7',8', СН5,9), 2.19-
(11). Выход 0.27 г (47%), белый порошок, т. пл. 109-
2.22 м (1H, CH15), 2.48 д (1H, СН21, J = 8.5), 2.52 д. т
111°С. ИК спектр, ν, см-1: 755 (C-S-C), 815 (C-C),
(1H, CH27eq, J = 3.0, 8.0), 2.65-2.72 м (4H, CH26',9'),
1027, 1105 (C-N), 1140, 1182, 1244, 1401,
1695
2.76 д. д (1H, СH22, J = 3.0, 5.5); 3.05 с (1H, CH12),
(C=O), 2866 (CH3), 2926 (CH2). Спектр ЯМР 1Н
3.66 с (3H, CH325), 4.72 с (4H, CH22',4'), 5.43 с (1H,
(500 МГц), δ, м. д. (J, Гц): 0.59 с (3H, CH320), 0.91 м
CH14). Спектр ЯМР 13C (125 МГц), δC, м. д.: 15.72
(1H, CH21ax), 0.93 д (3H, CH316, J = 8.0), 0.96 д (3H,
(C20), 16.74 (C19), 17.02 (C2), 19.90 (C16), 20.59 (C17),
CH317, J = 6.8), 1.15 с (3H, CH319), 1.21-1.74 м (12H,
21.76 (C6), 27.63 (C11), 29.80 (C7',8'), 30.14 (C6',9'),
CH21eq,2,3,6,7ax,11, СН5,9), 2.16-2.19 м (1Н, СН15), 2.43-
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
СИНТЕЗ N-ЗАМЕЩЕННЫХ ТИАЗАЦИКЛОАЛКАНОВ
37
2.48 м (3Н, CH27eq, СН21,22), 2.81 с (1H, CH12), 3.03 с
doi 10.1016/j.tet.2014.03.053
5. Хабибуллина Г.Р., Ахметова В.Р., Федотова Е.С.,
(4H, CH26',7'), 3.42-3.47 м (2Н, СН227), 3.67 с (3H,
Нигматуллин В.Р., Нигматуллин Р.Г., Ибрагимов А.Г. //
CH325), 4.12 с (2Н, СН226), 4.78 c (4H, CH22',4'), 5.38 с
Нефтехимия 2016. T. 56. № 6. С. 662; Khabibullina
(1H, CH14). Спектр ЯМР 13C (125 МГц), δC, м. д.:
G.R., Akhmetova V.R., Fedotova E.S., Nigmatullin V.R.,
15.64 (C20), 16.75 (C19), 17.04 (C2), 20.08 (C16), 20.68
Nigmatullin R.G., Ibragimov A.G. // Petroleum Chem.
(C17), 21.77 (C6), 27.58 (C11), 32.63 (C15), 35.27 (C12),
2016. Vol.
56. N
9.
P.
879. doi
10.1134/
35.48 (C7), 35.54 (C3), 35.79 (C6',7'), 36.71 (C1), 37.68
S0965544116090085
(С10), 37.78 (C8), 40.69 (C21), 45.03 (С27), 47.16 (C26),
6. El-Sherief H.A., Hozein Z.A., El-Mahdy F.M., Sarhan A.A. //
48.01 (C4), 49.53 (C5), 52.00 (C25), 52.37 (C22), 54.19
J. Heterocycl. Chem. 2010. Vol. 47. P. 1294. doi
10.1002/jhet.471
(C9), 59.38 (C2',4'), 124.37 (C14), 148.99 (C13), 177.48
7. El Bialy S.A.A., Abdelal A.M., El-Shorbagi A.-N.,
(C24), 178.66 (C23), 179.33 (C18). Спектр ЯМР 15N,
Kheira S.M.M. // Arch. Pharm. Chem. Life Sci. 2005.
δN, м. д.: 329.9 уш. c (1N, N3’CH2CH2). Масс-спектр
Vol. 338. P. 38. doi 10.1002/ardp.200400906
(MALDI TOF/TOF), m/z: 597.248 (100) [M + Na]+,
8. Ахметова В.Р., Анпилогова Г.Р., Хабибуллина Г.Р.,
613.202 (26) [M + K]+. Найдено, %: C 64.50; H 7.96;
Ахмадиев Н.С., Ибрагимов А.Г. // ЖПХ. 2014. T. 87.
N 5.00. C31H46N2О4S2. Вычислено, %: C 64.77; H
С. 595; Akhmetova V.R., Anpilogova G.R., Khabi-
8.07; N 4.87; S 11.16.
bullina G.R., Akhmadiev N.S., Ibragimov A.G. // Russ. J.
Appl. Chem. 2014. Vol. 87. P. 585. doi 10.1134/
ФОНДОВАЯ ПОДДЕРЖКА
S1070427214050085
9. Tretyakova E.V., Smirnova I.E., Salimova E.V.,
Работа выполнена при финансовой поддержке
Президента РФ (грант НШ-5240.2018.3) и
Р. 6543. doi 10.1016/j.bmc.2015.09.006
Российского фонда фундаментальных исследований
10. Delevallee F., Deraedt R., Benzoni J. Pat. FR
(проект № 17-43-020021 р_а) в рамках проектной
2586349A1 (1987).
части государственного задания (АААА-А17-
11. Taylor J.B., Ramm P.J., Fried F. Pat. US 3998823А
117012610060-7, АААА-А17-117012610057-7) с
(1976).
использованием оборудования Центра коллективного
12. Свикле Д.Я., Калниньш А.Я., Карклинь Р.Я., Прусе Б.А.,
пользования «Агидель» Института нефтехимии и
Прикуле А.Я., Румба А.А., Расиня Р.А., Швинска Д.Ф.,
катализа РАН.
Баумане Г.К., Кулькевиц А.Я. Пат. SU 584722A1
(1994).
КОНФЛИКТ ИНТЕРЕСОВ
13. Казакова О.Б., Третьякова Е.В., Куковинец О.С.,
Толстиков Г.А., Назыров Т.И., Чудов И.В.,
Авторы заявляют об отсутствии конфликта
Исмагилова А.Ф. // Биоорг. хим. 2010. Т. 36. С. 832;
интересов.
Kazakova O.B., Tret’yakova E.V., Kukovinets O.S.,
Tolstikov G.A., Nazyrov T.I., Chudov I.V., Ismagilo-
СПИСОК ЛИТЕРАТУРЫ
va A.F. // Russ. J. Bioorg. Chem. 2010. Vol. 36. P. 762.
1. Хабибуллина Г.Р., Федотова Е.С., Мещерякова Е.С.,
doi 10.1134/S1068162010060130
Буслаева Т.М., Ахметова В.Р., Ибрагимов А.Г. //
14. Tretyakova E.V., Smirnova I.E., Kazakova O.B.,
ХГС. 2016. Т. 52. № 10. С. 840; Khabibullina G.R.,
Tolstikov G.A., Yavorskaya N.P., Golubeva I.S.,
Fedotova E.S., Meshcheryakova E.S., Buslaeva T.M.,
Pugacheva R.B., Apryshko G.N., Poroikov V.V.
//
Akhmetova V.R., Ibragimov A.G. // Chem. Heterocycl.
Bioorg. Med. Chem. 2014. Vol. 22. P. 6481. doi
Сompd. 2016. Vol. 52. N 10. P. 840. doi 1007/s10593-
10.1016/j.bmc.2014.09.030
016-1975-7
15. Wang J., Chen Y.P., Yao K., Wilbon P.A., Zhang W.,
2. Khabibullina G.R., Fedotova E.S., Akhmetova V.R.,
Ren L., Zhou J., Nagarkatti M., Wang Ch., Chu F.,
Mesheryakova E.S., Khalilov L.M., Ibragimov A.G. //
He X., Decho A. W., Tang Ch. // Chem. Commun. 2012.
Mol. Divers. 2016. Vol. 20. P. 557. doi .1007/s11030-
Vol. 48. P. 916. doi 10.1039/C1CC16432E
016-9656-0
16. Schuller W.H., Minor J.C., Block S.S., Lawrence R.V.
3. Хабибуллина Г.Р., Федотова Е.С., Абдуллин М.Ф.,
Pat. US 3636215А (1969).
Тюмкина Т.В., Ахметова В.Р., Ибрагимов А.Г. //
17. Третьякова Е.В., Салимова Е.В., Парфенова Л.В. //
ЖОрХ. 2017. Т. 53. Вып. 2. С. 277; Khabibullina G.R.,
Биоорг. хим. 2018. Т. 44. № 5. С. 554; Tret’yakova E.V.,
Fedotova Е.S., Abdullin М.F., Tyumkina Т.V.,
Salimova E.V., Parfenova L.V. // Russ. J. Bioorg. Chem.
Akhmetova V.R., Ibragimov A.G. // Russ. J. Org. Chem.
2018. Vol.
44. N
5.
Р.
547. doi
10.1134/
2017. Vol.
53. N
2.
P.
277. doi
10.1134/
S1068162018050175
S1070428017020233
18. Wang H., Wang H., Zhou G. // Polym Int. 2011. 60.
4. Khabibullina G.R., Akhmetova V.R., Abdullin M.F.,
Р. 557. doi 10.1002/pi.2978
Tyumkina T.V., Khalilov L.M., Ibragimov A.G.,
19. Rakhimova E.B., Efremova E.A., Bushmarinov I.S.,
Dzhemilev U.M. // Tetrahedron. 2014. Vol. 70. P. 3502.
Goloveshkin A.S., Khalilov L.M., Ibragimov A.G.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
38
ХАБИБУЛЛИНА и др.
Dzhemilev U.M. // Tetrahedron Lett. 2012. Vol. 53.
Ismagilov R.A., Khalilov L.M., Zainullin R.A.,
P. 4225. doi 10.1016/j.tetlet.2012.05.161
Ibragimov A.G., Dzhemilev U.M. // Russ. J. Org. Chem.
20. Рахимова Е.Б., Исмагилов Р.И., Халилов Л.М.,
2015. Vol. 51. P. 951. doi 10.1134/S1070428015070118
Зайнуллин Р.А. Ибрагимов А.Г., Джемилев У.М. //
21. Zalkow L.H., Ford R.A., Kutney J.P. // J. Org. Chem.
ЖОрХ. 2015. Т. 51. Вып. 7. С. 971; Rakhimova E.B.,
1962. Vol. 27. P. 353. doi 10.1021/jo01057a031
Synthesis of N-Substituted Thiazacycloalkanes
by Cyclothiomethylation of Primary Aliphatic Amines
and Amino Derivatives of Maleopimaric Acid
G. R. Khabibullina*, E. S. Fedotova, E. V. Tretyakova, T. V. Tyumkina,
L. V. Parfenova, and A. G. Ibragimov
Institute of Petrochemistry and Catalysis, Russian Academy of Sciences, ul. Oktyabrya 141, Ufa, 450075 Russia
*e-mail: ink@anrb.ru
Received May 24, 2018
Revised May 24, 2018
Accepted June 4, 2018
Three-component cyclocondensation of primary aliphatic amines and amino derivatives of maleopimaric acid
methyl ester with formaldehyde and carbochain (1,2-ethane-, 1,3-propane-, 1,4-butane-, 1,5-pentane-, 1,6-hexane-
dithiols) α,ω-dithiols or 3,6-dioxa-1,8-octanedithiol produced N-substituted thiazacycloalkanes.
Keywords: three-component cyclocondensation, maleopimaric acid, α,ω-dithiols, cyclothiomethylation,
(oxa)thiazacycloalkanes
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019