ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 1, с. 39-44
УДК 547.789.6;547.792.9
СИНТЕЗ НОВЫХ ПРОИЗВОДНЫХ
ТИАЗОЛО[3,2-b][1,2,4]ТРИАЗОЛА И ПРЕДВАРИТЕЛЬНАЯ
ОЦЕНКА ИХ БИОЛОГИЧЕСКИХ СВОЙСТВ
© 2019 г. А. П. Енгоянa, b, *, В. А. Пивазянb, Э. А. Казарянb, Р. С. Акопянb
a Росийско-Армянский университет, ул. О. Эмина 123, Ереван, 0051 Армения
*e-mail: ayengoyan@mail.ru
bЛаборатория синтеза пестицидов и защиты растений,
Национальный аграрный университет Армении, Ереван, Армения
Поступило в Редакцию 5 июля 2018 г.
После доработки 5 июля 2018 г.
Принято к печати 13 июля 2018 г.
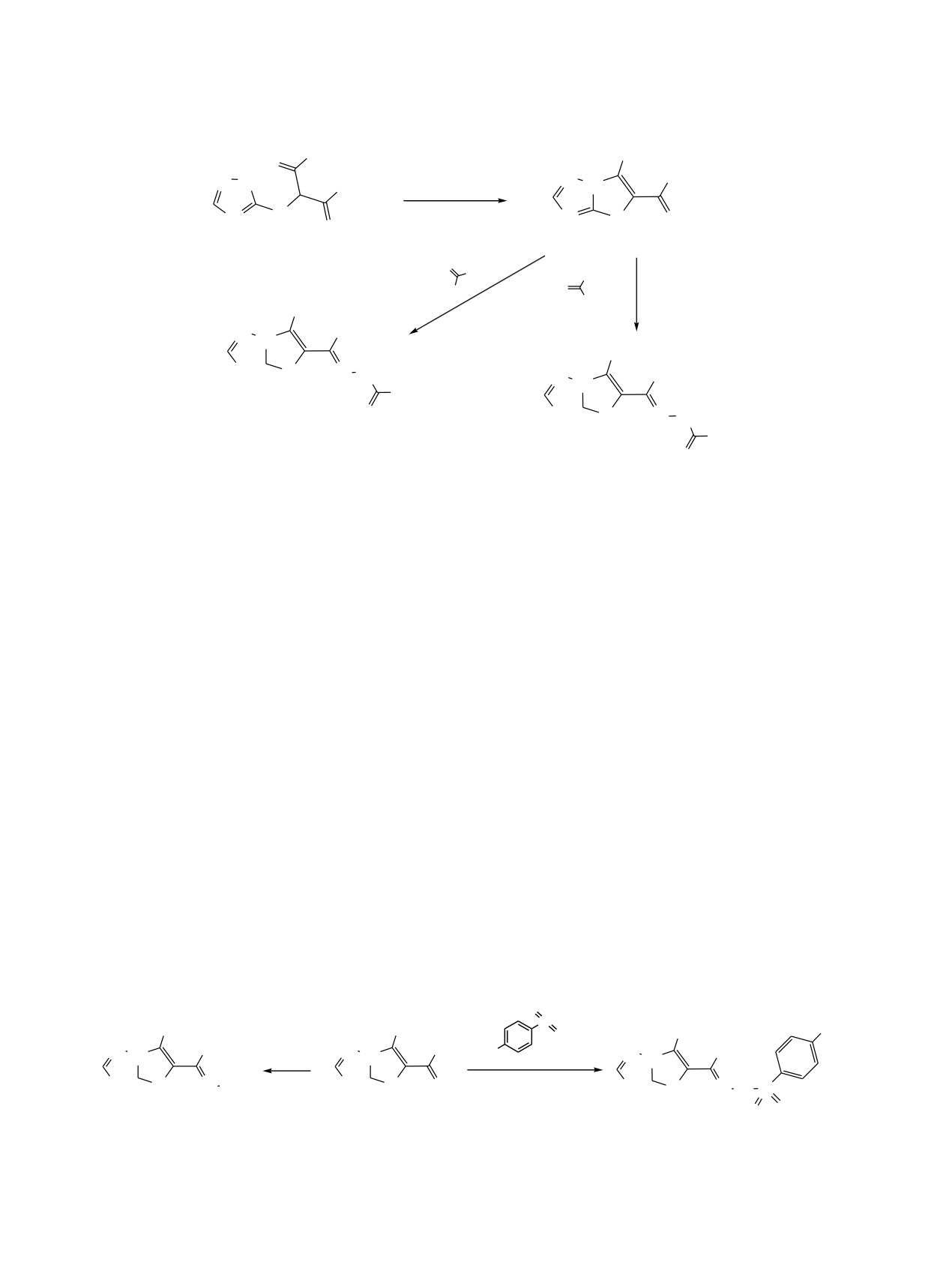
Гетероциклизацией
3-[(1H-1,2,4-триазол-3-ил)тио]пентан-2,4-диона синтезирован
1-(6-метилтиазоло-
[3,2-b][1,2,4]триазол-5-ил)этан-1-он, взаимодействием которого с гидроксиламином, гидразинкарбоксамидом,
гидразинкарботиоамидом, гидразингидратом и пара-толуолсульфогидразидом получены
соответствующие производные. Реакции оксима 1-(6-метилтиазоло[3,2-b][1,2,4]триазол-5-ил)этан-1-она с
алкилгалогенидами и фенилизоцианатом приводит к образованию соответствующих О-алкил- и
О-фенилкарбамоилпроизводных. Исследована росторегулирующая активность полученных соединений.
Ключевые слова: тиазоло[3,2-b][1,2,4]триазолы, оксим 1-(6-метилтиазоло[3,2-b][1,2,4]триазол-5-ил)этан-
1-она, гетероциклизация, росторегулирующая активность
DOI: 10.1134/S0044460X19010062
Производные таких азот- и серосодержащих
и противовирусной активностью [5]. Некоторые из
пятичленных гетероциклов, как 1,3-тиазол и 1,2,4-
полученных производных на основе 2-замещенных
триазол, обладают широким спектром биологи-
1-(6-метилтиазоло[3,2-b][1,2,4]триазол-5-ил)этан-1-
ческой активности. Большое число лекарственных
онов проявили противовирусную и антимико-
препаратов содержат в своей структуре 2-амино-
бактериальную активность [6, 7]. Оригинальный
тиазольный и аминотиазол-2-тионный фрагменты
одностадийный метод синтеза 5,6-дизамещенных
[1]. В последние годы большое внимание уделяется
тиазоло[3,2-b][1,2,4]триазолов на основе реакции
синтезу конденсированных систем на основе
ненасыщенных кетонов с бис(1H-1,2,4-триазолил)-
тиазола и
1,2,4-триазола. Так, бициклические
сульфоксидом предложен в работе [8]. Взаимо-
тиазолотриазолы были синтезированы реакцией
действием
5-арил-2,4-дигидро-3H-1,2,4-триазол-3-
5-фенил-2,4-дигидро-3H-1,2,4-триазол-3-тиона
с
тионов с
2-бром-1-фенилэтан-1-оном с после-
соединениями, содержащими цианометиленовую
дующей циклизацией полученных 1-фенил-2-[(3-
группу
[2]. Сходные по строению
2,6-диарил-
арил-1H-1,2,4-триазол-5-ил)тио]этан-1-онов получены
тиазоло[3,2-b][1,2,4]триазолы были получены
2-арил-6-фенилтиазоло[3,2-b][1,2,4]триазолы
[9].
взаимодействием
3-арил-1H-1,2,4-триазол-5-тиола
Аналогичный подход был применен для получения
с 2,2-дибром-1-арилэтан-1-оном [3]. Синтез 6-арил-
нафтиридинилзамещенных тиазолотриазолов под
тиазоло[3,2-b][1,2,4]триазолов реакцией 1H-1,2,4-
действием микроволнового облучения [10].
триазол-5-тиола с 2-бром-1-арилэтан-1-она пред-
ставлен в работе
[4]. Одно из полученных
Среди синтезированных соединений были обна-
соединений - 6-(4-пропоксифенил)тиазоло[3,2-b]-
ружены вещества с антимикробной
[3], анти-
[1,2,4]триазол - проявил более высокую актив-
бактериальной
[6,
9], противосудорожной
[4],
ность, чем карбамазепин. На основе тио-
противовирусной
[10] и противовоспалительной
эфиров
1,2,4-триазола получены полигетеро-
[11] активностью. Некоторые соединения проявили
циклические соединения с противовоспалительной
себя в качестве ингибиторов агрегации
39
40
ЕНГОЯН и др.
Схема 1.
CH3
CH3
O
CH3
N
NH
CH
N N
3
толуол, pTSA
S
125130°C
N
N
S
O
O
1
O
NH2
NH
2
S
H2NHN
NHNH2
CH3
N
CH3
N
CH3
N S
N
NH
CH3
N N
NH2
2
O
N S
N NH
NH2
3
S
тромбоцитов [12] и оказались близки по действию
зинкарботиоамидом синтезированы 2-{1-(6-метил-
к некоторым известным ингибиторам COX-2 [8].
тиазоло[3,2-b][1,2,4]триазол-5-ил)этилиден}гидразин-
1-карбоксамид 2 и его соответствующий тиоаналог 3.
Учитывая тот факт, что
1,3-тиазол и
1,2,4-
триазол являются базовыми гетероциклами
Взаимодействие кетона 1 с гидразингидратом и
большого числа пестицидов и регуляторов роста
пара-толуолсульфонилгидразидом приводит к
растений, а также возрастающий интерес к их
образованию
5-(1-гидразоноэтил)-6-метилтиазоло
конденсированным бициклическим производным,
[3,2-b][1,2,4]триазола 4 и 4-метил-N'-{1-(6-метил-
в настоящей работе представлены эффективные
тиазоло[3,2-b][1,2,4]триазол-5-ил)этилиден}бензол-
методы синтеза производных конденсированных
сульфоногидразида 5 соответственно (схема 2).
бициклических тиазолотриазолов и проведена
Взаимодействие соединения
1 с гидроксил-
предварительная оценка их биологической
амином приводит к образованию оксима
1-(6-
активности в плане поиска новых химических
метилтиазоло[3,2-b][1,2,4]триазол-5-ил)этан-1-она
средств защиты и регуляторов роста растений.
6 (схема 3). Нагреванием последнего с алкил-
Исходный
1-(6-метилтиазоло[3,2-b][1,2,4]три-
галогенидами в ДМФА в присутствии KОН
азол-5-ил)этан-1-он 1 был синтезирован гетеро-
синтезированы алкилзамещенные оксимы 7а, б.
циклизацией полученного ранее
3-[(1H-1,2,4-
При взаимодействии оксима 6 с фенилизоцианатом
триазол-3-ил)тио]пентан-2,4-диона
[13] при
при нагревании в толуоле в присутствии катали-
нагревании 125-130°С в толуоле в течение 8-10 ч в
тических количеств пиридина образуется О-фенил-
присутствии пара-толуолсульфокислоты (pTSA).
карбамоилоксим 8 (схема 3). В молекулах оксима 6
Дальнейшие превращения полученного кетона 1
и его О-замещенных производных 7, 8 возможна
приводят к новым производным конденсированной
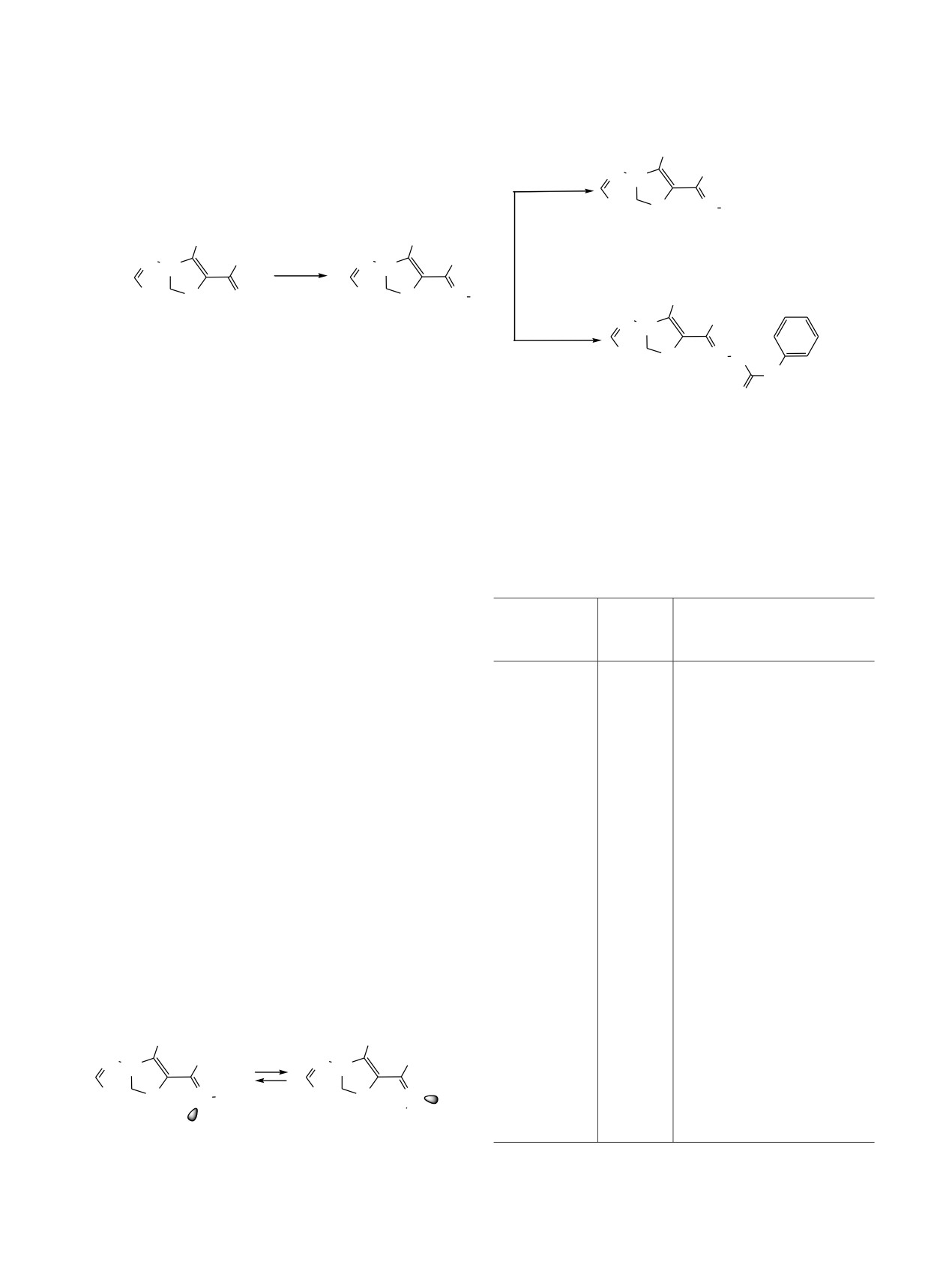
E/Z-изомеризация при двойной связи C=N (схема 4).
бициклической системы (схема 1). Так, реакцией
Действительно, в спектрах ЯМР 1Н и 13C этих
соединения 1 с гидразинкарбоксамидом и гидра-
соединений наблюдаются два набора сигналов,
Схема 2.
O NHNH2
S
CH3
CH3
CH3
CH3
O
N
CH3
CH3
H3C
CH3
N
4
N2H
N N
N N
H
N S N
NH2
N S O
N S N
N S
4
1
O O
5
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
СИНТЕЗ НОВЫХ ПРОИЗВОДНЫХ ТИАЗОЛО[3,2-b][1,2,4]ТРИАЗОЛА
41
Схема 3.
CH3
N
CH3
RHlg
N
N S
N
OR
7a, б
CH3
CH3
CH3
N
CH3
N N
NH2OH
N
N S
O
N S
N
OH
CH3
1
6
N
CH3
C6H5N=C=O
N
N S
N
O
NH
O
8
R = C3H7 (a), CH2CH
2OC6H5 (б).
соответствующих E- и Z-изомерам, в соотношении
триазол-5-ил)этан-1-она путем гетероциклизации
1:(3-4).
3-{(1Н-1,2,4-триазол-3-ил)тио}пентан-2,4-диона. В
результате его превращений был получен ряд
Для изучения гербицидных, фунгицидных и
производных, которые при предварительном
росторегулирующих свойств синтезированных
соединений были проведены лабораторно-
Ростостимулирующая активность соединений 1-8
вегетационные исследования. Оксим
6 и его
производные
7a и
7б проявили умеренную
Ростостимулирующая
гербицидную активность
(60-70%) при нормах
Соединение
с, мг/л
активность по сравнению
применения 3 кг/га. В то же время практически все
с гетероауксином, %
исследуемые соединения продемонстрировали
Гетероауксин
25
100
стимулирующее действие на рост растений.
50
100
Эксперименты проводили на семенах и саженцах
1
25
81.2
фасоли обыкновенной (Phaseolus vulgaris L.).
50
82.1
Изучали влияние водных суспензий соединений 1-
8 и раствора гетероауксина в качестве стандарта в
2
25
64.9
концентрациях 25 и 50 мг/л на жизнеспособность
50
65.7
семян, их прорастание и рост рассады. Активность
3
25
63.3
соединений колебалась в интервале 65-87% по
50
63.1
сравнению с гетероауксином (см. таблицу).
Вещества, проявившие в эксперименте наиболь-
4
25
60.6
шую активность (1, 5, 6 и 7a), были отобраны для
50
66.5
более глубокого изучения и дальнейших полевых
5
25
84.8
испытаний.
50
65.0
Таким образом, разработан простой и удобный
6
25
86.1
способ синтеза
1-(6-метилтиазоло[3,2-b][1,2,4]-
50
87.0
7a
25
74.7
Схема 4.
50
-
CH3
CH3
7b
25
65.7
CH3
CH3
N N
N N
50
66.1
8
25
69.1
N S
N OR
N S
N
50
60.7
RO
E
Z
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
42
ЕНГОЯН и др.
биологическом скрининге проявили стимули-
(3H, N=C-CH3), 7.41 уш. с и 8.32 уш. с (2H, NH2),
рующее действие на рост растений. Результаты
10.54 уш. с (1H, NH). Спектр ЯМР 13C, δС, м. д.:
исследования указывают на перспективность
12.49, 16.00, 125.87, 128.82, 142.95, 153.26, 155.70,
поиска новых стимуляторов роста растений в ряду
178.99. Найдено, %: C 37.66; H 3.77; N 33.27; S
конденсированных бициклических производных
25.03. C8H10N6S2. Вычислено, %: C 37.78; H 3.96; N
тиазолотриазола.
33.04; S 25.21.
5-(1-Гидразоноэтил)-6-метилтиазоло[3,2-b]-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
[1,2,4]триазол (4). Смесь соединения 1 (0.01 моль),
Спектры ЯМР 1H и 13C сняты на спектрометре
гидрохлорида гидразина (0.01 моль) и воды (10 мл)
ЯМР Varian Mercury-300
(300 и
75 MГц
перемешивали 3-4 ч при 80-90°C. Образовавшийся
соответственно) в ДМСО-d6. Ход реакций и
осадок отфильтровывали, промывали водой и
чистоту полученных соединений контролировали
сушили. Выход 88%, т. пл. 270-272°C. Спектр
методом ТСХ на пластинах Silufol UV-254, в
ЯМР 1H, δ, м. д.: 2.62 с (3H, 6-CH3), 2.88 уш. с (2H,
качестве элюента использовали смесь ацетон-
NH2), 2.92 с (3H, N=C-CH3), 8.18 с (1H, CH).
гексан (2:1). Температуры плавления определяли
Найдено, %: C 43.12; H 4.71; N 35.60; S 16.19. C7H9N5S.
капиллярным методом.
Вычислено, %: C 43.06; H 4.65; N 35.87; S 16.42.
1-(6-Метилтиазоло[3,2-b][1,2,4]триазол-5-ил)-
4-Метил-N'-{1-(6-метилтиазоло[3,2-b][1,2,4]-
этан-1-он
(1). Смесь 3-{(1H-1,2,4-триазол-5-ил)-
триазол-5-ил)этилиден}бензолсульфонилгидразид
тио}пентан-2,4-диона (0.01 моль) в 10 мл толуола и
(5). Смесь соединения
1
(0.01 моль) и пара-
каталитических количеств пара-толуолсульфо-
толуолсульфонилгидразида
(0.01 моль) в воде
кислоты кипятили в течение 10 ч. После удаления
(10 мл) перемешивали 1 ч при 60-70°C. Образо-
толуола остаток обрабатывали водой, отфиль-
вавшийся осадок отфильтровывали, промывали
тровывали и сушили. Выход 78%, т. пл. 138-140°C.
водой и сушили. Выход 90%, т. пл. 232-234°C.
Спектр ЯМР 1H, δ, м. д.: 2.61 с (3H, 6-CH3), 2.91 с
Спектр ЯМР 1H, δ, м. д.: 2.28 с (3H, CH3-толил),
(3H, COCH3), 8.18 с (1H, CH). Спектр ЯМР 13C, δС,
2.38 с (3H, 6-CH3), 2.63 с (3H, N=C-CH3), 7.39-7.74
м. д.: 12.56, 28.74, 126.60, 134.84, 154.57, 156.59,
м (4H, C6H4), 8.28 с (1H, CH), 10.78 с (1H, NH).
189.39. Найдено, %: C 46.28; H 3.79; N 23.30; S
Спектр ЯМР 13C, δС, м. д.: 12.24, 15.82, 20.77,
17.48. C7H7N3OS. Вычислено, %: C 46.40; H 3.89; N
125.43,
127.49,
128.71,
129.28,
135.63,
143.39,
23.19; S 17.69.
147.81, 153.23, 155.68. Найдено, %: C 48.03; H 4.27;
N 20.22; S 18.12. C14H15N5O2S2. Вычислено, %: C
2-{1-(6-Метилтиазоло[3,2-b][1,2,4]триазол-5-
48.12; H 4.33; N 20.04; S 18.35.
ил)этилиден}гидразин-1-карбоксамид (2). Смесь
гидрохлорида гидразинкарбоксамида (0.01 моль) и
Оксим 1-(6-метилтиазоло[3,2-b][1,2,4]триазол-
соединения 1 (0.01 моль) в воде (15 мл) пере-
5-ил)этан-1-она (6). К раствору NaOH (0.01 моль)
мешивали 4 ч при 100°C. Образовавшийся осадок
в воде (3 мл) при 0°C добавляли раствор гидро-
отфильтровывали и сушили. Выход 85%, т. пл. 274-
хлорида гидроксиламина (0.01 моль) в 5 мл воды,
275°C. Спектр ЯМР 1H, δ, м. д.: 2.31 с (3H, 6-CH3),
соединение 1 (0.01 моль) и этанол (5 мл). Смесь
2.71 с (3H, N=C-CH3), 7.62 уш. с и 8.27 уш. с (2H,
оставляли при 20°C на 24 ч, затем нагревали 2 ч
NH2), 9.09 уш. с (1H, NH). Спектр ЯМР 13C, δС, м.
при 50-60°C. После охлаждения осадок отфиль-
д.: 12.23, 15.20, 126.48, 127.04, 139.07, 152.97,
тровывали и сушили. Выход 91%, т. пл.178-180°C.
155.42, 156.21. Найдено, %: C 40.19; H 4.15; N
Спектр ЯМР 1H, δ, м. д. (Z:E = 3:1): 2.29 (Z) с и 2.31
35.45; S 13.60. C8H10N6OS. Вычислено, %: C 40.33;
(E) с (3H, 6-CH3), 2.65 (E) с и 2.71 (Z) с (3H, N=C-CH3),
H 4.23; N 35.27; S 13.46.
7.99 (Z) с и 8.01 (E) с (1H, CH), 11.50 (Z) с и 11.57
(E) с (1H, OH). Спектр ЯМР 13C, δС, м. д.: 12.09 (Z),
2-{1-(6-Метилтиазоло[3,2-b][1,2,4]триазол-5-ил)-
12.86 (Z), 12.99 (E), 21.08 (E), 116.69 (E), 123.99 (Z),
этилиден}гидразин-1-карботиоамид (3). К смеси
126.16 (Z), 127.65 (E), 142.22 (E), 147.20 (Z), 152.89
гидразинкарботиоамида (0.01 моль) и 36%-ного
(E), 154.76 (Z), 154.82 (Z), 155.04 (E). Найдено, %:
водного раствора HCl
(0.01 моль) прибавляли
C 42.74; H 4.02; N 28.22; S 16.08. C7H8N4OS.
соединение 1 (0.01 моль). Смесь перемешивали 4-
Вычислено, %: C 42.85; H 4.11; N 28.55; S 16.34.
5 ч при 100°C. Образовавшийся осадок отфиль-
тровывали и сушили. Выход 90%, т. пл. 267-268°C.
Синтез соединений 7a, б. Смесь KOH (0.01 моль)
Спектр ЯМР 1H, δ, м. д.: 2.43 с (3H, 6-CH3), 2.73 с
и соединения 6 в ДМФА (10 мл) перемешивали 2 ч
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
СИНТЕЗ НОВЫХ ПРОИЗВОДНЫХ ТИАЗОЛО[3,2-b][1,2,4]ТРИАЗОЛА
43
до полного образования соли, затем добавляли
155.47 (Z). Найдено, %: C 53.40; H 4.22; N 22.42; S
0.01 моля пропилбромида или 2-феноксиэтилбромида.
10.31. C14H13N5O2S. Вычислено, %: C 53.32; H 4.16;
Реакционную смесь оставляли на
24 ч при
N 22.21; S 10.17.
комнатной температуре, затем нагревали 2 ч при
ФОНДОВАЯ ПОДДЕРЖКА
60-70°C до достижения pH = 7. ДМФА удаляли,
остаток обрабатывали водой. Осадок отфиль-
Работа выполнена при поддержке Российско-
тровывали и сушили.
Армянского университета и Министерства
образования и науки Российской Федерации.
O-Пропилоксим 1-(6-метилтиазоло[3,2-b][1,2,4]-
триазол-5-ил)этан-1-она (7a). Выход 85%, т. пл.
КОНФЛИКТ ИНТЕРЕСОВ
48-50°C. Спектр ЯМР 1H, δ, м. д. (Z:E = 3:1): 0.98
Авторы заявляют об отсутствии конфликта
(Z) т и 0.99 (E) т (3H, CH3-пропил, J = 6.9 Гц), 1.73
интересов.
м (2H, CH2), 2.30 (Z) с и 2.33 (E) с (3H, 6-CH3), 2.67
(E) с и 2.72 (Z) с (3H, N=C-CH3), 4.09 (E) т и 4.12
СПИСОК ЛИТЕРАТУРЫ
(Z) т (2H, OCH2, J = 6.7 Гц), 8.01 (Z) с и 8.04 (E) с
1. Richards D., Coleman J., Reynolds J., Aronson J.
(1H, CH). Спектр ЯМР 13C, δС, м. д.: 9.89 (Z), 10.09
Oxford Handbook of Practical Drug Therapy. Oxford;
(E), 12.22 (Z), 13.03 (E), 13.62 (Z), 21.10 (E), 21.64
New York: Oxford University Press, 2011.
(E), 21.78 (Z), 75.41 (Z), 75.58 (E), 116.24 (E), 122.46
2. El-Sherief H.A.H., Hozien Z.A., El- Mahdy A.F.M.,
(Z), 127.09 (Z), 128.52 (E), 143.23 (E), 147.85 (Z),
Sarhan A.A.O. // Arkivoc. 2011. Vol. 10. P. 71. doi
153.01, 154.96 (Z), 155.27 (E). Найдено, %: C 50.52;
10.3998/ark.5550190.0012.a06
H 5.90; N 23.70; S 13.62. C10H14N4OS. Вычислено,
3. Purdeer R., Sushma, Sharma C., Aneja K.R. // Int. J.
%: C 50.40; H 5.92; N 23.51; S 13.46.
Adv. Res. Pharm. Biosci. 2013. Vol. 3. N 2. P. 102.
4. Deng X.-Q., Song M.-X., Gong G.-H., Wang S.-B.,
O-(2-Феноксиэтил)оксим
1-(6-метилтиазоло-
Quan Z.-S. // Iran. J. Pharm. Res. 2014. Vol. 13. N 2.
[3,2-b][1,2,4]триазол-5-ил)этан-1-она (7б). Выход
P. 459.
97%, т. пл. 70-72°C. Спектр ЯМР 1H, δ, м. д. (Z:E =
5. Zaharia V., Silvestru A., Palibroda N., Mogosan C. //
3.5:1): 2.32 (Z) с и 2.33 (E) с (3H, 6-CH3), 2.62 (E) с
Farmacia. 2011. Vol. 59. N 5. P. 624.
и 2.73 (Z) с (3H, N=C-CH3), 4.26 м (2H, NO-CH2),
6. Zahajska L., Klimesova V., Koci J., Waisser K.,
4.48 м (2H, C6H5OCH2), 6.85-7.26 м (5H, C6H5), 8.03
Kaustova J. // Arch. Pharm. 2004. Vol. 337. N 10.
(Z) с и 8.04 (E) с (1H, CH). Спектр ЯМР 13C, δС, м. д.:
P. 549. doi 10.1002/ardp.200400899
12.25 (Z), 12.97 (E), 13.91 (Z), 21.17 (E), 65.22 (E),
7. Abdel-Aal M.T., El-Sayed W.A., El-Kosy S.M., El-
65.43 (Z), 71.98 (E), 72.42 (Z), 113.98 (E), 114.02 (Z),
Ashry E.S.H. // Arch. Pharm. 2008. Vol. 341. N 5.
116.05, 120.16 (Z), 122.05 (E), 127.58 (E), 128.76 (Z),
P. 307. doi 10.1002/ardp.200700154
128.91, 144.36 (E), 149.12 (Z), 153.04, 155.04 (Z),
8. Katritzky A.R., Pastor A., Voronkov M., Steel P.J. //
155.23 (E), 157.97 (E), 158.08 (Z). Найдено, %: C
Org. Lett. 2000. Vol. 2. N 4. P. 429. doi 10.1021/
56.81; H 5.02; N 17.51; S 10.33. C15H16N4O2S.
ol990370w
Вычислено, %: C 56.94; H 5.10; N 17.71; S 10.14.
9. Barbuceanu S.F., Almajan G.L., Saramet I.L., Drag-
huci C.V., Tarcomnjcu A.L., Bancescu G. // Eur. J. Med.
O-(Фенилкарбамоил)оксим 1-(6-метилтиазоло-
Chem. 2009. Vol. 44. N 1. P. 4752. doi 10.1016/
[3,2-b][1,2,4]триазол-5-ил)этан-1-она
(8). Смесь
j.ejmech.2009.06.021
соединения
6
(0.01 моль), фенилизоцианата
10. Mogilaiah K., Prashanthi M., Kavitha S., Sharath
(0.01 моль), абсолютного толуола (15 мл) и катали-
Babu H. // J. Heterocycl. Chem. 2007. Vol. 44. N 5.
тических количеств пиридина кипятили
2 ч.
P. 1161. doi 10.1002/jhet.5570440530
Осадок отфильтровывали и перекристаллизо-
11. Uzgtren-Baran A., Tel B.C., Sarigol D., Ozturk E.İ.,
вывали из 50%-ного водного раствора этанола.
Kazkayasi İ., Okay G., Ertan M., Tozkoparan B. // Eur.
Выход 88%, т. пл. 202-204°C. Спектр ЯМР 1H, δ,
J. Med. Chem. 2012. Vol. 57. P. 398. doi 10.1016/
м. д. (Z:E = 4:1): 2.52 (Z) с и 2.53 (E) с (3H, 6-CH3),
j.ejmech.2012.07.009
2.63 (E) с и 2.83 (Z) с (3H, N=C-CH3), 6.96-7.58 м
12. Tozkoparan B., Akgün H., Ertan M., Rübsemann K. //
(5H, C6H5), 8.10 (Z) с и 8.14 (E) с (1H, CH), 9.47 (E)
Arch. Pharm. 1995. Vol. 328. N 2. P. 169. doi 10.1002/
с и 9.58 (Z) с (1H, NH). Спектр ЯМР 13C, δС, м. д.:
ardp.19953280215
12.67 (Z), 12.75 (E), 15.18, 115.41, 117.48, 118.50
13. Eliazyan K.A., Shahbazyan L.V., Pivazyan V.A.,
(Z), 121.23, 122.41 (Z), 128.02 (E), 128.12 (Z), 129.98
Ghazaryan E.A., Yengoyan A.P. // Heteroatom Chem.
(E), 138.06 (Z), 150.16 (E), 153.48 (E), 154.54 (E),
2009. Vol. 20. N 7. P. 405. doi 10.1002/hc.20565
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
44
ЕНГОЯН и др.
Synthesis of New Tiazolo[3,2-b][1,2,4]triazole Derivatives
and Preliminary Evaluation of Their Biological Activity
A. P. Engoyana,b, *, V. A. Pivazyanb, E. A. Kazaryanb, and R. S. Akopyanb
a Russian-Armenian University, ul. O. Emina 123, Yerevan, 0051 Armenia
* e-mail: ayengoyan@mail.ru
bPesticide Synthesis and Plant Protection Laboratory, National Agrarian University of Armenia, Yerevan, Armenia
Received July 5, 2018
Revised July 5, 2018
Accepted July 13, 2018
Heterocyclization of 3-[(1H-1,2,4-triazol-3-yl)thio]pentane-2,4-dione afforded 1-(6-methylthiazolo[3,2-b][1,2,4]-
triazol-5-yl)ethan-1-one, the reactions of which with hydroxylamine, hydrazincarboxamide, hydrazincarbo-
tioamide, hydrazine hydrate and para-toluenesulfonyl hydrazide resulted in the formation of the corresponding
derivatives. 1-(6-Methylthiazolo[3,2-b] [1,2,4]triazol-5-yl)ethan-1-one oxime reacted with alkyl halides and
phenyl isocyanate to produce the corresponding O-alkyl- and O-phenylcarbamoyl derivatives. The growth
regulating activity of the compounds obtained was studied.
Keywords: thiazolo[3,2-b][1,2,4]triazoles, 1-(6-methylthiazolo[3,2-b][1,2,4]triazol-5-yl)ethan-1one oxime, hetero-
cyclization, growth regulating activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019