ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 1, с. 45-50
УДК 661.725.814.2224:541.124
2-(ФУР-2-ИЛ)ТИАЗОЛО[4,5-f]ХИНОЛИН:
СИНТЕЗ И РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО
ЗАМЕЩЕНИЯ
© 2019 г. А. А. Александров*, М. М. Ельчанинов, Д. А. Заблоцкий
Южно-Российский государственный политехнический университет
(НПИ) имени М. И. Платова, пр. Просвещения 132, Новочеркасск, 346428 Россия
Поступило в Редакцию 21 июня 2018 г.
После доработки 21 июня 2018 г.
Принято к печати 28 июня 2018 г.
Конденсацией хинолин-5-амина с фуран-2-карбонилхлоридом в пропан-2-оле синтезирован N-(5-
хинолил)фуран-2-карбоксамид, обработка которого избытком P2S5 в безводном пиридине приводит к
соответствующему тиоамиду. Окислением последнего феррицианидом калия в щелочной среде
синтезирован 2-(фур-2-ил)тиазоло[4,5-f]хинолин и предложен механизм его образования. Изучены
реакции электрофильного замещения (нитрование, бромирование, формилирование, ацилирование)
полученного N-(5-хинолил)фуран-2-карбоксамида.
Ключевые слова: хинолин-5-амин, фуран-2-карбонилхлорид, феррицианид калия, 2-(фур-2-ил)тиазоло-
[4,5-f]хинолин, реакции электрофильного замещения
DOI: 10.1134/S0044460X19010074
Синтез и исследование спектральных характе-
циклические соединения такого типа представляют
ристик органических веществ, обладающих
интерес как потенциальные биологически активные
интенсивной флуоресценцией, является важным
вещества [1] и органические люминофоры [2].
направлением, цель которого - создание новых
Целью настоящей работы являлась разработка
лазерных красителей и зондов для биологических
или подбор удобного способа аннелирования
систем. Требования к флуоресцентным красителям
2-(фур-2-ил)тиазольного фрагмента к хинолину.
предусматривают, с одной стороны, наличие в
Для достижения этой цели мы применили метод
молекуле фрагмента
- флуорофора полицикли-
получения бензотиазолов по Якобсону
[3,
4],
ческого строения, обеспечивающего высокий
заключающийся в циклизации тиоамидов бензола в
квантовый выход флуоресценции, с другой
водных растворах щелочей в присутствии ферри-
стороны - присутствие в молекуле группировок,
цианида калия.
чувствительных к полярности или протоно-
донорной активности окружения. В литературе
Исходный N-(5-хинолил)фуран-2-карбоксамид 1
практически отсутствуют сведения о получении и
получен нами с выходом 74% при кипячении в
свойствах тиазоло[4,5-f]хинолина, содержащего
пропан-2-оле хинолин-5-амина с фуран-2-карбонил-
фурановый фрагмент. В то же время бисгетеро-
хлоридом. Нагревание соединения 1 с избытком
Схема 1.
H O
H S
N
N
P2S5
O
O
N
N
2
1
45
46
АЛЕКСАНДРОВ и др.
Схема 2.
H S
H
S
N
N
K3[Fe(CN)6]
O
O
N
KOH, e
N
2
А
S
O
O
N
N
OH
H2O
S
N
N
Б
3
пятисернистого фосфора в безводном пиридине
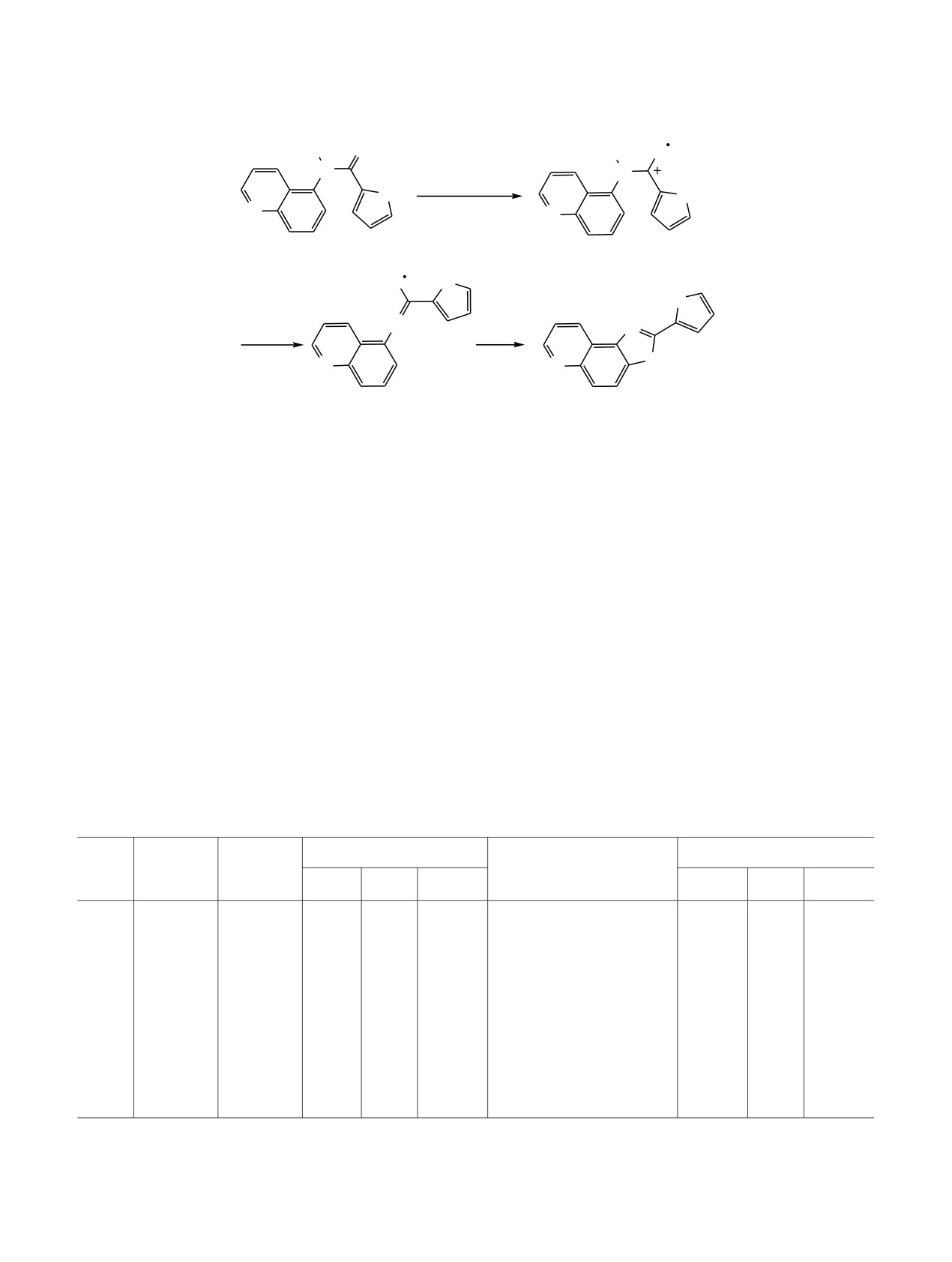
Калия феррицианид в щелочном растворе
позволяет обменять кислород карбонильной
действует как комплексный ион, отщепляющий
группы на серу с выходом соединения 2 ~57%
электрон и в результате такого окисления
(схема 1).
карботиоамида
2 образуется катион-радикал А,
который элиминируя протон превращается в S-
Окисление
N-(5-хинолил)фуран-2-карботио-
радикал Б, после чего следует замыкание тиазоль-
амида 2 в водном пропан-2-оле 20%-ным водным
ного кольца.
раствором K3[Fe(CN)6] приводит к образованию 2-
(фур-2-ил)тиазоло[4,5-f]хинолина 3 с выходом 34%
С целью изучения относительной реакционной
(табл.
1). В спектре ЯМP
1H полученного
способности
2-(фур-2-ил)тиазоло[4,5-f]хинолин
3
соединения сигналы протонов Н4 и Н5 хиноли-
подвергали действию электрофильных реагентов:
нового кольца зафиксированы в виде дублетов при
азотной кислоты, брома в дихлорэтане, уротропина
8.23 и 8.28 м. д. с характерными КССВ 9.0 Гц, что
говорит об 5,6-аннелировании 2-(2-фурил)тиазоль-
в полифосфорной кислоте, уксусного ангидрида,
ного фрагмента к хинолину (табл. 2). Вероятный
бензойной кислоты в полифосфорной кислоте
механизм этого превращения представлен на схеме 2.
(схема 3).
Таблица 1. Выходы, температуры плавления и данные элементного анализа соединений 1-8а
Найдено, %
Вычислено, %
Выход,
Т. пл.,
№
Формула
%
°С
С
Н
N
C
H
N
1
74
184-185
70.42
3.95
11.88
С14Н10N2O2
70.58
4.23
11.76
2
57
122-123
66.43
3.77
11.23
С14Н10N2ОS
66.12
3.96
11.02
3
34
98-99
66.83
3.46
11.34
С14Н8N2ОS
66.65
3.20
11.10
4
55
263-264
56.41
2.51
14.29
С14Н7N3O3S
56.56
2.37
14.13
5
61
205-206
50.55
1.79
8.51
С15Н8N2O2S
50.77
2.13
8.46
6
67
184-185
64.17
3.09
10.23
С15Н8N2O2S
64.27
2.88
9.99
7
23
173-174
65.53
3.17
9.79
С16Н10N2O2S
65.29
3.42
9.52
8
49
192-193
70.89
3.52
8.13
С21Н12N2O2S
70.77
3.39
7.86
а Результаты элементного анализа на содержание С, Н и N соответствуют вычисленным в пределах ±0.34%.
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
2-(ФУР-2-ИЛ)ТИАЗОЛО[4,5-f]ХИНОЛИН
47
Схема 3.
R
S
O
S
O
HNO3
N
N
N
N
Br2, DCE
4, 5
3
R
S
O
O
PhCO2H, (CH2)6N4
N
N
Ac2O_PPA
68
Ранее нами было показано, что влияние 2-бенза-
происходит резкое снижение ацидофобности гета-
зольного заместителя на гетероциклы пиррольного
рильных групп, что позволяет проводить реакции в
типа
характеризуется
общим снижением
более широком диапазоне условий, включая среды
электронной плотности в последних и ее пере-
высокой кислотности, повышенную температуру и
распределением в конденсированные с азолом
т.
д. Как и другие электроноакцепторы,
ароматические фрагменты [5, 6]. Одновременно
2-тиазольная группа способствует снижению
Таблица 2. Параметры ИК и ЯМР 1Н спектроскопии соединений 1-8
№
ν, см-1
δ, м. д. (J, Гц)
1
1680 с (С=О),
6.72-6.74 м (1Н, Н4, фуран), 7.43 д (1Н, Н3, фуран, J = 3.5), 7.51 д. д (1Н, Н3, хинолин, J =
3323 ш (NH)
4.2), 7.63 т (1Н, Н7, хинолин, J = 7.8), 7.68 д (1Н, Н6, хинолин, J = 7.6), 7.98 д (1Н, Н8,
хинолин, J = 7.5), 8.05 д (1Н, Н5, фуран, J = 2.4), 8.32 д (1Н, Н4, хинолин, J = 8.1), 8.79 д
(1Н, Н2, хинолин, J = 2.7), 10.47 с (1Н, NH)
2
1239 с (С=S),
6.71-6.74 м (1Н, Н4, фуран), 7.41 д (1Н, Н3, фуран, J = 3.7), 7.48 д. д (1Н, Н3, хинолин, J =
3345 ш (NН)
4.5), 7.66 т (1Н, Н7, хинолин, J = 7.6), 7.71 д (1Н, Н6, хинолин, J = 7.7), 7.95 д (1Н, Н8,
хинолин, J = 7.7), 8.01 д (1Н, Н5, фуран, J = 1.8), 8.27 д (1Н, Н4, хинолин, J = 8.0), 8.82 д
(1Н, Н2, хинолин, J = 2.7), 11.36 с (1Н, NH)
3
6.84-6.87 м (1Н, Н4, фуран), 7.45 д (1Н, Н3, фуран, J = 3.4), 7.71 д. д (1Н, Н8, хинолин, J =
4.3), 8.01 д (1Н, Н5, фуран, J = 0.9), 8.23 д (1Н, Н4, хинолин, J = 9.0), 8.28 д (1Н, Н5,
хинолин, J = 9.0), 8.79 д (1Н, Н9, хинолин, J = 8.1), 8.95 д (1Н, Н7, хинолин, J = 3.1)
4
1541 [νas(NO2)],
7.65 д (1Н, Н3, фуран, J = 3.9), 7.73 д (1Н, Н8, хинолин, J = 4.6), 7.75 д (1Н, Н4, фуран, J =
1388 [νs(NO2)]
3.9), 8.25 д (1Н, Н4, хинолин, J = 9.0), 8.31 д (1Н, Н5, хинолин, J = 9.1), 8.81 д (1Н, Н9,
хинолин, J = 8.0), 8.95 д (1Н, Н7, хинолин, J = 4.0)
5
6.75 д (1Н, Н4, фуран, J = 3.6), 7.41 д (1Н, Н3, фуран, J = 3.6), 7.67 д. д (1Н, Н8, хинолин, J
= 4.2), 8.22 д (1Н, Н4, хинолин, J = 9.0), 8.32 д (1Н, Н5, хинолин, J = 8.8), 8.75 д (1Н, Н9,
хинолин, J = 8.3), 8.92 д (1Н, Н7, хинолин, J = 3.3)
6
1668 с (С=О)
7.61 д (1Н, Н4, фуран, J = 3.8), 7.68 д (1Н, Н3, фуран, J = 3.6), 7.75 д. д (1Н, Н8, хинолин, J =
4.5), 8.21 д (1Н, Н4, хинолин, J = 8.9), 8.30 д (1Н, Н5, хинолин, J = 9.0), 8.73 д (1Н, Н9,
хинолин, J = 8.1), 8.98 д (1Н, Н7, хинолин, J = 3.2), 9.79 с (1Н, СНО)
7
1675 с (С=О)
2.65 с (3Н, СН3), 7.63 д (1Н, Н4, фуран, J = 3.6), 7.70 д (1Н, Н3, фуран, J = 3.6),7.77 д. д (1Н,
Н8, хинолин, J = 4.6), 8.23 д (1Н, Н4, хинолин, J = 8.9), 8.33 д (1Н, Н5, хинолин, J = 9.0),
8.70 д (1Н, Н9, хинолин, J = 8.2), 8.96 д (1Н, Н7, хинолин, J = 3.3)
8
1681 с (С=О)
7.55 т (3Н, Н3,4,5, арил, J = 7.5), 7.64 д (1Н, Н4, фуран, J = 3.3), 7.72 д (1Н, Н3, фуран,
J = 3.6), 7.75 д. д (1Н, Н8, хинолин, J = 4.6), 7.92 д (2Н, Н2,6, арил, J = 7.2), 8.20 д (1Н, Н4,
хинолин, J = 9.0), 8.31 д (1Н, Н5, хинолин, J = 9.0), 8.72 д (1Н, Н9, хинолин, J = 8.1), 9.01 д
(1Н, Н7, хинолин, J = 3.0)
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
48
АЛЕКСАНДРОВ и др.
равновесной концентрации протонированной формы
ность полученного
2-(фур-2-ил)тиазоло[4,5-f]-
фурана и уменьшению активности последней, что
хинолина в отношении электрофильных реагентов.
сводит к минимуму процессы олигомеризации и
присоединения всевозможных нуклеофилов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Взаимодействие соединения
3 с кипящей
ИК спектры регистрировали на спектрометре
разбавленной азотной кислотой (d = 1.32 г/см3)
Specord 75IR в вазелиновом масле. Спектры ЯМР
приводит к образованию 5-нитропроизводного 4 по
1Н записывали на приборе Varian Unity 300 (300
фурановому кольцу с выходом 55% (схема 3). В
МГц, ДМСО-d6, внутренний стандарт - ТМС). Ход
этом случае, как известно, реакция протекает по
реакции контролировали при помощи ТСХ на
радикальному механизму. Соединение 4 получено
пластинах с Al2O3 II степени активности по
также встречным синтезом путем ипсо-замещения
Брокману, проявление парами иода (элюент
-
атома брома на нитрогруппу в 2-(5-бромфур-2-ил)-
CH2Cl2, CHCl3). Элементный анализ проводили на
тиазоло[4,5-f]хинолине
5.
При бромировании
анализаторе PerkinElmer
2400.
Температуры
2-(фур-2-ил)тиазоло[4,5-f]хинолина 3 в дихлорэтане
плавления определяли капиллярным методом на
также происходит замещение в положение
5
приборе ПТП.
гетарильного ядра с образованием соединения 5.
Дальнейшее замещение не происходит даже при
N-(5-Хинолил)фуран-2-карбоксамид
(1).
К
длительном кипячении 2-(фур-2-ил)тиазоло[4,5-f]-
раствору 8.64 г (0.06 моль) хинолин-5-амина в
хинолина 3 с 3-кратным избытком брома.
60 мл пропан-2-ола прибавляли 7.83 г (0.06 моль)
фуран-2-карбонилхлорида. Смесь кипятили в
Формилирование пятичленных π-избыточных
течение
2 ч, затем выливали в
50 мл воды,
гетероциклов и их производных в настоящее время
нейтрализовали до слабощелочной реакции
успешно осуществляют по реакции Вильсмайера.
раствором аммиака и выдерживали в холодильнике
Однако, согласно данным работы
[7], для
24 ч. Выделившийся осадок соединения
1
большинства гетарилимидазолов применение данного
отфильтровывали и кристаллизовали из пропан-2-
метода не всегда бывает успешным. 2-(Фур-2-ил)-
ола. Выход 10.58 г, бесцветные кристаллы.
тиазоло[4,5-f]хинолин 3 также оказался инертным
к комплексу ДМФА-POCl3, поэтому для этой цели
N-(5-Хинолил)фуран-2-карботиоамид
(2). К
был применен метод формилирования гексамети-
раствору 10.01 г (0.042 моль) соединения 1 в 50 мл
лентетрамином в полифосфорной кислоте при 90-
безводного пиридина прибавляли 5.55 г (0.025 моль)
100°С. Выход альдегида 6 составил 67% (схема 3).
пятисернистого фосфора. Смесь кипятили
3 ч,
затем охлаждали и выливали в
100 мл воды.
Ацетилирование соединения 3 с учетом дез-
Выпавший желтый осадок соединения 2 отделяли и
активирующего влияния протонированного тиа-
кристаллизовали из водного пропан-2-ола. Выход
золохинолинового фрагмента сильно затруднено,
6.09 г.
однако его удалось осуществить действием
уксусного ангидрида в полифосфорной кислоте
2-(Фур-2-ил)тиазоло[4,5-f]хинолин
(3).
К
при 110-120°С; выход целевого продукта составил
раствору 5.85 г (0.023 моль) соединения 2 в 20 мл
~23%. Реакция также потекает по положению 5
пропан-2-ола добавляли 15 мл 1%-ного гидроксида
фуранового кольца. Бензоилирование 2-(фур-2-ил)-
калия, затем постепенно приливали 50 мл теплого
тиазоло[4,5-f]хинолина
3 проводили действием
водного раствора K3[Fe(CN)6], содержащего 22.70 г
бензойной кислоты в полифосфорной кислоте, но
(0.069 моль) соли. Смесь тщательно перемешивали
при более высокой температуре (150-160°С). Как и
и оставляли при комнатной температуре на ночь.
при ацетилировании, образуется 5-бензоилкетон 8
Осадок отделяли и кристаллизовали из водного
по пятичленному гетероциклу с выходом
49%
этанола. Выход 1.97 г, бесцветные кристаллы.
(схема 3).
2-(5-Нитрофур-2-ил)тиазоло[4,5-f]хинолин (4).
Физико-химические и спектральные характе-
Раствор 0.252 г (1 ммоль) соединения 3 в 15 мл
ристики всех полученных соединений представ-
азотной кислоты (d = 1.42 г/см3) нагревали до
лены в табл. 1, 2.
кипения 3 ч, затем реакционную массу выливали в
Таким образом, впервые успешно осуществлено
100 мл холодной воды. Осадок отделяли и
5,6-аннелирование 2-(фур-2-ил)тиазольного фраг-
промывали
2-3 раза небольшим количеством
мента к хинолину. Изучена реакционная способ-
холодной воды. Выход 0.16 г, желтые кристаллы.
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
2-(ФУР-2-ИЛ)ТИАЗОЛО[4,5-f]ХИНОЛИН
49
2-(5-Бромфур-2-ил)тиазоло[4,5-f]хинолин
(5).
проводили аналогично соединению 6. Соединение
К раствору 0.252 г (1 ммоль) соединения 3 в 10 мл
8 кристаллизовали из н-пропанола. Выход 0.17 г,
дихлорэтана прибавляли 0.48 г (3 ммоль) брома.
кремовые кристаллы.
Смесь кипятили 4 ч, затем удаляли дихлорэтан.
Остаток нейтрализовали раствором аммиака.
КОНФЛИКТ ИНТЕРЕСОВ
Бежевые кристаллы отделяли и кристаллизовали из
водного пропан-2-ола. Выход 0.20 г.
Авторы заявляют об отсутствии конфликта
интересов.
5-Тиазоло[4,5-f]хинолин-2-илфуран-2-карбаль-
дегид (6). Смесь 0.252 г (1 ммоль) соединения 3 и
СПИСОК ЛИТЕРАТУРЫ
0.42 г (3 ммоль) уротропина в 5 г полифосфорной
кислоты перемешивали при 110-120°С в течение
1. Pozharskii A. F., Soldatenkov A.T., Katritzky A.R.
6 ч. После окончания реакции смесь разбавляли
Heterocycles in Life and Society. Chichester: J. Wiley
10 мл воды и осторожно нейтрализовали раствором
& Sons, 1997. 301 p.
аммиака. Выделившийся продукт реакции
2. Рошаль А.Д., Лукьянов Б.С., Ельчанинов М.М. //
экстрагировали 15 мл хлороформа и хроматографи-
ЖФХ. 2003. Т. 77. № 10. С. 1899; Roshal A.D.,
ровали на колонке (h = 10 cм, d = 2.5 cм) с оксидом
Lukianov B.S., Elchaninov M.M. // Russ. J. Phys. Chem.
алюминия, элюируя хлороформом. Соединение 6
(А). 2003. Vol. 77. N 10. P. 1709.
кристаллизовали из этанола. Выход 0.188 г, желтые
3. Jacobson P. // Ber. 1886. Vol. 19. P. 1067, 1811.
кристаллы.
4. Fărcăşan V., Makkay C.
// Acad. Rep. Populare
Române, Filiala Cluj, St. Cerc. Chim. 1959. Vol. 10.
1-(5-Тиазоло[4,5-f]хинолин-2-ил-фур-2-ил)-
Р. 145.
этанон (7). Смесь 0.252 г (1 ммоль) соединения 3 и
5. Ачкасова А.А., Ельчанинов М.М. // ХГС. 2006. № 2.
0.31 г
(3 ммоль) уксусного ангидрида в
5 г
полифосфорной кислоты перемешивали при 110-
Heterocycl. Compd. 1983. Vol. 42. N 2. P. 166. doi
120°C в течение 12 ч, затем разбавляли 10 мл воды
10.1007/s10593-006-0065-7
и нейтрализовали раствором аммиака. Далее
6. Мельникова Е.Б., Ельчанинов М.М., Милов А.А.,
выделение продукта реакции проводили аналогично
Лукьянов Б.С. // ХГС. 2006. № 9. С. 1331; Melni-
соединению 6. Соединение 7 кристаллизовали из
kova E.B., El’chaninov M.M, Milov A.A., Lukyanov B.S.
//
метанола. Выход 0.068 г, бесцветные кристаллы.
Chem. Heterocycl. Compd. 2008. Vol. 44. N 9. P. 1070.
doi 10.1007/s10593-008-0156-8
Фенил-(5-тиазоло[4,5-f]хинолин-2-ил-фур-2-
7. Ельчанинов М.М., Симонов А.М., Олейникова Л.Я. //
ил)метанон (8). Смесь 0.252 г (1 ммоль) соеди-
нения 3 и 0.37 г (3 ммоль) бензойной кислоты в 5 г
nov A.M., Oleinikova L.Ya.
// Chem. Heterocycl.
полифосфорной кислоты перемешивали 8 ч при
Compd. 1983. Vol. 19. N 10. P. 1041. doi 10.1007/
150-160°С. Далее выделение продукта реакции
BF00505746
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
50
АЛЕКСАНДРОВ и др.
2-(Fur-2-yl)thiazolo[4,5-f]quinoline:
Synthesis and Electrophilic Substitution Reactions
A. A. Aleksandrov*, M. M. El’chaninov, and D. A. Zablotskii
M.I. Platov South Russian State Polytechnic University (NPI), pr. Prosveshcheniya 132, Novocherkassk, 346428 Russia
*e-mail: aaanet1@yandex.ru
Received on June 21, 2018
Revised June 21, 2018
Accepted June 28, 2018
Condensation of quinoline-5-amine with furan-2-carbonyl chloride in propan-2-ol afforded N- (5-quinolyl)furan-
2-carboxamide, treatment of which with an excess of P2S5 in anhydrous pyridine led to the formation of the
corresponding thioamide. Oxidation of the latter with potassium ferricyanide in an alkaline medium furnished
2-(fur-2-yl)thiazolo[4,5-f]quinoline. A plausible mechanism for its formation was proposed. The reactions of
electrophilic substitution (nitration, bromination, formylation, acylation) of the obtained N-(5-quinolyl)furan-2-
carboxamide were studied.
Keywords: quinoline-5-amine, furan-2-carbonyl chloride, potassium ferricyanide, 2-(fur-2-yl)thiazolo[4,5-f]-
quinoline, electrophilic substitution reactions
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019