ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 1, с. 60-67
УДК 546.183:547.79:661.693
ВЗАИМОДЕЙСТВИЕ
3a,6a-ДИАЗА-1,4-ДИФОСФАПЕНТАЛЕНА
С ЗАМЕЩЕННЫМИ АЦЕТИЛЕНАМИ
© 2019 г. А. Н. Корнев*, В. Е. Гальперин, Ю. С. Панова, В. В. Сущев,
Г. К. Фукин, E. В. Баранов, Г. А. Абакумов
Институт металлоорганической химии имени Г. А. Разуваева Российской академии наук,
ул. Тропинина 49, Нижний Новгород, 603137 Россия
*e-mail: akornev@iomc.ras.ru
Поступило в Редакцию 21 июня 2018 г.
После доработки 21 июня 2018 г.
Принято к печати 28 июня 2018 г.
Взаимодействие
3a,6a-диаза-1,4-дифосфапенталена с
1-бром-2-фенилацетиленом приводит к
образованию 1,1-бис(фенилэтинил)- и 1,4-дибром-3a,6a-диаза-1,4-дифосфапенталена. Последний получен
также альтернативным путем по реакции
1,4-дихлор-3a,6a-диаза-1,4-дифосфапенталена с
фенилацетиленидом лития с выходом 96%. Изомерный 1,4-бис(фенилэтинил)-3a,6a-диаза-1,4-дифосфа-
пентален в данной реакции не образуется. Реакция в трехкомпонентной системе 3a,6a-диаза-1,4-
дифосфапентален-[Ph3PC≡CPh]Br-карбазол идет как присоединение карбазола к первоначально
образующемуся комплексу 3a,6a-диаза-1,4-дифосфапенталена с [Ph3PC≡CPh]Br с разрывом связи P-N.
Методом B3LYP/6-31+G(d) выполнен расчет продуктов и интермедиатов реакции.
Ключевые слова: гетерофосфолы, гетеропенталены, илиды фосфора, карбеноиды
DOI: 10.1134/S0044460X19010098
Азафосфолы и диазафосфолы [1-3] принадлежат
совершено иные химические свойства, принципиально
к классу ароматических гетероциклов, содержащих
отличные от обычных азафосфолов. В частности,
двухкоординированый атом фосфора, инертный к
было показано, что DDP реагирует с серой,
действию электрофильных реагентов [4]. Получен-
селеном, сероуглеродом, образуя продукты присо-
ный нами
3а,6а-диаза-1,4-дифосфапентален
1
единения по атому фосфора цвиттер-ионного
(DDP) [5], принадлежащий к классу аннелиро-
характера
[6]. Атом фосфора
3а,6а-диаза-1,4-
ванных азафосфолов, демонстрирует, однако,
дифосфапенталена способен образовывать аддукты
Схема 1.
1
2
P
6a
N
6
3
N
3a
P
5
4
1
RX
RX
X
R
нековалентное
R
взаимодействие
P
P
N
N
N
N
P
P
X
1,4-присоединение
1,1-присоединение
60
ВЗАИМОДЕЙСТВИЕ 3a,6a-ДИАЗА-1,4-ДИФОСФАПЕНТАЛЕНА
61
Схема 2.
Ph
Ph
Br
P
P
P
N
+
N
2Ph
Br
N
N
N
P
2
N
P
P
Br
1
2
3
с карбенами, строение и свойства которых может
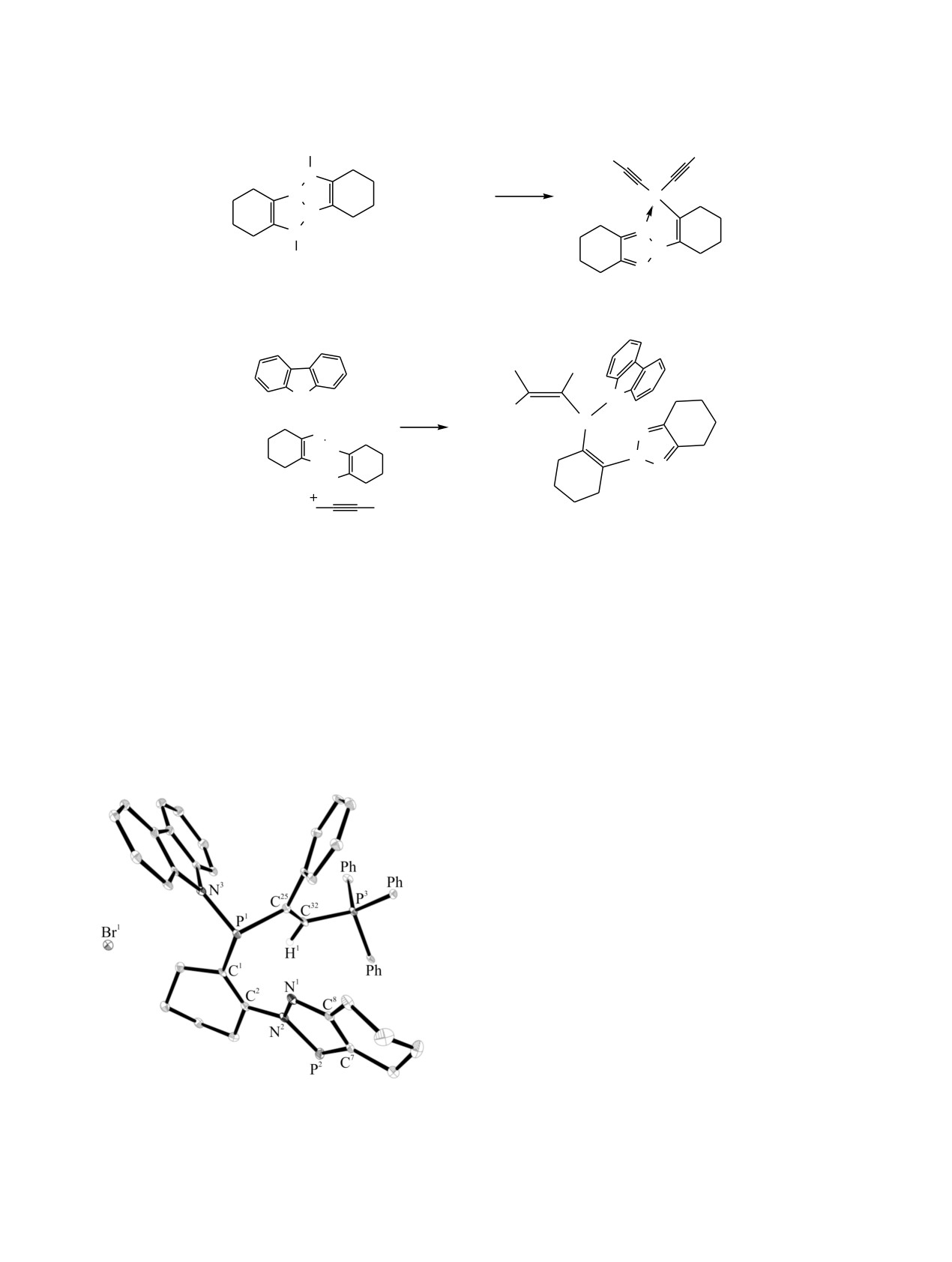
Геометрия молекулы соединения
2,
сильно варьироваться в зависимости от способ-
оптимизированная методом B3LYP в базисе 6-
ности R2C-фрагментов к делокализации заряда
31+G(d), изображена на рис. 1. Согласно расчету,
[6-8]. С алкилгалогенидами 3а,6а-диаза-1,4-дифос-
расстояние между атомом азота диазафосфольного
фапентален 1 реагирует с образованием продуктов
цикла и атомом фосфора, несущим этинильные
1,1- или
1,4-присоединения. Фосфор при этом
заместители, составляет 2.727 Å, что больше, чем
остается трехвалентным [9, 10] (схема 1). В то же
сумма ковалентных радиусов (1.73 Å) [12], но
время подобные реакции присоединения к атому
заметно меньше суммы ван-дер-ваальсовых
фосфора в ароматических азафосфолах неизвестны.
радиусов элементов (3.35 Å). Мы провели также
расчет изомерного продукта присоединения, 1,4-
В настоящей работе изучены реакции 3а,6а-
бис(фенилэтинил)-3а,6а-диаза-1,4-дифосфапенталена,
диаза-1,4-дифосфапенталена с
1-бром-2-фенил-
который на 13.9 ккал/моль энергетически менее
ацетиленом и трифенил(фенилэтинил)фосфоний-
выгоден, чем 1,1-изомер.
бромидом, приводящие к продуктам их присоеди-
1,1-Бис(фенилэтинил)-3a,6a-диаза-1,4-дифосфа-
нения к атому фосфора DDP. Взаимодействие 3а,6а-
пентален 2, как было установлено, можно получить
диаза-1,4-дифосфапенталена 1 c 1-бром-2-фенил-
и другим путем - замещением атомов хлора в 1,4-
ацетиленом при комнатной температуре идет с
дихлор-3а,6а-диаза-1,4-дифосфапенталене на фенил-
образованием двух продуктов реакции согласно
этинильные группы при действии фенилэтинил-
схеме 2.
лития (схема 3).
Один из продуктов - 1,4-дибром-3а,6а-диаза-1,4-
дифосфапентален 3 - был охарактеризован нами
ранее
[10]. Он количественно выделяется из
реакционной смеси в виде темно-желтых
кристаллов. Вторым продуктом реакции является
производное 3а,6а-диаза-1,4-дифосфапенталена 2, в
котором к одному атому фосфора присоединены
две фенилэтинильные группировки. Спектр ЯМР
31P этого продукта содержит два дублета при 222.4
и -70.1 м. д., отнесенных к двух- и трехкоордини-
рованному атомам фосфора соответственно. Их
химические сдвиги находятся в областях,
типичных для азафосфолов (190-240 м. д.) [1] и
бисэтинилфосфинов [11]. Константа спин-спинового
взаимодействия JPP, несмотря на значительное
расстояние между атомами фосфора, составляет
56.0 Гц, и лежит в диапазоне, характерном для 1,1-
дизамещенных производных
3а,6а-диаза-1,4-
дифосфапенталена [9, 10]. В ИК спектре соеди-
нения 2 наблюдается полоса средней интенсив-
ности при 2161 см-1, отнесенная к колебаниям
тройной С≡С связи, сдвинутая на
50 см-1
Рис. 1. Геометрия молекулы соединения 2, оптимизиро-
относительно исходного фенилацетилена (2111 см-1).
ванная методом B3LYP/6-31+G(d).
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
62
КОРНЕВ и др.
Схема 3.
Cl
Ph
Ph
P
N
P
+
2PhC CLi
N
2LiCl
P
N
N
Cl
P
4
2
Схема 4.
Ph3P+
Ph
N
N
H
H
P
P
N
N
Br
N
N
P
P
Br
Ph
P
Ph
3
5
Ни в одной из этих реакций нам не удалось
3a,6a-Диаза-1,4-дифосфапентален 1 потенциально
зафиксировать интермедиаты - производные 3a,6a-
способен присоединяться по кратным связям, но
диаза-1,4-дифосфапенталена, содержащие одну
мы не наблюдали таких продуктов в реакциях DDP
фенилэтинильную группу. В контрольном опыте
с
1-бром-2-фенилацетиленом и другими ацети-
при нагревании раствора эквимольной смеси
ленами [толаном, фенилацетиленом, бис(дифенил-
соединений 4 и 2 обмен между атомами хлора и
фосфино)ацетиленом]. Тем не менее, при исполь-
фенилэтинильными фрагментами не наблюдается.
зовании трифенил(фенилэтинил)фосфонийбромида,
Отметим, что 1,1-бис(фенилэтинил)-3а,6а-диаза-1,4-
содержащего активированную тройную связь,
дифосфапентален оказался термически весьма
наблюдались признаки медленной реакции (в
устойчив и перегоняется без разложения при 250°С.
течение нескольких дней), судя по меняющемуся
спектру ЯМР
31P реакционной смеси. Однако
индивидуальных продуктов в системе DDP-
[Ph3PC≡CPh]Br выделить не удалось. По аналогии
с трехкомпонентными системами на основе
ацетилендикарбоксилатов, в которых образуются
продукты двойного присоединения по тройной
связи [13, 14], в качестве третьего компонента мы
использовали карбазол. Результат оказался
неожиданным: при перемешивании эквимольной
смеси DDP,
[Ph3PC≡CPh]Br и карбазола при
комнатной температуре в течение
6 ч коли-
чественно образуется продукт двойного присо-
единения 5 (схема 4).
Спектр ЯМР
31P соединения
5 содержит
сигналы трех неэквивалентных атомов фосфора.
Дублет при 218.0 м. д. (JPP = 5.0 Гц) находится в
области, типичной для азафосфолов [1]; дублет при
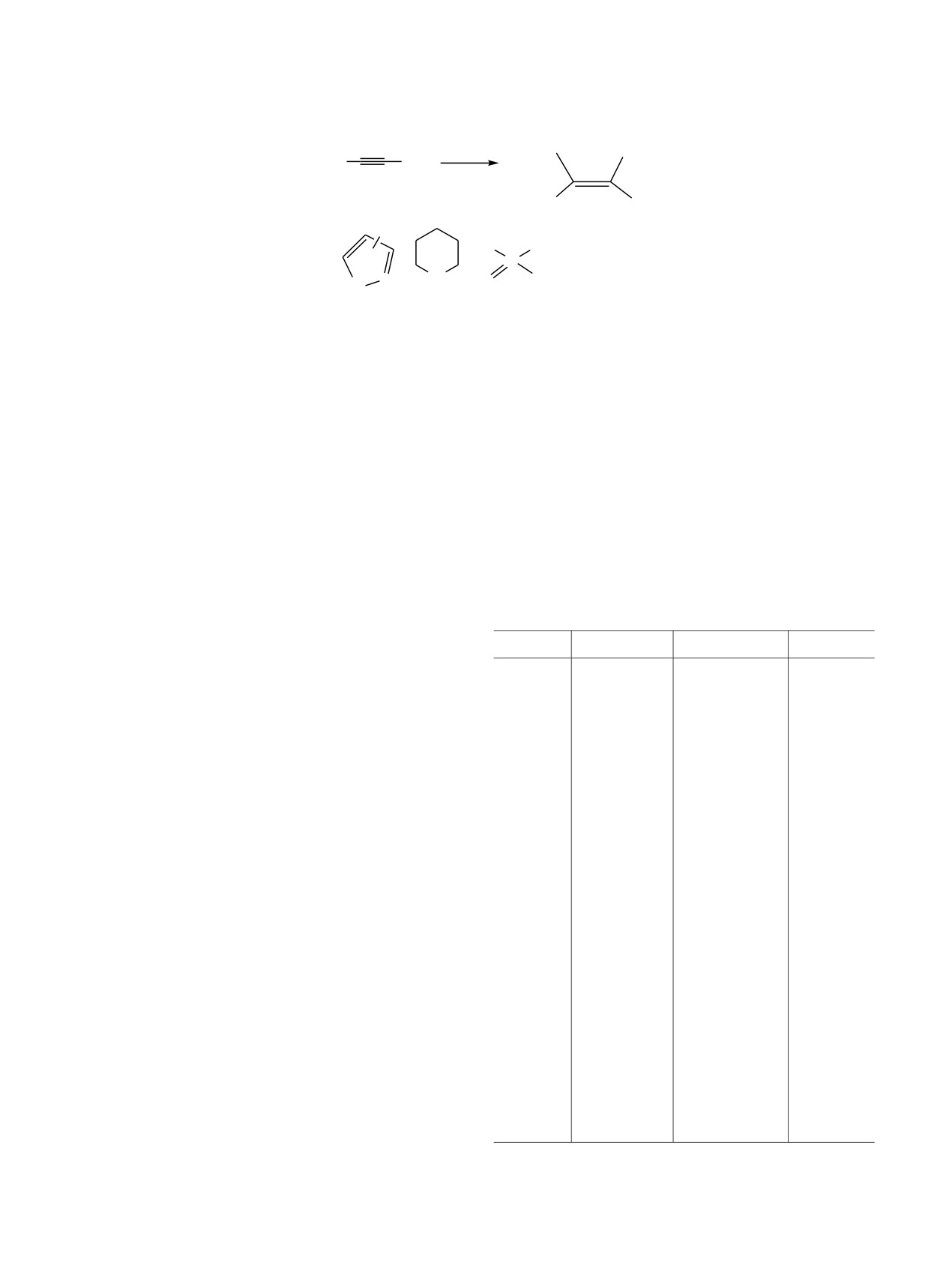
Рис. 2. Общий вид молекулы соединения 5 в кристалле.
Тепловые эллипсоиды приведены с вероятностью 30%.
12.3 м. д. (JPP
=
5.5 Гц) соответствует иону
Атомы водорода и сольватные молекулы ТГФ не показаны.
фосфония. Трехкоординированный атом фосфора
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
ВЗАИМОДЕЙСТВИЕ 3a,6a-ДИАЗА-1,4-ДИФОСФАПЕНТАЛЕНА
63
Схема 5.
Ph3P+
X
HX
Ph3P+
Ph
Br
Br
H
Ph
R
H
Ph
HX =
,
,
P
, Ph
, PhSH.
2PH
N
N
O
Ph
HN
H
проявляется триплетом при
27.5 м. д. ввиду
трифенил(фенилэтинил)фосфонийбромидом даже
близких значений КССВ.
при длительном выдерживании реакционной
смеси. Карбазол не реагирует также с 3a,6a-диаза-
Структура соединения 5 была изучена методом
1,4-дифосфапенталеном.
Известно,
что
РСА. Основные длины связей и валентные углы
азафосфолы (к которым принадлежит DDP) не
даны в таблице. Общий вид молекулы производ-
склонны к реакциям присоединения, однако
ного
5 изображен на рис.
2. Соединение
5
ситуация меняется существенным образом в
кристаллизуется с сольватной молекулой ТГФ и
присутствии окислителей (схема 6) [4].
содержит в кристаллической ячейке два
энантиомера. Из рис. 2 видно, что в молекуле
В случае реакции в трехкомпонентной системе
соединения 5 присутствуют все три компонента,
DDP-[Ph3PC≡CPh]Br-карбазол можно предположить,
участвующие в реакции. 3a,6a-Диаза-1,4-дифосфа-
что первой стадией реакции является образование
пентален присоединяется атомом фосфора P1 к
комплекса
3a,6a-диаза-1,4-дифосфапенталена с
ацетиленовому атому углерода С25 трифенил-
(фенилэтинил)фосфонийбромида со стороны
Основные длины связей и углы в молекуле соединения 5
фенильной группы. Связь P-N в 3a,6a-диаза-1,4-
дифосфапенталеновом фрагменте при этом
Связь
d, Å
Угол
ω, град
разрывается. Расстояние P1-N1 2.601 Å значи-
P1-N3
1.745(4)
N3P1C1
103.1(2)
тельно больше суммы ковалентных радиусов
элементов (1.73 Å), но меньше суммы ванн-дер-
P1-C1
1.837(4)
N3P1C25
097.8(2)
ваальсовых радиусов (3.35 Å). Во фрагменте DDP
P1-C25
1.856(4)
C1P1C25
104.7(2)
происходит перераспределение двойных и
P2-N2
1.706(3)
N2P2C7
088.7(2)
одинарных связей с образованием пятичленного
6πе-ароматического диазафосфольного цикла.
P2-C7
1.715(5)
C39P3C45
107.4(2)
Длина связи C7-C8 1.411(6) Å в таком цикле
P3-C39
1.793(4)
C39P3C32
111.0(2)
типична для ароматических соединений, длина
P3-C45
1.815(4)
C45P3C32
106.0(2)
связи C1-C2 типична для алкенов [1.344(5) Å].
Длина связи C25-C32
1.335(6) Å также
P3-C32
1.794(4)
C39P3C33
112.5(2)
соответствует
двойной с геометрическим
P3-C33
1.790(4)
C45P3C33
105.8(2)
окружением близким к планарному.
N1-C8
1.314(5)
C32P3C33
113.6(2)
Отметим, что молекула карбазола присо-
N1-N2
1.364(4)
C8N1N2
109.4(3)
единяется атомом азота не к ацетиленовому
фрагменту трифенил(фенилэтинил)фосфонийбромида,
N2-C2
1.417(5)
N1N2C2
116.0(3)
а к атому фосфора DDP, уже присоединенного к
N3-C13
1.413(5)
N1N2P2
115.9(3)
нему. Известно, что трифенил(фенилэтинил)фос-
фонийбромид вступает в реакции присоединения
N3-C24
1.401(5)
C2N2P2
127.8(3)
по тройной связи с соединениями, содержащими
C1-C2
1.344(5)
C13N3C24
106.9(3)
NH-, PH- или SH-функции (схема 5) [15-18].
C7-C8
1.411(6)
C13N3P1
119.1(3)
Такие реакции протекают обычно при
C1-C6
1.514(5)
C24N3P1
133.2(3)
длительном нагревании растворов реагентов. При
C2-C3
1.512(5)
C1C2N2
123.0(3)
комнатной температуре карбазол не реагирует с
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
64
КОРНЕВ и др.
Схема 6.
S
Et2NH/S
нет реакции
N
N
N
N
NH
Et2
P
S
P
NEt2
Схема 7.
Ph3P+
Ph
Ph3P+
Ph
Ph3P+
Ph
+
Br
P N
P N
P
+
N
Br
N P
Br
N P
N
P
6
трифенил(фенилэтинил)фосфонийбромидом цвиттер-
реакций фосфиренов происходит с раскрытием
ионного типа 6 (схема 7). Интермедиат 6 является,
напряженного цикла по связи P-C [20].
по существу, илидом фосфония. Илидный атом
углерода, обладая высокой основностью, вполне
Таким образом, показано, что в реакции 3a,6a-
способен депротонировать ароматические амины
диаза-1,4-дифосфапенталена с
1-бром-2-фенил-
(схема 8) [19]. Оптимизация геометрии цвиттер-
ацетиленом фенилэтинильная группа дважды
иона 6 показала, что дополнительным способом его
присоединяется к одному атому фосфора, образуя
стабилизации является образование фосфирена 7
1,1-бис(фенилэтинил)-3a,6a-диаза-1,4-дифосфа-
(схема
9, рис.
3). Известно, что большинство
пентален, в то время как образование 1,4-изомера
Схема 8.
N
H
H
N
Ph3P+
Ph3P+
5
P+
N
P N
Br
Ph
Br
Ph
+
N P
N P
6
Схема 9.
Ph
Ph
Ph3P+
P N
Ph3P+
P N
N P
+NP
7
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
ВЗАИМОДЕЙСТВИЕ 3a,6a-ДИАЗА-1,4-ДИФОСФАПЕНТАЛЕНА
65
на 13.9 ккал/моль менее выгодно. Исследована
также трехкомпонентная система DDP-
[Ph3PC≡CPh]Br-карбазол, в которой происходит
первоначальное образование комплекса DDP-
[Ph3PC≡CPh]Br и последующее присоединение к
нему карбазола с выходом продукта присоеди-
нения, близким к количественному.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез соединений 2 и 5 проводили в вакууме и
атмосфере высокочистого аргона. Растворители
Рис. 3. Геометрия молекулярного иона 7, оптимизиро-
(толуол, ТГФ, диэтиловый эфир, бензол) очищали
ванная методом B3LYP в базисе 6-31+G(d). Атомы
водорода не показаны.
перегонкой над натрием. 3a,6a-Диаза-1,4-дифосфа-
пентален (DDP)
[5], трифенил(фенилэтинил)
фосфонийбромид
[21] были получены по
фрагментов разупорядочен по двум положениям.
известным методикам. Использовали
1-бром-2-
Структура депонирована в Кембриджском банке
фенилацетилен фирмы «Sigma Aldrich».
структурных данных (CCDC 1843848).
Спектры ЯМР регистрировали в растворах
Квантово-химические расчеты выполнены
СD2Cl2 на спектрометрах Bruker DPX-200 и AV-400.
методом DFT/B3LYP/6-31+G(d) с использованием
ИК спектры записывали на приборе PerkinElmer
программы GAUSSIAN-03
[27]. Соответствие
577 в диапазоне от 4000 до 400 см-1 в вазелиновом
оптимизированной геометрии соединений 2 и 7
масле или на приборе PerkinElmer FT-IR 2000.
минимумам энергии подтверждается действитель-
ными значениями всех вычисленных колеба-
Рентгеноструктурное исследование соединения
тельных частот.
5 выполнено на дифрактометре Bruker D8 Quest (φ-
и ω-сканирование, МоKα-излучение, λ = 0.71073 Å,
2-{2-[Бис(фенилэтинил)фосфино]циклогекс-1-
100 K). Экспериментальные наборы интенсив-
енил}-4,5,6,7-тетрагидро-2Н-бензо[d][1,2,3]диаза-
ностей интегрировали с помощью программы
фосфол (2). а. Взаимодействие 3a,6a-диаза-1,4-
SAINT
[22]. Структура расшифрована прямым
дифосфапенталена c бромфенилацетиленом. К
методом с помощью пакета программ SHELXTL
раствору
3a,6a-диаза-1,4-дифосфапенталена
1
[23-25] и уточнена полноматричным МНК по Fhkl в
(0.10 г, 0.4 ммоль) в толуоле (10 мл) добавляли
анизотропном приближении для всех неводо-
раствор
1-бром-2-фенилацетилена
(0.07
г,
родных атомов. Атомы водорода помещены в
0.4 ммоль) в том же растворителе (10 мл). При
геометрически рассчитанные положения и
сливании растворов реакционная смесь приобретала
уточнены в модели наездника. Программу SADABS
красную окраску. Растворитель заменяли на ТГФ,
[26] использовали для введения поправок на
раствор концентрировали и оставляли при 0°С.
поглощение. Кристаллы соединения
5 светло-
Выпавший через 12 ч темно-оранжевый осадок 1,4-
желтые, триклинные, C50H45BrN3P3·C4H8O, М
=
дибром-3a,6a-диаза-1,4-дифосфапенталена 3 отфиль-
932.81 г/моль, пространственная группа Р-1,
тровывали. Остаток обрабатывали гексаном для
размер кристалла 0.12×0.10×0.05, a = 11.5481(14) Å,
осаждения остаточного количества
1,4-дибром-
b = 12.1634(14) Å, c = 17.017(2) Å, α = 86.996(2)°,
3a,6a-диаза-1,4-дифосфапенталена. Раствор отфиль-
β = 85.806(2)°, γ = 74.186(2)°, V = 2292.3(5) Å3, Z =
тровывали, маслообразный остаток анализировали.
2, dвыч = 1.351 г/см3, m = 1.045 мм-1 , собрано 19354
Выход 0.04 г (90%). ИК спектр, ν, см-1: 2161 (С≡С),
отражения в пределах θ от 2.255° до 25.027°, из них
1589, 1344, 1287, 1247, 1181, 1160, 1070, 1024, 961,
8024 независимых (Rint
=
0.0857) и
7944
918, 852, 837, 806, 755, 690, 590, 542, 480, 466.
наблюдаемых отражений [I ≥ 2σ(I)], 569 пара-
Спектр ЯМР 1Н, δ, м. д.: 7.10-7.60 м (10H, Ph), 0.8-
метров уточнения; R1 = 0.0584 [I > 2s(I)], wR2 =
3.2 м (16H, c-С6Н8). Спектр ЯМР 13C, δС, м. д.: 155.9
0.1435 (по всем данным), максимальная остаточная
д (=CP, J = 9.0 Гц), 151.3 д. д (NP=C, J = 39.0,
электронная плотность
1.406 и
-0.912 e/Å3. В
4.0 Гц), 155.9 д (=CP, J = 9.0 Гц), 149.2 д. д (NN=C,
кристалле присутствует сольватная молекула ТГФ
J = 25.0, 9.0 Гц), 122.7 д (C-ипсо, Ph, J = 1.3 Гц),
в общем положении. Один из циклогексеновых
121.6 т (=C-N, J = 4.0 Гц), 103.3 д (PhC, J = 5.0 Гц),
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
66
КОРНЕВ и др.
84.2 д. д (PC≡C, J = 8.0, 3.0 Гц), 131.8 д (м-Ph, J =
КОНФЛИКТ ИНТЕРЕСОВ
2.0 Гц), 128.9 (п-Ph), 128.3 (о-Ph), 22.0-32.0 м
Авторы заявляют об отсутствии конфликта
(CH2). Спектр ЯМР 31Р, δP, м. д.: 222.4 д (=Р-N),
интересов.
–70.1 д (=N-P, JPP = 56.0 Гц). Найдено, %: C 74.28;
H 5.83; P 13.72. C28H26N2P2. Вычислено, %: C 74.33;
СПИСОК ЛИТЕРАТУРЫ
H 5.79; P 13.69.
1.
Bansal R.K. // Top Heterocycl. Chem. 2009. Vol. 20.
P. 21. doi 10.1007/7081_2008_10
б. Взаимодействие 1,4-дихлор-3a,6a-диаза-1,4-
дифосфапенталена с фенилацетиленидом лития.
2.
Schmidpeter A., Bansal R.K., Karaghiosoff K.,
Steinmüller F., Spindler C.
// Phosphorus, Sulfur,
К раствору 0.32 г (1.0 ммоль) 1,4-дихлор-3a,6a-
Silicon, Relat. Elem. 1990. Vol. 49-50. P. 349. doi
диаза-1,4-дифосфапенталена в ТГФ добавляли 0.22 г
10.1080/10426509008038977
(2.0 ммоль) фенилацетиленида лития, приготовлен-
3.
Nyulászi L. // Chem. Rev. 2001. Vol. 101. P. 1229. doi
ного из 0.10 г фенилацетилена и 2.0 ммоль н-
10.1021/cr990321x
бутиллития. ТГФ удаляли при пониженном
4.
Karaghiosoff K., Cleve C., Schmidpeter A.
//
давлении и заменяли гексаном. Хлорид лития
Phosphorus, Sulfur, Silicon, Relat. Elem. 1986. Vol. 28.
отфильтровывали, гексан удаляли в вакууме.
P. 289. doi 10.1080/03086648608072819
Получили 0.43 г (96%) соединения 2 с характе-
5.
Kornev A.N., Sushev V.V., Panova Y.S., Lukoyanova O.V.,
ристиками, описанными выше.
Ketkov S.Y., Baranov E.V., Fukin G.K., Lopatin M.A.,
Budnikova Y.G., Abakumov G.A. // Inorg. Chem. 2014.
(E)-{2-[(9H-карбазол-9-ил){2-(4,5,6,7-тетра-
Vol. 53. P. 3243. doi 10.1021/ic500274h
гидро-2H-бензо[d][1,2,3]диазафосфол-2-ил)цикло-
6.
Корнев А.Н., Дорадо Даса Д.Ф., Сущев В.В., Пано-
гекс-1-ен-1-ил}фосфанил]-2-фенилвинил}трифенил-
ва Ю.С., Гальперин В.Е., Фукин Г.К., Баранов E.В.,
фосфонийбромид
(5). Раствор
3a,6a-диаза-1,4-
Абакумов Г.А. // Изв. АН. Сер. хим. 2017. № 1.
дифос-фапенталена (0.16 г, 0.64 ммоль) в ТГФ
C. 114; Kornev A.N., Dorado Daza D.F., Sushev V.V.,
(15 мл) и раствор карбазола (0.107 г, 0.64 ммоль) в
Panova Y.S., Galperin V.E., Fukin G.K., Baranov E.V.,
ТГФ (10 мл) приливали к мелкодисперсной взвеси
Abakumov G.A. // Russ. Chem. Bull. 2018. Vol. 67.
трифенил(фенилэтинил)фосфонийбромида (0.283 г,
P. 114. doi 10.1007/s11172-018-2045-3
0.64 ммоль) в том же растворителе
(5 мл).
7.
Корнев А.Н., Гальперин В.Е., Сущев В.В.,
Золотарева Н.В., Фукин Г.К., Черкасов А.В.,
Реакционную смесь перемешивали в течение 1 ч до
Абакумов Г.А. // Изв. АН. Сер. хим. 2016. № 10.
полного растворения фосфониевой соли. Цвет
С. 2425; Kornev A.N., Galperin V.E., Sushev V.V.,
раствора становился желто-коричневым. Раствор
Zolotareva N.V., Fukin G.K., Cherkasov A.V.,
концентрировали. Желтые кристаллы перекристал-
Abakumov G.A. // Russ. Chem. Bull. 2017. Vol. 65.
лизовывали из ТГФ. Выход 0.53 г (97%). ИК
P. 2425. doi 10.1007/s11172-016-1632-4
спектр, ν, см-1: 1622, 1586, 1338, 1328, 1251, 1216,
8.
Kornev A.N., Galperin V.E., Panova Y.S., Arapova A.V.,
1169, 1145, 1107, 1165, 1022, 997, 974, 960, 921,
Baranov E.V., Fukin G.K., Abakumov G.A. // Z. anorg.
887, 859, 847, 814, 791, 749, 689, 632, 611, 590, 558,
allg. Chem. 2017. Vol. 643. P. 1208. doi 10.1002/
516, 496, 470, 454. Спектр ЯМР 1Н, δ, м. д.: 0.8-3.2
zaac.201700223
м (16H, с-С6Н8), 6.4-8.1 м (24Н, СН). Спектр ЯМР
9.
Kornev A.N., Galperin V.E., Sushev V.V., Zolotareva N.V.,
31Р, δР, м. д.: 218.0 д (3JPP = 5.0 Гц), 27.5 м, 12.3 д
Baranov E.V., Fukin G.K., Abakumov G.A. // Eur. J.
(3JPP = 5.5 Гц). Найдено, %: C 69.47; H 5.78; Br 8.63;
Inorg. Chem. 2016. Vol. 22. P. 3629. doi 10.1002/
ejic.201600348
P 9.90. C54H53BrN3OP3. Вычислено, %: C 69.53; H
10.
Корнев А.Н., Гальперин В.Е., Сущев В.В., Пано-
5.73; Br 8.57; P 9.96.
ва Ю.С., Фукин Г.К., Черкасов А.В., Абакумов Г.А. //
Изв. АН. Сер. хим. 2016. № 11. С. 2658; Kornev A.N.,
ФОНДОВАЯ ПОДДЕРЖКА
Galperin V.E., Sushev V.V., Panova Y.S., Fukin G.K.,
Cherkasov A.V., Abakumov G.A. // Russ. Chem. Bull.
Работа выполнена при финансовой поддержке
2017. Vol. 65. P. 2658. doi 10.1007/s11172-016-1601-y
Российского научного фонда (грант № 14-13-01015-
11.
Bushuk S.B., Carré F.H., Guy D.M.H., Douglas W.E.,
П) с использованием оборудования Аналитического
Kalvinkovskya Y.A., Klapshina L.G., Rubinov A.N.,
центра Института металлоорганической химии им.
Stupak A.P., Bushuk B.A. // Polyhedron. 2004. Vol. 23.
Г.А. Разуваева РАН. Рентгенодифракционные
P. 2615. doi 10.1016/j.poly.2004.06.026
исследования выполнены в рамках госзадания
12.
Бацанов С.С. // Изв. АН. Сер. хим.
1991.
№ 7.
Министерства образования и науки РФ (№ АААА-
С. 1548; Batsanov S.S. // Russ. J. Inorg. Chem. 1991.
А16-116122110053-1, тема № 44.2).
Vol. 36. P. 1694. doi 10.1007/BF00696950
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
ВЗАИМОДЕЙСТВИЕ 3a,6a-ДИАЗА-1,4-ДИФОСФАПЕНТАЛЕНА
67
13. Yavari I., Adib M., Hojabri L. // Tetrahedron. 2002.
23. Sheldrick G.M. SHELXTL, Structure Determination
Vol. 58. P. 7213. doi 10.1016/s0040-4020(02)00788-3
Software Suite. Bruker AXS, Madison, WI, 2003.
14. Maghsoodlou M.T., Hazeri N., Khorasani S.M.H.,
24. Sheldrick G.M. // Acta Crystallogr. (A). 2015. Vol. 71.
Moghaddam H.M., Nassiri M., Salehzadeh J.
//
P. 3. doi 10.1107/S2053273314026370
Phosphorus, Sulfur, Silicon, Relat. Elem.
2009.
25. Sheldrick G.M. // Acta Crystallogr. (C). 2015. Vol 71.
Vol. 184. P. 1713. doi 10.1080/10426500802275093
P. 3. doi 10.1107/S2053229614024218
15. Багдасарян Г.В., Погосян П.С., Паносян Г.А.,
26. Sheldrick G.M. SADABS Bruker/Siemens Area
Инджикян М.Г.
// ЖОХ.
2007. Т.
77. С.
769;
Bagdasaryan G.B., Panosyan P.S., Indzhikyan M.G. //
Detector Absorption Correction Program. Bruker AXS,
Russ. J. Gen. Chem. 2007. Vol. 77. P. 866. doi
Madison, Wisconsin, USA, 2016.
10.1134/S1070363207050088
27. Frisch G.W.T.M.J., Schlegel H.B., Scuseria G.E.,
16. Багдасарян Г.В., Погосян П.С., Паносян Г.А.,
Robb M.A., Cheeseman J.R., Montgomery J.A., Jr.,
Асратян Г.В., Инджикян М.Г. // ЖОХ. 2006. Т. 76.
Vreven T., Kudin K.N., Burant J.C., Millam J.M.,
С. 1380; Bagdasaryan G.B., Pogosyan P.S., Panosyan G.A.,
Iyengar S.S., Tomasi J., Barone V., Mennucci B., Cossi M.,
Asratyan G.V., Indzhikyan M.G. // Russ. J. Gen. Chem.
Scalmani G., Rega N., Petersson G.A., Nakatsuji H.,
2006.
Vol.
76.
P.
1324.
doi
10.1134/
Hada M., Ehara M., Toyota K., Fukuda R., Hasegawa J.,
S1070363206080299
Ishida M., Nakajima T., Honda Y., Kitao O., Nakai H.,
17. Bagdasaryan G.B., Pogosyan P.S., Indzhikyan M.G. //
Klene M., Li X., Knox J.E., Hratchian H.P., Cross J.B.,
Hayastani Kimiakan Handes. 2008. Vol. 61. P. 397.
Adamo C., Jaramillo J., Gomperts R., Stratmann R.E.,
18. Hoffmann H.F.H. // Tetrahedron Lett. 1964. Vol. 5.
Yazyev O., Austin A.J., Cammi R., Pomelli R., Ochterski R.,
P. 983. doi 10.1016/S0040-4039(00)90417-9
Ayala P.Y., Morokuma K., Voth G.A., Salvador P.,
19. Kolodiazhnyi O.I. Phosphorus Ylides. Chemistry and
Dannenberg J.J., Zakrzewski V.G., Dapprich S.,
Application in Organic Synthesis. New York;
Daniels A.D., Strain M.C., Farkas M.C., Malick D.K.,
Chichester; Brisbane; Singapore; Toronto: Wiley VCH,
Rabuck A.D., Raghavachari K., Foresman J.B., Ortiz J.V.,
1999.
Cui Q., Baboul A.G., Clifford S., Ciosłowski J., Stefa-
20. Mathey F. // Chem. Rev. 1990. Vol. 90. P. 997. doi
nov B.B., Liu G., Liashenko A., Piskorz P., Komaromi I.,
10.1021/cr00104a004
Martin R.L., Fox D.J., Keith T., Al&Laham M.A.,
21. Dickstein J.I., Miller S.I. // J. Org. Chem. 1972. Vol. 37.
Peng C.Y., Nanayakkara A., Challacombe M., Gill P.M.W.,
P. 2168. doi 10.1021/jo00978a025
Johnson B., Chen W., Wong M.W., Gonzalez C.,
22. BrukerAXS. SAINT Data Reduction and Correction
Pople J.A. Gaussian-03. Gaussian, Inc., Pittsburgh (PA),
Program 8.37A. Madison, Wisconsin, USA, 2016.
2004.
Reactions of 3a,6a-Diaza-1,4-diphosphapentalene
with Substituted Acetylenes
A. N. Kornev*, V. E. Galperin, Yu. S. Panova, V. V. Sushev,
G. K. Fukin, E. V. Baranov, and G. A. Abakumov
Razuvaev Institute of Organometallic Chemistry of Russian Academy of Sciences,
ul. Tropinina 49, Nizhny Novgorod, 603137 Russia
*e-mail: akornev@iomc.ras.ru
Received June 21, 2018
Revised June 21, 2018
Accepted June 28, 2018
The reaction of 3a, 6a-diaza-1,4-diphosphapentalene with 1-bromo-2-phenylacetylene led to the formation of 1,1
-bis(phenylethynyl)- and 1,4-dibromo-3a,6a-diaza-1,4-diphosphapentalene. The latter was also obtained in an
alternative way by reacting 1,4-dichloro-3a,6a-diaza-1,4-diphosphapentalene with lithium phenylacetylide in
96% yield; no isomeric 1,4-bis(phenylethynyl)-3a, 6a-diaza-1,4-diphosphapentalene was formed. The reaction in
the three-component system
3a,
6a-diaza-1,4-diphosphapentalene-[Ph3PC≡CPh]Br-carbazole proceeded
through the addition of carbazole to the initially formed complex of 3a,6a-diaza-1,4-diphosphapentalene with
[Ph3PC≡CPh]Br with a P-N bond rupture. B3LYP/6-31+G(d) method was used to calculate the reaction
products and intermediates.
Keywords: heterophosphols, heteropentalenes, phosphorus ylides, carbenoids
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019