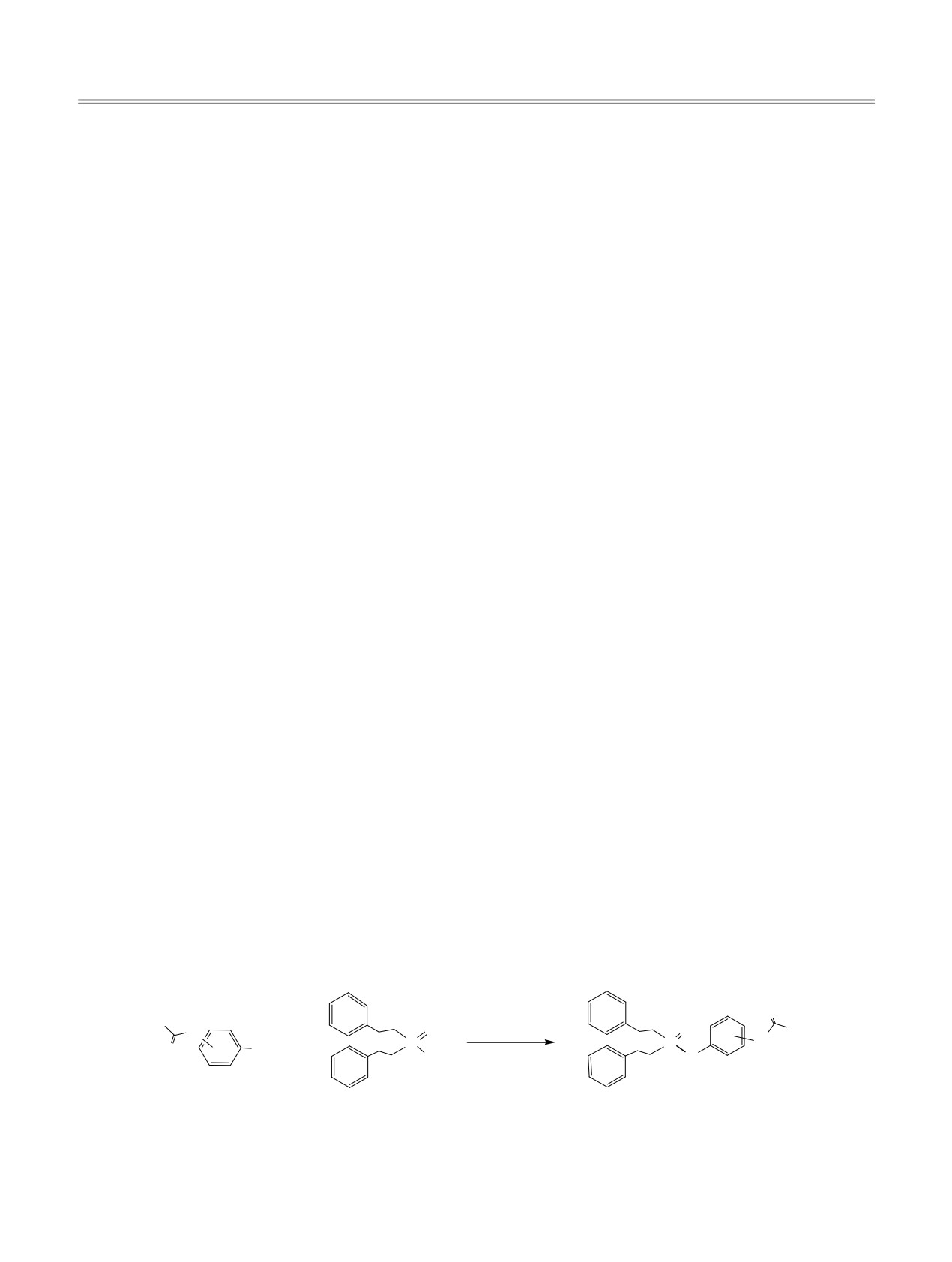ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 1, с. 68-72
УДК 547.34
ФОСФОРИЛИРОВАНИЕ АЦЕТИЛАМИНОФЕНОЛОВ
ВТОРИЧНЫМИ ФОСФИНХАЛЬКОГЕНИДАМИ: СИНТЕЗ
О-(АЦЕТИЛАМИНО)ФЕНИЛХАЛЬКОГЕНОФОСФИНАТОВ
© 2019 г. П. А. Волков, Н. И. Иванова, А. А. Тележкин, К. О. Храпова,
Л. И. Ларина, Н. К. Гусарова, Б. А. Трофимов*
Иркутский институт химии имени А. Е. Фаворского Сибирского отделения Российской академии наук,
ул. Фаворского 1, Иркутск, 664033 Россия
*e-mail: boris_trofimov@irioch.irk.ru
Поступило в Редакцию 5 июля 2018 г.
После доработки 5 июля 2018 г.
Принято к печати 16 июля 2018 г.
4-Ацетиламинофенол (парацетамол) и его структурные изомеры (2- и 3-ацетиламинофенолы) реагируют
со вторичными фосфинхалькогенидами при комнатной температуре в системе CCl4-Et3N по схеме
окислительного кросс-сочетания, образуя О-(ацетиламино)фенилхалькогенофосфинаты с выходом до
80%.
Ключевые слова: ацетиламинофенолы, вторичные фосфинхалькогениды, кросс-сочетание, O-(ацетил-
амино)фенилхалькогенофосфинаты
DOI: 10.1134/S0044460X19010104
Ацетиламинофенолы и их производные обладают
интермедиатов для создания, например, молеку-
различными видами фармакологической актив-
лярных микрогелей [8], ингибиторов пептидаз [9],
ности [1-6], включая противораковую [2], противо-
гибридных нанокомпозитов
[14], супрамолеку-
туберкулезную [4] и антиартритную [5]. Среди них
лярных комплексов [15], антипиренов [13]. При
особое место занимает
4-ацетиламинофенол
-
этом в качестве фосфорилирующих реагентов
известный анальгетик и антипиретик (парацетамол,
использовались диэтилцианофосфонаты
[16],
циклофосфазены [11, 13], реагент Лоуссона [12].
В настоящей работе нами впервые проде-
монстрирована возможность применения доступ-
ных вторичных фосфинхалькогенидов, легко
получаемых из элементного фосфора, стирола и
В последнее десятилетие значительное внимание
халькогенов [17], для синтеза новых фосфорилиро-
исследователей уделяется направленному синтезу
ванных производных парацетамола и его изомеров.
фосфорилированных производных парацетамола и
его структурных изомеров (2- и 3-ацетиламино-
Установлено, что 2-, 3- и 4-ацетиламинофенолы
фенолов) [7-15] - перспективных прекурсоров и
1-3 реагируют с бис(2-фенилэтил)фосфиноксидом
Схема 1.
Et3N/CCl4,
O
Me
H
X
2025oC
X
Me
N
P
P
NH
OH
+
O
H
CHCl3
O
[Et3NH]Cl
13
46
7aд
R = 2-NHC(O)Me (1, 7а-в), 3-NHC(O)Me (2, 7г), 4-NHC(O)Me (3, 7д).
68
ФОСФОРИЛИРОВАНИЕ АЦЕТИЛАМИНОФЕНОЛОВ
69
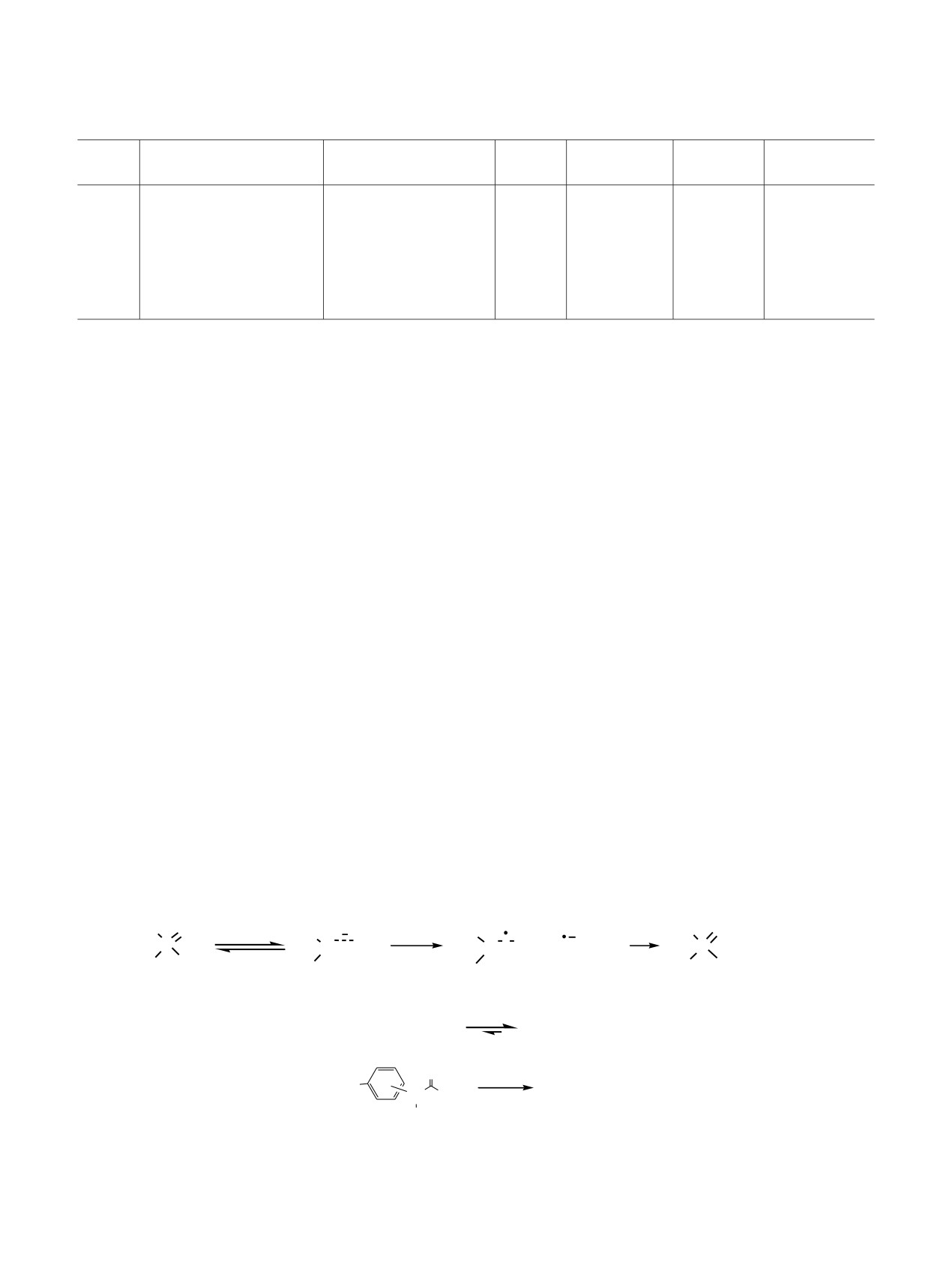
Фосфорилирование ацетиламинофенолов вторичными фосфинхалькогенидамиа
№
Ацетиламинофенол
[Ph(CH2)2]2P(X)H
X
Время, ч
Продукт
Выход, %
опыта
1
1
4
О
17
7а
80
2
1
5
S
12
7б
68
3
1
6
Se
6
7в
78
4
2
6
Se
3
7г
76
5
3
6
Se
4
7д
77
а Условия реакции: ацетиламинофенол 1-3 (1.0 ммоль), фосфинхалькогенид 4-6 (1.0 ммоль), Et3N (1.0 ммоль), ССl4 (4 мл),
инертная атмосфера (аргон).
4, фосфинсульфидом 5 и фосфинселенидом 6 в
генидами, вероятно, включает депротонирование
мягких условиях (комнатная температура, 3-17 ч,
вторичного фосфинхалькогенида в присутствии
система CCl4-Et3N) по схеме окислительного кросс-
триэтиламина и образование P,X-амбидентного
сочетания, образуя O-(ацетиламино)фенилхалько-
халькогенофосфинит-аниона А, который участвует
генофосфинаты 7а-д с выходом 68-80% (схема 1,
в одноэлектронном переносе с молекулой ССl4,
см. таблицу). В этих условиях зафиксировано
образуя свободный радикал Б и анион-радикал В,
также образование хлороформа и гидрохлорида
взаимодействие которых между собой приводит к
триэтиламмония.
хлорфосфинхалькогениду Г и карбаниону -CCl3
(схема 2). Протониpование последнего катионом
Мониторинг реакции осуществляли методом
триэтиламмония ведет к регенерации триэтил-
ЯМР 31Р по степени уменьшения интегральной
амина и образованию хлороформа, а реакция
интенсивности сигналов исходных вторичных
между хлоридом Г и ацетиламинофенолом 1-3
фосфинхалькогенидов 4-6 (31.2, 21.3 и 2.7 м. д.), а
дает O-(ацетиламино)фенилхалькогенофосфинаты
также по синхронному увеличению интегральной
7а-д.
интенсивности сигналов образующихся O-(ацетил-
амино)фенилхалькогенофосфинатов
7а-д
(92.0,
Хлорфосфинхалькогенид Г идентифицирован в
106-108 м. д.).
реакционной смеси методом ЯМР 1H, 13C, 31P с
использованием заведомого образца [19]. Подобная
Полученные результаты свидетельствуют о том,
схема окислительного кросс-сочетания между
что реакционная способность вторичных фосфин-
вторичными фосфинхалькогенидами и диацетон-D-
халькогенидов 4-6 возрастает в ряду: оксид 4 <
глюкозой в системе CCl4-Et3N была подтверждена
сульфид 5 < селенид 6 (см. таблицу, оп. № 1-3),
ранее методом ЭПР [20].
что согласуется с известными данными [18].
Схема реакции окислительного кросс-сочетания
Таким образом, разработан оригинальный и
ацетиламинофенолов с вторичными фосфинхалько-
эффективный метод фосфорилирования ацетил-
Схема 2.
R
X
Et3N
R
X
R
CCl4
R
P
+
CCl3
P X
P X
+
CCl4
P
R
H
e
R
Cl
_Et3
HN+
R
R
A
Б
В
Г
CCl3
+
Et3HN+
Et3N + CHCl3
O
Et3N
Г + HO
[Et3NH]Cl
+
7
N Me
H
13
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
70
ВОЛКОВ и др.
аминофенолов вторичными фосфинхалькогени-
85.5 Гц), 121.4 д (C6, 3JPC = 3.7 Гц), 124.7 (С3), 124.9
дами, открывающий удобный путь к ранее
(С4), 126.1 (С5), 126.8 (Сп), 128.1 (Сo), 128.9 (См),
неизвестным O-(ацетиламино)фенилхалькогенофос-
130.5 д (C2, 3JPC = 3.0 Гц),
140.0 д (Cи, 3JPC =
финатам
- потенциальным прекурсорам лекар-
14.3 Гц), 141.1 д (C1, 2JPC = 10.8 Гц), 168.9 (C=О).
ственных препаратов и новым реагентам для
Спектр ЯМР
15N (CDCl3), δN, м. д.: -254.4 д
органического синтеза.
(1JNH = 91.3 Гц). Спектр ЯМР 31P (CDCl3): δP 62.0 м. д.
Найдено, %: С 70.59; Н 6.34; N 3.28; P 7.49.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
С24Н26NO3P. Вычислено, %: С 70.75; Н 6.43; N 3.44;
P 7.60.
ИК спектры записаны на спектрометре Varian
O-[2-(Ацетиламино)фенил]дифенэтилтио-
3100 FT-IR в микрослое. Спектры ЯМР 1H, 13C, 15N,
фосфинат (7б). Выход 288 мг (68%), т. пл. 73-76°C.
31P и 77Se получены на спектрометрах Bruker DPX-
ИК спектр (пленка), ν, см-1: 3292, 3187 пл (NH),
400 и Bruker AV-400 (400.13, 100.62, 40.56, 161.98
1684 (C=O), 1600 (Ph), 1186 (P-O-C), 616 (P=S).
и 76.31 МГц соответственно) в ацетоне-d6, ДМСО-
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 2.23 с (3H, Me),
d6 и CDCl3, внутренний стандарт - ГМДС (1H, 13C),
2.13-2.23 м (4H, CH2P), 2.89-2.99 м (4H, CH2Ph),
MeNO2 (15N), Me2Se (77Se) и 85%-ная Н3РО4 (31Р).
7.04-7.09 м (2H, C4H, C6H), 7.16 д (4H, Ho, 3JНН =
Отнесение сигналов в спектрах ЯМР 1Н проведено
7.7 Гц), 7.21 м (1H, C5H), 7.26 м (2H, Hп), 7.32 д. д
с использованием 2D гомоядерного корреляцион-
(4H, Hм, 3JНН = 7.7, 3JНН = 7.5 Гц), 8.17 д (1H, C3H,
ного метода COSY. Резонансные сигналы атомов
3JНН = 8.2 Гц), 9.53 с (1Н, NH). Спектр ЯМР 13C
углерода отнесены на основании анализа
2D
(CDCl3), δС, м. д.: 24.7 (Me), 28.9 (CH2Ph), 36.0 д
гетероядерных корреляционных спектров HSQC и
(CH2P, 1JPC = 63.9 Гц), 121.5 д (C6, 3JPC = 3.2 Гц),
HMBC.
124.2 (С3), 124.7 (С4), 126.1 (С5), 126.8 (Сп), 128.3
Эксперимент проводили в инертной атмосфере
(Сo), 128.8 (См), 130.9 д (C2, 3JPC = 3.9 Гц), 139.8 д
(аргон). Контроль за ходом реакции осуществляли
(Cи, 3JPC = 15.6 Гц), 141.0 д (C1, 2JPC = 10.8 Гц),
методом 31Р ЯМР.
168.9 (C=О). Спектр ЯМР 15N (CDCl3), δN, м. д.:
-253.0 д (1JNH = 90.4 Гц). Спектр ЯМР 31P (CDCl3):
Синтез O-(ацетиламино)фенилдифенэтил-
δP 107.8 м. д. Найдено, %: С 67.91; Н 6.02; N 3.18; P
халькогенофосфинатов 7а-д (общая методика).
7.11; S 7.44. С24Н26NO2PS. Вычислено, %: С 68.06;
Смесь вторичного фосфинхалькогенида
4-6
Н 6.19; N 3.31; P 7.31; S 7.57.
(1.0 ммоль) и Et3N (1.0 ммоль) в 4 мл ССl4
O-[2-(Ацетиламино)фенил]дифенэтилселено-
перемешивали при температуре 20-25°C в течение
фосфинат (7в). Выход 367 мг (78%), т. пл. 84-86°C.
10 мин, затем добавляли ацетиламинофенол 1-3
ИК спектр (пленка), ν, см-1: 3300, 3184 пл (NH),
(1.0 ммоль) и перемешивали полученную смесь
1681 (C=O), 1600 (Ph), 1185 (P-O-C), 701 (P=Se).
при 20-25°C еще в течение 3-17 ч. Растворитель
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 2.23 с (3H, Me),
упаривали при пониженном давлении, к остатку
2.48-2.60 м (4H, CH2P), 2.90-3.12 м (4H, CH2Ph),
добавляли 1,4-диоксан (4 мл). Выпавший осадок
7.07-7.10 м (2H, C4H, C6H), 7.18 д (4H, Ho, 3JНН =
(хлорид триэтиламмония) удаляли фильтрованием,
7.7 Гц), 7.24-7.28 м (3H, C5H, Hп), 7.33 д. д (4H, Hм,
фильтрат упаривали в вакууме. Остаток промывали
3JНН = 7.8, 3JНН = 7.6 Гц), 8.17 д (1H, C3H, 3JНН =
небольшими порциями гексана (3 × 1 мл) и сушили
8.2 Гц), 8.62 с (1Н, NH). Спектр ЯМР 13C (CDCl3),
при пониженном давлении.
δС, м. д.: 24.8 (Me), 29.4 (CH2Ph), 37.9 д (CH2P, 1JPC =
2-(Ацетиламино)фенилдифенэтилфосфинат
53.5 Гц), 121.6 д (C6, 3JPC = 3.1 Гц), 124.6 (С3), 124.9
(7а). Выход 326 мг (80%), т. пл. 95-96°C. ИК
(С4), 126.3 (С5), 126.9 (Сп), 128.3 (Сo), 128.9 (См),
спектр (пленка), ν, см-1: 3259, 3194 пл (NH), 1683
130.9 д (C2, 3JPC = 3.1 Гц),
139.6 д (Cи, 3JPC =
(C=O),
1602 (Ph),
1233 (P=О),
1186 (P-O-C).
15.3 Гц), 141.2 д (C1, 2JPC = 11.9 Гц), 168.8 (C=О).
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 2.22 с (3H, Me),
Спектр ЯМР
15N (CDCl3), δN, м. д.: -252.2 д
2.15-2.26 м (4H, CH2P), 2.89-2.97 м (4H, CH2Ph),
(1JNH =
96.5 Гц). Спектр ЯМР 31P (ацетон-d6): δP
7.02-7.09 м (2H, C4H, C6H), 7.15 д (4H, Ho, 3JНН =
107.5 м. д. Спектр ЯМР 77Se (ацетон-d6), δSe, м. д.: -
7.5 Гц), 7.19-7.27 м (3H, C5H, Hп), 7.32 д. д (4H, Hм,
260.8 д (1JPSe = 804.6 Гц). Найдено, %: С 61.15; Н
3JНН = 7.5, 3JНН = 7.3 Гц), 8.18 д (1H, C3H, 3JНН =
5.49; N
2.91; P
6.43; Se
16.68. С24Н26NO2PSe.
8.1 Гц), 9.49 с (1Н, NH). Спектр ЯМР 13C (CDCl3),
Вычислено, %: С 61.28; Н 5.57; N 2.98; P 6.58; Se
16.79.
δС, м. д.: 24.5 (Me), 27.9 (CH2Ph), 29.5 д (CH2P, 1JPC =
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
ФОСФОРИЛИРОВАНИЕ АЦЕТИЛАМИНОФЕНОЛОВ
71
O-[3-(Ацетиламино)фенил]дифенэтилселено-
Mikhailenko M.A., Shakhtshneider T.P., Drebu-
фосфинат (7г). Выход 357 мг (76%), масло. ИК
shchak T.N., Boldyrev V.V. // Russ. J. Gen. Chem. 2006.
Vol. 76. P. 52. doi 10.1134/S1070363206010117
спектр (пленка), ν, см-1: 3281, 3185 пл (NH), 1683
(C=O), 1600 (Ph), 1187 (P-O-C), 700 (P=Se). Спектр
2. Hanif F., Perveen K., Jawed H., Ahmed A., Malhi S.M.,
Jamall S., Simjee S.U. // Cancer Cell Int. 2014. Vol. 14.
ЯМР 1Н (CDCl3), δ, м. д.: 2.18 c (3H, Me), 2.46-2.58
P. 133. doi 10.1186/s12935-014-0133-5
м (4H, CH2P), 2.93-3.11 м (4H, CH2Ph), 6.95 д (1H,
C6H, 3JНН = 7.8 Гц), 7.21 д (4H, Ho, 3JНН = 7.9 Гц),
3. Маленковская М.А., Васянина Л.К., Грачев М.К. //
ЖОХ. 2015. Т. 85. С. 1661; Malenkovskaya M.A.,
7.20-7.23 м (4H, C4H, C5H, Hп), 7.31 д. д (4H, Hм,
Vasyanina L.K., Grachev M.K. // Russ. J. Gen. Chem.
3JНН = 7.9, 3JНН = 7.8 Гц), 7.49 уш. c (1H, C2H), 9.28
2015.
Vol.
85.
P.
1681.
doi
10.1134/
уш. с (1Н, NH). Спектр ЯМР 13C (CDCl3), δС, м. д.:
S1070363215070191
24.6 (Me), 29.4 (CH2Ph),
37.6 д (CH2P, 1JPC =
4. Guzman J.D., Mortazavi P.N., Munshi T.,
53.5 Гц), 113.4 д (C6, 3JPC = 3.6 Гц), 116.4 (C5), 117.3
Evangelopoulos D., McHugh T.D., Gibbons S.,
(C2), 126.6 (Сп), 128.3 (Сo), 128.7 (См), 129.6 (С4),
Malkinson J., Bhaktaa S. // Med. Chem. Commun.
139.3 (C3), 140.0 д (Cи, 3JPC = 15.8 Гц), 151.0 д (C1,
2014. Vol. 5. P. 47. doi 10.1039/c3md00251
1JPC
= 10.0 Гц), 168.8 (C=О). Спектр ЯМР 15N
5. Gul A., Kunwar B., Mazhar M., Perveen K., Simjee U.S. //
(CDCl3): δN -247.1 м. д. Спектр ЯМР 31P (CDCl3): δP
Inflammation. 2017. Vol. 40. P. 1177. doi 10.1007/
106.1 м. д. Спектр ЯМР 77Se (CDCl3), δSe, м. д.:
s10753-017-0561-1
–249.0 д (1JPSe = 799.0 Гц). Найдено, %: С 61.19; Н
6. Santoh M., Sanoh S., Ohtsuki Y., Ejiri Y., Kotake Y.,
5.43; N 2.89; P 6.46; Se 16.65. С24Н26NO2PSe. Вычис-
Ohta S. // Biochem. Biophys. Res. Commun. 2017.
лено, %: С 61.28; Н 5.57; N 2.98; P 6.58; Se 16.79.
Vol. 486. P. 639. doi 10.1016/j.bbrc.2017.03.073
7. Lusch M.J., Woller K.R., Keller A.M., Turk M.C. //
O-[4-(Ацетиламино)фенил]дифенэтилселено-
Synthesis. 2005. N 4. P. 0551. doi 10.1055/s-2005-
фосфинат (7д). Выход 362 мг (77%), т. пл. 86-88°C.
861790
ИК спектр (пленка), ν, см-1: 3300, 3204 (NH), 1664
8. Pasetto P., Maddock S.C., Resmini M. // Anal. Chim.
(C=O), 1608 (Ph), 1200 (P-O-C), 698 (P=Se). Спектр
Acta.
2005. Vol.
542. P.
66. doi
10.1016/
ЯМР 1Н (ДМСО-d6), δ, м. д.: 2.03 (3H, Me), 2.58-
j.aca.2005.01.069
2.60 м (4H, CH2P), 2.88-2.97 м (4H, CH2Ph), 7.09 д
9. Van der Veken P., Soroka A., Brandt I., Chen Y.-S.,
(2H, C2H, C6H, 3JНН = 8.2 Гц), 7.20-7.33 м (10H, Ph),
Maes M.-B., Lambeir A.-M., Chen X., Haemers A.,
7.55 д (2H, C3H, C5H, 3JНН = 8.2 Гц), 10.02 с (1Н,
Scharpe S., Augustyns K., De Meester I. // J. Med.
NH). Спектр ЯМР 13C (ДМСО-d6), δС, м. д.: 24.8
Chem. 2007. Vol. 50. P. 5568. doi 10.1021/jm701005a
(Me), 29.4 (CH2Ph), 37.3 д (CH2P, 1JPC = 53.5 Гц),
10. Reddy K.R.K.K., Prasad G.S., Kumar M.A., Reddy C.S.,
120.1 (C3,5), 121.0 д (C2,6, 3JPC = 4.1 Гц), 126.4 (Сп),
Raju C.N. // E-Journal Chem. 2008. 5(S1). P. 1025. doi
128.5 (Сo), 128.6 (См), 136.5 (С4), 140.5 д (Cи, 3JPC =
10.1155/2008/415030
16.1 Гц), 145.9 д (C1, 1JPC = 10.1 Гц), 168.4 (C=О).
11. Чистяков Е.М., Филатов С.H., Киреев В.В., Лысен-
Спектр ЯМР 15N (ДМСО-d6), δN, м. д.: -246.1 д
ко К.А., Бузин М.И., Чуев В.П. // ЖОХ. 2012. Т. 82.
(1JNH = 90.0 Гц). Спектр ЯМР 31P (ацетон-d6): δP
С. 906; Chistyakov E.M., Filatov S.N., Kireev V.V.,
107.2 м. д. Спектр ЯМР 77Se (ацетон-d6), δSe, м. д.:
Lysenko K.A., Buzin M.I., Chuev V.P. // Russ. J. Gen.
–260.9 д (1JPSe = 804.9 Гц). Найдено, %: С 61.17; Н
Chem.
2012. Vol.
82. Р.
1065. doi
10.1134/
5.41; N 2.86; P 6.49; Se 16.67. С24Н26NO2PSe. Вычис-
S1070363212060047
лено, %: С 61.28; Н 5.57; N 2.98; P 6.58; Se 16.79.
12. Низамов И.С, Батыева Е.С., Шуматбаев Г.Г.,
Низамов И.Д., Черкасов Р.А. // ЖОрХ. 2014. Т. 50.
Работа выполнена с использованием материально-
С. 1774; Nizamov I.S., Batyeva E.S., Shumatbaev G.G.,
технической базы Байкальского аналитического
Nizamov I.D., Cherkasov R.A. // Russ. J. Org. Chem.
центра коллективного пользования Сибирского
2014. Vol. 50. Р. 1755. doi 10.1134/S1070428014120069
отделения Российской академии наук.
13. Krishnadevi K., Selvaraj V. // New J. Chem. 2015.
Vol. 39. P. 6555. doi 10.1039/c5nj00364d
КОНФЛИКТ ИНТРЕСОВ
14. Heck J.G., Feldmann C. // J. Colloid Interface Sci.
Авторы заявляют об отсутствии конфликта
2016. Vol. 481. P. 69. doi 10.1016/j.jcis.2016.07.030
интересов.
15. Sharma K., Kalita A.Ch., Murugavel R. // Cryst. Eng.
Commun.
2017. Vol.
19. P.
1058. doi
10.1039/
СПИСОК ЛИТЕРАТУРЫ
C6CE02215D
1. Михайленко М.А., Шаxтшнейдер Т.П., Дребущак Т.Н.,
16. Guzman A., Diaz E. // Synth. Commun. 1997. Vol. 27.
Болдырев В.В.
// ЖОХ.
2006. Т.
76. С.
48;
P. 3035. doi 10.1080/00397919708005008
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
72
ВОЛКОВ и др.
17. Gusarova N.K., Arbuzova S.N., Trofimov B.A. // Pure
С. 206; Gusarova N.K., Volkov P.А., Ivanova N.I.,
Appl. Chem. 2012. Vol. 84. P. 439. doi 10.1351/PAC-
Khrapova K.O., Trofimov B.A. // Russ. J. Gen. Chem.
CON-11-07-11
2015. Vol. 85. P. 380. doi 10.1134/S107036321502005X
18. Gusarova N.K., Volkov P.А., Ivanova N.I., Larina L.I.,
20. Volkov P.A., Ivanova N.I., Gusarova N.K., Sukhov B.G.,
Trofimov B.A. // Synthesis. 2011. N 22. P. 3723. doi
Khrapova K.O., Zelenkov L.E., Smirnov V.I., Borodi-
10.1055/s-0030-1260227
na T.N., Vakul’skaya T.I., Khutsishvili S.S., Trofimov B.A. //
19. Гусарова Н.К., Волков П.А., Иванова Н.И., Хра-
Heteroatom Chem. 2015. Vol. 26. P. 329. doi 10.1002/
пова К.О., Трофимов Б.А. // ЖОХ. 2015. Т.
85.
hc.21264
Phosphorylation of Acetylaminophenols with Secondary
Phosphine Chalcogenides:
Synthesis of O-(Acetylamino)phenyl Chalcogenophosphinates
P. A. Volkov, N. I. Ivanova, A. A. Telezhkin, K. O. Khrapova,
L. I. Larina, N. K. Gusarova, and B. A. Trofimov*
A.E. Favorskii Irkutsk Institute of Chemistry, Siberian Branch of the Russian Academy of Sciences,
ul. Favorskogo 1, Irkutsk, 664033 Russia
*e-mail: boris_trofimov@irioch.irk.ru
Received July 5, 2018
Revised July 5, 2018
Accepted July 16, 2018
Oxidative cross-coupling of 4-acetylaminophenol (paracetamol) and its structural isomers (2- and 3-acetylamino-
phenols) with secondary phosphine chalcogenides at room temperature in the CCl4-Et3N produced O-(acetyl-
amino)phenyl chalcogeneophosphinates in a 80% yield.
Keywords: acetylaminophenols, secondary phosphine chalcogenides, cross-coupling, O-(acetylamino)phenyl
chalcogenephosphinates
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019