ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 1, с. 83-88
УДК 546.791.6
СИНТЕЗ И ИССЛЕДОВАНИЕ УРАНАТОВ КАЛЬЦИЯ,
СТРОНЦИЯ И БАРИЯ
© 2019 г. Н. Г. Черноруков, О. В. Нипрук*, Г. Н. Черноруков,
Р. В. Абражеев, К. А. Чаплиёва
Нижегородский государственный университет имени Н. И. Лобачевского,
пр. Гагарина 23а, Нижний Новгород, 603950 Россия
*e-mail: nipruk@yandex.ru
Поступило в Редакцию 28 июня 2018 г.
После доработки 28 июня 2018 г.
Принято к печати 9 июля 2018 г.
При взаимодействии синтетического скупита UO3·2.25H2O с водными растворами нитратов кальция,
стронция и бария в гидротермальных условиях при 200°С и рН = 7-8 получены индивидуальные
кристаллические соединения MIIU3O10·nH2O (MII = Ca, Sr) и BaU2O7·3H2O. Методами химического
анализа, рентгенофлуоресцентной спектрометрии, рентгенографии, ИК спектроскопии, термографии
установлен их состав и строение, изучены процессы дегидратации и термораспада.
Ключевые слова: уранаты, кальций, стронций, барий, рентгенография, дегидратация, термораспад
DOI: 10.1134/S0044460X1901013X
Уранаты щелочноземельных элементов могут
Вa [r(Ba2+)/r(O2-) = 1.01]. Это обстоятельство может
быть отнесены к числу эффективных форм связы-
служить реальной причиной различий в составе и
вания урана в природной среде и в различных
строении полиуранатов щелочноземельных элементов.
технологических процессах. Возможность взаимо-
Наши попытки получить по гидротермальной
действия урана с кальцием обусловлена его
методике какой-либо уранат бериллия оказались
значительным содержанием в земной коре (3.20%).
безуспешными, вероятно, потому, что отношение
Стронций - постоянный спутник урана как продукт
r(Be2+)/r(O2-) = 0.25 соответствует тетраэдрической
деления, и возможность его взаимодействия с
координации Ве, что существенно ниже границы
ураном с
образованием
индивидуальных
октаэдрической и более высокой координации,
кристаллических фаз весьма важна при получении
характерной для большинства известных уранатов.
ядерного
топлива
и
при
переработке
Следующий за бериллием щелочноземельный элемент
радиоактивных отходов. Барий в виде его
Mg образует легко воспроизводимый уранат
различных изотопов - также один из продуктов
MgU3O10·6H2O [1, 2]. Кристаллическая решетка
деления урана. Значительные количества бария
данного соединения имеет слоистое строение. В
содержатся в радиоактивных отходах - продуктах
ней двумерные слои
[(UO2)3O4]δ
–,
несущие
ядерного топливного цикла. Изучение возмож-
отрицательные электронные заряды, объединены
ности образования индивидуальных соединений
ионными форами атомов Mgδ+ в трехмерную
при взаимодействии урана и бария важно для
решетку. Молекулы H2O образуют координацион-
технологий ядерного топливного цикла.
ное окружение атомов Mg и выполняют функцию
компенсатора их координационной емкости.
Размерные параметры щелочноземельных
Наряду с увеличением координационных возмож-
элементов в виде ионных радиусов занимают
ностей в ряду Са → Sr → Ва следует ожидать
широкий диапазон значений от 0.34 Å для Ве до
возрастания ионных составляющих связей MII-О и
1.38 Å для Ва. При таком различии размеров
соответствующего этому усиления эффекта ненап-
координационные
числа
щелочноземельных
равленности и ненасыщаемости связей в силовом
элементов весьма разнообразны и лежат в пределах
поле, создаваемом сферически симметричными
от 4 для Ве [r(Be2+)/r(O2-) = 0.25] до 8 и более для
s-орбиталями
атомов
щелочноземельных
83
84
ЧЕРНОРУКОВ и др.
Таблица 1. Результаты химического анализа уранатов кальция, стронция и бария
MIIO, мас%
UO3, мас%
H2O, мас%
Соединение
rM2+, Å
rM2+/rO2-
вычислено
найдено
вычислено
найдено
вычислено
найдено
СаU3O10·5H2O
5.59
5.49
85.45
85.37
8.97
8.87
1.04
0.76
SrU3O10·4H2O
10.02
9.93
83.01
82.94
6.97
6.89
1.20
0.88
ВаU2O7·3H2O
19.67
19.40
73.39
72.81
6.93
7.00
1.38
1.01
элементов. В результате возможно искажение
MII(NO3)2 + 3UO3·2.25H2O + nH2O
формы полиэдров MII-Оn с образованием различ-
ных по составу и строению уранатов, что
P, T MII[(UO2)3O4]·nH2O + 2HNO3 + 5.75H2O,
подтверждают имеющиеся данные о различных
(MII = Ca и Sr),
(1)
уранатах щелочноземельных элементов, наиболее
достоверными из которых следует считать резуль-
MII(NO3)2 + 2UO3·2.25H2O
таты рентгеноструктурных работ, выполненных на
образцах минеральных образований Ca(UO2)6O4
P, T MIIU2O7·3H2O +2HNO3 + 0.5H2O,
(OH)6·8H2O (becquerelite), Вa(UO2)6O4(OH)6·8H2O
(2)
(billietite) и Ba(UO2)3O3(OH)2·3H2O (protasite) [3-6].
(MII = Ba).
Результаты других работ противоречивы и менее
достоверны [7-10].
С применением спектральных и термогра-
фических методов изучен химический и функци-
Нами получены уранаты кальция, стронция и
ональный состав полученных соединений, опре-
бария в виде соединений MII[(UO2)3О4]·nH2O (MII =
делены их кристаллографические характеристики,
Ca, Sr) и BaU2O7·3H2O по реакциям (1) и
(2)
исследовано состояние и роль H2O в форми-
соответственно.
ровании структуры, дана оценка основных факто-
ров, определяющих состав и строение гидра-
тированных уранатов кальция, стронция и бария.
Таблица 2. Рентгенографические характеристики уранатов
кальция, стронция и бария
В табл. 1 приведены результаты химического
анализа синтезированных нами уранатов Са, Sr и
СаU3O10·5H2O
SrU3O10·4H2O
ВаU3O10·3H2O
Ва. Здесь же представлены отношения ионных
d, Å
I, %
d, Å
I, %
d, Å
I, %
радиусов r(М2+)/r(O2-), величины которых могут
служить оценкой наиболее вероятной формы
6.768
100
6.873
100
7.058
37
координационных полиэдров МIIОn. Результаты
6.038
5
6.050
7
3.515
54
химического анализа показывают, что формульные
3.469
40
3.534
43
3.472
50
единицы каждого из уранатов не аналогичны,
однако все соединения получены в виде индиви-
3.376
51
3.466
55
3.115
100
дуальных кристаллических фаз. Подтверждением
3.081
65
3.093
67
2.828
6
этому может служить полное совпадение в каждом
из повторных синтезов дифракционных макси-
2.752
7
2.766
9
2.473
21
мумов отражения по их относительной интен-
2.419
21
2.441
28
2.006
18
сивности и положению на оси 2θ. Кристаллические
решетки кальция и стронция близки между собой
2.272
10
2.288
14
1.191
6
по набору дифракционных максимумов отражения
2.244
11
2.291
10
1.954
38
hkl и их относительной интенсивности (см.
2.155
5
2.184
8
1.923
6
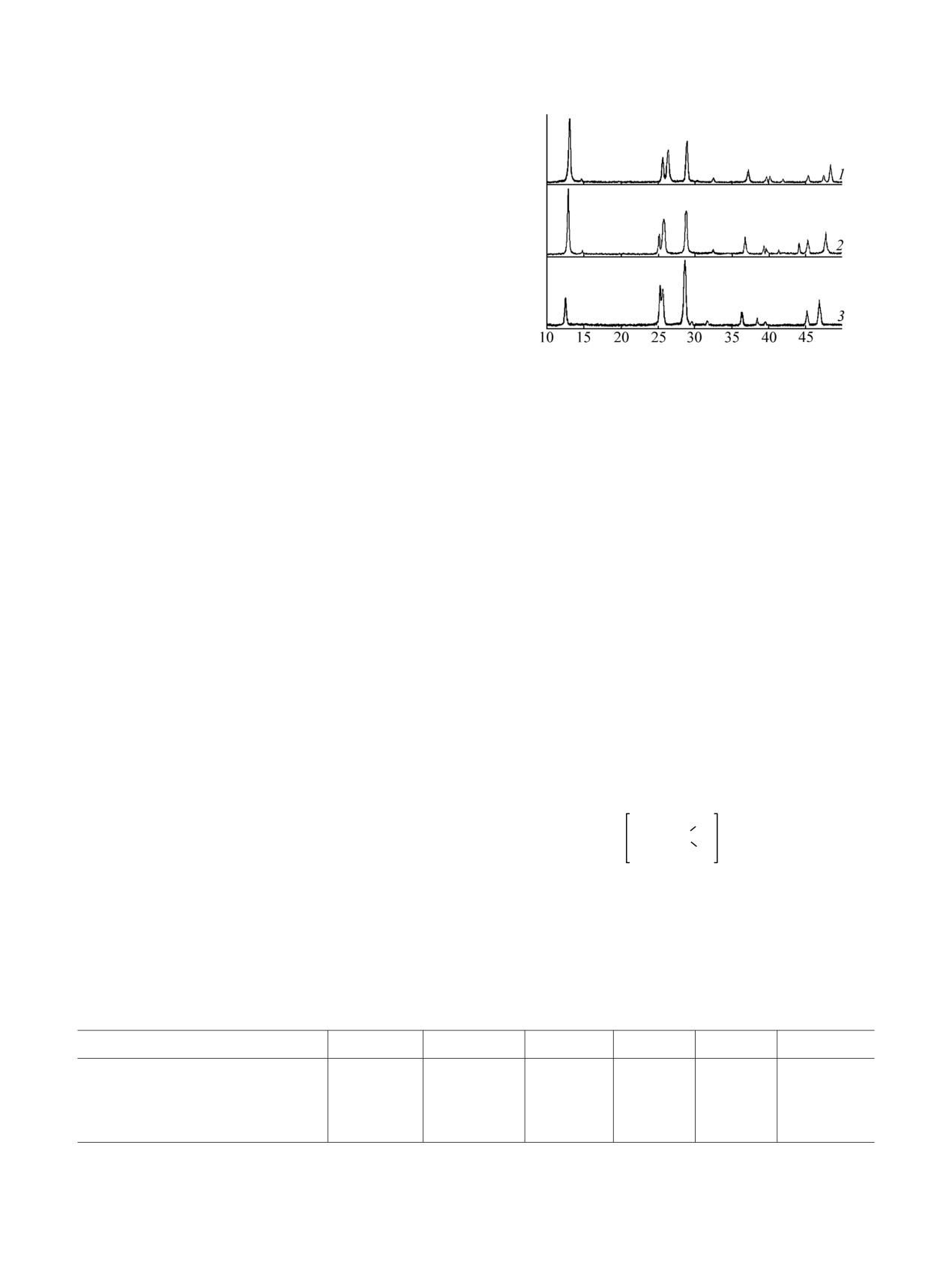
рисунок, табл. 2).
2.000
11
2.053
17
1.909
5
В приведенных на рисунке дифрактограммах
уранатов кальция и стронция в области малых
1.916
11
2.003
23
углов 2θ присутствуют интенсивные максимумы
1.884
30
1.907
36
отражения от плоскостей с индексами
00l и
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
СИНТЕЗ И ИССЛЕДОВАНИЕ УРАНАТОВ КАЛЬЦИЯ
85
системы соответствующих им пинакоидальных
пиков (для ураната кальция d = 6.768 Å; для
ураната стронция d = 6.873 Å). Это указывает на
слоистый тип структуры соединений кальция и
стронция. Некоторое различие в их строении
проявляется в незначительном расщеплении распо-
ложенных на больших углах 2θ дифракционных
максимумов отражения. Уранат бария, в сравнении
с уранатами кальция и стронция, судя по
формульному составу и набору дифракционных
данных, полностью отличается по составу и
строению.
2θ, град
Для установления причин наблюдаемых разли-
Рентгеновские дифрактограммы уранатов кальция (1),
чий в составе и строении уранатов Ca, Sr и Ba было
стронция (2) и бария (3).
выполнено ИК спектроскопическое исследование
(табл. 3). ИК спектрах для каждого соединения
группами полос поглощения. Среди них дефор-
представлены следующие группы условно
мационные колебания молекулярной Н2О в области
независимых колебаний: колебания уранильного
~1600 см-1. Некоторое смещение этих полос в
фрагмента UOδ+, колебания молекулярной Н2О и
коротковолновую область от значения 1595 см-1,
колебания фрагмента UOH. Этих групп колебаний
характерного для свободных молекул Н2О в
вполне достаточно для оценки их функциональной
газовой фазе [12], обусловлено участием Н2О в
принадлежности. Наличие в спектрах колебаний
образовании Н-связей. В силу этой же причины
уранильного фрагмента ν(UOδ+) указывает на то,
валентные колебания ν(Н-ОН) не разделены на
что весь уран присутствует в соединениях в
составляющие νas, νs и представлены в спектрах
степени окисления
+6 и в этом состоянии
интегральными полосами с незначительными по
проявляет тенденцию к образованию соединений
интенсивности максимумами поглощения при
со слоистым типом кристаллической решетки. В
3448 см-1 для CaU3O10·5H2O и 3410 см-1 для
уранатах кальция и стронция валентные колебания
SrU3O10·4H2O.
ν(UOδ+) разделены на составляющие νas и νs, что
указывает на нелинейную и неравноплечную
В спектре присутствуют также полосы валентных
конфигурацию уранильного фрагмента [11]. Для
и деформационных колебаний UOH в области
CaU3O10·5H2O колебания νas(UOδ+) и νs(UOδ+)
~3200 и
~1000 см-1 соответственно. Полосы
соответствуют значениям
882 и
851 см-1. По
валентных и деформационных колебаний в
данным известных корреляций [11], эти значения
координационном комплексе
указывают на семерную координацию в уран-
+
H
кислородном полиэдре. Аналогичные колебания в
MII O
SrU3O10·4H2O существенно смещены в область
H
меньших волновых чисел (860 и 828 см-1), что
может быть обусловлено большим размером атомов
в силу значительных ионных составляющих связей
Sr и соответствующим увеличением длин уран-
MII-O в ИК спектрах неактивны.
кислородных связей в уранильных группах UOδ+.
Форма и положение полос поглощения
Колебания Н2О представлены в спектрах
валентных и деформационных колебаний и их
уранатов кальция и стронция несколькими
групповая
принадлежность указывают на
Таблица 3. Параметры ИК спектров (см-1) уранатов кальция, стронция и бария
Соединение
ν(Н2О)
ν(U-ОН)
δ(Н2О)
δ(UОН)
νas(UOδ+)
νs(UOδ+)
СаU3O10·5H2O
3448 с
3182 пл
1621 с
1016 с
882 с
851 сл
SrU3O10·4H2O
3410 с
3180 пл
1622 с
1017 с
860 с
828 сл
ВаU2O7·3H2O
3388 с
1178 пл
1623 с
967 с
851 с
-
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
86
ЧЕРНОРУКОВ и др.
значительное подобие в строении уранатов кальция
SrU3O10·4H2O. Их кристаллические решетки состоят
и стронция. Однако существенное различие в
из слоев [(UO2)3O4]δ
–. Слои связаны в трехмерную
размерных параметрах атомов Ca и Sr и
структуру ионами щелочноземельных элементов
соответствующий этому не одинаковый вклад в
Mδ+. Часть воды в составе соединений сохраняет
ионную составляющую металл-кислородных связей
молекулярную индивидуальность и выполняет
допускает некоторую вариативность в компоновке
функцию компенсатора координационной ёмкости
структурообразующих элементов U, Ca и Sr.
щелочноземельных элементов. Другая часть Н2О в
координации не участвует, образует средние по
Выше показано, что вода в составе уранатов Ca
энергии Н-связи и занимает свободные полости в
и Sr сохраняет молекулярную индивидуальность.
межслоевом пространстве.
Для уточнения состояния Н2О и оценки ее места и
роли в структуре было проведено термогра-
В отличие от уранатов кальция и стронция,
фическое исследование уранатов Ca и Sr.
уранат бария имеет иной набор стехиометрических
Термограммы уранатов Ca и Sr аналогичны и
коэффициентов в формульной единице, соответ-
имеют близкие температурные интервалы дегидра-
ствующий составу Ba[(UO2)2O3]·3H2O. По данным
тации. Удаление двух молекул Н2О из обоих
ИК спектра, в области уранильного фрагмента для
соединений происходит в одну стадию в
него характерны полосы поглощения только анти-
соответствии с эндоэффектами на кривых ДТА в
симметричных валентных колебаний νas(UOδ+).
интервале температур 102-110°С и не сопровож-
Отсутствие в спектрах колебаний νs(UOδ+) указывает
дается какими-либо изменениями рентгено-
на линейную и равноплечную конфигурацию
графических данных. Это свидетельствует о том,
уранильного фрагмента вида [O…U…O]δ+. Положение
что удаляемые молекулы Н2О являются слабо-
этой полосы при 851 см-1 соответствует семерной
связанными, не занимают самостоятельных
координации уран-кислородного полиэдра [11]. По
кристаллографических позиций, не выполняют
данным ИК спектроскопии и термографии, часть
функцию компенсатора координационной емкости
молекул Н2О в составе ураната бария, так же как и
Ca и Sr, и их удаление не приводит к каким-либо
в соединениях кальция и стронция, в количестве
изменениям кристаллических решеток уранатов.
одного моля на формульную единицу Ba[(UO2)2O3]·
Удаление оставшихся молекул Н2О происходит
3H2O сохраняет молекулярную индивидуальность,
при более высоких температурах в интервале 281-
не принимает участия в координационном окружении
296°С и сопровождается полным разрушением
Ва, не занимает самостоятельных кристаллогра-
кристаллических решеток до аморфного состояния,
фических позиций в структуре соединения, удер-
что свидетельствует об участии молекулярной Н2О
живается в их составе системой Н-связей и
в формировании координационного окружения
удаляется при
78°С с сохранением структуры
атомов Ca и Sr. При дальнейшем нагревании до
исходного соединения. Другая часть Н2О в
600°С происходит экзотермическая кристалли-
количестве двух молекул на формульную единицу
зация фаз безводных уранатов CaU3O10 и SrU3O10,
соединения представлена в ИК спектре полосой
информация о которых приведена в ряде
ν(UO-H) и полосой δ(UOH). Удаление обеих
публикаций
[13-15]. Процессы дегидратации
молекул Н2О происходит в одну стадию при
уранатов Ca и Sr могут быть представлены
нагревании до
275°С и приводит к полному
реакциями (3), (4).
разрушению кристаллической решетки ураната
110°C
бария до аморфного состояния. При дальнейшем
СаU3O10·5H2O
СаU3O10·3H2O
-2H2O
нагревании аморфного ураната бария при 875°С
происходит экзотермическая кристаллизация моно-
296°C
CaO·UO3617°C СаU3O11,
ураната бария BaUO4 [16]. Процессы дегидратации
(3)
-3H2O
и термораспада ураната бария могут быть
102°C
представлены реакцией (5).
SrU3O10·4H2O
SrU3O10·2H2O
-2H2O
780°C
ВаU2O7·3H2O
ВаU2O7·2H2O
281°C
-H2O
SrO·UO3600°C SrU3O10.
(4)
-2H2O
275°C
Таким образом, проведенные исследования
BaO·2UO3(ам)
-2H2O
показали, что кристаллогидраты уранатов Ca и Sr -
875°C
(5)
неизвестные ранее соединения СаU3O10·5H2O и
ВаUO4 + 1/3U3O8 + 1/6О2.
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
СИНТЕЗ И ИССЛЕДОВАНИЕ УРАНАТОВ КАЛЬЦИЯ
87
Таким образом, вариативность при получении
Массовую долю H2O определяли весовым
уранатов Ca, Sr и Ba СаU3O10·5H2O, SrU3O10·4H2O
методом, прокаливая исследуемые образцы при
и ВаU2O7∙3H2O, различающихся составом и
600°С в течение 2 ч.
строением, определяется размерными параметрами
щелочноземельных элементов, а не их электрон-
ФОНДОВАЯ ПОДДЕРЖКА
ным строением. Увеличение ионных радиусов в
ряду Mg → Ca → Sr → Ba обусловливает образо-
Работа выполнена при финансовой поддержке
вание уранатов различного состава и строения. Для
Министерства образования и науки РФ (грант №
уранатов щелочноземельных элементов характерны
4.5706.2017/БЧ) в рамках базовой части
общие принципы структурной компоновки, анало-
государственного задания.
гична роль воды, сохраняющей молекулярную
индивидуальность, и выполняющей функцию
КОНФЛИКТ ИНТЕРЕСОВ
компенсатора координационной емкости M(II), а
также аналогичен функциональный состав с близкими
Авторы заявляют об отсутствии конфликта
колебательными характеристиками уранильных
интересов.
групп UOδ+, молекулярной Н2О и фрагментов UOH.
СПИСОК ЛИТЕРАТУРЫ
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1. Черноруков Н.Г., Нипрук О.В., Князев А.В.,
Измерение интенсивности флуоресцентного
Арова М.И., Чаплиёва К.А. // ЖНХ. 2013. Т. 58. № 1.
излучения проводили на спектрометре EDX-900
С. 11; Chernorukov N.G., Nipruk O.V., Knyazev A.V.,
(Shimadzu). Фазовую индивидуальность и рентгено-
Arova M.I., Chaplieva K.A. // Russ. J. Inorg. Chem.
графические характеристики образцов определяли
2013. Vol. 58. N 1. P. 9. doi 10.1134/S0036023613010051
на дифрактометре XRD-6000 (Shimadzu). Функцио-
2. Черноруков Н.Г., Нипрук О.В., Черноруков Г.Н.,
нальный состав соединений устанавливали с
Седелкина О.С. // Радиохимия. 2015. Т. 57. № 4.
помощью ИК спектрометра FTIR-8400s (Shimadzu).
С. 321; Chernorukov N.G., Nipruk O.V., Chernorukov G.N.,
Термическую устойчивость изучали методом
Sedelkina O.S. // Radiochemistry. 2015. Vol. 57. N 4.
P. 378. doi 10.1134/S1066362215040062
дифференциально-термического анализа с исполь-
зованием прибора Labsys фирмы Setaram.
3. Finch R.J., Burns P.C., Hawthorne F.C., Ewing R.C. //
Can. Mineralogist. 2006. Vol. 44. P. 1197.
Уранаты щелочноземельных элементов. Навеску
4. Cejka J., Sejkora J., Skala R., Cejka J., Novotna M.,
синтетического скупита [17] массой 0.5 г помещали
Ederova J. // J. Neues Jb. Miner. Mh. 1998. Vol. 174.
в раствор нитрата щелочноземельного элемента
P. 159.
объемом
100 мл и концентрацией
0.5 моль/л.
5. Pagoaga M.K., Appleman D.E., Stewart J.M. // Mineral.
Стальной автоклав с помещенными в него
Mag. 1986. Vol. 50. P. 125.
реагентами нагревали 10 ч при 200°С. Образовав-
6. Pagoaga M.K., Appleman D.E., Stewart J.M. // Am.
шуюся твердую фазу отфильтровывали, промывали
Mineralogist. 1987. Vol. 72. P. 1230.
охлажденной дистиллированной водой и сушили
7. Sobry R. // J. Inorg. Nucl. Chem. 1973. Vol. 35. N 5.
на воздухе до постоянной массы. Полноту проте-
P. 1516. doi 10.1016/0022-1902(73)80240-4
кания реакции контролировали по присутствию на
8. Sobry R. // J. Inorg. Nucl. Chem. 1973. Vol. 35. N 8.
рентгенограмме дифракционных максимумов
P. 2754. doi 10.1016/0022-1902(73)80506-8
отражения кристаллической фазы UO3·2.25H2O.
При необходимости время нагревания реакцион-
9. Dunn H. X-Ray Diffraction Data for Some Uranium
Compounds. ORNL-2092, Oak Ridge National
ной массы увеличивали. Приведенные выше
Laboratory, Oak Ridge, Tennessee, August 1956
условия оптимальны для получения соединений
достаточной степени кристалличности и чистоты.
10. Peters J. // Mem. Soc. Roy. Sci. Liege. 1967. P. 5.
Изменение условий не приводит к получению
11. Володько М.В., Комяк А.И., Умрейко Д.С.
соединений иного состава и строения, однако,
Ураниловые соединения. Минск.: БГУ, 1981. Т. 1.
уменьшает выход конечного продукта реакции и
12. Юхневич Г.В. Инфракрасная спектроскопия воды.
увеличивает время синтеза. Количество урана,
М.: Наука, 1973.
кальция, стронция и бария в исследуемых образцах
13. Cordfunke E.H.P., Loopstra B.O. // J. Inorg. Nucl.
определяли методом рентгенофлуоресцентного
Chem. 1967. Vol. 29. P. 51. doi 10.1016/0022-1902(67)
анализа по линиям ULα, ULβ, CaKα, SrKβ, BaLα.
80143-X
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
88
ЧЕРНОРУКОВ и др.
14. Sali S.K., Sampath S., Venugopal V. // J. Nucl. Mater.
1969. Vol. 25. P. 787. doi 10.1107/S0567740869002974
2000. Vol. 277. P. 106. doi 10.1016/S0022-3115(99)
17. Нипрук О.В., Князев А.В., Черноруков Г.Н., Пыхо-
00145-2
ва Ю.П. // Радиохимия. 2011. Т.53. № 2. С.128;
15. Allen G.C., Griffiths A.J. // J. Chem. Soc. Dalton Trans.
Nipruk O.V., Knyazev A.V., Chernorukov G.N., Pykho-
1979. P. 315. doi 10.1039/dt9790000315
va Y.P. // Radiochemistry. 2011. Vol. 53. N 2. P. 146.
16. Loopstra B.O., Rietveld H.M. // Acta Crystallogr. (B).
doi 10.1134/S1066362211020044
Synthesis and Study of Calcium, Strontium,
and Barium Uranates
N. G. Chernorukov, O. V. Nipruk*, G. N. Chernorukov, R. V. Abrazheev, and K. A. Chaplieva
N.I. Lobachevskii Nizhny Novgorod State University, pr. Gagarina 23a, Nizhny Novgorod, 603950 Russia
*e-mail: nipruk@yandex.ru
Received June 28, 2018
Revised June 28, 2018
Accepted July 9, 2018
The reaction of synthetic schoepite UO3·2.25H2O with aqueous solutions of calcium, strontium and barium
nitrates under hydrothermal conditions at 200°C and pH = 7-8 yielded individual crystalline compounds with
general formula MIIU3O10·nH2O (MII = Ca, Sr) and BaU2O7·3H2O. Their composition and structure were
established using the methods of chemical analysis, X-ray fluorescence spectrometry, X-ray diffraction, IR
spectroscopy, thermography. The processes of dehydration and thermal decomposition were studied.
Keywords: uranates, calcium, strontium, barium, X-ray diffraction, dehydration, thermal decomposition
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019