ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 1, с. 122-127
УДК 541.14;546.55;546.561
ФОТОХИМИЧЕСКИЙ СИНТЕЗ НАНОЧАСТИЦ
Сu2O и Сu2O/Ag В МНОГОАТОМНЫХ СПИРТАХ
© 2019 г. Е. И. Исаева*, В. В. Горбунова, В. П. Пронин, Д. М. Долгинцев
Российский государственный педагогический университет имени А. И. Герцена,
наб. р. Мойки 48, Санкт-Петербург, 191186 Россия
*e-mail: katiavolkova@yandex.ru
Поступило в Редакцию 19 июля 2018 г.
После доработки 19 июля 2018 г.
Принято к печати 30 июля 2018 г.
Фотовосстановлением комплексных соединений меди(II) с этиленгликолем и глицерином синтезированы
наночастицы Cu2O в объеме фотолита, исследованы их оптические свойства, морфология, фазовый
состав и фотокаталитическая активность в реакциях разложения метилового оранжевого. Реакцией
электрохимического замещения получены композитные наночастицы Сu2O/Ag и установлена их
повышенная активность в реакциях фотодеградации метилового оранжевого по сравнению с
немодифицированными частицами Сu2O.
Ключевые слова: фотолиз, комплексные соединения меди(II), наночастицы оксида меди(I),
наночастицы серебра, фотокатализ
DOI: 10.1134/S0044460X19010190
В последние годы большое внимание уделяется
Ранее нами были синтезированы наночастицы
синтезу наноразмерных полупроводниковых оксид-
Cu2O на поверхности кварца при фотолизе ком-
ных частиц TiO2, ZnO, Cu2O, CeO2 и исследованию
плексов меди(II) с аминокислотами и обнаружена
их адсорбционных, оптических, электрических,
их фотокаталитическая активность в реакциях
каталитических и антибактериальных свойств
разложения метилоранжа [11]. В данной работе
[1-3]. Особый практический интерес представляют
нами приведены данные по синтезу наночастиц
фотокаталитические свойства указанных полупро-
Cu2O в объеме фотолита и исследованию
водниковых наночастиц, позволяющие повысить
сравнительной фотокаталитической активности
эффективность очистки воды от токсичных органи-
наночастиц Cu2O и гетероструктур Сu2O/Ag.
ческих примесей. Наноразмерный оксид меди(I) не
так широко применяется в фотокатализе, как ZnO и
Ионы меди(II) образуют устойчивые хелатные
TiO2, вследствие высокой химической активности,
комплексы с многоатомными спиртами, которые
однако его преимущество - невысокое значение
поглощают свет в ультрафиолетовой области
энергии запрещенной зоны
(2-2.2 эВ) и, как
спектра
(240-260 нм, полоса переноса заряда
следствие, проявление фотокаталитической актив-
лиганд→металл) и в видимом диапазоне (650-
ности при действии видимого света [4-6]. Быстрая
700 нм, d-d-переход). При облучении светом
рекомбинация фотогенерированных электронов и
комплексных соединений меди(II) в области
дырок уменьшает фотокаталитическую эффектив-
полосы переноса заряда лиганд→металл проис-
ность полупроводниковых наночастиц и ограни-
ходит одноэлектронное восстановление централь-
чивает их применение. Нанесение наночастиц
ного иона, которое приводит к формированию
благородных металлов (серебро, золото) на
наноразмерных частиц оксида меди(I) при pH >7
поверхность Cu2O, которые выступают в качестве
вследствие гидролиза ионов меди(I). В
электронных поглотителей, способствуют разделе-
присутствии многоатомных спиртов, выполняю-
нию фотоиндуцированных дырок и таким образом
щих дополнительно функцию стабилизатора,
увеличивают их фотокаталитическую активность
образование наночастиц оксида меди(I) проис-
[7-10].
ходит в объеме фотолита.
122
ФОТОХИМИЧЕСКИЙ СИНТЕЗ НАНОЧАСТИЦ
123
0.4
0.3
40
0.2
5
4
20
0.1
3
1
2
0.0
300
400
500
600
700
800
0
λ, нм
30
34
38
43
51
64
72
106
Рис.
1. Эволюция спектров поглощения раствора
d, нм
Cu(CH3COO)2 в этиленгликоле в процессе фотолиза
Рис. 2. Гистограмма наночастиц Cu2O, полученных
УФ светом, λвозб = 254 нм. Время, мин: 1 - 0, 2 - 15,
фотолизом
10-2 М. раствора ацетата меди(II) в
3 - 30, 4 - 45, 5 - 60.
глицерине в течение 60 мин.
Фотолиз 10-2 М. раствора ацетата меди(II) в
По данным сканирующей электронной микро-
этиленгликоле в течение
15 мин приводит к
скопии (рис. 2), образец состоит из монодиспер-
появлению в спектре поглощения раствора
сных частиц сферической формы с размером 40-
максимума при длине волны 445 нм и изменению
50 нм. Состав частиц подтвержден методом
цвета раствора с синего на оранжевый, что
рентгеноструктурного спектрального микроанализа.
свидетельствует о формировании частиц оксида
Образцы полученных частиц, нанесенных на
меди(I) (рис. 1). Дальнейшее облучение в течение
кварцевое стекло, характеризуются линиями Kα
45 мин приводит к батохромному сдвигу макси-
кислорода (34.95 ат%), кремния (3.08 ат%) и Lα
мума поглощения до 480 нм и к увеличению
меди (61.97 ат%). Учитывая, что часть атомов
оптической плотности до 0.26 отн. ед. При замене
кислорода связанa с кремнием кварцевой подложки
этиленгликоля на глицерин в аналогичных
(SiO2), состав образующихся частиц можно
условиях в спектрах поглощения через 45 мин
описать формулой Cu2O (атомное соотношение
наблюдается батохромное смещение края полосы
Cu-O 2.15:1).
поглощения с одновременным увеличением
Композитные частицы Cu2O/Ag получали путем
оптической плотности в диапазоне длин волн 310-
введения в коллоидный раствор Cu2O в глицерине
450 нм и появление плеча при 340 нм. Цвет
водного раствора нитрата серебра, c = 10-3-5×10-2
раствора изменяется с синего на желтый.
моль/л. При добавлении 0.5 мл 10-3 М. раствора
Дальнейшее облучение приводит к батохромному
AgNO3 к 20 мл раствора, содержащего 5×10-5 моль
сдвигу края полосы поглощения до 360 нм и
Cu2O
[мольное соотношениe n(Cu2O):n(Ag+)
=
увеличению оптической плотности до 1.48 отн. ед.,
50:1], происходит частичное растворение нано-
свидетельствующее об увеличении размера форми-
частиц оксида меди(I) с образованием кластеров
рующихся частиц.
серебра (1).
По данным рентгенодифракционного анализа,
Cu2O + Ag+ + 2H+ → 2Cu2+ + Ag0 + H2O.
(1)
порошки, полученные при фотолизе раствора
ацетата меди(II) в глицерине в течение 60 мин,
В спектрах поглощения наблюдается умень-
имеют кубическую кристаллическую структуру
шение оптической плотности с 1.3 до 0.4 отн. ед.
куприта по точкам (110), (111), (200), (220), что
(рис. 3). в диапазоне длин волн 350-450 нм, что
подтверждено пиками при 2θ = 29.71°, 36.57°,
указывает на растворение наночастиц Cu2O, однако
42.47°, 61.37°. Присутствие гало на рентгенограмме
плазмонная полоса поглощения, характерная для
обусловлено поликристаличностью образцов и
наночастиц серебра, при данном соотношении
малым размером образующихся частиц Cu2O.
реагентов не проявляется. При мольном
Средний размер кристаллитов Cu2O, рассчитанный
соотношении n(Cu2O):n(Ag+)
=
20:1 в спектре
по формуле Селякова-Шерерра [12], составляет 20 нм.
поглощения появляется плазмонная полоса с λ =
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
124
ИСАЕВА и др.
энергодисперсионного анализа, образцы содержат
1.5
не только линии Kα кислорода, Lα меди, но и линии
1
Lα серебра (6.05 ат%), что доказывает образование
композитных частиц, включающих наночастицы
1.0
серебра. По результатам рентгенодифракционного
анализа, образцы Cu2O/Ag характеризуются двумя
6
наборами пиков. Пики при 2θ = 36.58°, 42.72°, и
0.5
5
4
61.76° соответствуют кубической кристаллической
3
структуре куприта, а пики при 2θ = 38.38° и 64.55°
2
указывают на присутствие серебра. Малая интен-
0.0
сивность дифракционных пиков серебра свидетель-
300
400
500
600
700
800
900
ствует о низком его количестве в образце. Кроме
λ, нм
того, по сравнению с рентгенограммами
Рис. 3. Спектры поглощения наночастиц Cu2O (1) и
наночастиц Cu2O очевидных сдвигов дифракцион-
гетероструктур Cu2O/Ag в глицерине при мольном
ных пиков не наблюдается, что может указывать на
O):n(Ag) = 50:1 (2), 20:1 (3), 10:1 (4),
соотношении n(Cu2
то, что серебро присутствует в виде металлических
5:1 (5), 2:1 (6).
частиц на поверхности частиц Cu2O, а не внедрено
в кристаллическую решетку куприта. Рентгено-
420 нм, характеризующая присутствие наночастиц
граммы образцов с большим количеством серебра
серебра, предположительно, на поверхности
[n(Cu2O):n(Ag+)
=
2:1], характеризуются более
частиц Cu2O.
интенсивными дифракционными пиками серебра.
Фотокаталитическая активность наночастиц
Для доказательства формирования гетерострук-
Cu2O и Cu2O/Ag. По литературным данным,
туры Cu2O/Ag полученный коллоидный раствор
наноразмерый оксид меди(I) проявляет фотокатали-
центрифугировали. Фильтрат имел голубую
тичесую активность в реакциях разложения
окраску, что свидетельствовало о присутствии
различных органических соединений при
ионов меди(II) в растворе, а также не содержал
облучении как УФ, так и видимым светом [4-6].
мелкодисперсных частиц серебра, что было
Для исследования фотокаталитической активности
подтверждено отсутствием плазмонной полосы
наночастиц Cu2O и гетероструктур Cu2O/Ag были
поглощения. Присутствие ионов меди(II) в
выбраны водные растворы метилоранжа в связи с
растворе при добавлении нитрата серебра было
высокой устойчивостью красителя к действию УФ
доказано появлением полосы поглощения и
и видимого света в отсутствие катализатора и
увеличением оптической плотности в диапазоне
наличием характерного максимума поглощения
600-700 нм.
при
465 нм (при рН
=
7). Использование
электронной спектроскопии удобно для анализа
При добавлении 0.5 мл 5×10-2 М. раствора
кинетики фотодеструкции метилоранжа, поскольку
AgNO3 к 20 мл раствора частиц Cu2O [мольное
изменение оптической плотности растворов может
соотношение n(Cu2O):n(Ag+) = 2:1] полоса плазмон-
служить критерием оценки скорости процесса.
ного поглощения наночастиц серебра при 430 нм
увеличивается и появляется характерный для колло-
По мере облучения раствора метилоранжа
идного серебра минимум при 325 нм; исчезает
монохроматическим светом (λвозб
=
365 нм) в
полоса поглощения наноразмерных частиц Cu2O
течение 110 мин в присутствии наночастиц Cu2O,
(350-410 нм) и увеличиватся интенсивность
полученных фотолизом 10-2 М. раствора ацетата
полосы d-d-перехода соединений Cu2+ при 640-680
меди(II) в глицерине, в спектрах поглощения
нм, что указывает на практически полное
наблюдается уменьшение оптической плотности D
окисление частиц Cu2O ионами серебра с образо-
от
0.63 до
0.35 отн. ед. при λ
=
465 нм и
ванием коллоидного серебра (рис. 3).
обесцвечивание раствора, что свидетельствует о
фотокаталитическом разложении метилоранжа. На
Результаты сканируюшей электронной микро-
рис.
4
приведены кинетические кривые
скопии свидетельствуют об увеличении размеров
фотодеструкции метилоранжа в присутствии
гетерочастиц Cu2O/Ag [n(Cu2O):n(Ag+) = 20:1] до
частиц Cu2O при облучении монохроматическим
55 нм по сравнению с чистым Cu2O. По данным
(λвозб = 365 нм) и полихроматическим светом. Как
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
ФОТОХИМИЧЕСКИЙ СИНТЕЗ НАНОЧАСТИЦ
125
0.6
0.6
0.5
0.4
1
0.4
5
1
2
0.3
0.2
4
2
3
0.2
0
20
40
60
80
100
0.0
0
20
40
60
80
100
Время облучения, мин
Время облучения, мин
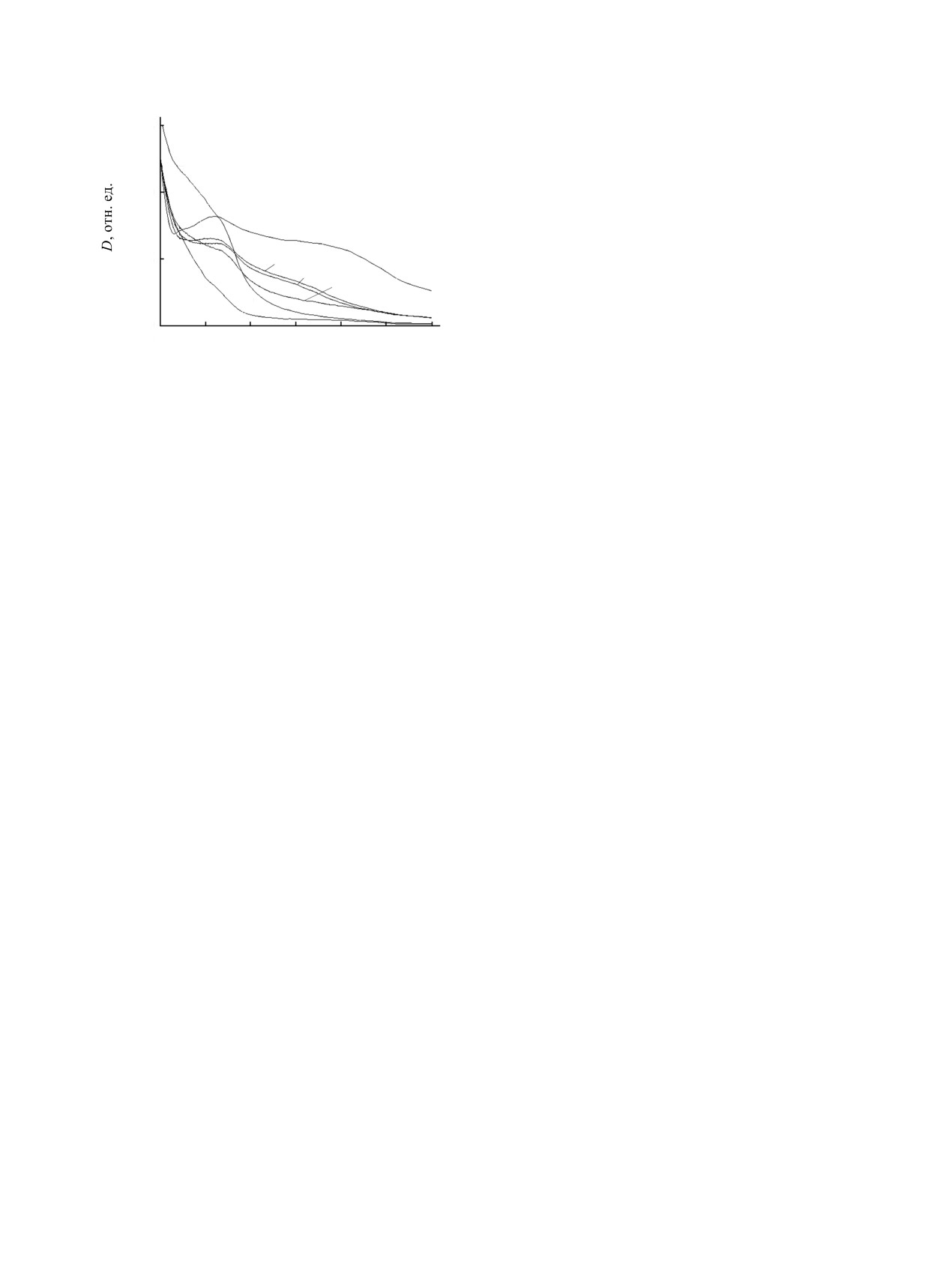
Рис. 5. Кинетические кривые фотодеструкции метилового
оранжевого при облучении монохроматическим светом
Рис. 4. Кинетические кривые фотодеструкции метилового
оранжевого в присутствии наночастиц Cu2O при
(λвозб = 365 нм) в присутствии наночастиц Cu2O (1) и
гетероструктур Cu2O/Ag с мольным соотношением
облучении монохроматическим (λвозб = 365 нм, 1) и
полихроматическим светом (2).
n(Cu2O):n(Ag) = 50:1 (2), 20:1 (3), 10:1 (4), 2:1 (5).
видно из рисунка, начальная скорость фотод-
Использование концентраций AgNO3 более
еструкции метилоранжа при облучении поли-
2×10-2 моль/л [n(Cu2O):n(Ag+) = 5:1] приводит к
хроматическим светом в 4 раза выше, чем при
уменьшению доли Cu2O в композитных частицах и
облучении монохроматическим светом, что может
к увеличению количества наночастиц серебра на
быть связано с поглощением наночастиц Cu2O в
поверхности ядра, что снижает фотокаталити-
широком диапазоне от
310-450 нм и, как
ческую активность Cu2O вследствие экранирования
следствие, его большей светочувствительностью
света. Добавление растворов нитрата серебра с
при более низких энергиях.
с = 1×10-3 моль/л и соотношением менее n(Cu2O):
n(Ag+) = 50:1 недостаточнo для формирования
По литературным данным, фотокаталитическая
необходимого количества наночастиц серебра,
активность нанокомпозитов Cu2O/Ag выше, чем у
акцептирующих электроны на границе металл-
частиц Cu2O, что можно объяснить наличием
полупроводник и способных разделить заряды,
границ между наночастицами серебра и
препятствуя рекомбинации электронов и дырок.
наночастицами Cu2O, которые могут эффективно
подавлять скорость рекомбинации пар электрон-
Таким образом, фотолиз раствора ацетата
дырка в Cu2O [7-10]. Сравнение фотокаталити-
меди(II) в глицерине приводит к формированию
ческой активности частиц Cu2O и гетероструктур
наночастиц Сu2O со средним размером 40-50 нм,
Cu2O/Ag с разным мольным соотношением
обладающих фотокаталитической активностью при
показано на кинетических кривых (рис. 5). При
облучении УФ и видимым светом. Добавление
облучении монохроматическим светом (λвозб
=
нитрата серебра к коллоидным растворам Сu2O
365 нм) наибольшей фотокаталической актив-
приводит к образованию гетероструктур Cu2O/Ag,
ностью обладают частицы Cu2O/Ag с мольными
проявляющих повышенную активность в реакциях
соотношениями 5:1, 10:1 и 20:1, имея наибольшие
фотодеструкции метилоранжа. Максимальная
начальные скорости фотодеструкции (см. таблицу).
фотокаталитическая активность регистрируется в
Зависимость начальной скорости фотодеструкции метилоранжа в присутствии гетероструктур Cu2O/Ag от мольного
соотношения n(Cu2O):n(Ag)а
Параметер
Значение
n(Cu2O):n(Ag)
2:1
5:1
10:1
20:1
50:1
с(Ag+), моль/л
5×10-2
2×10-2
1×10-2
5×10-3
1×10-3
υнач×10-3, мин-1
2.54
3.86
3.15
3.27
1.86
а с(Cu2O) = 0.84 моль/л.
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
126
ИСАЕВА и др.
присутствии гетероструктур Cu2O/Ag с мольным
рентгено-дифракционного анализа (ДРОН-7) с
соотношением n(Cu2O):n(Ag+) от 5:1 до 20:1.
медным анодом рентгеновской трубки и с
параболическим зеркалом между рентгеновской
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
трубкой и образцом для подавления эмиссионной
линии меди CuKβ, λ = 1.3992 Å. Размер кристал-
Для получения наночастиц Cu2O и Cu2O/Ag в
литов рассчитывали по формуле Селякова-Шерерра
качестве источников ионов металлов использовали
[12] [уравнение (2)].
ацетат меди(II) моногидрат (ЧДА, ЗАО «Вектон»),
D = k λ/βcosθ.
(2)
нитрат серебра (ЧДА, АО «Реахим»). В качестве
стабилизаторов применяли глицерин, этилен-
Здесь k - постоянная величина (k = 1.0747), λ -
гликоль (ЧДА, АО
«Экос-1»). рН растворов в
длина волны рентгеновского излучения CuKα1, β -
диапазоне
12-13 ед. поддерживали, добавляя
полуширина пика рентгеновской дифракции (рад),
раствор NaOH (ЧДА, ЗАО «Вектон»).
θ - угол дифракции Брэгга.
Для синтеза наночастиц Cu2O 4.5 мл этилен-
Исследование фотокаталитической активности
гликоля или глицерина смешивали с 5 мл 10-1 М.
полученных частиц проводили на примере реакции
раствора гидроксида натрия и к полученному
фотокаталитического разложения красителя мети-
раствору добавляли 0.5 мл 10-1 М. раствора ацетата
лового оранжевого в водном растворе. В ходе
меди, после чего облучали 60 мин УФ светом
эксперимента по изучению фотокаталитических
монохроматической лампы Philips TUV 4W/G4 T5,
свойств полученных образцов
7 мл раствора
λвозб = 254 нм.
метилового оранжевого (с
=
2.5×10-5 моль/л)
наливали в бюкс (толщина слоя
1 см), куда
Для отделения синтезированных частиц от
добавляли 2 мг частиц Cu2O или Cu2О/Ag. Перед
органических примесей их промывали в водно-
облучением образцы выдерживали
20 мин в
спиртовом растворе и центрифугировали 5-6 раз
темноте в водном растворе метилоранжа для
(Centrifuge CM-6MT) в течение 5 мин при 2500 об.
установления равновесия адсорбция-десорбция в
Полученные частицы сушили на воздухе при
системах Cu2O-метилоранж, Cu2O/Ag-метилоранж.
комнатной температуре.
Затем бюкс с раствором метилоранжа облучали 2 ч
Для получения нанокомпозитов Cu2O/Ag к
полихроматическим светом ртутной лампы Philips
20 мл свежеприготовленных частиц Сu2O, дис-
PL-S 11W или монохроматическим светом лампы
пергированных в глицерине, добавляли
0.5 мл
Philips TUV
4W/G4 T5, λвозб
=
365 нм,
раствора нитрата серебра (с = 5×10-2-1×10-3 моль/л)
интенсивность света 3.0×1016 квант·см-2·с-1. В ходе
и перемешивали 20 мин, после чего промывали в
эксперимента через определенные промежутки
водно-спиртовым раствором и центрифугировали
времени отбирали из бюкса раствор метилоранжа,
5 раз по 5 мин при 2000 об. и сушили на воздухе
центрифугировали 3 мин (1500 об/мин.). Фильтрат
при комнатной температуре.
помещали в кварцевую кювету с длиной опти-
ческого пути 1 см и снимали спектр поглощения в
Образование наноструктур Cu2O и Cu2O/Ag
диапазоне длин волн 200-800 нм.
фиксировали спектрофотометрически по появлению
характерного поглощения в диапазоне длин волн
КОНФЛИКТ ИНТРЕСОВ
200-800 нм (СФ-2000). Морфологию медьсодержа-
щих частиц и их размер оценивали с помощью
Авторы заявляют об отсутствии конфликта
сканирующих электронных микроскопов Zeiss
интересов.
ЕVО 40 и Zeiss Merlin 42-37 при ускоряющем
напряжении 5-24 кВ и токе зонда 175 пА. Для
СПИСОК ЛИТЕРАТУРЫ
исключения накопления отрицательного заряда на
поверхность образца наносили слой золота
1. Zhuiykov S. Nanostructured semiconductor oxides for
толщиной 5 нм с помощью установки SC7620 Mini
the next generation of electronics and functional
Sputter Coater. Состав образцов определяли с
devices: properties and applications. Cambridge:
помощью рентгеноструктурного спектрального
Woodhead Publishing, 2014. 466 p.
микроанализа с энергодисперсионным рентгено-
2. Nanostructure for Antimicrobial Therapy
/
Eds
спектральным детектором. Состав частиц Cu2O и
A. Ficai, A.M. Grumezescu. Bucharest: Elsevier, 2017.
Cu2O/Ag подтвержден методом порошкового
722 p.
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019
ФОТОХИМИЧЕСКИЙ СИНТЕЗ НАНОЧАСТИЦ
127
3. Shelovanova G.N., Patrusheva T.N., Avilov N.E.,
8. Zhang L., Wang X. // Appl. Phys. (A). 2014. Vol. 117.
Baranov O.Yu., Khol’kin A.I. // Theor. Found. Chem.
P. 2189. doi 10.1007/s00339-014-8644-4
Eng.
2016. Vol.
50. N
5. P.
793. doi
10.1134/
9. Zhang W., Yang X., Zhu Q., Wang K., Lu J., Chen Min,
S0040579516050213
Yang Z. // Ind. Eng. Chem. Res. 2014. Vol.
53.
4. Lin X., Zhou R., Zhang J., Sheng X. // Nuclear Sci.
P. 16316. doi 10.1021/ie502737t
Techniques. 2010. Vol. 21. N 3. p. 146. doi 10.13538/
10. Kandula S., Jeevanandam P. // Eur. J. Inorg. Chem.
j.1001-8042/nst.21.146-151
5. Hurtado L., Natividad R., García H. // Catal. Commun.
11. Исаева Е.И., Горбунова В.В. // ЖОХ. 2017. Т. 87.
6. Jiang Y., Yuan H., Chen H. // Phys. Chem. Chem. Phys.
2015. Vol. 17. N 1. P. 630. doi 10.1039/c4cp03631j
10.1134/S1070363217120155
7. Wang Z., Zhao S., Zhu S., Sun Y., Fang M. // Cryst. Eng.
Commun.
2011. Vol.
13. P.
2262. doi
10.1039/
12. Ковба Л.М., Трунов В.К. Рентгенофазовый анализ.
C0CE00681E
М.: МГУ, 1976. 232 с.
Photochemical Synthesis of Cu2O and Cu2O/Ag Nanoparticles
in Polyols
E. I. Isaeva , V. V. Gorbunova, V. P. Pronin, and D. M. Dolgintsev
Herzen State Pedagogical University of Russia, nab. reki Moiki 48, St. Petersburg, 191186 Russia
*e-mail: katiavolkova@yandex.ru
Received July 19, 2018
Revised July 19, 2018
Accepted July 30, 2018
Cu2O nanoparticles were synthesized by photoreduction of copper(II) complex compounds with ethylene glycol
and glycerin in the photolite volume. Their optical properties, morphology, phase composition, and
photocatalytic activity in methyl orange decomposition were studied. The electrochemical substitution reaction
afforded Cu2O/Ag composite nanoparticles. Their increased activity in photodegradation reactions of methyl
orange in comparison with unmodified Cu2O particles was found.
Keywords: photolysis, copper(II) complex compounds, copper(I) oxide nanoparticles, silver nanoparticles,
photocatalysis
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 1 2019