ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 10, с. 1511-1519
УДК 547.855.7;547.792;547.795
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
НОВЫХ ПРОИЗВОДНЫХ
2-{[6-МЕТИЛ-2-(ПИРРОЛИДИН-1-ИЛ)ПИРИМИДИН-
4-ИЛ]ОКСИ}АЦЕТОГИДРАЗИДА
© 2019 г. В. А. Пивазянa, Э. А. Казарянa, Ж. А. Азарянb, А. П. Енгоянa, b, *
a Исследовательский центр синтеза пестицидов и защиты растений,
Национальный аграрный университет Армении, ул. Теряна 74, Ереван, 0009 Армения
b Российско-Армянский университет, ул. О. Эмина 123, Ереван, 0051 Армения
*e-mail: ayengoyan@mail.ru
Поступило в Редакцию 15 апреля 2019 г.
После доработки 15 апреля 2019 г.
Принято к печати 22 апреля 2019 г.
Взаимодействием 6-метил-2-(пирролидин-1-ил)пиримидин-4(3H)-она с эфиром хлоруксусной кислоты с
последующим гидразинолизом получен 2-{[6-метил-2-(пирролидин-1-ил)пиримидин-4-ил]окси}ацетоги-
дразид, на основе которого синтезирован ряд новых производных, в том числе сочетающих в молекулах
пиримидиновое кольцо с 1,2,4-триазольным, 1,3,4-оксадиазольным и фурановым. При предваритель-
ном биологическом скрининге синтезированные соединения проявили выраженное стимулирующее
действие на рост растений. Активность веществ составляла 65-87% по сравнению с гетероауксином.
Ключевые слова: 2-{[6-метил-2-(пирролидин-1-ил)пиримидин-4-ил]окси}ацетогидразид, 5-{[(пири-
мидин-4-ил)окси]метил}-4H-1,2,4-триазол-3-тиол, 5-{[(пиримидин-4-ил)окси]метил}-1,3,4-оксадиа-
зол-2(3H)-тион, стимуляторы роста растений
DOI: 10.1134/S0044460X19100056
Производные пиримидина обладают ши-
анти-ВИЧ [19-22], противотуберкулезной [23-25],
роким спектром биологической активности.
антималярийной [26, 27] и кардиотонической ак-
Пиримидиновые и пуриновые основания входят
тивностью [28, 29]. В сельском хозяйстве произво-
в состав нуклеиновых кислот, коэнзимов и алка-
дные пиримидина применяются в качестве фунги-
лоидов. Витамин В1 и полученная на его основе
цидов, инсектицидов, акарицидов и гербицидов -
кокарбоксилаза также содержат пиримидиновое
в основном пиримидиндиамины, пиримидинилок-
кольцо. В медицинской практике широко приме-
сибензиламины, пиримидинилокси- и пиримиди-
няются синтетические лекарственные средства на
нилсульфанилпроизводные бензойной кислоты.
основе пиримидина: барбитураты, сульфанилами-
Наибольшей активностью обладают сульфуроно-
ды, а также антимикробные, антигипертензивные,
вые производные пиримидина, в молекулах кото-
противогельминтные, противогерпесные, проти-
рых пиримидиновый цикл связан с другими гете-
воопухолевые и анти-ВИЧ препараты.
роциклами или с арильным остатком через суль-
фонилуроновую группу [30].
В ряду производных пиримидина обнаруже-
ны соединения, обладающие антибактериальной
Из анализа литературных данных видно, что
[1-4], противогрибковой [5-7], противоопухоле-
достаточно мало исследованы соединения, со-
вой [8-10], противовоспалительной и анестези-
четающие в молекулах пиримидиновое кольцо с
рующей [11-13], противосудорожной [14], анти-
другими гетероциклами, в частности с азолами,
оксидантной [15, 16], противовирусной [17, 18],
на базе которых получен и применяется целый
1511
1512
ПИВАЗЯН и др.
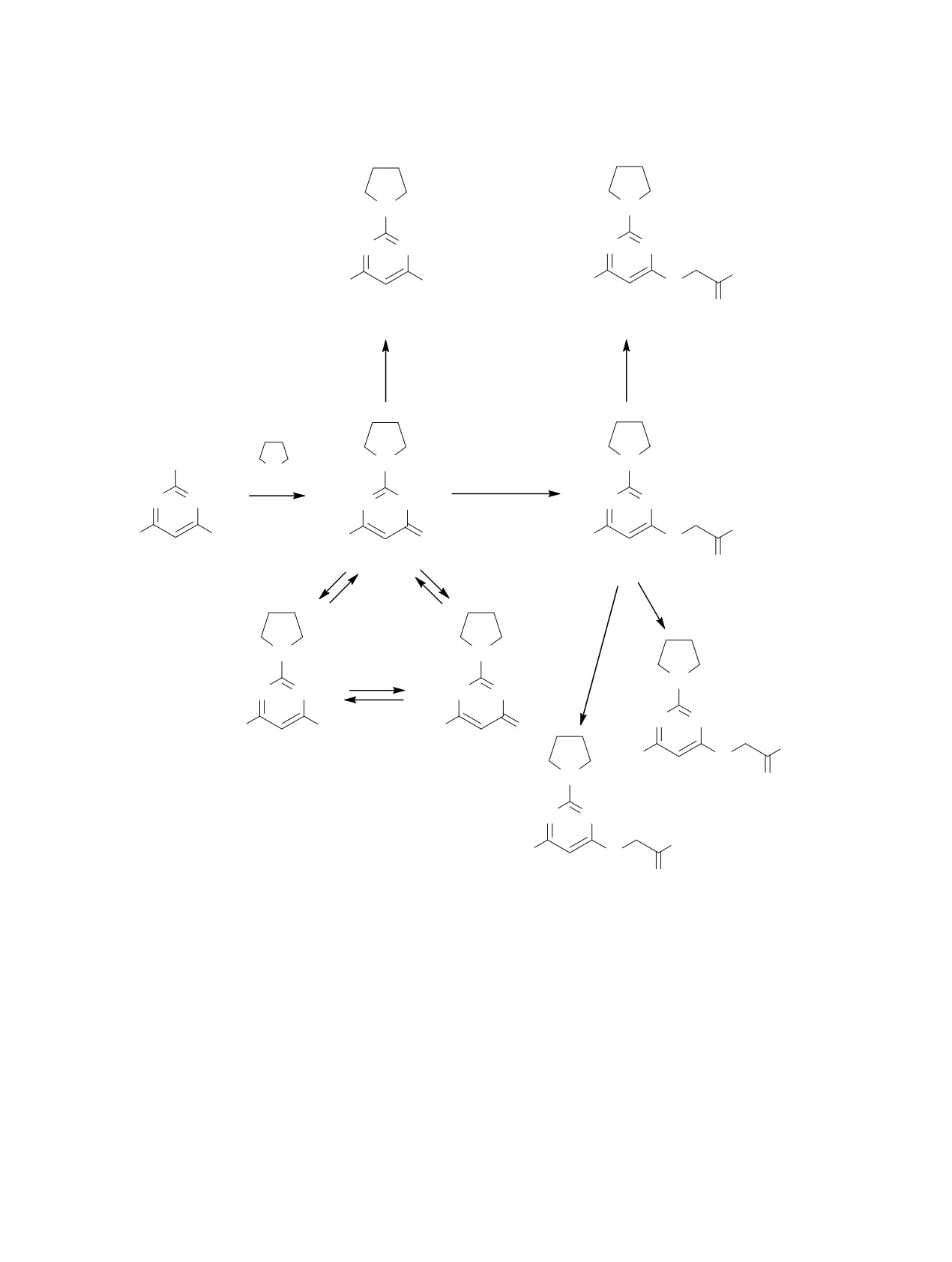
Схема 1.
N
N
N N
N N
OH
H3C
Cl
H3C
O
O
2
4
KOH,
tq
3
POCl
C2H5OH
SCH3
N
N
N
H
ClCH2COOCH3
N N
N NH
N N
KOH
OCH3
H3C
OH
H3C
O
H3C
O
1
O
3
N2H4
N
N
NH3
N
N N
HN
N
N N
H3C
OH
H3C
O
NHNH2
H3C
O
N
O
6
N N
NH2
H3C
O
O
5
ряд химических средств защиты и стимуляторов
В настоящей работе нами синтезирован новый
роста растений. Выработка вредными организ-
ряд соединений на основе 6-метил-(2-пирроли-
мами и возбудителями болезней растений рези-
дин-1-ил)пиримидин-4-она, в том числе сочетаю-
стентности к применяемым препаратам вызывает
щих в молекулах пиримидиновое ядро с 1,3,4-три-
необходимость систематического пополнения их
азольным или 1,3,4-оксадиазольным циклами, и
ассортимента новыми веществами с различными
изучены их биологические свойства.
механизмами действия. Целенаправленный синтез
Взаимодействием
6-метил-2-(метилсульфа-
новых соединений на базе пиримидина может при-
нил)-пиримидин-4(3H)-она с пирролидином был
вести к биологически активным производным, по
отношению к которым резистентность не сформи-
получен 6-метил-2-(пирролидин-1-ил)пиримидин-
ровалась.
4(3H)-он 1 (схема 1). Реакция последнего с хло-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ НОВЫХ ПРОИЗВОДНЫХ
1513
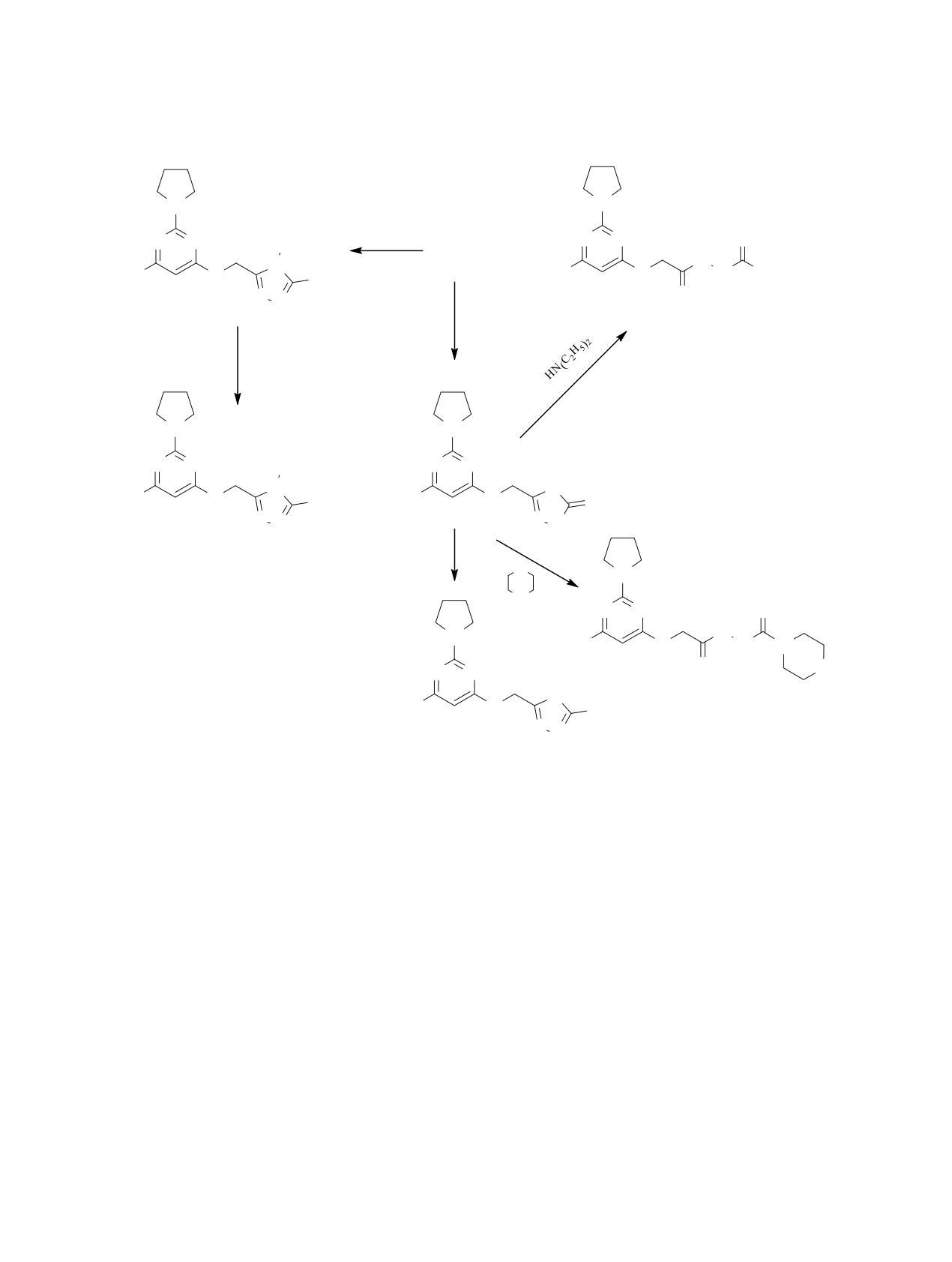
Схема 2.
N
N
N N
RN=C=S
N N
S
R
H
6
N
N
H3C
O
H3C
O
N
SH
N(C2H5)2
H
KOH; CS2
12
O
7
N N
C2H5OH, tq
CH3I
N
N
N N
R
N N
N
O
H3C
O
H3C
O
SCH3
S
N N
N NH
8
9
RHlg
O
N
N
H
N N
S
H
N
N
H3C
O
N
N
H
N N
O
O
11
O
H3C
O
SR
10
N N
R = C2H5 (7a, 8a), C6H5 ( ɛ, ɛ), CH3 ( ɚ), CH2COOCH3 ( ɛ), CH2CONH2 ( ɜ).
рокисью фосфора приводит к соответствующему
1 с метиловым эфиром хлоруксусной кислоты
4-хлорпроизводному 2.
(схема 1), в области валентных колебаний группы
Соединение 1 может существовать в трех воз-
С=О проявляется лишь одна полоса поглощения
можных таутомерных формах в зависимости от
при 1754 cм-1, соответствующая эфирной карбо-
нильной группе. Кроме того, в спектрах ЯМР 1Н и
положения подвижного атома водорода (схема 1).
13С ацетата 3 наблюдаются сигналы группы ОСН2
В ИК спектре этого соединения в кристаллической
при 4.74 и 61.2 м. д. соответственно. Эти данные
форме при 1646 см-1 наблюдается полоса погло-
однозначно указывают на то, что замещение про-
щения, соответствующая карбонильной группе
исходит по атому кислорода группы ОН.
С=О. Однако в растворе может происходить пере-
нос атома водорода к атому кислорода, вследствие
Щелочным гидролизом ацетата 3 и реакцией с
чего реакция замещения может протекать как по
аммиаком получены кислота 4 и амид 5 соответ-
атому кислорода гидроксильной группы, так и по
ственно (схема 1). Взаимодействие ацетата 3 с ги-
одному из атомов азота пиримидинового цикла. В
дразингидратом приводит к образованию 2-{[6-ме-
ИК спектре метил-2-{[(6-метил-2-(пирролидин-
тил-2-(пирролидин-1-ил)пиримидин-4-ил]окси}-
1-ил)пиримидин-4-ил]окси}ацетата
3, получен-
ацетогидразида 6, на основе которого был про-
ного при взаимодействии исходного соединения
веден ряд превращений. Так, при нагревании со-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
1514
ПИВАЗЯН и др.
единения 6 с этил- или фенилизотиоцианатом в
Синтезированные соединения были подвер-
толуоле в присутствии каталитических количеств
гнуты лабораторно-вегетационным испытани-
пиридина происходит гетероциклизация с образо-
ям для определения гербицидных, фунгицид-
ванием триазольного цикла 7a, б (схема 2). При ме-
ных и регулирующих рост растений свойств.
тилировании этих соединений иодистым метилом
Практически все соединения продемонстриро-
получены соответствующие S-метилпроизводные
вали стимулирующее действие на рост растений.
8a, б.
Эксперименты проводили на семенах и саженцах
фасоли обыкновенной (Phaseolus vulgaris L.).
Соединения 7a, б могут находиться как в ти-
онной, так и в тиольной таутомерных формах. В
Изучали влияние водных суспензий соединений
спектрах ЯМР 13С данных соединений в области
1-14 в концентрациях 25 и 50 мг/л на жизнеспо-
175-185 м. д. отсутствуют сигналы, которые могли
собность семян, прорастание и рост рассады.
бы соответствовать атому углерода двойной связи
Эти данные сравнивали с аналогичным эффектом
C=S, что указывает на тиольную форму.
растворов гетероауксина тех же концентраций.
Активность соединений колебалась в интерва-
Метилирование соединений 7a, б протекает по
ле 41-91% по сравнению с гетероауксином (см.
экзоциклическому атому серы (схема 2). Об этом
таблицу). Данные биологического скрининга отра-
свидетельствует наличие в спектрах ЯМР 1Н син-
жают интересный факт, когда в ряде случаев сти-
глетных сигналов в области 2.67-2.70 м. д., соот-
мулирующее действие растворов с меньшей кон-
ветствующих S-метильной группе.
центрацией оказалось выше более концентриро-
С целью синтеза соединений, включающих
ванных растворов (3, 5, 8б, 13, 14). Вещества, про-
пиримидиновый и
1,3,4-оксадиазольный ци-
явившие в эксперименте активность выше 70% (1,
клы, проведена гетероциклизация гидразида
6
3, 5, 7б, 8б, 9, 11, 10в, 13, 14), отобраны для более
под действием KОН и CS2 в спиртовой среде
глубокого изучения и дальнейших полевых испы-
(схема 2). В полученном соединении 9 1,3,4-ок-
таний с применением растворов синтезированных
садиазольный цикл, в отличие от 1,2,4-триазоль-
соединений в концентрациях менее 25 мг/л.
ного цикла в соединениях 7, находится в тион-
Схема 3.
ной форме. В пользу такого строения свидетель-
ствует наличие в спектре ЯМР 13С сигнала при
177.9 м. д., соответствующего атому углерода
N
двойной связи C=S. При алкилировании соедине-
N N
ния 9 диметилсульфатом и алкилгалогенидами за-
H
мещение также протекает по атому серы (схема 2),
N
H3C
O
N C6H5
что подтверждается данными ЯМР.
O
Для замены тиоксогруппы 1,3,4-оксадиазоль-
13
ного цикла на аминогруппу была проведена реак-
ция соединения 9 с диэтиламином и морфолином.
O
C6H5
Однако вместо образования 2-аминопроизводного
происходило расщепление оксадиазольного цикла
с образованием соединений 11 и 12 (схема 3), что
6
подтверждалось наличием в спектрах ЯМР 1Н сиг-
налов, соответствующих двум группам NH.
O NO2
O
В результате взаимодействия гидразида 6 с бен-
N
зальдегидом и
5-нитрофуран-2-карбальдегидом
получены соединения 13 и 14, в спектрах ЯМР
N N
H
которых наблюдаются два набора сигналов, соот-
N
O
H3C
O
N
NO2
ветствующих E- и Z-изомерам, с преобладанием
стерически более выгодной Е-формы (E/Z ~3:1)
O
14
(схема 3).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ НОВЫХ ПРОИЗВОДНЫХ
1515
Стимулирование роста растений растворами соедине-
ролидина в 20 мл бутан-1-ола нагревали 15 ч при
ний 1-14
130-140°С. Бутан-1-ол отгоняли, остаток промы-
вали диэтиловым эфиром, отфильтровывали и су-
Активность по сравнению
с гетероауксином, %
шили. Выход 72%, т. пл. 240-242°C. ИК спектр, ν,
Соединение
см-1: 1646 (C=O). Спектр ЯМР 1Н, δ, м. д.: 1.92-1.99
25 мг/л
50 мг/л
м (4Н, СН2СН2), 2.04 с (3Н, СН3), 3.43-3.51 м (4Н,
Гетероауксин
100.0
100.0
СН2NСН2), 5.32 с (1Н, СН, пиримидин), 10.84 уш.
с (1Н, ОН). Спектр ЯМР 13С, δС, м. д.: 23.7, 24.7,
1
76.0
79.6
46.1, 98.8, 152.2, 163.7, 165.1. Найдено, %: C 60.21;
3
71.7
58.4
H 7.26; N 23.20. C9H13N3O. Вычислено, %: C 60.32;
4
54.2
-
H 7.31; N 23.45.
5
74.7
50.4
4-Хлор-6-метил-2-(пирролидин-1-ил)пири-
мидин (2). Смесь 0.01 моль соединения 1 и 5 мл
6
50.4
42.5
POCl3 нагревали 2 ч при 80-85°C, затем отгоняли
7а
61.7
57.9
2/3 POCl3, добавляли ледяную воду и нейтрали-
зовали гидроксидом аммония. Продукт реакции
7б
44.1
80.2
экстрагировали диэтиловым эфиром. После удале-
8а
67.7
41.2
ния эфира получали чистый продукт. Выход 75%,
8б
91.2
46.9
густое масло. Спектр ЯМР 1Н, δ, м. д.: 1.93-2.00 м
(4Н, СН2СН2), 2.27 с (3Н, СН3), 3.48-3.55 м (4Н,
9
74.3
-
СН2NСН2), 6.34 с (1Н, СН, пиримидин). Спектр
10а
50.4
42.5
ЯМР 13С, δС, м. д.: 23.3, 24.8, 46.1, 106.8, 159.4,
10б
48.9
68.0
159.7, 168.0. Найдено, %: C 54.77; H 6.21; N, 21.41.
C9H12ClN3. Вычислено, %: C 54.69; H 6.12; N, 21.26.
10в
70.9
72.4
Метил-2-{[(6-метил-2-(пирролидин-1-ил)-
11
91.4
91.0
пиримидин-4-ил]окси}ацетат
(3). К раствору
13
78.5
48.9
0.01 моль калиевой соли соединения 1 в 10 мл
ДМФА при охлаждении (-5-0оС) по каплям добав-
14
79.5
72.5
ляли 0.011 моль метилового эфира хлоруксусной
кислоты. Полученную смесь оставляли на ночь
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
при 20°С, затем нагревали 2 ч при 80-90°С. Осадок
отфильтровывали, и отгоняли ДМФА при низком
ИК спектры зарегистрированы на спектрометре
давлении. Остаток обрабатывали водой, отфиль-
330FT-IR (Thermo Nicolet) с использованием мето-
тровывали и сушили. Выход 84%, т. пл. 68-70°C.
дики ATR. Спектры ЯМР 1H и 13C сняты при 30°С
ИК спектр, ν, см-1: 1754 (C=O). Спектр ЯМР 1Н, δ,
на спектрометре ЯМР Varian Mercury-300 (300 и
м. д.: 1.90-2.01 м (4Н, СН2СН2), 2.22 с (3Н, СН3),
75 MГц соответственно) в смеси растворителей
3.38-3.53 м (4Н, СН2NСН2), 3.70 c (3H, OCH3),
ДМСО-d6-СCl4 (3:1), внутренний стандарт - ТМС.
4.74 c (2H, OCH2), 5.85 с (1Н, СН, пиримидин).
Ход реакций и чистоту полученных соединений
Спектр ЯМР 13С, δС, м. д.: 23.5, 24.9, 45.7, 51.0,
контролировали методом ТСХ на пластинах Silufol
61.2, 93.4, 159.0, 167.4, 167.9, 168.2. Найдено, %: C
UV-254, элюент - ацетон-гексан, 2:1. Элементный
57.24; H 6.75; N 16.59. C12H17N3O3. Вычислено, %:
анализ выполнен на CHNS-анализаторе Eurovector
C 57.36; H 6.82; N 16.72.
EA30000. Температуры плавления определены ка-
2-{[6-Метил-2-(пирролидин-1-ил)пирими-
пиллярным методом без корректировки.
дин-4-ил]окси}уксусная кислота (4). К 0.01 моль
6-Метил-2-(пирролидин-1-ил)пиримидин-
соединения
3 прибавляли спиртовый раствор
4(3H)-он (1). Смесь 0.01 моль 6-метил-2-(метил-
0.02 моль KОН. Смесь кипятили 2 ч, затем спирт
сульфанил)пиримидин-4(3H)-она и 0.02 моль пир-
отгоняли. Остаток растворяли в воде, нейтрализо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
1516
ПИВАЗЯН и др.
вали уксусной кислотой до рН = 6-7. Прозрачный
зол-3-тиол (7a). Выход 88%, т. пл. 166-168°C.
раствор упаривали, из остатка продукт реакции
Спектр ЯМР 1Н, δ, м. д.: 1.31 т (3Н, NСН2СН3,
извлекали ацетоном. Выход 65%, т. пл. 95-97°C.
J = 7.1 Гц), 1.92-2.01 м (4Н, СН2СН2), 2.21 с (3Н,
Спектр ЯМР 1Н, δ, м. д.: 1.93-2.06 м (4Н, СН2СН2),
СН3), 3.47-3.59 м (4Н, СН2NСН2), 3.45-3.75 уш. с
2.42 с (3Н, СН3), 3.45-3.80 м (4Н, СН2NСН2), 4.72 с
(SH + H2O растворителя), 4.03 к (2Н, NСН2СН3,
(2Н, ОСН2), 6.34 с (1Н, СН, пиримидин), 7.50-8.50
J = 7.1 Гц), 5.36 с (2Н, ОСН2), 5.79 с (1Н, СН, пи-
уш. с (1Н, ОН). Спектр ЯМР 13С, δС, м. д.: 24.5,
римидин). Спектр ЯМР 13С, δС, м. д.: 13.1, 23.5,
24.9, 47.1, 62.1, 95.2, 168.5, 168.7. Найдено, %: C
24.8, 38.4, 45.9, 56.1, 93.1, 147.0, 159.2, 167.2,
55.59; H 6.30; N 17.59. C11H15N3O3. Вычислено, %:
167.7, 167.8. Найдено, %: C 52.35; H 6.12; N 26.05.
C 55.69; H 6.37; N 17.71.
C14H20N6OS. Вычислено, %: C 52.48; H 6.29; N
26.23.
2-{[6-Метил-2-(пирролидин-1-ил)пирими-
дин-4-ил]окси}ацетамид (5). Смесь 0.01 моль
5-{[6-Метил-2-(пирролидин-1-ил)пирими-
соединения 3 и 10 мл 25%-ного NH4OH выдер-
дин-4-ил]оксиметил}-4-фенил-4H-1,2,4-три-
живали 24 ч при 20°С. Осадок отфильтровывали,
азол-3-тиол (7б). Выход 72%, т. пл. 110-112°C.
промывали водой и сушили. Выход 82%, т. пл.
Спектр ЯМР 1Н, δ, м. д.: 1.91-2.00 м (4Н, СН2СН2),
160-162°C. Спектр ЯМР 1Н, δ, м. д.: 1.91-1.98 м
2.20 с (3Н, СН3), 3.00-3.80 уш. с (SH + H2O раство-
(4Н, СН2СН2), 2.21 с (3Н, СН3), 3.46-3.53 м (4Н,
рителя), 3.42-3.52 м (4Н, СН2NСН2), 5.20 с (2Н,
СН2NСН2), 4.59 с (2Н, ОСН2), 5.86 с (1Н, СН, пи-
ОСН2), 5.64 с (1Н, СН, пиримидин), 7.20-7.58 м
римидин), 6.87 уш. с и 7.06 уш. с (2Н, NH2). Спектр
(5H, C6H5). Найдено, %: C 58.77; H 5.55; N 22.99.
ЯМР 13С, δС, м. д.: 23.5, 24.9, 45.8, 63.0, 93.6, 159.3,
C18H20N6OS. Вычислено, %: C 58.68; H 5.47; N
167.2, 168.1, 169.3. Найдено, %: C 55.78; H 6.73; N
22.81.
23.58. C11H16N4O2. Вычислено, %: C 55.92; H 6.83;
Общая методика синтеза соединений 8a, б. К
N 23.71.
раствору 0.01 моль соединения 7 и 0.01 моль KОН
2-{[6-Метил-2-(пирролидин-1-ил)пири-
в 10 мл воды по каплям прибавляли 0.01 моль
мидин-4-ил]окси}ацетогидразид
(6).
Смесь
CH3I. Через 3 ч выпавший осадок отфильтровыва-
0.01 моль соединения 3 и 10 мл 70%-ного гидрази-
ли и сушили.
на перемешивали 6 ч при комнатной температуре
4-Метил-6-{[5-(метилсульфанил)-4-этил-
и оставляли на ночь. На следующий день добавля-
4H-1,2,4-триазол-3-ил]метокси}-2-(пирроли-
ли 10 мл воды, продукт реакции отфильтровывали
дин-1-ил)пиримидин (8a). Выход 68%, т. пл.
и сушили. Выход 78%, т. пл. 158-160°C. Спектр
85-87°C. Спектр ЯМР 1Н, δ, м. д.: 1.33 т (3Н,
ЯМР 1Н, δ, м. д.: 1.91-1.98 м (4Н, СН2СН2), 2.21 с
NСН2СН3, J = 7.2 Гц), 1.92-2.03 м (4Н, СН2СН2),
(3Н, СН3), 3.45-3.53 м (4Н, СН2NСН2), 4.01 уш. с
2.21 с (3Н, СН3), 2.70 c (3H, SCH3), 3.51-3.59 м (4Н,
(2Н, NH2), 4.64 с (2Н, ОСН2), 5.86 с (1Н, СН, пи-
СН2NСН2), 3.96 к (2Н, NСН2СН3, J = 7.1 Гц), 5.45
римидин), 8.91 уш. с (1Н, NH). Спектр ЯМР 13С,
с (2Н, ОСН2), 5.78 с (1Н, СН, пиримидин). Спектр
δС, м. д.: 23.5, 24.8, 45.8, 62.4, 93.7, 159.2, 166.7,
ЯМР 13С, δС, м. д.: 14.3, 14.6, 23.5, 24.9, 45.9, 56.2,
167.0, 168.1. Найдено, %: C 52.58; H 6.82; N 27.87.
93.1, 150.6, 150.7, 159.3, 167.6, 167.9. Найдено, %:
C11H17N5O2. Вычислено, %: C 52.58; H 6.82; N
C 53.69; H 6.52; N 24.81. C15H22N6OS. Вычислено,
27.87.
%: C 53.87; H 6.63; N 25.13.
Общая методика синтеза соединений 7a, б.
4-Метил-6-{[5-(метилсульфанил)-4-фенил-
Смесь 0.01 моль соединения 6, 0.01 моль этили-
4H-1,2,4-триазол-3-ил]метокси}-2-(пирроли-
зотиоцианата (или фенилизотиоцианата) и ката-
дин-1-ил)пиримидин (8б). Выход 72%, т. пл.
литического количества пиридина в 15 мл толуола
67-69°C. Спектр ЯМР 1Н, δ, м. д.: 1.90-1.98 (4Н,
оставляли при комнатной температуре на ночь, за-
СН2СН2), 2.20 с (3Н, СН3), 2.67 c (3H, SCH3),
тем нагревали 3 ч при 125-130°С. Толуол отгоня-
3.43-3.53 м (4Н, СН2NСН2), 5.30 с (2Н, ОСН2), 5.64
ли, осадок отфильтровывали и сушили.
с (1Н, СН, пиримидин), 7.32-7.55 м (5Н, С6Н5).
5-{[6-Метил-2-(пирролидин-1-ил)пирими-
Найдено, %: C 59.87; H 5.91; N 22.19. C19H22N6OS.
дин-4-ил]оксиметил}-4-этил-4H-1,2,4-триа-
Вычислено, %: C 59.66; H 5.80; N 21.97.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ НОВЫХ ПРОИЗВОДНЫХ
1517
5-{[6-Метил-2-(пирролидин-1-ил)пири-
2-{[5-({[6-Метил-2-(пирролидин-1-ил)пири-
мидин-4-ил]оксиметил}-1,3,4-оксадиазол-
мидин-4-ил]окси}метил)-1,3,4-оксадиазол-2-
2(3H)-тион (9). К раствору 0.01 моль KОН 25 мл
ил]сульфанил}ацетамид (10в). Выход 60%, т. пл.
этанола прибавляли
0.01 моль соединения
6,
165-167°C. Спектр ЯМР 1Н, δ, м. д.: 1.91-2.02 м
затем по каплям прибавляли 0.011 моль CS2.
(4Н, СН2СН2), 2.22 с (3Н, СН3), 3.43-3.55 м (4Н,
Полученную смесь кипятили 2 ч, спирт отгоняли.
СН2NСН2), 3.99 с (2Н, SСН2), 5.45 с (2Н, ОСН2),
Остаток растворяли в воде и нейтрализовали уксус-
5.85 с (1Н, СН, пиримидин), 7.08 уш. с и 7.55 уш.
ной кислотой. Осадок отфильтровывали и сушили.
с (2H, NH2). Спектр ЯМР 13С, δС, м. д.: 23.5, 24.8,
Выход 82%, т. пл. 185-187°C. Спектр ЯМР 1Н, δ,
35.9, 45.8, 55.5, 93.2, 159.1, 163.1, 164.1, 167.0,
м. д.: 1.91-2.00 м (4Н, СН2СН2), 2.22 с (3Н, СН3),
167.6, 167.8. Найдено, %: C 47.82; H 5.11; N 23.75.
3.45-3.53 м (4Н, СН2NСН2), 5.30 с (2Н, ОСН2),
C14H18N6O3S. Вычислено, %: C 47.99; H 5.18; N 23.98.
5.86 с (1Н, СН, пиримидин), 10.25 уш. с (1H, NH).
Общая методика синтеза соединений 11, 12.
Спектр ЯМР 13С, δС, м. д.: 23.5, 24.8, 45.9, 55.6,
Смесь 0.01 моль соединения 9 и 0.02 моль диэти-
93.2, 104.5, 159.0, 167.6, 167.9, 177.9. Найдено, %:
ламина (или морфолина) в пропан-1-оле кипятили
C 49.01; H 5.08; N 23.69. C12H15N5O2S. Вычислено,
10 ч. После удаления растворителя к остатку до-
%: C 49.13; H 5.15; N 23.87.
бавляли воду, осадок отфильтровывали и сушили.
Общая методика синтеза соединений 10a-в.
2-{[6-Mетил-2-(пирролидин-1-ил)пирими-
К калиевой соли, полученной из 0.01 моль KОН и
дин-4-ил]окси}-N’-(морфолин-4-карботиоил)-
0.01 моль соединения 9 в 15 мл ДМФА, по каплям
ацетогидразид (11). Выход 78%, т. пл. 170-172°C.
прибавляли 0.01 моль диметилсульфата или ал-
Спектр ЯМР 1Н, δ, м. д.: 1.89-2.01 м (4Н, СН2СН2),
килгалогенида (амид или метиловый эфир хлорук-
2.22 с (3Н, СН3), 3.48-3.56 м (4Н, СН2NСН2),
сусной кислоты). Полученную смесь оставляли на
3.61-3.68 м и 3.81-3.88 м [8H, N(CH2CH2)2O],
ночь при комнатной температуре, затем нагревали
4.80 с (2Н, ОСН2), 5.89 с (1Н, СН, пиримидин),
2 ч при 70-80°С до рН = 7. После удаления ДМФА
9.30-9.82 уш. с (2Н, NHNH). Спектр ЯМР 13С, δС,
к остатку добавляли 10-20 мл воды, отфильтровы-
м. д.: 23.5, 24.9, 45.8, 48.2, 65.6, 93.5, 159.2, 165.7,
вали осадок и сушили.
167.2, 168.0, 182.8. Найдено, %: C 50.63; H 6.41;
4-Метил-6-{[5-(метилсульфанил)-4H-1,3,4-
N 22.30. C16H24N6O3S. Вычислено, %: C 50.51; H
оксадиазол-3-ил]метокси}-2-(пирролидин-1-
6.36; N 22.09.
ил)пиримидин (10a). Выход 70%, т. пл. 65-67°C.
2-(2-{[6-Метил-2-(пирролидин-1-ил)пири-
Спектр ЯМР 1Н, δ, м. д.: 1.90-2.02 м (4Н, СН2СН2),
мидин-4-ил]окси}ацетил)гидразинил-1-кар-
2.22 с (3Н, СН3), 2.72 c (3H, SCH3), 3.43-3.55 м
ботио-N,N-диэтиламид (12). Выход 70%, т. пл.
(4Н, СН2NСН2), 5.45 с (2Н, ОСН2), 5.84 с (1Н, СН,
115-117°C. Спектр ЯМР 1Н, δ, м. д.: 1.22 т (3Н,
пиримидин). Спектр ЯМР 13С, δС, м. д.: 13.9, 23.5,
NCH2CH3, J = 6.9 Гц), 1.90-2.01 м (4Н, СН2СН2),
24.8, 45.8, 55.4, 93.1, 159.1, 163.1, 162.5, 167.6, 167.7.
2.22 с (3Н, СН3), 3.45-3.55 м (4Н, СН2NСН2), 3.68
Найдено, %: C 50.67; H 5.45; N 22.59. C13H17N5O2S.
Вычислено, %: C 50.80; H 5.58; N 22.79.
к (3Н, NCH2CH3, J = 6.9 Гц), 4.82 с (2Н, ОСН2),
5.89 с (1Н, СН, пиримидин), 9.18 уш. с (1H, NH),
Метил-2-{[5-({[6-метил-2-(пирролидин-1-
9.62 уш. с (1H, NH). Найдено, %: C 52.33; H 7.06;
ил)пиримидин-4-ил]окси}мeтил)-1,3,4-оксади-
N 22.74. C16H26N6O2S. Вычислено, %: C 52.44; H
азол-2-ил]сульфанил}ацетат (10б). Выход 68%,
7.15; N 22.93.
т. пл. 75-78°C. Спектр ЯМР 1Н, δ, м. д.: 1.92-2.00
м (4Н, СН2СН2), 2.22 с (3Н, СН3), 3.44-3.52 м (4Н,
Общая методика синтеза соединений 13 и 14.
СН2NСН2), 3.74 c (3H, OCH3), 4.12 с (2Н, SСН2),
К 0.01 моль соединения 6 прибавляли 10 мл воды,
5.46 с (2Н, ОСН2), 5.85 с (1Н, СН, пиримидин).
затем по каплям 2 мл 20%-ного раствора HCl до
Спектр ЯМР 13С, δС, м. д.: 23.5, 24.8, 33.2, 45.8,
полного растворения соединения 6, после чего по
52.1, 55.5, 93.1, 159.0, 163.0, 163.4, 166.9, 167.6,
каплям добавляли бензальдегид (или 5-нитрофу-
167.7. Найдено, %: C 49.22; H 5.13; N 19.01.
ран-2-карбальдегид). Полученную смесь переме-
C15H19N5O4S. Вычислено, %: C 49.31; H 5.24; N
шивали 3 ч при комнатной температуре. Осадок
19.17.
отфильтровывали и сушили.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
1518
ПИВАЗЯН и др.
N'-Бензилиден-2-{[6-метил-2-(пирролидин-
7. Kanagarajan V, Thanusu J., Gopalakrishnan M.A. //
1-ил)пиримидин-4-ил]окси}ацетогидразид (13).
J. Korean Chem. Soc. 2009. Vol. 53. N 6. P. 731. doi
Выход 89% (E:Z = 75:25), т. пл. 155-156°C. Спектр
10.5012/jkcs.2009.53.6.731
ЯМР 1Н, δ, м. д.: 1.86-2.11 м (4Н, СН2СН2), 2.60
8. Kraljevic T.K., Ilic N., Stepanic V., Sappe L., Petranovic J.,
с (3Н, СН3), 3.47-3.80 м (4Н, СН2NСН2), 5.00 с
Pavelic S.K., Raic-Malic S. // Bioorg. Med. Chem.
(3H, OCH2, Z), 5.39 c (3H, OCH2, Е) 6.30 с (1Н, СН,
Lett. 2014. Vol. 24. N 13. P. 2913. doi 10.1016/j.
пиримидин, E), 6.33 с (1Н, СН, пиримидин, Z),
bmcl.2014.04.079
7.30-7.75 м (5H, C6H5), 8.06 с (1H, N=CH, E), 8.42
9. Verma A.K., Kumari R., Sing A.K., Sharma B.B., Mar-
c (1H, N=CH, Z), 11.70 с (1H, NH, E), 12.36 c (1H,
tin A., Kant R. // Int. Res. J. Pharm. 2014. Vol. 5. N 12.
NH, Z). Спектр ЯМР 13С, δС, м. д.: 19.1, 23.9, 25.3,
P. 922. doi 10.7897/2230-8407.0512187
48.2, 63.6, 97.0, 126.6, 128.2, 129.4, 133.8, 144.2,
10. Ghorab M., Ragab A., Alqasoumi S.I., Alafeefy A.M.,
152.1, 159.9, 166.7, 169.6. Найдено, %: C 63.59; H
Aboulmagd S.A. // Eur. J. Med. Chem. 2010. Vol. 45.
6.13; N 20.40. C18H21N5O2. Вычислено, %: C 63.70;
P. 171. doi 10.1016/j.ejmech.2009.09.039
H 6.24; N 20.64.
11. Goudar V., Rashmi P., Shantharam U., Hazra K.,
2-{[6-Mетил-2-(пирролидин-1-ил)пирими-
Nargund L.G. // J. Chem. Pharm. Res. 2012. Vol. 4.
дин-4-ил]окси}-N'-[(5-нитрофур-2-ил)метили-
N 6. P. 3100.
ден]ацетогидразид (14). Выход 91% (E:Z = 70:30),
12. Kumaresan S., Chandrasekaran S., Sakthivel K.M.,
т. пл. 208-210°C. Спектр ЯМР 1Н, δ, м. д.: 1.92-2.13
Guruvayoorappan C., Israel V.M. // J. Chem. Pharm.
м (4Н, СН2СН2), 2.57 с (3Н, СН3), 3.52-3.90 м
Res. 2014. Vol. 6. N 10. P. 593.
(4Н, СН2NСН2), 5.03 с (3H, OCH2, Z), 5.38 c (3H,
OCH2, E), 6.31 с (1Н, СН, пиримидин, E), 6.34 с
13. Kota1 R.K., Kompelly K.K., Surampudi R., Kulakarni R. //
(1Н, СН, пиримидин, Z), 7.12 д и 7.57 д (СH=CH
J. Chem. Pharm. Res. 2011. Vol. 3. N 4. P. 848.
фуран, J = 3.8 Гц), 8.07 с (1H, N=CH, E), 8.51 c (1H,
14. Dalkara S., Karakurt A. // Curr. Top. Med. Chem. 2012.
N=CH, Z), 12.18 с (1H, NH, E), 13.06 c (1H, NH, Z).
Vol. 12. P. 1033. doi 10.2174/156802612800229215
Найдено, %: C 51.24; H 4.77; N 22.28. C16H18N6O5.
15. Abu-Hashem A.A., Youssef M.M., Hussein H.A.R. // J.
Вычислено, %: C 51.33; H 4.85; N 22.45.
Chin. Chem. Soc. 2011. Vol. 58. N 1. P. 41. doi 10.1002/
jccs.201190056
КОНФЛИКТ ИНТЕРЕСОВ
16. Abu-Hashem A.A., El-Shehry M.F., Badria F.A. // Acta
Авторы заявляют об отсутствии конфликта
Pharm. 2010. Vol. 60. N 3. P. 311. doi 10.2478/v10007-
интересов.
010-0027-6
17. Holy A., Votruba I., Masojıdkova M. // J. Med. Chem.
СПИСОК ЛИТЕРАТУРЫ
2002. Vol. 45. N 9. P. 1918. doi: 10.1021/jm011095y
1. Kaur N., Aggarwal A.K., Sharma N., Choudhary B. //
18. Nasr M.N., Gineinah M.M. // Arch Pharm. 2002.
Int. J. Pharm. Sci. Drug. Res. 2012. Vol. 4. N 3. P. 199.
Vol.
335. N
6. P.
289. doi
10.1002/1521-
2. Patel D.H., Chikhalia K.H., Shah N. K., Patel D.P.,
4184(200208)335:6<289::AID-ARDP289>3.0.CO;2-Z
Kaswala P.B., Buha V.M. // Pharm. Chem. J. 2010.
19. Isono Y., Sakakibara N., Ordonez P., Hamasaki T.,
Vol. 44. N 2. P. 94. doi 10.1007/s11094-010-0406-9
Baba M., Ikejiri M., Maruyama T. // Antivir. Chem.
3. David V.B., Babu V.H., Reddy V.M. // Int. J. Pharm.
Chemother. 2011. Vol. 22. N 2. P. 57. doi 10.3851/
Chem. Res. 2014. Vol. 3. N 1. P. 2278.
IMP1844
4. Gupta Y.K., Gupta V., Singh S. // J. Pharm. Res. 2013.
20. Sakakibara N., Hamasaki T., Baba M., Demixu Y.,
Vol. 7. N 6. P. 491. doi: 10.1016/j.jopr.2013.05.020
Kurihara M., Irie K., Iwai M., Asada E., Kato Y.,
5. Ingarsal N., Saravanan G., Amutha P., Nagarajan S.
Maruyama T. // Bioorg. Med. Chem. 2013. Vol. 21.
// Eur. J. Med. Chem. 2007. Vol. 42. N 4. P. 517. doi
N 18. P. 5900. doi 10.1016/j.bmc.2013.06.061
10.1016/j.ejmech.2006.09.012.
21. Novikov M.S., Ivanova O.N., Alexander V. Ivanov,
6. Gholap A.R., Toti K.S., Shirazi F., Deshpande M.V.,
Alexander A. Ozerov, Valiev-Elliston V.T., Temburni-
Srinivasan K.V. // Tetrahedron. 2008. Vol. 64. N 44.
kar K., Gurskaya G.V., Kochetkov S.N., Pannecouque Ch.,
P. 10214. doi 10.1016/j.tet.2008.08.033
Balzarini J., Seley-Radtke K.L. // Bioorg. Med.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ НОВЫХ ПРОИЗВОДНЫХ
1519
Chem. 2011. Vol. 19. N 19. P. 5794. doi 10.1016/j.
26. Agarwal A., Srivastava K., Puri S.K., Chauhan P.M.S. //
bmc.2011.08.025
Bioorg. Med. Chem. 2005. Vol. 13. N 15. P. 4645. doi
22. Tang J., Maddali K., Dreis Ch.D, Sham Y.Y., Vince R.,
10.1016/j.bmc.2005.04.061
Pommier Y., Zh.Wang // Bioorg. Med. Chem. Lett. 2011.
27. Tarnchompoo B., Sirichaiwat C., Phupong W.,
Vol. 21. N 8. P. 2400. doi 10.1016/j.bmcl.2011.02.069
Intaraudom Ch., Sirawaraporn W., Kamchonwon-
23. Virsodia V., Pissurlenkar R.R.S., Manvar D., Dhola-
gpaisan S., Vanichtanankul J., Thebtaranonth Y.,
kia Ch., Adlakha P., Sham A., Coutinho E.C.// Eur. J.
Yuthavong Y. // J. Med. Chem. 2002. Vol. 45. N 6.
Med. Chem. 2008. Vol. 43. N 10. Р. 2103. doi 10.1016/j.
P. 1244. doi 10.1021/jm010131q
ejmech.2007.08.004
28. Rana K., Kaur B., Kumar B. // Ind. J. Chem. (B). 2004.
24. Srivastav N.C., Rai D., Tse C., Agrawal B., Kunimoto D.Y.,
Vol. 43. N 7. P. 1553.
Kumar R. // J. Med. Chem. 2010. Vol. 53. N 16. P. 6180.
29. Kumar B., Kaur B., Kaur J., Parmar A., Anand R.D.,
doi 10.1021/jm100568q
Kumar H. // Ind. J. Chem. (B). 2002. Vol. 41. N 7.
25. Siddiqui A.B., Trivedi A.R., Kataria V.B., Shah V.H. //
P. 1526.
Bioorg. Med. Chem. Lett. 2014. Vol. 24. N 6. P. 1493.
doi 10.1016/j.bmcl.2014.02.012
html.
Synthesis and Biological Activity
of New 2-{[6-Methyl-2-(pyrrolidin-1-yl)pyrimidin-
4-yl]oxy}acetohydrazide Derivatives
V. A. Pivazyana, E. A. Ghazaryana, Zh. A. Azaryanb, and A. P. Yengoyana, b, *
a Pesticides Synthesis and Plant Protection Research Center, National Agrarian University of Armenia,
ul. Teryana 74, Yerevan, 0009 Armenia
*e-mail: ayengoyan@mail.ru
b Department of General and Pharmaceutical Chemistry, Russian-Armenian University, Yerevan, Armenia
Received April 15, 2019; revised April 15, 2019; accepted April 22, 2019
The reaction of 6-methyl-2-(pyrrolidin-1-yl)pyrimidin-4(3H)-one with chloroacetic acid ester and the subse-
quent hydrazinolysis afforded 2-{[6-methyl-2-(pyrrolidin-1-yl)pyrimidin-4-yl]oxy}acetohydrazide. Based on
the latter a number of new derivatives was synthesized, including compounds with a combination of pyrim-
idine and 1,2,4-triazole ring, as well as 1,3,4-oxadiazole and furan rings in the molecule. In preliminary bio-
logical screening, the synthesized compounds exhibited a pronounced stimulating action on plant growth. The
activity of substances was 41-91% compared to heteroauxin.
Keywords: 2-{[6-methyl-2-(pyrrolidin-1-yl)pyrimidin-4-yl)oxy]acetohydrazide, 5-{[(pyrimidin-4-yl)oxy]-
methyl}-4H-1,2,4-triazole-3-thiol, 5-{[(pyrimidin-4-yl)oxy]methyl}-1,3,4-oxadiazole-2(3H)-thione, plant
growth stimulants
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019