ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 10, с. 1531-1540
УДК 547.724.3
СИНТЕЗ 2-ЗАМЕЩЕННЫХ ЭФИРОВ
5-(1,2,3-СЕЛЕНАДИАЗОЛ-4-ИЛ)ФУРАН-3-КАРБОНОВОЙ
КИСЛОТЫ
© 2019 г. Р. Маадади, Л. М. Певзнер*, М. Л. Петров
Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
*e-mail: pevzner_lm@list.ru
Поступило в Редакцию 14 марта 2019 г.
После доработки 14 марта 2019 г.
Принято к печати 21 марта 2019 г.
Исходя из 2-замещенных эфиров 5-ацетилфуранкарбоновой кислоты, получена серия соответствующих
семикарбазонов. При окислении их двуокисью селена в уксусной кислоте образуются эфиры 5-(1,2,3-се-
ленадиазол-4-ил)фуран-3-карбоновой кислоты, имеющие функциональную группу в положении 2
фуранового кольца.
Ключевые слова: фуранкарбоновые кислоты, селенадиазолы, семикарбазоны, двуокись селена,
окисление
DOI: 10.1134/S0044460X1910007X
Продолжая изучение методов синтеза и хи-
ран-3-карбоновой кислоты и изучение возможно-
мических свойств гибридных гетероциклических
сти их дальнейшей функционализации по метиль-
систем, мы обратились к синтезу производных
ной группе. При этом большой теоретический и
2-(1,2,3-селенадиазол-4-ил)фурана, содержащих в
практический интерес представляло сравнение
положении 4 фуранового кольца сложноэфирную
методов синтеза и химических свойств данных
группу. Как нами было установлено ранее [1], вве-
соединений с аналогичной серией тиадиазолилфу-
дение подобного акцепторного заместителя в фу-
ранов [1], позволяющее выяснить влияние замены
рановое кольцо 2-(1,2,3-тиадиазол-4-ил)фуранов
серы на селен в сходных по строению структурах.
стабилизирует такого рода гетероциклические си-
Для синтеза целевых соединений использова-
стемы и позволяет проводить дальнейшую функ-
ли этиловый эфир 2-метил-5-ацетилфуран-3-кар-
ционализацию фуранового кольца. Селенадиазолы
боновой кислоты. Его семикарбазон 1 получали
более лабильны, чем тиадиазолы, поэтому в дан-
действием гидрохлорида семикарбазида и ацетата
ном случае поиск подходящей стабилизирующей
натрия в спирте в мольном соотношении фуран:се-
группы представлялся нам тем более оправдан-
микарбазид:ацетат натрия 1:1.2:2 при кипячении в
ным. Целью настоящей работы явился синтез
течение 10 ч (схема 1). Выход семикарбазона 1 со-
эфиров
2-метил-5-(1,2,3-селенадиазол-4-ил)фу-
ставил 74%.
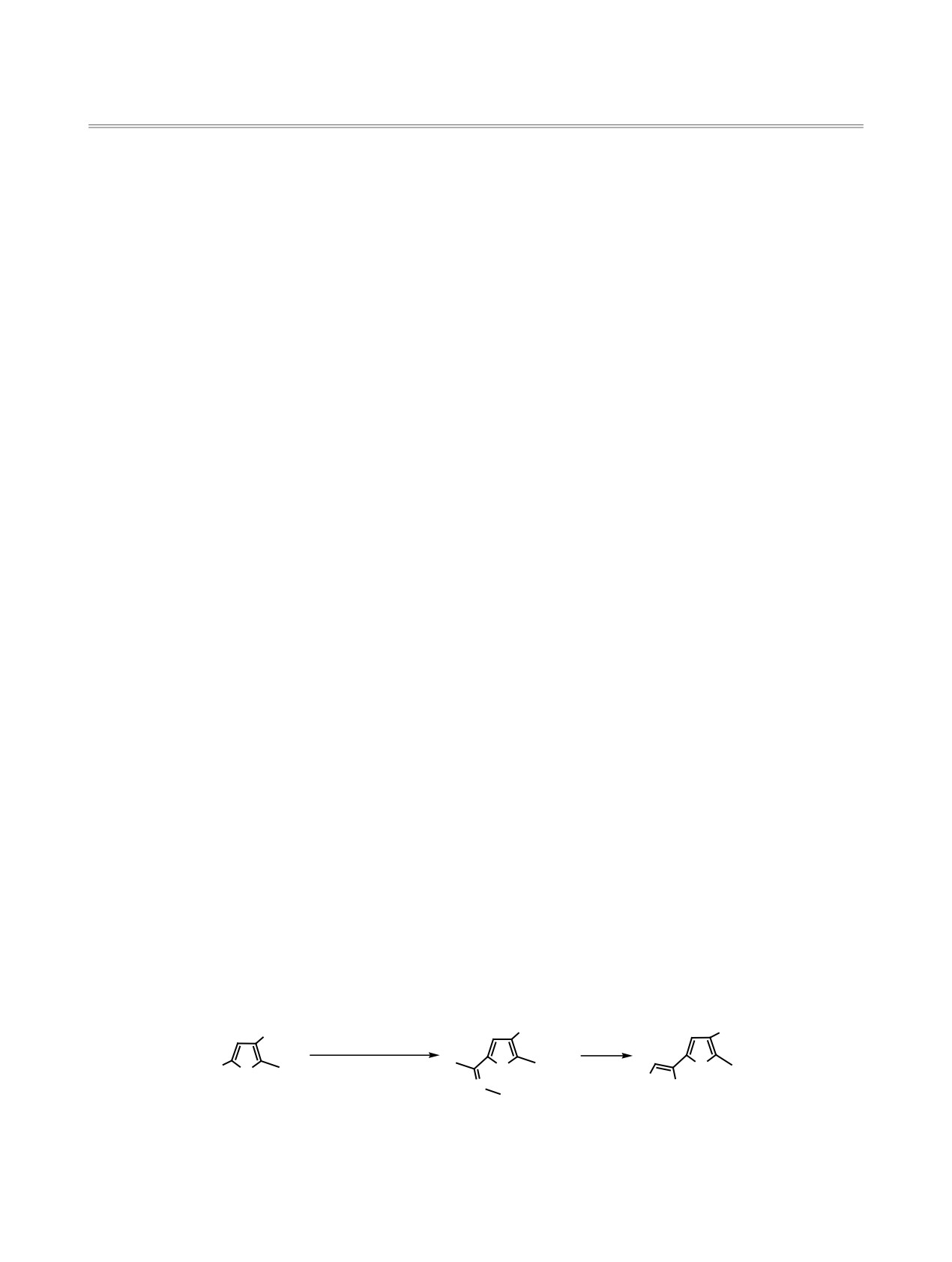
Схема 1.
CO2Et
CO2Et
CO2Et
H2N NHCONH2·HCl
SeO2
H3COC
NaOAc
O
AcOH
O
O
Se
N
NN
NHCONH2
1
2
1531
1532
МААДАДИ и др.
вводить на стадиях, предшествующих форми-
Схема 2.
рованию селенадиазольного цикла. Наиболее
COOH
подходящим для этого субстратом нам представ-
HCl
лялся этиловый эфир 2-бромметил-5-ацетилфу-
2
Se
O
AcOH
ран-3-карбоновой кислоты 4 [3]. Данный бромид
N N
вводили в реакции с разнообразными О-, S-, N- и
3
P-нуклеофилами. В качестве О-нуклеофилов были
использованы ацетат натрия и 2-метоксифенолят
Окисление семикарбазона 1 двуокисью селена
калия, генерируемый непосредственно в ходе ре-
проводили в уксусной кислоте в течение 3 ч при
акции из 2-метоксиметилфенола и карбоната ка-
70°С аналогично методике, описанной в работе
лия.
[2]. Селенадиазол 2 был выделен с выходом 78%
Поскольку на стадии получения семикарба-
(схема 2). В спектре ЯМР 1Н полученного соеди-
зонов в качестве основания используется аце-
нения исчезают сигналы протонов гидразонного
тат натрия, замещение брома на ацетоксигруппу
фрагмента, и появляется сигнал при 9.30 м. д., име-
проводили непосредственно в ходе синтеза семи-
ющий сателлиты с константой расщепления 2JHSe =
карбазона этилового эфира
2-ацетоксиметил-5-
39.2 Гц. Он был отнесен к протону Н5 селенадиазо-
ацетилфуран-3-карбоновой кислоты, не выделяя
льного цикла. В спектре ЯМР 13С появляются два
промежуточных продуктов. Реакцию проводили в
сигнала при 135.34 (С5-селенадиазол) и 154.08 м. д.
спирте при кипячении в присутствии 4-кратного
(С4-селенадиазол). Состав селенадиазола 2 был
избытка ацетата натрия в течение 10 ч (схема 3).
подтвержден с помощью масс-спектрометрии вы-
Семикарбазон 5 был выделен с выходом 60%.
сокого разрешения (ESI). Эфир 2 оказался доста-
Замещение брома на феноксильную группу
точно стабильным при температурах до 100°С.
проводили в ацетонитриле при 60°C при переме-
Поскольку селенадиазолы обычно нестабиль-
шивании в присутствии избытка карбоната калия
ны при нагревании в основных средах, мы попы-
в течение 4 ч (схема 3). Мольное соотношение бро-
тались провести кислотный гидролиз эфира 2 с це-
мид 4-фенол составляло 1:1.1. Феноксильное про-
лью получения свободной кислоты 3. Нагревание
изводное 6 было выделено с выходом 71%.
в смеси уксусной и соляной кислот при 75°С в
В качестве S-нуклеофила нами был выбран бу-
течение 9 ч сопровождалось заметным образова-
тантиол. В присутствии карбоната калия в ацето-
нием коллоидного селена, однако целевой про-
нитриле он замещает бром в соединении 4 уже при
дукт 3 был выделен в чистом виде с выходом 42%
комнатной температуре. Бутилтиометильное про-
(схема 2). Он разлагается на свету, но в темноте
изводное 7 было получено с выходом 95% (схема 3).
при комнатной температуре его можно хранить в
В качестве N-нуклеофила нами был использо-
течение нескольких дней без заметного накопле-
ван морфолин. Замещение брома проводили в бен-
ния спектрально различимых примесей. В усло-
золе при 80°С в течение 6 ч (схема 3). Мольное со-
виях масс-спектрометрического определения кис-
отношение бромид 4-морфолин составляло 1: 2.3.
лота 3 полностью разлагается. В спектрах ЯМР
Третичный амин 8 был выделен с выходом 62%.
сигнал протона селенадиазольного цикла наблю-
дается при 9.91 м. д. и имеет сателлиты с констан-
Фосфорилирование бромида 4 проводили три-
той 2JHSe = 37.6 Гц. Сигналы ядер углерода селена-
этилфосфитом по методике [3] (схема 3). Выход и
диазольного цикла проявляются при 139.81 (С5) и
спектральные характеристики фосфоната 9 были
153.53 м. д. (С4).
идентичны описанным.
Попытка бромирования эфира 2 по метильной
Семикарбазоны
2-замещенных производных
группе действием N-бромсукцинимида привела к
эфиров
5-ацетилфуран-3-карбоновой кислоты
осмолению. Очевидно, для получения произво-
10-13 получали по общей методике в спирте при
дных
5-(1,2,3-селенадиазол-4-ил)фуран-3-карбо-
кипячении в течение 9-10 ч. Мольное соотноше-
новой кислоты, замещенных по метильной группе
ние кетон-гидрохлорид семикарбазида-ацетат на-
в положении 2, функциональную группу следует
трия составляло 1:1.2:2.0. Соединения 10-13 были
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
НАЗВАНИЕ
1533
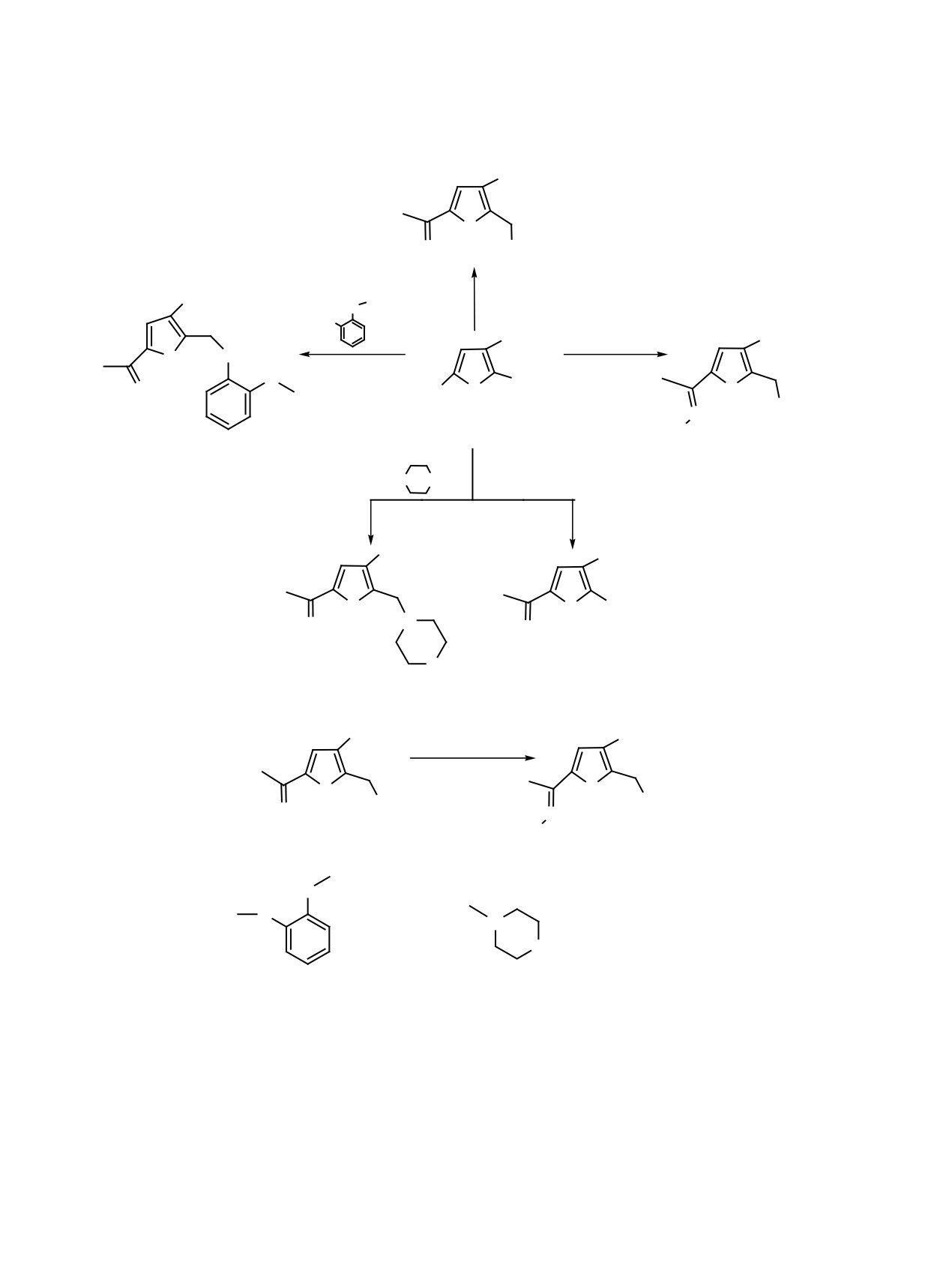
Схема 3.
CO2Et
O
O
SC4H9
7
BuSH
COOEt
O
K2CO3, CH3CN
HO
CO2Et
CO2Et
H2N NHCONH2
O
O
K2CO3, CH3CN
NaOAc
O
CH2Br
O
H3COC
O
O
OCOCH3
N
4
H2NOCHN
6
5
O NH
P(OEt)
3
COOEt
COOEt
O
O
CH2PO(OEt)2
O
N
O
8
O
9
Схема 4.
COOEt
COOEt
H2N NHCONH2·HCl
NaOAc
O
O
X
X
O
N
H2NOC-HN
6 9
10 13
O
O
N
X=
(6, 10); S-Bu (7, 11);
(8, 12); PO(OEt)2 (9, 13).
O
выделены с выходом 71-84% (схема 4); определен-
селена = 1:1.1. Окисление ацетоксиметильного
ной зависимости выхода от природы заместителя в
производного 5 проводили в течение 5 ч при 70°С.
боковой цепи отмечено не было.
Оказалось, что реакция протекает в двух направ-
Окисление функционально-замещенных семи-
лениях (схема 5). Наибольшее количество семи-
карбазонов 5, 9-13 проводили аналогично рабо-
карбазона окисляется до кетона 14. Образование
те [2] двуокисью селена в уксусной кислоте при
последнего вероятнее всего связано с кислотным
мольном соотношении семикарбазон:двуокись
расщеплением гидразона 5 в присутствии срав-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
1534
МААДАДИ и др.
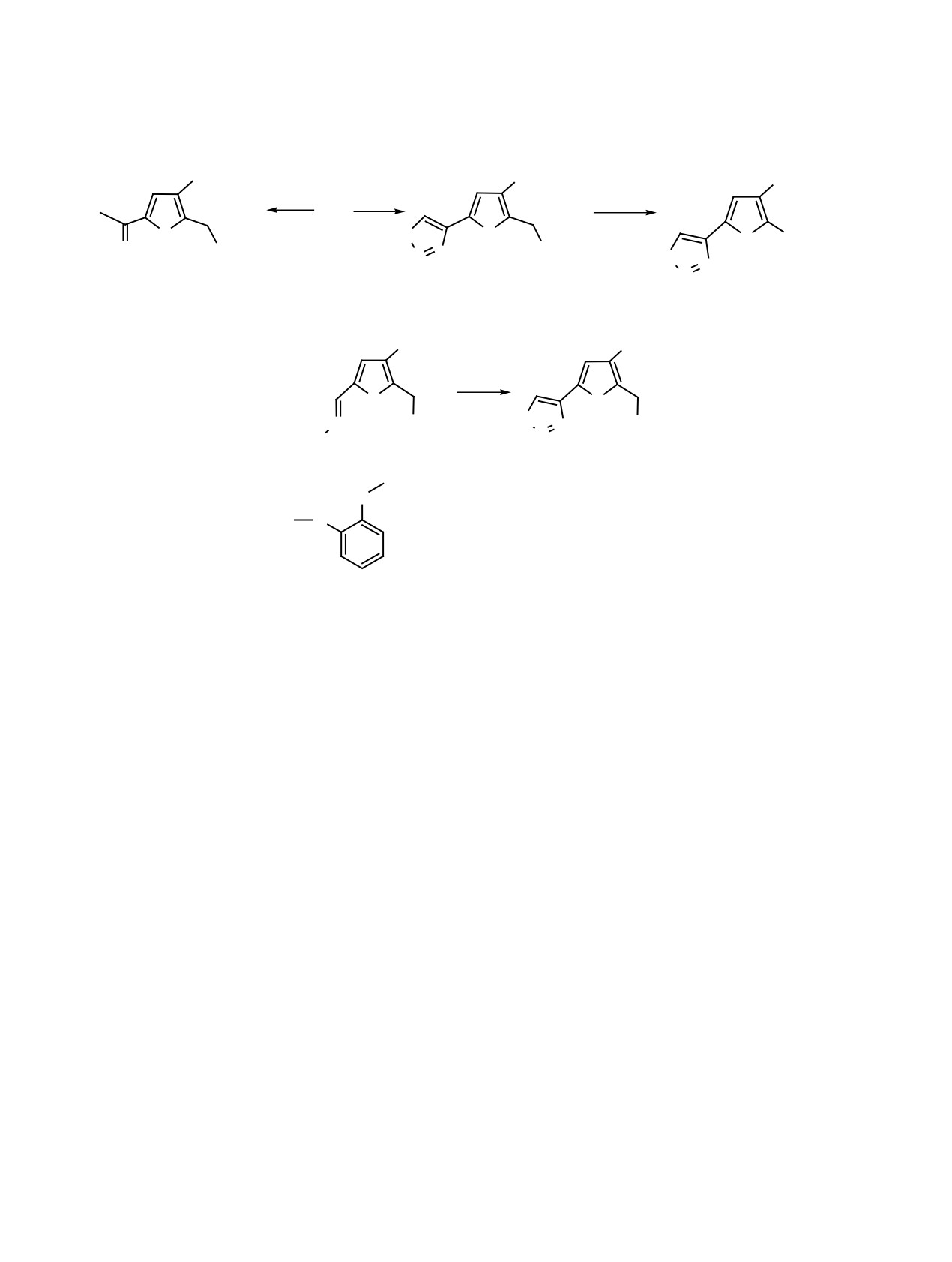
Схема 5.
CO2Et
CO2Et
COOMe
SeO2
SeO2
MeOH
5
MeONa
O
Se
O
O CH2OH
O
OCOCH3
OCOCH3
N N
Se
N
14
N
15
16
Схема 6.
COOEt
COOEt
SeO2
O
AcOH
O
N
X
Se
X
N
N
H2NOCHN
10, 11, 13
17, 18, 19
O
O
X=
(10, 17), S C4H9 (11, 18), PO(OEt)2 (13, 19).
нительно сильной селеновой кислоты, образовав-
зывается присутствием синала протона Н5 селена-
шейся из двуокиси селена путем гидратации ее
диазольного цикла при 9.99 м. д., имеющего сател-
реакционной водой. Выделившийся семикарба-
литы с константой расщепления 2JHSe = 34.8 Гц, а
зид при окислении образует воду, что благопри-
также наличием сигналов углерода селенадиазо-
ятствует предполагаемому пути реакции. Вторым
льного кольца при 140.90 (С5) и 161.15 м. д. (С4).
продуктом окисления является селенадиазол 15.
Сигнал метиленовых протонов гидроксиметиль-
Разделить эти продукты удалось путем кристалли-
ной группы проявляется в виде дублета при 4.80
зации из гексана. Выход кетона 14 составил 62%,
м. д. (JHН = 4.4 Гц), сигнал гидроксильного прото-
селенадиазола 15 - 15%. Образование селенади-
на выглядит как сильно уширенный триплет при
азольного кольца подтверждалось появлением в
5.62 м. д., а сигнал ядра углерода располагается
спектрах ЯМР сигнала протона селенадиазольно-
при 54.81 м. д.
го кольца Н5 при 9.44 м. д., имеющего сателлиты
Окисление морфолинового производного
12
с константой расщепления 2JHSe = 38.8 Гц, а так-
как при 70°С, так и при комнатной температу-
же сигналов углерода селенадиазольного кольца
ре не приводит к образованию селенадиазола. В
при 137.00 (С5) и 157.19 м. д. (С4). Состав полу-
обоих случаях из реакционной массы было выде-
ченных соединений был подтвержден с помощью
лено около 40% исходного вещества, а продукты
масс-спектрометрии высокого разрешения (ESI).
окисления представляли собой сложную смесь, в
Метанолизом соединения 15 при комнатной
спектре ЯМР 1Н которой сигналы протонов фура-
температуре в присутствии следовых количеств
нового кольца не наблюдались. Таким образом, в
метилата натрия удалось получить спирт 16 с
данном случае дальнейшее окисление первичных
выходом 74% (схема 5). Он разлагается на све-
продуктов идет легче, чем соединения 12, что и
приводит к возврату исходного вещества.
ту и в тени при нагревании (149-150°С), не пла-
вясь, а также полностью распадается в условиях
Окисление семикарбазонов 10, 11 и 13 протека-
масс-спектрометрических определений. Наличие
ет более селективно. Соединения 10 и 11, содержа-
селенадиазольного кольца в этом соединении дока-
щие легко окисляемые фенольный и сульфидный
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
НАЗВАНИЕ
1535
фрагменты, окисляли при 55-60 и 42-45°С соот-
Этиловый эфир
2-метил-5-(1,2,3-селенади-
ветственно (схема 6). В ходе реакции наблюдалось
азол-4-ил)фуран-3-карбоновой кислоты (2). К
заметное выделение коллоидного селена, селена-
раствору 7.46 г семикарбазона этилового эфира
диазолы 17 и 18 были выделены с выходами 41 и
2-метил-5-ацетилфуран-3-карбоновой кислоты
1
49% соответственно. Образования исходных кето-
в 60 мл уксусной кислоты прибавляли небольши-
нов 6, 7 ни в одном случае не зафиксировано.
ми порциями 3.6 г двуокиси селена. Реакционную
массу перемешивали 3 ч при 70°С, затем выливали
Реакцию окисления фосфоната 13 проводили
в 200 мл воды. Полученную смесь перемешивали
при 60°С в течение 7 ч. Фосфорилированный селе-
1 ч, отфильтровывали осадок и промывали его на
надиазол 19 был выделен с выходом 70% (схема 6).
фильтре 50 мл хлороформа. Водную фазу экстра-
В его спектре ЯМР 13С присутствовали дублетные
гировали хлороформом (2×20 мл). Хлороформный
сигналы фуранового цикла при 109.80 (С4, 4JРС =
раствор промывали 30 мл раствора NaCl, сушили
3.1 Гц),
117.35 (С3, 3JРС = 8.3 Гц), 146.83 (С5,
сульфатом натрия, затем фильтровали через слой
4JРС = 2.9 Гц) и 152.90 м. д. (С2, 2JРС = 13.9 Гц), что
силикагеля и упаривали досуха. Выход 6.54 г
позволило отнести сигналы углерода фуранового
(78%), красные кристаллы, т. пл. 94°С. Спектр ЯМР
и селенадиазольного колец для всей серии синте-
1Н (CDCl3), δ, м. д.: 1.37 т (3Н, СН3-эфир, JHH =
зированных фурилселенадиазолов.
7.2 Гц), 2.68 с (СН3-фуран), 4.23 к (2Н, ОСН2-
Анализ выходов полученных селенадиазо-
эфир, JHH = 7.2 Гц), 7.29 с (1Н, Н4-фуран), 9.30 с
лов позволил заключить, что присутствие легко
(1Н, Н5-селенадиазол, сателлит 2JHSe = 39.2 Гц).
окисляемой группы в боковой цепи семикарба-
Спектр ЯМР 13С (CDCl3), δС, м. д.: 13.90 (СН3-
зона снижает выход селенадиазола практиче-
фуран),
14.33 (СН3-эфир),
60.43 (ОСН2-эфир),
ски вдвое. Присутствие третичной аминогруппы
109.80 (С4-фуран), 115.55 (С3-фуран), 135.34 (С5-
полностью подавляет образование селенадиазо-
селенадиазол),
145.45 (С5-фуран),
154.08 (С4-
льного кольца, а в случае ацетоксигруппы боль-
селенадиазол), 159.62 (С2-фуран), 163.91 (С=О).
шая часть семикарбазона превращается в кетон.
Масс-спектр, m/z: 286.9939 [M + Н]+ (вычислено
Гидроксилсодержащие группы, такие как кислот-
для С10Н10N2О3Se: 286.9934).
ная и спиртовая, очень заметно понижают стабиль-
2-Метил-5-(1,2,3-селенадиазол-4-ил)фуран-
ность селеналиазольного фрагмента и способству-
3-карбоновая кислота (3). Раствор 4.45 г этило-
ют выделению при хранении коллоидного селена.
вого эфира 2-метил-5-(1,2,3-селенадиазол-4-ил)-
Таким образом, функционально замещенные
фуран-3-карбоновой кислоты 2 в смеси 22 мл ук-
фурилселенадиазолы в отличие от аналогичных
сусной и 10 мл соляной кислоты перемешивали
тиадиазолов могут быть получены только при
9 ч при 75°С. После этого отгоняли на роторном
предварительном введении всех необходимых за-
испарителе летучие вещества, остаток растворяли
местителей в соединения-предшественники. При
в 10%-ом растворе карбоната натрия. Полученный
этом природа заместителей в значительной сте-
раствор фильтровали через бумажный фильтр мар-
пени ограничивает возможность формирования
ки «синяя лента» и подкисляли 20%-ной соляной
1,2,3-селеналиазольного цикла при окислении
кислотой до рН = 2-3. Осадок отфильтровывали и
функционально замещенных семикарбазонов аце-
сушили на воздухе. Выход 1.68 г (42%), темно-ко-
тилфурана.
ричневые кристаллы, т. разл. 100°С. Спектр ЯМР
1Н (ДМСО-d6), δ, м. д.: 2.65 с (СН3-фуран), 7.21 с
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(1Н, Н4-фуран), 9.91с (1Н, Н5-селенадиазол, сател-
лит 2JHSe = 37.6 Гц), 12.83 уш. с (1Н, ОН). Спектр
Спектры ЯМР 1Н, 13С, и 31Р снимали на при-
ЯМР 13С (ДМСО-d6), δС, м. д.: 14.02 (СН3-фуран),
боре Bruker AVANCE-III HD [400.13 (1Н), 161.97
109.70 (С4-фуран), 116.09 (С3-фуран), 139.81 (С5-
(31Р), 100.16 МГц (13С)]. Масс-спектры высокого
селенадиазол),
145.73 (С5-фуран),
153.53 (С4-
селенадиазол), 159.33 (С2-фуран), 164.80 (С=О).
разрешения (HRMS-ESI) регистрировали на при-
боре Micromass 70-VSE. Температуры плавления
Семикарбазон этилового эфира 2-(ацетокси-
измеряли на приборе Boёtius.
метил)-5-ацетилфуран-3-карбоновой кислоты
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
1536
МААДАДИ и др.
(5). К раствору 4.64 г этилового эфира 2-бром-
фуран),
150.19 (С1-фенил),
151.74 (С2-фенил),
метил-5-ацетилфуран-3-карбоновой кислоты 4 в
158.40 (С2-фуран),
162.10 (С=О-эфир),
186.69
40 мл этанола прибавляли 2.27 г гидрохлорида се-
(С=О-кетон). Масс-спектр, m/z: 341.1013 [M + Na]+
микарбазида и 4.82 г ацетата натрия. Реакционную
(вычислено для С17Н18О6: 341.0996).
массу кипятили при перемешивании 10 ч, затем
Этиловый эфира 2-(бутилтиометил)-5-аце-
выливали в 130 мл воды. Полученную смесь экс-
тилфуран-3-карбоновой кислоты (7). К раствору
трагировали хлороформом (3×50 мл), промывали
2.82 г этилового эфира 2-бромметил-5-ацетилфу-
40 мл раствора NaCl и сушили сульфатом натрия.
ран-3-карбоновой кислоты 4 и 1.2 мл бутантиола
Хлороформ отгоняли, остаток затирали с этила-
в 20 мл ацетонитрила прибавляли 2.00 г карбо-
цетатом. Выход 3.26 г (60%), желтые кристаллы,
ната калия. Полученную смесь перемешивали до
т. пл. 168-172°C. Спектр ЯМР 1Н (ДМСО-d6), δ,
прекращения выделения СО2. Осадок отфильтро-
м. д.: 1.27 т (3Н, СН3-эфир, JHH = 7.0 Гц), 2.06 с (3Н,
вывали и промывали 10 мл ацетонитрила. После
СН3-ацетат), 2.12 с (3Н, СН3-семикарбазон), 4.25 к
удаления ацетонитрила остаток выдерживали в ва-
(2Н, ОСН2-эфир, JHH = 7.0 Гц), 5.32 с (2Н, ОСН2-
кууме (1 мм рт. ст) 1 ч при комнатной температуре.
фуран), 6.53 уш. с (2Н, NH2), 7.20 с (1Н, Н4-фуран),
Выход 2.75 г (95%), желтоватое сиропообразное
9.66 уш. с (1Н, NH). Спектр ЯМР 13С (ДМСО-d6),
вещество. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 0.89 т
δС, м. д.: 13.16 (СН3-семикарбазон), 14.49 (СН3-
(3Н, СН3-Bu, JHH = 7.2 Гц), 1.36 т (3Н, СН3-эфир,
эфир), 20.91 (СН3-ацетат), 57.02 (ОСН2-фуран),
J
= 7.2 Гц), 1.41 секстет (2Н, СН23-Bu, JHH =
HH
61.03 (ОСН2-эфир), 109.15(С4-фуран), 118.71 (С3-
7.2 Гц), 1.56 квинтет (2Н, СН22-Bu, JHH = 7.2 Гц),
фуран), 135.90 (С=N), 152.93(С5-фуран),
154.03
2.47 с (3Н, СН3-ацетил), 2.59 т (2Н, SСН2-Bu,
(С2-фуран), 157.22 (О=СNH), 162.47 (С=О-фуран),
J
= 7.2 Гц), 4.08 с (2Н, SСН2-фуран), 4.32 к (2Н,
HH
170.27 (С=О-ацетат). Масс-спектр, m/z: 334.1003
ОСН2-эфир, JHH = 7.2 Гц), 7.41 с (1Н, Н4-фуран).
[M + Na]+ (вычислено для С13Н16N3О6: 334.1010).
Спектр ЯМР 13С (CDCl3), δС, м. д.: 13.61 (СН3-
Этиловый эфир 2-(2-метоксифенилметил)-
Bu), 14.24 (СН3-эфир), 21.90 (СН23-Bu),
27.18
5-ацетилфуран-3-карбоновой кислоты
(6). К
(SСН2-Bu), 31.34 (СН22-Bu), 32.20 (SСН2-фуран),
раствору 3.71 г этилового эфира 2-бромметил-5-
60.96 (ОСН2-эфир), 116.17 (С4-фуран), 117.94 (С3-
ацетилфуран-3-карбоновой кислоты 4 и 1.9 г 2-ме-
фуран), 150.63 (С5-фуран), 162.42 и 162.74 (С2-
токсифенола в 40 мл ацетонитрила прибавляли
фуран, С=О).
3 г карбоната калия. Полученную смесь переме-
Этиловый эфир
2-(N-морфолинометил)-5-
шивали 4 ч при 60°С до прекращения выделения
ацетилфуран-3-карбоновой кислоты (8). Раствор
углекислого газа. Отфильтровывали осадок неор-
1.69 г этилового эфира 2-бромметил-5-ацетилфу-
ганических солей, фильтрат упаривали. Остаток
ран-3-карбоновой кислоты 4 и 1.2 мл морфолина
растворяли в минимальном количестве этилацета-
в 20 мл бензола кипятили при перемешивании
та и добавляли 40 мл гексана. При испарении этого
6 ч. Реакционную смесь экстрагировали 10%-ной
раствора получали 3.08 г (71%) этилового эфира
соляной кислотой (3×10 мл), экстракт промывали
2-(2-метоксифенилметил)-5-ацетилфуран-3-кар-
10 мл этилацетата, подщелачивали карбонатом на-
боновой кислоты в виде желтоватых игольчатых
трия до рН = 9-10, насыщали хлористым натрием и
кристаллов с т. пл. 43°С. Спектр ЯМР 1Н (CDCl3),
экстрагировали хлороформом (3×15 мл). Экстракт
δ, м. д.: 1.31 т (3Н, СН3-эфир, JHH = 7.0 Гц), 2.46
сушили сульфатом натрия, отгоняли хлоро-
с (3Н, СН3-ацетил), 3.84 с (3Н, СН3О), 4.30 к
форм, остаток выдерживали в вакууме (1 мм
(2Н, СН2О-эфир, JHH = 7.0 Гц), 5.44 с (2Н, фу-
рт. ст) 1 ч при комнатной температуре. Выход 1.08 г
ран-СН2О), 6.84-6.91 м (2Н, Н3,6-фенил), 6.96-7.02
(62%), светло-желтое сиропообразное вещество.
м (2Н, Н4,5-фенил), 7.42 с (1Н, Н4-фуран). Спектр
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.37 т (3Н, СН3-
ЯМР 13С (CDCl3), δС, м. д.: 14.15 (СН3-эфир), 26.14
эфир, JHH = 7.2 Гц), 2.48 с (3Н, СН3-ацетил), 2.58
(СН3-ацетил), 55.89 (СН3О), 61.13 (СН2О-эфир),
т (4Н, СН2N-морфолин, JHH = 4.4 Гц), 3.69 т (4Н,
62.64 (фуран-СН2О),
112.26 (С6-фенил),115.74
СН2О-морфолин, JHH = 4.4 Гц), 3.99 с (2Н, фу-
(С3-фенил) 116.99 (С4-фуран), 118.83 (С3-фуран),
ран-СН2N), 4.32 к (2Н, СН2О-эфир, JHH = 7.2 Гц),
120.82 (С5-фенил), 122.84 (С4-фенил), 147.53(С5-
7.42 с (1Н, Н4-фуран). Спектр ЯМР 13С (CDCl3),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
НАЗВАНИЕ
1537
δС, м. д.: 14.24 (СН3-эфир), 26.05 (СН3-ацетил),
фенил), 122.59 (С4-фенил), 135.85 (С=N), 147.72
53.19 (СН2N-морфолин), 60.95 (СН2О-эфир), 66.89
(С5-фуран), 149.92 (С1-фенил), 152.83 (С2-фенил),
(СН2О-морфолин),
67.97 (фуран-СН2N),
117.77
155.52 (С2-фуран), 157.26 (О=СNH), 162.65 (С=О).
(С4-фуран), 118.52 (С3-фуран), 151.06 (С5-фуран),
Масс-спектр, m/z: 398.1339 [M + Na]+ (вычислено
160.90 (С2-фуран),
162.47 (С=О-эфир),
186.23
для С18Н21N3О6: 398.1323).
(С=О-кетон).
Семикарбазон этилового эфира
2-(бутил-
Семикарбазоны 2-замещенных производных
тиометил)-5-ацетилфуран-3-карбоновой кис-
этилового эфира 5-ацетилфуран-3-карбоновой
лоты (11). Выход 75%, желтые кристаллы, т. пл.
кислоты (общая методика). К раствору 10 ммоль
136°C. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 0.90 т
соответствующего эфира в 30 мл этанола прибав-
(3Н, СН3-Bu, JHH = 7.2 Гц), 1.37 т (3Н, СН3-эфир,
ляли 12 ммоль гидрохлорида семикарбазида и
J
= 7.2 Гц), 1.40 секстет (2Н, СН23-Bu, JHH =
HH
20 ммоль ацетата натрия. Реакционную массу пе-
7.2 Гц), 1.58 квинтет (2Н, СН22-Bu, JHH = 7.2 Гц),
ремешивали при кипячении 9-10 ч, затем охла-
2.13 (3Н, СН3-семикарбазон), 2.58 т (2Н, SСН2-Bu,
ждали и выливали в 70 мл воды. Выделившиеся
JHH = 7.2 Гц), 4.08 с (2Н, SСН2-фуран), 4.32 к (2Н,
кристаллы отфильтровывали, промывали водой и
ОСН2-эфир, JHH = 7.2 Гц), 5.45 уш. с и 6.29 уш. с
сушили на воздухе. При необходимости получен-
(2Н, NH2), 6.89 с (1Н, Н4-фуран), 9.11 с (1Н, NH).
ное вещество перекристаллизовывали.
Спектр ЯМР 13С (CDCl3), δС, м. д.: 12.60 (СН3-
семикарбазон), 13.64 (СН3-Bu), 14.31(СН3-эфир),
Семикарбазон этилового эфира 2-метил-5-
21.98 (СН23-Bu), 27.08 (SСН2-Bu), 31.44 (СН22-
ацетилфуран-3-карбоновой кислоты (1). Выход
Bu),
31.96 (SСН2-фуран),
60.67 (ОСН2-эфир),
74%, желтые кристаллы, т. пл. 204°С (EtOH).
110.00 (С4-фуран),
115.90 (С3-фуран),
137.20
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 1.29 т (3Н, СН3-
(С=N), 150.58 (С5-фуран), 157.93 (О=СNH), 159.51
эфир, JHH = 7.2 Гц), 2.09 с (3Н, СН3-гидразон), 2.57
(С2-фуран), 163.06 (С=О).
с (3Н, СН3-фуран), 4.24 к (2Н, СН2О-эфир, JHH =
7.2 Гц), 6.43 уш. с (2Н, NH2), 7.08 с (1Н, Н4-фуран),
Семикарбазон этилового эфира
2-(N-мор-
9.95 уш. с (1Н, NH). Спектр ЯМР 13С (ДМСО-d6),
фолинометил)-5-ацетилфуран-3-карбоновой
δС, м. д.: 13.09 (СН3-гидразон), 14.18 (СН3-фуран),
кислоты (12). Выделен после отгонки спирта,
14.66 (СН3-эфир), 60.45 (СН2О-эфир), 109.44 (С4-
растворения в 30 мл воды и подщелачивания до
фуран), 115.18 (С3-фуран), 136.22 (С=N), 150.79
рН = 10. Выход 71%, серо-желтые кристаллы, т.
(С5-фуран), 157.39 (С2-фуран), 159.35 (О=СNH),
пл. 85°С. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 1.24
163.36 (С=О). Масс-спектр, m/z: 254.1145 [M + H]+
т (3Н, СН3-эфир, JHH = 7.2 Гц), 2.11 с (3Н, СН3-
(вычислено для С11Н15N3О4: 254.1140).
семикарбазон), 2.49 т (4Н, NСН2-морфолин, JHH =
4.4 Гц), 3.55 т (4Н, ОСН2-морфолин, JHH = 4.4
Семикарбазон этилового эфира 2-(2-меток-
Гц), 3.87 с (2Н, NСН2-фуран), 4.25 к (2Н, СН2О-
сифенилметил)-5-ацетилфуран-3-карбоновой
эфир, JHH = 7.2 Гц), 6.44 уш. с (2Н, NH2), 7.15 с
кислоты (10). Выход 84%, желтые кристаллы,
(1Н, Н4-фуран), 9.47 с (1Н, NH). Спектр ЯМР 13С
т. пл. 83°С. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
(ДМСО-d6), δС, м. д.: 13.13 (СН3-семикарбазон),
1.24 т (3Н, СН3-эфир, JHH = 7.2 Гц), 2.17 с (3Н,
14.63
(СН3-эфир),
53.18
(NСН2-морфолин),
СН3-семикарбазон), 3.74 с (3Н, СН3О), 4.24 к (2Н,
60.73 (СН2О-эфир), 66.61 (ОСН2-морфолин, фу-
СН2О-эфир, JHH = 7.2 Гц), 5.33 с (2Н, фуран-СН2О),
ран-СН2N), 109.10 (С4-фуран), 118.20 (С3-фуран),
6.47 уш. с (2Н, NH2), 6.88 д. д (1Н, Н5-фенил, 3JHH =
136.20 (С=N), 152.03 (С5-фуран), 157.25 (О=СNH),
7.6,
4JHH = 1.6 Гц), 6.96 уш. д (1Н, Н4-фенил,
157.43(С2-фуран), 163.08 (С=О).
3JHH = 7.6 Гц), 6.99 д. д (1Н, Н3-фенил, 3JHH =
7.6,
4JHH = 1.6 Гц), 7.07 уш. д (1Н, Н6-фенил,
Семикарбазон этилового эфира 2-(диэтокси-
3JHH = 7.6 Гц), 7.24 с (1Н, Н4-фуран), 9.55 уш. с
фосфорилметил)-5-ацетилфуран-3-карбоновой
(1Н, NH). Спектр ЯМР 13С (ДМСО-d6), δС, м. д.:
кислоты (13). Выделен путем экстракции реакци-
13.04 (СН3-семикарбазон),
14.49 (СН3-эфир),
онной массы хлороформом, промывки экстракта
55.91 (СН3О), 61.00 (СН2О-фенил), 61.86 (СН2О-
раствором NaCl, сушки сульфатом натрия и упа-
эфир),
109.11 (С4-фуран),
112.87 (С6-фенил),
ривания. Выход
83%, светло-коричневые кри-
115.21(С3-фенил), 118.72(С3-фуран), 121.05 (С5-
сталлы, т. пл. 86°С. Спектр ЯМР 1Н (CDCl3), δ,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
1538
МААДАДИ и др.
м. д.: 1.31 т (6Н, СН3-фосфонат, JHH = 7.2 Гц), 1.38
2-(ацетоксиметил)-5-(1,2,3-селенадиазол-4-ил)-
т (3Н, СН3-эфир, JHH = 7.0 Гц), 2.19 с (3Н, СН3-
фуран-3-карбоновой кислоты (15) с т. пл. 89°С.
семикарбазон), 3.77 д (2Н, СН2Р, JРН = 22.4 Гц),
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.39 т (3Н, СН3-
4.13 д. к (4Н, СН2О-фосфонат, JHH = 7.2, JРH = 13.2
эфир, JHH = 7.2 Гц), 2.13 с (3Н, СН3-ацетил), 4.37 к
Гц), 4.33 к (2Н, СН2О-эфир, JHH = 7.0 Гц), 5.18 уш.
(2Н, СН2О-эфир, JHH = 7.2 Гц), 5.49 с (2Н, ОСН2-
с и 6.31 уш. с (2Н, NH2), 6.92 с (1Н, Н4-фуран),
фуран), 7.39 с (1Н, Н4-фуран), 9.44 c (1Н, Н5-
8.70 с (1Н, NH). Спектр ЯМР 13С (CDCl3), δС, м. д.:
селенадиазол, сателлит 2JHSe = 38.8 Гц). Спектр
12.38 (СН3-семикарбазон), 14.13 (СН3-эфир), 16.34
ЯМР 13С (CDCl3), δС, м. д.: 14.24 (СН3-эфир), 20.77
д (СН3-фосфонат, 3JРС = 6.2 Гц), 26.70 д (СН2Р,
(СН3-ацетил), 56.80 (ОСН2-фуран), 61.04 (ОСН2-
1JРС = 138.5 Гц), 60.71 (СН2О-эфир), 62.51 д (СН2О-
эфир),
109.87 (С4-фуран),
119.36 (С3-фуран),
фосфонат, 3JРС = 6.3 Гц), 110.03 д (С4-фуран, 4JРС =
137.00 (С5-селенадиазол),
147.58 (С5-фуран),
3.0 Гц), 117.08 д (С3-фуран, 3JРС = 8.2 Гц), 136.93
154.24 (С2-фуран), 157.18 (С4-селенадиазол), 162.44
(С=N), 150.90 д (С5-фуран, 4JРС = 3.0 Гц), 153.15 д
(С=О-эфир).
(С2-фуран, 2JРС = 11.0 Гц), 157.46 уш. с (О=СNH),
Метиловый эфир
2-(гидроксиметил)-5-
162.93 д (С=О, 4JРС = 2.4 Гц). Спектр ЯМР 31Р
(1,2,3-селенадиазол-4-ил)фуран-3-карбоновой
(CDCl3): δР 20.91 м. д. Масс-спектр, m/z: 412.1249
кислоты (16). К раствору 0.63 г этилового эфира
[M + Na]+ (вычислено для С15Н24N3О7Р: 412.1249).
2-(ацетоксиметил)-5-(1,2,3-селенадиазол-4-ил)фу-
Реакция семикарбазона 5 с двуокисью селе-
ран-3-карбоновой кислоты 15 в смеси 7 мл хлоро-
на в уксусной кислоте. К раствору 3.26 г семикар-
форма и 15 мл метанола прибавляли 2 капли 1 M.
базона этилового эфира 2-ацетоксиметил-5-аце-
раствора метилата натрия в метаноле. Полученную
тилфуран-3-карбоновой кислоты в 25 мл уксусной
смесь оставляли на сутки при комнатной темпера-
кислоты прибавляли при перемешивании 1.28 г
туре в темноте. На следующий день быстро пропу-
двуокиси селена. Полученную смесь перемешива-
скали раствор через слой силикагеля и упаривали
ли 5 ч при 70°С, затем выливали в 100 мл воды и
досуха. Остаток затирали с гексаном, получив-
экстрагировали хлороформом (3×25 мл). Экстракт
шийся красный порошок отфильтровывали и су-
промывали раствором бикарбоната калия до пре-
шили на воздухе в темноте до постоянной массы.
кращения выделения углекислого газа, затем 20
Выход 0.37 г (74%), т. разл. 149-150°С. Спектр
мл воды и сушили сульфатом натрия. Раствор
ЯМР 1Н (ДМСО-d6), δ, м. д.: 3.83 с (3Н, СН3О-
фильтровали через слой силикагеля и отгоняли
эфир), 4.80 д (2Н, ОСН2-фуран, JHH = 4.4 Гц), 5.62
хлороформ. Остаток кипятили с гексаном до пол-
уш. т (1Н, ОН), 7.30 с (1Н, Н4-фуран), 9.99 (1Н,
ного растворения и оставляли на ночь. Осадок
Н5-селенадиазол, сателлит 2JHSe = 34.8 Гц). Спектр
отфильтровывали и сушили на воздухе до посто-
ЯМР 13С (ДМСО-d6), δС, м. д.: 52.26 (СН3О-
янной массы. Получили 1.56 г (62%) этилового
эфир), 54.81 (ОСН2-фуран), 109.08 (С4-фуран),
эфира
2-ацетоксиметил-5-ацетилфуран-3-кар-
115.72 (С3-фуран),
140.90 (С5-селенадиазол),
боновой кислоты (14) с т. пл. 130°С. Спектр ЯМР
146.85 (С5-фуран), 153.21 (С2-фуран), 161.15 (С4-
1Н (CDCl3), δ, м. д.: 1.40 т (3Н, СН3-эфир, JHH =
селенадиазол), 163.25 (С=О-эфир).
7.2 Гц), 2.13 с (3Н, СН3-ацетил), 2.50 с (3Н, СН3-
Этиловый эфир 2-(2-метоксифенилметил)-
кетон), 4.35 к (2Н, СН2О-эфир, JHH = 7.2 Гц), 5.44
5-(1,2,3-селенадиазол-4-ил)фуран-3-карбоновой
с (2Н, ОСН2-фуран), 7.45 с (1Н, Н4-фуран). Спектр
кислоты (17). К раствору 2.46 г семикарбазона
ЯМР 13С (CDCl3), δС, м. д.: 14.24 (СН3-эфир), 20.61
этилового эфира 2-(2-метоксифенилметил)-5-аце-
(СН3-ацетил), 25.99 (СН3-кетон), 56.96 (ОСН2-
тилфуран-3-карбоновой кислоты 10 в 13 мл уксус-
фуран), 61.28 (ОСН2-эфир), 117.46 (С4-фуран),
ной кислоты прибавляли при перемешивании 0.8 г
118.94 (С3-фуран), 151.63 (С5-фуран), 153.54 (С2-
двуокиси селена. Полученную смесь перемешива-
фуран), 161.85 (С=О-эфир), 186.37 (С=О-кетон).
ли 6 ч при 55-59°С, затем выливали в 60 мл воды.
Фильтрат упаривали досуха, остаток затирали
Смесь экстрагировали хлороформом (3×25 мл),
с небольшим количеством гексана, образовавши-
промывали 20 мл воды, 20 мл раствора NaCl и су-
еся кристаллы сушили на воздухе до постоянной
шили сульфатом натрия, затем фильтровали через
массы. Получили 0.53 г (15%) этилового эфира
слой силикагеля и упаривали. Выход 1.13 г (41%),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
НАЗВАНИЕ
1539
светло-коричневые кристаллы, т. пл. 94°С. Спектр
(С5-селенадиазол), 146.42 (С5-фуран), 153.86 (С5-
ЯМР 1Н (CDCl3), δ, м. д.: 1.37 т (3Н, СН3-эфир,
селенадиазол), 159.10 (С2-фуран), 163.13 (С=О).
JHH = 7.2 Гц), 3.88 с (3Н, СН3О), 4.36 к (2Н, ОСН2-
Этиловый эфир2-(диэтоксифосфорилметил)-
эфир, JHH = 7.2 Гц), 5.54 с (2Н, ОСН2-фуран), 6.91
5-(1,2,3-селенадиазол-4-ил)фуран-3-карбоновой
д. д (1Н, Н5-фенил, JHH = 7.6, 8.0 Гц), 6.92 д (1Н,
кислоты (19). К раствору 1.27 г семикарбазона
Н3-фенил, JHH = 7.6 Гц), 7.00 т (1Н, Н4-фенил,
этилового эфира 2-(диэтоксифосфорилметил)-5-
JHH = 7.6 Гц), 7.40 с (1Н, Н4-фуран), 7.60 д (1Н, Н6-
ацетилфуран-3-карбоновой кислоты в 25 мл ук-
фенил, JHH = 8.0 Гц), 9.43 с (1Н, Н5-селенадиазол,
сусной кислоты прибавляли 0.4 г двуокиси селена.
сателлит
2JHSe
=
38.8 Гц). Спектр ЯМР
13С
Реакционную массу перемешивали 7 ч при 60°С,
(CDCl3), δС, м. д.: 14.24 (СН3-эфир), 55.90 (СН3О),
затем выливали в 70 мл воды. Полученную смесь
60.95 (ОСН2-эфир), 62.39 (ОСН2-фуран), 109.74
насыщали хлористым натрием и экстрагирова-
(С4-фуран), 112.07 (С6-фенил), 115.40 (С3-фенил),
ли хлороформом (3×30 мл). Экстракт промывали
118.94 (С3-фуран), 120.87 (С5-фенил), 122.55 (С4-
фенил), 136.88 (С5-селенадиазол), 147.58 и 147.61
40 мл насыщенного раствора бикарбоната натрия,
(С5-фуран, С1-фенил), 150.05 (С2-фенил), 153.74
20 мл раствора NaCl и сушили сульфатом натрия.
(С2-фуран), 155.61 (С5-селенадиазол), 162.76 (С=О).
Отгоняли растворитель, остаток затирали с гекса-
Масс-спектр, m/z: 431.0120 [M + Na]+ (вычислено
ном. Выход 0.99 г (70%), серое порошкообразное
для С17Н16N2О5Se: 431.0117).
вещество, т. пл. 82°С. Спектр ЯМР 1Н (CDCl3), δ,
= 7.2 Гц), 1.39
м. д.: 1.30 т (6Н, СН3-фосфонат, JHH
Этиловый эфир 2-(бутилтиометил)-5-(1,2,3-
т (3Н, СН3-эфир, JHH = 7.2 Гц), 3.83 д (2Н, СН2Р,
селенадиазол-4-ил)фуран-3-карбоновой кис-
J
= 22.0 Гц), 4.15 д. к (4Н, ОСН2-фосфонат, JHH =
РH
лоты (18). К раствору 0.90 г семикарбазона эти-
7.2, JРH = 14.4 Гц), 4.35 к (2Н, ОСН2-эфир, JHH =
лового эфира
2-(бутилтиометил)-5-ацетилфу-
7.2 Гц), 7.36 с (1Н, Н4-фуран), 9.40 с (1Н, Н5-
ран-3-карбоновой кислоты 11 в 10 мл уксусной
селенадиазол, сателлит 2JHSe = 39.2 Гц). Спектр
кислоты прибавляли при перемешивании 0.32 г
ЯМР 13С (CDCl3), δС, м. д.: 14.30 (СН3-эфир),
двуокиси селена. Полученную смесь переме-
16.37 д (СН3-фосфонат, 3JРС = 6.2 Гц), 26.65 д
шивали 5 ч при 42-45°С, затем отгоняли уксус-
ную кислоту. К остатку приливали в 30 мл воды.
(СН2Р, 1JРС = 139.0 Гц), 60.74 (ОСН2-эфир), 62.55
Полученную смесь экстрагировали хлороформом
д (ОСН2-фосфонат, 2JРС = 6.5 Гц), 109.80 д (С4-
(3×20 мл), промывали 20 мл воды, 20 мл насы-
фуран, 4JРС = 3.1 Гц), 117.35 д (С3-фуран, 3JРС =
щенного раствора бикарбоната калия и 20 мл рас-
8.3 Гц), 136.11 (С5-селенадиазол), 146.83 д (С5-
твора NaCl. Раствор сушили в темноте сульфатом
фуран, 4JРС = 2.9 Гц), 152.90 д (С2-фуран, 2JРС =
натрия, затем фильтровали через слой силикаге-
13.9 Гц), 159.65 (С5-селенадиазол), 163.00 д (С=О,
ля и упаривали. Остаток выдерживали в вакууме
4JРС = 2.5 Гц). Спектр ЯМР 31Р (CDCl3): δР 20.94 м. д.
(1 мм рт. ст.) 1 ч при комнатной температуре.
Масс-спектр, m/z: 445.0034 [M + Na]+ (вычислено
Выход 0.52 г (49%), светло-коричневое сиропо-
для С14Н19N2О6РSe: 445.0038).
образное вещество. Спектр ЯМР 1Н (CDCl3), δ,
ФОНДОВАЯ ПОДДЕРЖКА
м. д.: 0.90 т (3Н, СН3-Bu, JHH = 7.2 Гц), 1.41 т (3Н,
СН3-эфир, JHH = 7.2 Гц), 1.48 секстет (2Н, СН23-
Работа выполнена в рамках базовой части го-
Bu, JHH = 7.2 Гц), 1.61 квинтет (2Н, СН22-Bu, JHH =
сударственного задания Министерства образова-
7.2 Гц), 2.62 т (2Н, SСН2-Bu, JHH = 7.2 Гц), 4.19 с
ния и науки России (проект № 4.5554.2017/8.9) с
(2Н, SСН2-фуран), 4.37 к (2Н, ОСН2-эфир, JHH =
использованием оборудования Инжинирингового
7.2 Гц), 7.37 с (1Н, Н4-фуран), 9.39 с (1Н, Н5-
центра Санкт-Петербургского государственного
селенадиазол, сателлит 2JHSe = 39.2 Гц). Спектр
технологического института.
ЯМР 13С (CDCl3), δС, м. д.: 13.66 (СН3-Bu), 14.31
КОНФЛИКТ ИНТЕРЕСОВ
(СН3-эфир), 21.99 (СН23-Bu), 27.13 (SСН2-Bu),
31.49 (СН22-Bu), 31.95 (SСН2-фуран), 60.74 (ОСН2-
Авторы заявляют об отсутствии конфликта
эфир), 109.83 (С4-фуран), 116.43 (С3-фуран), 136.05
интересов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
1540
МААДАДИ и др.
СПИСОК ЛИТЕРАТУРЫ
2. Петров М.Л., Ляпунова А.Г., Андросов Д.А. // ЖОрХ.
2012. Т. 48. Вып. 1. С 151; Petrov M.L., Lyapunova A.G.,
1. Маадади Р., Певзнер Л.М., Петров М.Л. // ЖОХ. 2016.
Androsov D.A. // Russ. J. Org. Chem. 2012. Vol. 48.
Т. 86. Вып. 11. С. 1819; Maadadi R., Pevzner L.M.,
N 1. P. 147. doi 10.1134/S1070428012010265
Petrov M.L. // Russ. J. Gen. Chem. 2016. Vol. 86. N 11.
3. Певзнер Л.М., Игнатьев В.М., Ионин Б.И. // ЖОХ.
P. 2462. doi 10.1134/S1070363216110104
1996 Т. 66. Вып. 5. С. 743.
Synthesis of 2-Substituted
5-(1,2,3-Selenadiazol-4-yl)furan-3-carboxylic Acids Esters
R. Maadadi, L. M. Pevzner*, and M. L. Petrov
St. Petersburg State Institute of Technology (Technical University), Moskovskii pr. 26, St. Petersburg, 190013 Russia
*e-mail: pevzner_lm@list.ru
Received March 14, 2019; revised March 14, 2019; accepted March 21, 2019
A series of the corresponding semicarbazones was obtained Starting from 2-substituted 5-acetylfurancarboxyl-
ic acid esters. When oxidized with selenium dioxide in acetic acid, 5- (1,2,3-selenadiadiazol-4-yl)furan-3-car-
boxylic acid esters are formed bearing a functional group in position 2 of the furan ring.
Keywords: furancarboxylic acids, selenadiazoles, semicarbazones, selenium dioxide, oxidation
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019