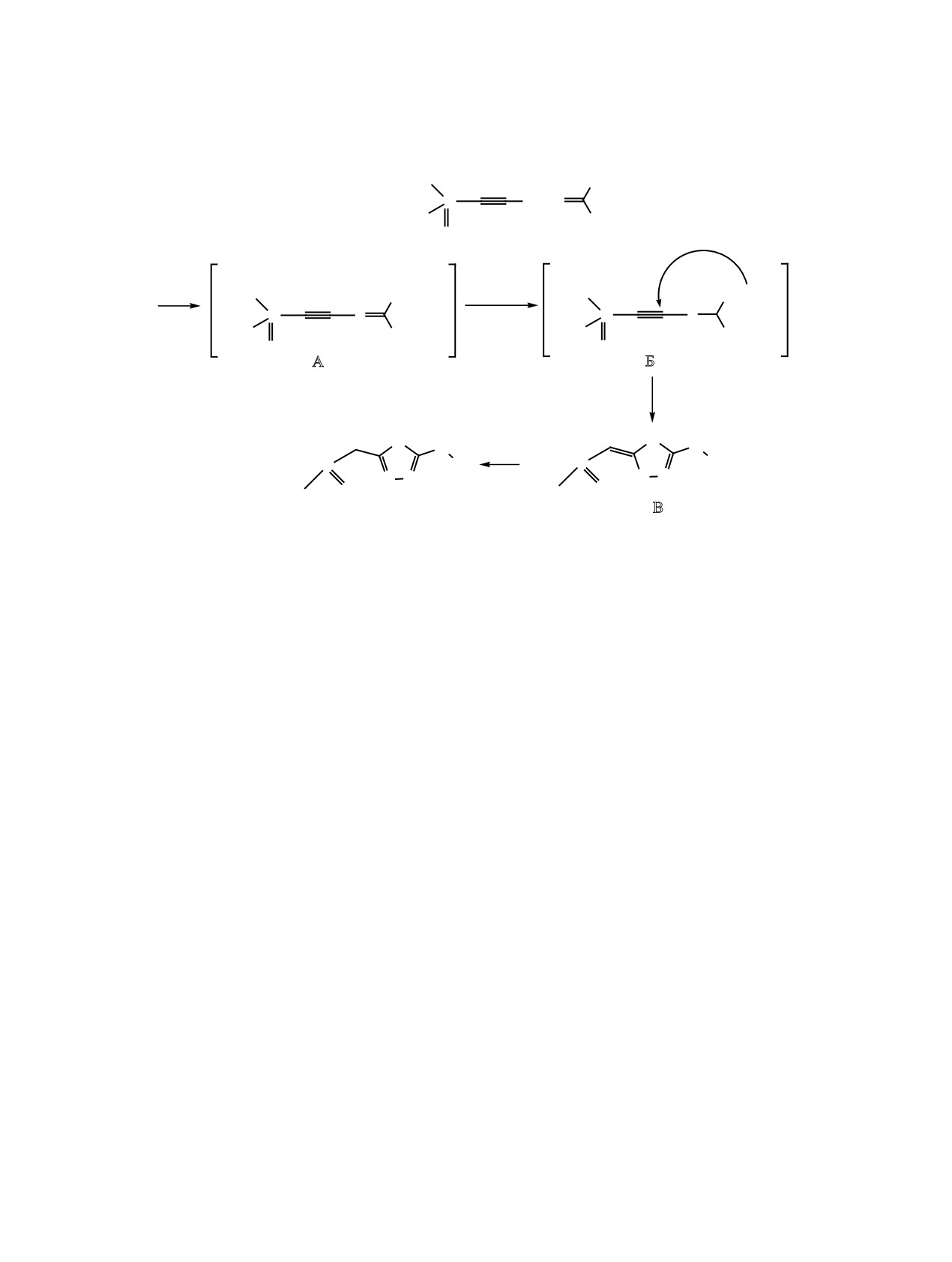ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 10, с. 1541-1549
УДК 547.794.3; 547.792.9; 547.669
ОСОБЕННОСТИ ФОСФОРИЛИРОВАНИЯ
4-ЗАМЕЩЕННЫХ ТИОСЕМИКАРБАЗИДОВ
ХЛОРЭТИНФОСФОНАТАМИ
© 2019 г. Д. М. Егоровa, И. С. Черновa, М. В. Попчукa, В. А. Полукеевb, А. В. Догадинаa,*
a Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
*e-mail: dog_alla@mail.ru
b Институт экспериментальной медицины, Санкт-Петербург, Россия
Поступило в Редакцию 1 июня 2019 г.
После доработки 1 июня 2019 г.
Принято к печати 7 июня 2019 г.
Взаимодействие хлорэтинфосфонатов с 4-замещенными тиосемикарбазидами приводит к преимуще-
ственному образованию диалкиловых эфиров 5-замещенных (1,3,4-тиадиазол-2-ил)метилфосфоновых
кислот с примесью (до 31%) диалкил-(3-амино-2-(алкилимино)-2,3-дигидро-1,3-тиазол-4-ил)фосфонатов
в качестве минорного продукта.
Ключевые слова: фосфорилирование, хлорэтинфосфонат, тиосемикарбазид, 1,3,4-тиадиазолы
DOI: 10.1134/S0044460X19100081
Среди большого разнообразия гетероцикличе-
высокую эффективность по таким видам биологи-
ских структур важное место занимают 1,3,4-тиа-
ческой активности, как противораковая [2, 4], про-
диазол и его производные [1]. В первую очередь
тивотуберкулезная [5-7], антиоксидантная [8-10],
это связано с высокой биологической активно-
противовирусная [11-13] и противосудорожная
стью этих соединений. Примером их лекарствен-
[14-16]. Введение в молекулу фосфорсодержаще-
ных субстанций, используемых в практике, могут
го фрагмента может улучшить ее фармакологиче-
служить сульфаниламидные препараты и ряд це-
ский профиль, расширив спектр проявляемых ви-
фалоспориновых антибиотиков, модифицирован-
дов активности, а также увеличить растворимость
ных 1,3,4-тиадиазольным фрагментом. Высокую
и снизить токсичность.
эффективность проявили производные 1,3,4-ти-
Впервые
1,3,4-тиадиазолы были описаны в
адиазола в качестве гербицидов, таких как тебу-
1882 г. и их синтез к настоящему времени хорошо
тиурон, тиазафлурон, этидимурон, бутиурон, бу-
изучен
[17]. Разработано несколько общих
тидазол, метидатион. Наряду с уже известными
подходов к их синтезу: из гидразидов кислот
препаратами многие функционализированные
[18-21], семикарбазида и его производных [22,
соединения, включающие в свой состав 1,3,4-ти-
23], 1,3,4-оксадиазолов [24, 25] и диацилгидра-
адиазольный фрагмент, проходят в настоящее
зинов [26, 27]. Использование ацетиленовых со-
время лабораторные исследования и показывают
единений для синтеза 1,3,4-тиадиазолов практи-
Схема 1.
R1
R1
NH NH
2
MeOH
S
R2
Br
+
S
O
O
R2
N N
1541
1542
ЕГОРОВ и др.
Схема 2.
RO
NH NH2
RO
S
CH3CN, K2CO3
NH2
P
Cl
+
S
P
RO
20qC
NH2
RO
N N
O
O
R= Me, Et, i-Pr.
Схема 3.
O
2
S
S
NHR
K2CO
NHR2
NR2
3
(R1O)2PCH2
+
(R1O)2P{CCl +S
CH3CN
N N
N
NHNH
2
(R1O)2P
NH2
O
1ɚ ɢ
2ɚ ɢ
R1 = Me, R2 = Me (ɚ); R1 = Me, R2 = Et (ɛ); R1 = Me, R2 = Ph (ɜ); R1 = Et, R2 = Me (ɝ); R1 = Et, R2 = Et (ɞ);
R1 = Et, R2 = Ph (ɟ); R1 =i-Pr, R2 = Me (ɠ); R1 =
i
i
= Ph (ɢ).
чески не описано в литературе. Это направление
хлорэтинфосфонатов с тиосемикарбазидом прохо-
представлено только в исследованиях Глотовой
дит при комнатной температуре с образованием
и сотр. на примере реакций активированных
5-фосфорилированных 1,3,4-тиадиазолов, а имен-
ацилацетиленов и
1-замещенных
3-бромпроп-
но диалкиловых эфиров (5-амино-1,3,4-тиадиа-
2-ин-1-онов с замещенными тиогидразидами
зол-2-ил)метилфосфоновой кислоты c хорошим
(схема 1) [28-31].
выходом (схема 2) [34].
Хорошо известно, что хлорэтинфосфонат явля-
В данной работе в реакции с хлорэтинфосфо-
ется мягким фосфорилирующим агентом и легко
натами были введены 4-замещенные тиосеми-
вступает в реакции с различными нуклеофилами
карбазиды. В соответствии с полученными ранее
[32-33]. Недавно нами было показано, что реакция
данными [34], основным направлением реакции
Таблица 1. Условия реакции и выходы соединений 1а-и и 2а-иа
б
Соотношение, %
№
R1
R2
Время реакции, ч
Выход, %в
1
2
а
Me
Me
99
1
1
90
б
Me
Et
98
2
1
86
в
Me
Ph
99
1
3
85
г
Et
Me
72
28
2
91
д
Et
Et
85
15
2
83
е
Et
Ph
90
10
4
76
ж
i-Pr
Me
69
31
5
84
з
i-Pr
Et
81
19
6
86
и
i-Pr
Ph
91
9
7
88
а Реакции проводили при комнатной температуре. б По данным ЯМР 31Р и 1Н. в Указан общий выход продуктов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
ОСОБЕННОСТИ ФОСФОРИЛИРОВАНИЯ 4-ЗАМЕЩЕННЫХ ТИОСЕМИКАРБАЗИДОВ
1543
Рис. 1. Общий вид молекулы диизопропил-[5-(фени-
Рис. 2. Общий вид молекулы диизопропил-(3-ами-
ламино)-1,3,4-тиадиазол-2-ил]метилфосфоната
1и
но-2-метилимино-2,3-дигидротиазол-4-ил)фосфоната
(CCDC 1951277).
2ж (CCDC 1951278).
явилось преимущественное образование 1,3,4-ти-
акции представлены в табл. 1.
адиазольного цикла, а именно диалкиловых эфи-
Строение полученных соединений доказано на
ров
5-замещенных
(1,3,4-тиадиазол-2-ил)метил-
основании данных спектроскопии ЯМР 1Н, 13С,
фосфоновых кислот 1а-и, и минорных фосфона-
31Р. Так, химический сдвиг атома фосфора основ-
тов 2а-и (схема 3).
ных продуктов реакции 1а-и находится в области
Оптимальные условия синтеза были подобра-
19.26-24.82 м. д., что характерно для фосфонатов,
ны по результатам мониторинга хода реакции
у которых атом фосфора связан с sp3-гибриди-
методом ЯМР 31Р. В обычных условиях при ком-
зованным атомом углерода. В спектрах ЯМР 1Н
натной температуре полной конверсии удавалось
можно отметить в сильном поле дублет метилено-
достичь за 1-7 ч. Условия и выходы продуктов ре-
вой группы расщепленной от ядра фосфора с ха-
Таблица 2. Характерные параметры спектров ЯМР 1Н, 13С, 31Р фосфонатов 1а-и
δ(PCH2), м. д.
δС, м. д. (JPC, Гц)
№
R1
R2
δP, м. д.
(2JРН, Гц)
PCH2C=N
PCH2C=N
SС=N
1а
Me
Me
24.42
3.40 (2J = 20.8)
27.74 (1J = 142.5)
147.66 (2J = 9.8)
172.10
1б
Me
Et
24.82
3.38 (2J = 20.8)
27.71 (1J = 142.8)
147.47 (2J = 9.8)
171.14
1в
Me
Ph
24.16
3.55 (2J = 20.8)
27.76 (1J = 142.6)
148.57 (2J = 9.8)
167.33
1г
Et
Me
21.71
3.38 (2J = 20.8)
28.78 (1J = 142.4)
148.14 (2J = 9.8)
171.76
1д
Et
Et
21.74
3.40 (2J = 20.7)
28.98 (1J = 142.4)
147.02 (2J = 9.9)
171.36
1е
Et
Ph
21.72
3.53 (2J = 20.8)
28.56 (1J = 142.3)
149.32 (2J = 9.7)
167.33
1ж
iPr
Me
19.82
3.39 (2J = 20.9)
30.20 (1J = 143.9)
148.52 (2J = 9.8)
172.25
1з
iPr
Et
19.26
3.45 (2J = 20.7)
30.28 (1J = 143.8)
148.73 (2J = 9.7)
171.37
1и
iPr
Ph
19.41
3.55 (2J = 20.8)
30.23 (1J = 143.6)
149.57 (2J = 9.5)
167.23
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
1544
ЕГОРОВ и др.
Схема 4.
R1O
NH NH2
P
Cl +S
R1O
2
NH R
O
Cl
R1O
NH NH2
K2CO3
R1O
N NH2
+
P
S
KCl
P
S
KHCO3
R1O
R1O
NH R2
NH R2
O
O
A
Ȼ
H
H
S
S
N
N
R1O P
R2
R1O P
R2
N N
HN N
O
R1O
O
R1O
ȼ
рактерной константой спин-спинового взаимодей-
Помимо основного продукта было отмечено
ствия 3JHP = 20.7-20.9 Гц. Наиболее информатив-
образование минорного соединения, которое было
ны спектры ЯМР 13С. Так, в сильном поле пред-
идентифицировано как диалкил-[3-амино-2-(алки-
ставлен дублет метиленового атома углерода в ин-
лимино)-2,3-дигидро-1,3-тиазол-4-ил]фосфонат
2
тервале 27.71-30.28 м. д. (1JCP = 142.3-143.9 Гц).
(табл. 1). Для минорного продукта реакции можно
Сигналы атомов углерода 1,3,4-тиадиазольного
было предположить две структуры Г и Д (схема 5).
фрагмента выходят в слабом поле: атом углеро-
По данным спектроскопии ЯМР 1Н, 13С, 31Р
да С2 представлен дублетом в области 147.02-
и гетероядерной корреляционной спектроскопии,
149.57 м. д. (2JCP = 9.5-9.9 Гц), сигнал углерода
наиболее вероятным представляется образование
С5 регистрируется синглетом в самом слабом поле
фосфоната 2 структуры Г. Так, сигналы в спектре
167.23-172.25 м. д. Основные параметры спектро-
ЯМР 31Р химический сдвиг атома фосфора лежит
скопии ЯМР 1Н, 13С, 31Р представлены в табл. 2.
в области 0-6 м. д., что соответствует данным,
Однозначно строение фосфонатов 1а-и под-
полученным ранее для структур со связью атома
тверждено данными рентгеноструктурного ана-
фосфора с sp2-углеродным атомом С4 тиазольного
лиза на примере диизопропил-[5-(фениламино)-
цикла [34]. В спектрах ЯМР 1Н фосфонатов 2а-и
1,3,4-тиадиазол-2-ил]метилфосфоната 1и (рис. 1).
в области 5-6 м. д. регистрируется дублетный
Образование основного продукта реакции 1а-и
сигнал олефинового протона тиазольного цикла c
можно представить схемой 4, аналогичной опи-
3JНР = 8.1 Гц, аминогруппа представлена уширен-
санной в работе [34]. Вероятно, на первом этапе
ным сиглетом в области ~4.4 м. д. Интегральные
протекает нуклеофильное замещение атома хлора
интенсивности сигналов согласуются со структу-
в хлорэтинфосфонате атомом серы с образовани-
рой Г. В спектре ЯМР 13С все сигналы также со-
ем интермедиата А, который, отщепляя хлористый
ответствуют предложенной структуре. Так, атом
водород под действием K2CO3, переходит в интер-
углерода РСН2 резонирует дублетом при 132 м. д.
медиат Б. Последний через внутримолекулярную
с характерной КССВ 1JCP = 219 Гц, углеродный
5-экзо-диг-циклизацию образует интермедиат В,
атом СН= цикла представлен дублетом при 107 м. д.
который ароматизуется посредством 1,3-сдвига
(2JCP = 15.0 Гц). В самом слабом поле резониру-
протона гетероциклического фрагмента NH с об-
ет атом углерода С=N (159 м. д., 3JCP = 14.0 Гц).
разованием 1,3,4-тиадиазола 1 (схема 4).
Подтверждают предложенную структуру фосфо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
ОСОБЕННОСТИ ФОСФОРИЛИРОВАНИЯ 4-ЗАМЕЩЕННЫХ ТИОСЕМИКАРБАЗИДОВ
1545
Схема 5.
Схема 7.
S
S
S
N
N
H
N
C5
C2
R2
NH2
O
O
N
N
CH3
C4
N3
P
P
NH2
R2
R1O
R1O
OR1
OR1
H3CO
N
H
P
H
Ƚ
Ⱦ
H3CO O
Схема 6.
в образовании тиазольного цикла участвует NH-
группа гидразинильного фрагмента.
В спектре 1H-15N фосфоната 2ж можно от-
S
H
N
метить кросс-пик, соответствующий взаимодей-
C5
C2
ствию протона у атома С5 тиазольного цикла с
CH3
3
C4 N
атомом азота N3, входящим в цикл (схема 7). В то
N
же время этот атом азота взаимодействует с NH2-
H3CO
H
P
H
группой, что возможно только в случае прямого
H3CO O
взаимодействия.
натов 2а-и и данные спектроскопии ЯМР 1Н-15N
Однозначно структура полученных фосфона-
тов 2а-и подтверждена данными рентгенострук-
HMBC и 1H-13C HMBC. Так, в спектре HMBC
турного анализа на примере диизопропил-(3-ами-
1H-13C фосфоната 2ж (схема 6) наблюдаются
но-2-метилимино-2,3-дигидротиазол-4-ил)фосфо-
кросс-пики, соответствующие взаимодействию
протона тиазольного цикла с атомами углерода С2
ната (2ж) (рис. 2).
и С4. Наиболее информативным является нали-
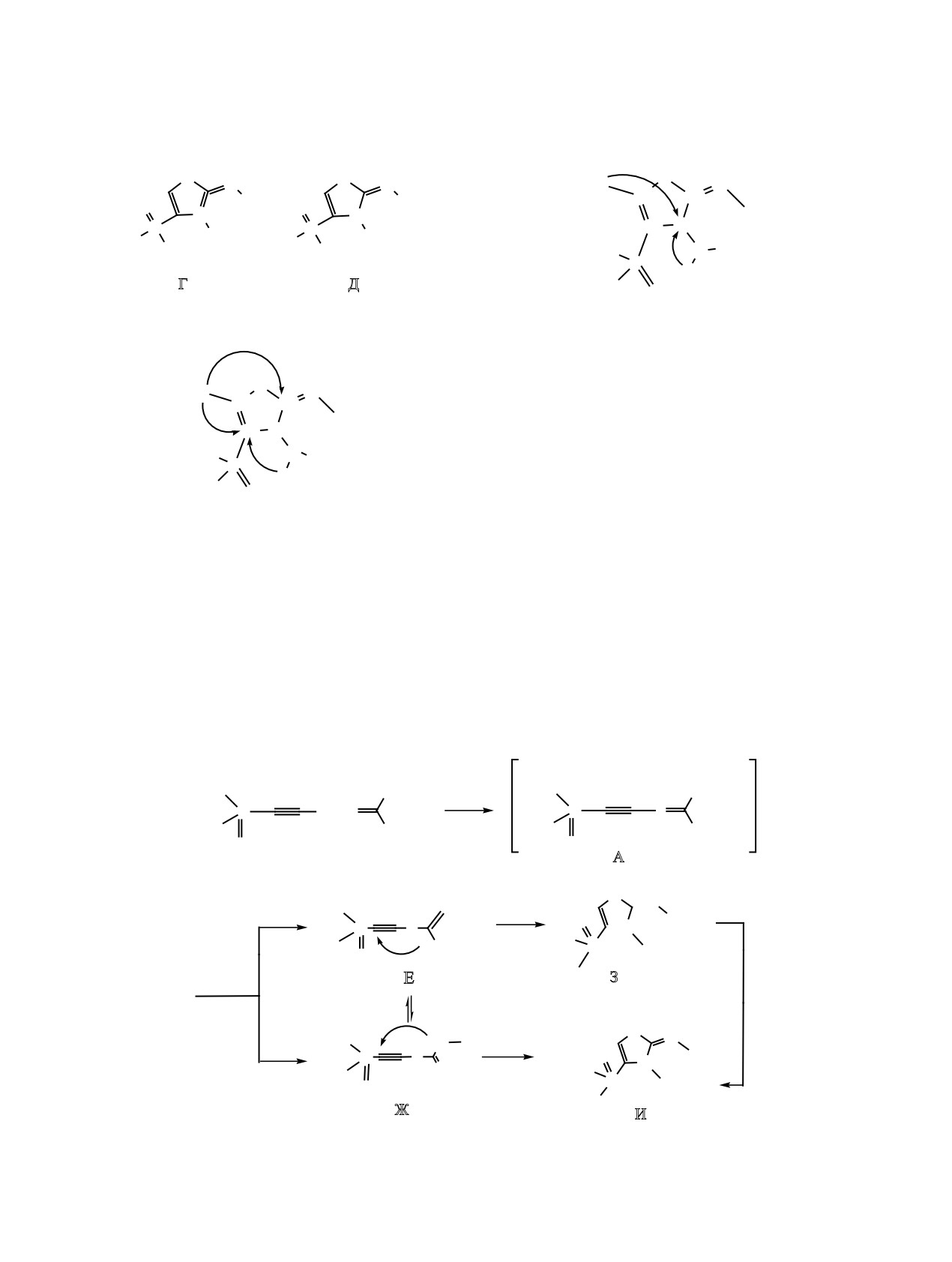
Образование минорного продукта
- диал-
чие кросс-пика атомов водорода гидразинильного
кил-[3-амино-2-(алкилимино)-2,3-дигидро-1,3-
фрагмента с атомом углерода С4. Данная корреля-
тиазол-4-ил]фосфоната
- можно представить
ция может наблюдаться только в том случае, когда
схемой 8. На первом этапе реализуется атака
Схема 8.
Cl
R1O
NH NH2
R1O
NH NH2
+
P
Cl +S
P
S
R1O
R1O
NH CH
NH R2
3
O
O
A
B
N NH2
S N
R1O
NH2
P
S
O N
R1O
R
1O
P
HN CH3
CH
O
3
ȿ
R1O
Ɂ
K2CO
3
S
R1O
N
HN
NH2
P
S
O
CH3
N
N CH3
R1O
R1O
P
O
NH2
R1O
ɀ
ɂ
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
1546
ЕГОРОВ и др.
хлорэтинфосфоната по атому серы тиосеми-
т. пл. 95°С (этилацетат). Спектр ЯМР 1H, δ, м. д.
карбазида, приводящая к образованию соли А.
(J, Гц): 1.14 т (3H, CH3CH2, 3JHH = 7.2), 3.22 к
Дальнейшее отщепление гидрохлорида может
(2H, CH3CH2, 3JHH = 7.2), 3.38 д (2H, PCH2, 1JPH =
приводить к одному из интермедиатов Е или Ж,
20.8), 3.64 д (6H, CH3O, 3JHP = 7.2), 7.07 с (1H, NH).
которые, в свою очередь, могут переходить в со-
Спектр ЯМР 13C, δС, м. д. (J, Гц): 14.31 (CH3CH2N),
ответствующие фосфорилированные тиазолы З
27.71 д (PCH2, 1JPC = 142.8), 41.13 (CH3CH2N),
или И. Образование структуры И можно связать и
53.22 д (CH3O, 2JPC = 7.0), 147.41 д (SC=N, 2JPC =
с изомеризацией, описанной для аналогичных ци-
9.9), 171.14 (SC=N). Спектр ЯМР 31P: δР 24.82 м. д.
клов в работе [35].
Диметил-[5-(фениламино)-1,3,4-тиадиазол-
В заключение можно отметить, что реакция
2-ил]метилфосфонат (1в). Бесцветные кристал-
хлорэтинфосфонатов с 4-замещенными тиосеми-
лы т. пл. 160-169°С (этилацетат). Спектр ЯМР 1H,
карбазидами в отличие от аналогичной реакции с
δ, м. д. (J, Гц): 3.55 д (2H, PCH2, 3JHP = 20.8), 4.67
уш. c (1H, NH), 3.73 д (6H, CH3O, 3JHP = 11.1), 6.99
незамещенным тиосемикарбазидом проходит не-
хемоселективно и приводит к преимущественно-
т (1H, CHp, 3JHH = 7.4), 7.27 т (2H, CHm, 3JHH = 7.4),
7.46 д (2H, CHo, 3JHH = 7.4). Спектр ЯМР 13C, δC,
му образованию 5-замещенных диалкил-(1,3,4-ти-
м. д. (J, Гц): 27.76 д (PCH2, 1JCP = 142.6), 53.42 д
адиазол-2-ил)метилфосфонатов с примесью
(CH3O, 2JCP = 6.7), 118.207 (Ph), 122.96 (Ph), 129.32
(до ~31%) минорного продукта, а именно диал-
(Ph), 140.48 (Ph), 148.57 д (SC=N, 2JCP = 9.8), 167.33
кил-[3-амино-2-(алкилимино)-2,3-дигидро-1,3-ти-
(SC=N). Спектр ЯМР 31P: δP 24.16 м. д.
азол-4-ил]фосфонатов.
Диэтил-[5-(метиламино)-1,3,4-тиадиазол-2-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ил]метилфосфонат (1г). Cветло-желтая вязкая
жидкость. Спектр ЯМР 1H, δ, м. д. (J, Гц): 1.32 т
Cпектры ЯМР 1Н, 13С, 31Р (CDCl3) сняты на
(6Н, CH3CH2О, 3JHH = 7.1), 3.04 с (3H, CH3N), 3.50
спектрометре Bruker Avance III HD 400 NanoBay
д (2H, PCH2, 2JHP = 20.8), 4.04 д. к (4H, OCH2, 3JHH =
на рабочих частотах 400.17, 100.63 и 162.01 МГц
7.1, 3JHP = 8.1), 6.20 уш. c (3H, NH). Спектр ЯМР
соответственно. Данные ренгеноструктурного
13C, δС, м. д. (J, Гц): 16.25 д (CH3СH3, 3JPC = 6.0),
анализа получены на дифрактометрах Agilent
28.78 д (СН2Р, 3JPC = 142.4), 62.94 д (OCH2, 2JPC =
Technologies SuperNova и Xcalibur.
5.6), 148.14 д (SC=N, 2JPC = 9.8), 171.76 (SC=N).
Общая методика синтеза. Смесь 1 ммоль ди-
Спектр ЯМР 31P: δР 21.71 м. д.
алкилхлорэтинилфосфоната, 1 ммоль 4-замещен-
Диэтил-[5-(этиламино)-1,3,4-тиадиазол-2-
ного тиосемикарбазида и 1.2 ммоль карбоната
ил]метилфосфонат (1д). Светло-желтая вязкая
калия в 10 мл абсолютного ацетонитрила переме-
жидкость. Спектр ЯМР 1H, δ, м. д. (J, Гц): 1.26 т
шивали при комнатной температуре 1-7 ч. Осадок
(3Н, NHCH2CH3, 3JHH = 7.2), 1.26 т (6Н, ОCH2CH3,
отфильтровывали. Фильтрат упаривали в вакууме,
3JHР = 7.2), 3.31 к (2H, NHCH2CH3, 3JHH = 7.2), 3.45
остаток разделяли колоночной хроматографией на
д (2H, PCH2, 2JHP = 20.8), 4.04 д. к (4H, OCH2, 3JHH =
силикагеле (элюент - этилацетат).
7.2, 3JHP = 8.1),
6.69 с (1H, NH). Спектр ЯМР
Диметил-[5-(метиламино)-1,3,4-тиадиазол-
13C, δC, м. д. (J, Гц): 14.50 (CH3CH2N), 16.31 д
2-ил]метилфосфонат (1а). Светло-желтая вязкая
(CH3CH2O, 3JCP = 5.9), 28.98 д (PCH2, 1JPC = 142.4),
жидкость. Спектр ЯМР 1H, δ, м. д. (J, Гц): 2.88 c
41.63 (CH3CH2N), 62.80 д (OCH2, 2JPC = 6.6), 148.02
(3H, NHCH3), 3.40 д (2H, PCH2, 2JPH = 20.8), 3.65
д (SC=N, 2JCP = 9.9), 171.36 (SC=N). Спектр ЯМР
д (6H, CH3O, 3JPH = 11.1), 7.12 уш. с (1H, NHCH3).
31P: δP 21.74 м. д.
Спектр ЯМР 13C, δС, м. д. (J, Гц): 27.74 д (PCH2,
Диэтил-[5-(фениламино)-1,3,4-тиадиазол-2-
1JPC
= 142.5),
32.37 (NHCH3), 53.27 д (CH3O,
ил]метилфосфонат (1е). Светло-желтая вязкая
3JPC = 6.7), 147.66 д (SC=N, 2JPC = 9.8), 172.10
жидкость. Спектр ЯМР 1H, δ, м. д. (J, Гц): 1.27 т
(SC=N). Спектр ЯМР 31P: δР 24.42 м. д.
(6H, CH3CH2, 3JHH = 7.0), 2.83 уш. c (1H, NH), 3.56
Диметил-[5-(этиламино)-1,3,4-тиадиазол-2-
д (2H, PCH2, 3JHP = 20.8), 4.11 д. к (4H, CH3CH2O,
ил]метилфосфонат (1б). Бесцветные кристаллы,
3JHP = 7.2, 3JHH 7.0), 7.03 т (1H, СНp, 3JHH = 7.6),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
ОСОБЕННОСТИ ФОСФОРИЛИРОВАНИЯ 4-ЗАМЕЩЕННЫХ ТИОСЕМИКАРБАЗИДОВ
1547
7.30 т (2H, СНm, 3JHH = 7.6), 7.45 д (2H, СНo, 3JHH =
кристаллы, т. пл. 139-140°С (петролейный эфир).
7.6). Спектр ЯМР 13C, δC, м. д. (J, Гц): 16.28 д
Спектр ЯМР 1H, δ, м. д. (J, Гц): 1.35 д и 1.41 д [12H,
(CH3CH2, 3JCP = 6.0), 28.56 д (PCH2 1JCP = 142.3),
(CH3)2CH, 3JHH = 6.2], 3.06 с (3H, NНCH3), 4.44 с
63.22 д (CH3CH2O, 2JCP = 6.6), 118.07 (Ph), 123.21
(2H, NH2), 4.87 м [2H, (CH3)2CH, 3JHH = 6.2, 3JHP =
(Ph),
129.33 (Ph), 140.34 (Ph), 149.32 д (SC=N,
7.5], 6.60 д (1H, CH=C, 2JHP = 8.1 Гц). Спектр ЯМР
2JCP = 9.7), 167.33 (SC=N). Спектр ЯМР 31P: δP
13C, δC, м. д. (J, Гц): 23.81 д и 24.18 д [(CH3)2CHO,
21.72 м. д.
3JCP = 4.5], 40.54 (CH3N), 72.27 д [(CH3)2CHO,
Диизопропил-[5-(метиламино)-1,3,4-
2JCP = 5.8], 107.61 д (C=CH, 2JPC = 15.7), 132.52
тиадиазол-2-ил]метилфосфонат
(1ж).
Бес-
д (PC, 1JPC = 219.6), 159.92 д (C=N, 3JCP = 14.4).
цветные кристаллы, т. пл. 95-96°С (этилацетат).
Спектр ЯМР 31P: δP 0.37 м. д.
Спектр ЯМР 1H, δ, м. д. (J, Гц): 1.23 д и 1.26 д [12H,
Диизопропил-(3-амино-2-этилимино-2,3-
(CH3)2CH, 3JHH = 6.3], 2.96 с (3H, NНCH3), 3.39
дигидротиазол-4-ил)фосфонат (2з). Бесцветные
д (2H, PCH2, 1JHP = 20.7), 4.64 м [2H, (CH3)2CH,
кристаллы, т. пл. 135-136°С (петролейный эфир).
3JHH = 6.3, 3JHP = 6.3], 6.86 с (1H, NH). Спектр ЯМР
Спектр ЯМР 1H, δ, м. д. (J, Гц): 1.26 т (3H, CH3СН2,
13C, δC, м. д. (J, Гц): 23.82 д [(CH3)2CH, 3JCP 4.9],
3JHH = 7.2), 1.32 д и 1.35 д [12H, (CH3)2CHO,
23.94 д [CH3)2CH, 3JCP = 4.0], 30.20 (PCH2, 1JPC =
3JHР = 6.3], 3.14 к (2H, CH2CH3, 3JHH = 7.2), 4.39 c
143.9), 32.62 (NНCH3), 71.62 д [(CH3)2CH, 2JPC =
(2H, NH2), 4.84 м [2H, (CH3)2CHO, 3JHH = 7.2, 3JHP =
6.8], 148.52 д (SC=N, 2JCP = 9.8), 172.25 (SC=N).
7.5], 6.55 д (1H, SCH=C, 1JHP = 8.1). Спектр ЯМР
Спектр ЯМР 31P: δP 19.82 м. д.
13C, δC, м. д. (J, Гц): 15.83 (CH3СН2N), 23.80 д и
Диизопропил-[5-(этиламино)-1,3,4-тиа-
24.16 д[(CH3)2CHO, 3JCP = 4.5], 49.14 (CH3СН2N),
диазол-2-ил]метилфосфонат (1з). Светло-желтая
72.19 д [(CH3)2CHO, 2JPC = 5.8], 107.53 д (CH=C,
вязкая жидкость. Спектр ЯМР 1H, δ, м. д. (J, Гц):
2JCP = 15.5), 132.17 д (PC=, 1JPC = 219.9), 157.71 д
1.28 д [12H, (CH3)2CHO, 3JHН = 6.2], 1.29 т (3H,
(C=N, 3JCP = 14.1). Спектр ЯМР 31P: δP 0.52 м. д.
CH3СН2, 3JHH = 6.7), 1.31 д [6H, (CH3)2CHO, 3JHН =
6.2], 3.35 к (2H, CH2CH3, 3JHH = 7.2), 3.45 д (2H,
ФОНДОВАЯ ПОДДЕРЖКА
РCH2, 3JHP = 20.7), 4.39 с (2H, NH2), 4.69 м [2H,
(CH3)2CHO, 3JHH = 6.2, 3JHP = 7.6), 6.24 с (1Н, NH).
Работа выполнена при финансовой поддерж-
Спектр ЯМР 13C, δC, м. д. (J, Гц): 14.60 (CH3СН2N),
ке Российского фонда фундаментальных иссле-
23.87 д и 24.99 д [(CH3)2CHO, 3JCP = 4.9], 30.28 д
дований (гранты № 19-03-00365, № 18-33-00430)
(PCН2, 1JPC = 143.8), 41.74 (CH3СН2N), 71.64 д
в рамках базовой части государственного за-
[(CH3)2CHO, 2JPC = 6.7), 148.73 д (SC=N, 2JCP =
дания Министерства образования и науки РФ
9.7), 171.37 (SC=N). Спектр ЯМР 31P: δP 19.26 м. д.
(№ 4.5554.2017/8.9) с использованием оборудова-
Диизопропил-[5-(фениламино)-1,3,4-тиади-
нияИнжиниригового центраСанкт-Петербургского
азол-2-ил]метилфосфонат (1и). Бесцветные кри-
государственного технологического института,
сталлы, т. пл. 149-150°С (петролейный эфир).
ресурсного центра «Рентгенодифракционные ме-
Спектр ЯМР 1H, δ, м. д. (J, Гц): 1.33 д и 1.31 д
тоды исследования» Санкт-Петербургского госу-
[12H, (CH3)2CH, 3JHH = 6.2], 3.55 д (2H, PCH2,
дарственного университета.
3JHP = 20.8), 4.73 м [2H, (CH3)2CHOР,3JHH = 6.2,
3JHP = 7.6], 7.07 т (1H, CHp, 3JHH = 7.4), 7.36 т
КОНФЛИКТ ИНТЕРЕСОВ
(2H, CHm, 3JHH = 7.4), 7.45 д (2H, CHo, 3JHH = 7.4).
Спектр ЯМР 13C, δC, м. д. (J, Гц): 23.88 д и 23.99 д
Авторы заявляют об отсутствии конфликта
[(CH3)2CH, 3JCP = 4.4], 30.23 д (PCH2, 1JCP = 143.6),
интересов.
71.88 д (CHO, 2JCP = 6.8), 118.28 (Ph), 123.15 (Ph),
СПИСОК ЛИТЕРАТУРЫ
129.44 (Ph), 140.39 (Ph), 149.57 д (SC=N, 2JCP =
9.5), 167.23 (SC=N). Спектр ЯМР 31P: δP 19.41 м. д.
1. Jain A.K., Sharma S., Vaidya A. , Ravichandran V.,
Диизопропил-(3-амино-2-метилимино-2,3-
Agrawal R.K. // Chem. Biol. Drug Des. 2013. Vol. 81.
дигидротиазол-4-ил)фосфонат (2ж). Бесцветные
P. 557. doi 10.1111/cbdd.12125
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
1548
ЕГОРОВ и др.
2. Kumar D., Kumar N.M., Chang K.-H., Shah K. // Eur.
17. Hu Y., Li C.-Y., Wang X.-M., Zhu H.-L. // Chem. Rev.
J. Med. Chem. 2010. Vol. 45. P. 4664. doi 10.1016/j.
2014. Vol. 114. N 10. 572. doi 10.1021/cr400131u
ejmech.2010.07.023
18. Young R.W., Wood K.H. // J. Am. Chem. Soc. 1955.
3. Kumar D., Vaddula B.R., Chang K.-H., Shah K. //
Vol. 77. N 2. P. 400. doi 10.1021/ja01607a051
Bioorg. Med. Chem. Lett. 2011. Vol. 21. P. 2320. doi
19. Garfunkle J., Ezzili C., Rayl T.J., Hochstatter D.G.,
10.1016/j.bmcl.2011.02.083
Hwang I., Boger D.L. // J. Med. Chem. 2008. Vol. 51.
4. Sun J., Yang Y.-S., Li W., Zhang Y.-B., Wang X.-L.,
P. 4392. doi 10.1021/jm800136b
Tang J.-F., Zhu H.-L. // Bioorg. Med. Chem. Lett. 2011.
20. Fan Z., Yang Z., Zhang H., Mi N., Wand H., Cai F.,
Vol. 21. P. 6116. doi 10.1016/j.bmcl.2011.08.039
Zuo X., Zheng Q., Song H. // J. Agric. Food Chem. 2010.
5. Foroumadi A., Soltani F., Jabini R., Moshafi M.H.,
Vol. 58. P. 2630. doi 10.1021/jf9029628
Rasnani F.M. // Arch. Pharm. Res. 2004. Vol. 27. N 5.
21. Zhou Z., Liu Y., Chen J., Yao E., Cheng J. // Org. Lett.
P. 502. doi 10.1007/BF02980122
2016. Vol. 18. P. 5268. doi 10.1021/acs.orglett.6b02583
6. Talath S., Gadad A.K. // Eur. J. Med. Chem. 2006.
22. Jacobsen E.J., Mitchell M.A., Hendges S.K., Belonga K.L.,
Vol. 41. P. 918. doi 10.1016/j.ejmech.2006.03.027
Skaletzky L.L., Stelzer L.S., Lindberg T.J., Fritzen E.L.,
7. Quintana C., Klahn A.H., Artigas V., Fuentealba M.,
Schostarez H.J., O’Sullivan T.J., Maggiora L.L., Stu-
Biot C., Halloum I., Kremer L., Arancibia R. // Inorg.
chly C.W., Laborde A.L., Kubicek M.F., Poorman R.A.,
Beck J.M., Miller H.R., Petzold G.L., Scott P.S.,
Chem. Commun. 2015. Vol. 55. P. 48. doi 10.1016/j.
inoche.2015.03.008
Truesdell S.E., Wallace T.L., Wilks J.W., Fisher C.,
Goodman L.V., Kaytes P.S., Ledbetter S.R., Powers E.A.,
8. Kadi A.A., Al-Abdullah E.S., Shehata I.A., Habib E.E.,
Vogeli G., Mott J.E., Trepod C.M., Staples D.J., Bald-
Ibrahim T.M., El-Emam A.A. // Eur. J. Med. Chem. 2010.
win E.T., Finzel B.C. // J. Med. Chem. 1999. Vol. 42.
Vol. 45. P. 5006. doi 10.1016/j.ejmech.2010.08.007
P. 1525. doi 10.1021/jm9803222
9. Maddila S., Gorle S., Sampath Ch., Lavanya P. // J.
23. Chapleo C.B., Myers M., Myers P.L., Saville J.F.,
Saudi Chem. Soc. 2016. Vol. 20. P. 306. doi 10.1016/j.
Smith A.C.B., Stillings M.R., Tulloch I.F., Walter D.S.,
jscs.2012.11.007
Welbourn A.P. // J. Med. Chem. 1986. Vol. 29. P. 2273.
10. Cristina A., Leonte D., Vlase L., Bencze L.C., Imre S.,
doi 10.1021/jm00161a024
Marc G., Apan B., Mogosan C., Zaharia V. // Molecules
24. Padmavathi V., Reddy G.S., Mohan A.V.N., Mahesh K. //
2018. Vol. 23. P. 2425. doi 10.3390/molecules23102425
Arkivoc. 2008. Vol. 2008. N 17. P. 48. doi 10.3998/
11. Chen Z., Xu W., Liu K., Yang S., Fan H., Bhadury P.S.,
ark.5550190.0009.h05
Hu D.-Y., Zhang Y. // Molecules. 2010. Vol. 15. P. 9046.
25. Liesen A.P., de Aquino T.M., Carvalho C.S., Lima V.T.,
doi 10.3390/molecules15129046
de Araújo J.M., de Lima J.G., de Faria A.R.,
12. Gan X., Hu D., Chen Z., Wang Y., Song B. // Bioorg.
de Melo E.J.T., Alves A.J., Alves E.W., Alves A.Q.,
Med. Chem. Lett. 2017. Vol. 27. P. 4298. doi 10.1016/j.
Góes A.J.S. // Eur. J. Med. Chem. 2010. Vol. 45. P. 3685.
bmcl.2017.08.038
doi 10.1016/j.ejmech.2010.05.017
13. Yu L., Gan X., Zhou D., He F., Zeng S., Hu D. //
26. Kaleta Z., Makowski B.T., Soos T., Dembinski R. // Org.
Molecules. 2017. Vol. 22. P. 658. doi 10.3390/
Lett. 2006. Vol. 8. N 8. P. 1625. doi 10.1021/ol060208a
molecules22040658
27. Kadi A.A., El-Brollosy N.R., Al-Deeb O.A., Habib E.E.,
14. Dogan H.N., Duran A., Rollas S., Sener G., Uysal
Ibrahim T.M., El-Emam A.A. // Eur. J. Med. Chem.
M.K., Gulen D.l. // Bioorg. Med. Chem. 2002. Vol. 10.
2007. Vol. 42. P. 235. doi 10.1016/j.ejmech.2006.10.003
P. 2893. doi 10.1016/S0968-0896(02)00143-8
28. Глотова Т.Е., Нахманович А.С., Комарова Т.Н.,
15. Masereel B., Rolin S., Abbate F., Scozzafava A., Supu-
Сигалов М.В. // Изв. АН СССР. Сер. хим. 1988. Т.
ran C.T. // J. Med. Chem. 2002. Vol. 45. P. 312. doi
37. № 11. С. 2376; Glotova T.E., Nakhmanovich A.S.,
10.1021/jm0109199
Komarova T.N., Sigalov M.V. // Bull. Acad. Sci. USSR.
16. Siddiqui N., Ahsan W. // Med. Chem. Res. 2011. Vol. 20.
Div. Chem. Sci. 1988. Vol. 37. N 11. P. 2376. doi
P. 261. doi 10.1007/s00044-010-9313-6
10.1007/BF00959905
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
ОСОБЕННОСТИ ФОСФОРИЛИРОВАНИЯ 4-ЗАМЕЩЕННЫХ ТИОСЕМИКАРБАЗИДОВ
1549
29. Глотова Т.Е., Нахманович А.С., Сигалов М.В. // ХГС.
Russ. J. Gen. Chem. 2015. Vol. 85. N 2. P. 351. doi
1989. Т. 25. № 5. С. 680; Glotova T.E., Nakhmano-
10.1134/S1070363215020012
vich A.S., Sigalov M.V. // Chem. Heterocycl. Compd.
33. Егоров Д.М., Питерская Ю.Л., Эрхитуева Е.Б.,
1989. Vol. 25. N 5. P. 568. doi 10.1007/BF00482510
Свинцицкая Н.И., Догадина А.В. // ЖОХ. 2017. Т. 87.
30. Глотова Т.Е., Александрова А.Е., Нахманович А.С.,
Вып. 9. С. 1440; Egorov D.M., Piterskaya Yu.L.,
Виноградова Т.И. // Хим.-фарм. ж. 1990. Т. 24. № 11.
Erkhitueva E. B., Svintsitskaya N.I., Dogadina A.V. //
С. 48; Glotova T.E., Aleksandrova A.E., Nakhmano-
Russ. J. Gen. Chem. 2017. Vol. 87. N 9. P. 1924. doi
vich A.S., Vinogradova T.I. // Pharm. Chem. J. 1990.
10.1134/S1070363217090067
Vol. 24. N 11. P. 830. doi 10.1007/BF00768386
34. Асадуллина А.Э., Егоров Д.М., Питерская Ю.Л.,
31. Глотова Т.Е., Дворко М.Ю., Самойлов В.Г., Уша-
Догадина А.В. // ЖОХ. 2016. Т. 86. Вып. 3. С. 536;
ков И.А. // ЖОрХ. 2008. Т. 44. Вып. 6. С. 875; Gloto-
Asadullina A.E., Egorov D.M., Piterskaya Yu.L.,
va T.E., Dvorko M.Yu., Samoilov V.G., Ushakov I.A. //
Dogadina A.V. // Russ. J. Gen. Chem. 2016. Vol. 86.
Russ. J. Org. Chem. 2008. Vol. 44. N 6. P. 866. doi
N 3. P. 729. doi 10.1134/S1070363216030361
10.1134/S1070428008060158.
35. Pfeiffer W.-D., Junghans D., Saghyan A.S., Langer P. //
32. Догадина А.В., Свинцицкая Н.И. // ЖОХ. 2015. Т. 85.
J. Heterocycl. Chem. 2014. Vol. 51. N 4. P. 1063. doi
Вып. 2. С. 177; Dogadina A.V., Svintsitskaya N.I. //
10.1002/jhet.2007
Some Features of Phosphorylation of 4-Substituted
Thiosemicarbazides with Chloroethynylphosphonates
D. M. Egorova, I. S. Chernova, M. V. Popchuka, V. A. Polukeevb, and A. V. Dogadinaa, *
a St. Petersburg State Institute of Technology (Technical University), Moskovskii pr. 26, St. Petersburg, 190013 Russia
*e-mail: dog_alla@mail.ru
b Institute of Experimental Medicine, St. Petersburg, Russia
Received June 1, 2019; revised June 1, 2019; accepted June 7, 2019
The reactions of chloroethylphosphonates with 4-substituted thiosemicarbazides leads to the predominant for-
mation of dialkyl esters of 5-substituted (1,3,4-thiadiazol-2-yl)methylphosphonic acids with an admixture (up
to 31%) of dialkyl [3-amino-2-(alkylimino)-2,3-dihydro-1,3-thiazol-4-yl)phosphonates as a minor product.
Keywords: phosphorylation, chloroethynylphosphonate, thiosemicarbazide, 1,3,4-thiadiazoles
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019