ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 10, с. 1560-1565
УДК 541.49:547.854.9
КОМПЛЕКСООБРАЗОВАНИЕ 2,3-ДИМЕТИЛ-
5-ГИДРОКСИ-6-АМИНОПИРИМИДИН-4(3Н)-ОНА
С ИОНАМИ МЕДИ(II) В НЕВОДНЫХ РАСТВОРАХ
© 2019 г. В. Ю. Мишинкин, С. А. Грабовский, Н. Н. Кабальнова, Ю. И. Муринов*
Уфимский институт химии Уфимского федерального исследовательского центра Российской академии наук,
пр. Октября 69, Уфа, 450054 Россия
*e-mail: murinov@anrb.ru
Поступило в Редакцию 15 апреля 2019 г.
После доработки 15 апреля 2019 г.
Принято к печати 19 апреля 2019 г.
Методами электронной, ЯМР, ИК спектроскопии и масс-спектрометрии изучено комплексообразова-
ние 2,3-диметил-5-гидрокси-6-аминопиримидин-4(3Н)-она с ионами меди(II) в неводных растворах.
Наблюдается последовательное образование четырех- и пятикоординационных комплексов меди(II), в
которых лиганд координирован моно- и бидентатно. Спектрофотометрическим методом мольных отно-
шений определен состав комплекса. Установлены донорные центры в молекуле лиганда, участвующие
в координации с ионами меди(II) и рассчитаны константы комплексообразования.
Ключевые слова: 2,3-диметил-5-гидрокси-6-аминопиримидин-4(3Н)-он, четырехкоординационные и
пятикоординационные комплексы, ионы меди(II)
DOI: 10.1134/S0044460X1910010X
Окислительно-восстановительные
реакции
реакции. В отсутствие воды и кислорода
в живых системах катализируются металлофермен-
2,3-диметил-5-гидрокси-6-аминопиримидин-
тами, имеющими в своем составе ионы металлов
4(3Н)-он практически не расходуется, добавление
переменной валентности (медь, кобальт, железо
воды значительно ускоряет реакцию. Было
и др.) [1-]. Ион меди в таких металлоферментах
предположено, что процесс протекает через
обычно координирован электронодонорными
образование комплексов иона меди(II) с
связями с атомами азота и кислорода аминокислот
2,3-диметил-5-гидрокси-6-аминопиримидин-
белков
[4,
5].
Поскольку производные
4(3Н)-оном.
пиримидиновых оснований гомологичны нуклео-
В данной работе изучено комплексообразование
тидным компонентам ДНК и РНК, синтез
2,3-диметил-5-гидрокси-6-аминопиримидин-
низкомолекулярных координационных соединений
4(3Н)-она с ионами меди(II) в неводных растворах.
ионов меди с производными пиримидинов
При добавлении лиганда L к раствору хлорида
представляет интерес для моделирования
меди(II) в безводном ДМСО и ацетонитриле в
ферментативных процессов. Перспективными
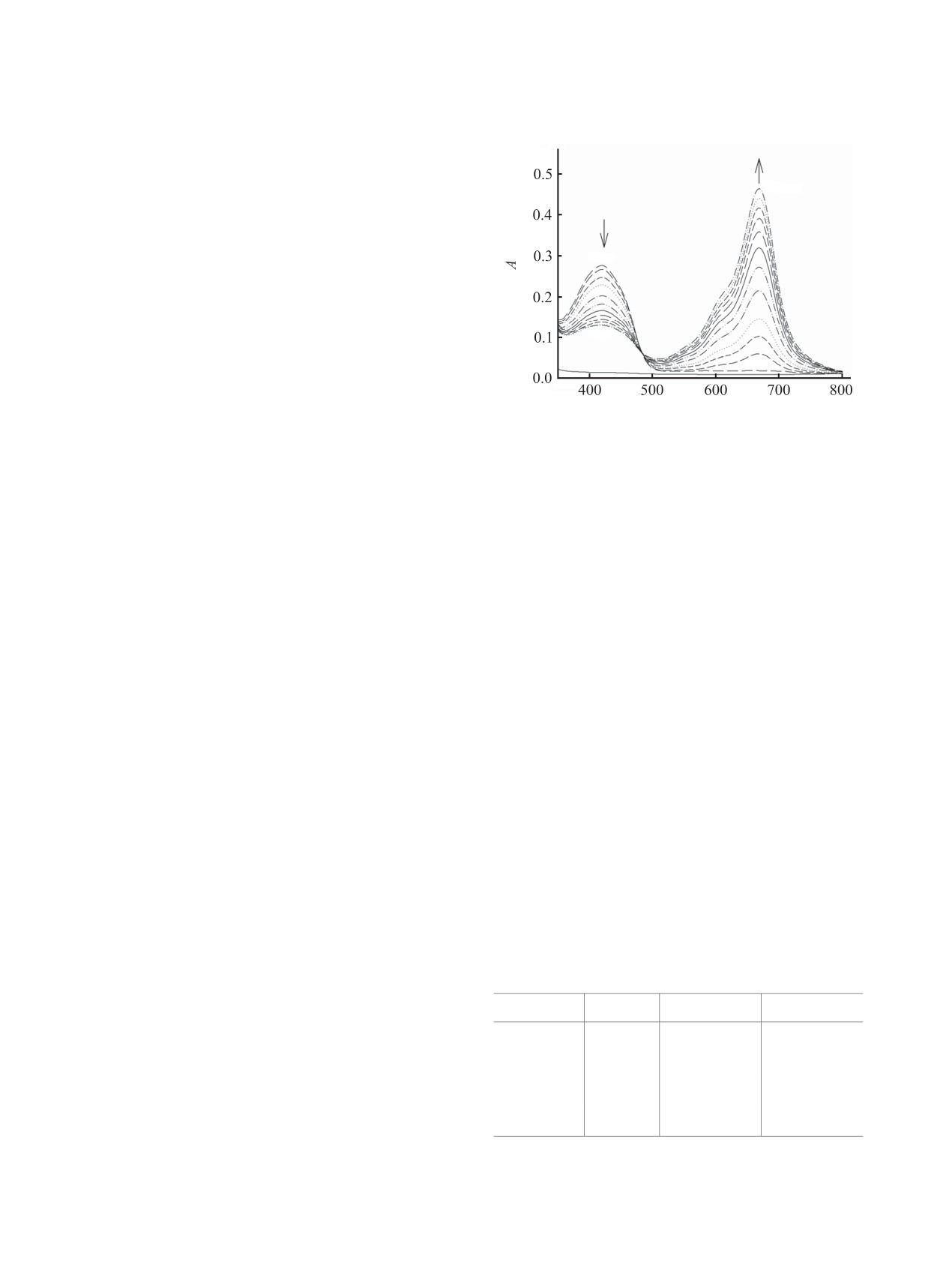
видимой области спектра появляется полоса
лигандами являются производные урацила с
поглощения с максимумом при 420 нм (ДМСО)
заместителями различной природы [6-8]. В работе
и 410 нм (CH3CN), характерная для четырех-
[9] изучено каталитическое гидроксилирование
координационных комплексов меди(II) [10]. Со
2,3-диметил-5-гидрокси-6-аминопиримидин-
временем интенсивность этой полосы поглощения
4(3Н)-она (L) молекулярным кислородом в
уменьшается и появляется полоса поглощения при
присутствии хлорида меди(II) в водных и
665 нм (ДМСО) и 635 нм (CH3CN), характерная для
неводных растворах. Показано, что растворитель
пятикоординационных комплексов меди(II) [11-
оказывает значительное влияние на протекание
13], интенсивность которой увеличивается. При
1560
КОМПЛЕКСООБР
АЗОВАНИЕ 2,3-ДИМЕТИЛ-5-ГИДРОКСИ-...
1561
этом наблюдается изменение окраски раствора. На
рисунке в качестве примера приведено изменение
60 мин
спектров поглощения реакционной смеси в
диметилсульфоксиде.
Состав комплексов определяли методом моль-
0 мин
ных отношений при фиксированной концентрации
ионов меди(II). При смешении растворов лиганда
и CuCl2 в различных мольных соотношениях в на-
чальный момент времени не менее чем из 3 опытов
определяли среднее значение оптической плот-
60 мин
ности раствора в максимуме полосы поглощения
0 мин
комплекса 1 (420 нм). Для комплекса 2 значение
оптической плотности при 665 нм определяли при
λ, нм
установлении равновесия, которое достигалось
Изменение электронных спектров поглощения ком-
через 60 мин. Из зависимостей оптической плот-
плексов ионов меди(II) с 2,3-диметил-5-гидрокси-6-
ности растворов в максимумах полос поглощения
аминопиримидин-4(3Н)-оном в ДМСО от времени
от соотношения концентраций лиганда и CuCl2
([L]0 = [CuCl2]0 = 1×10-4 моль/л, 20°С).
определяли состав комплексов, равный 1:1.
CuCl2 при молярном отношении 1:1 в ДМСО-d6
При увеличении концентрации лиганда состав
(табл. 2). Наибольшее изменение химического
комплексов сохраняется, поэтому мы предположи-
сдвига наблюдается для атома С5 лиганда и незна-
ли, что при переходе от четырех- к пятикоордина-
ционному комплексу происходит перестройка вну-
чительное для атома С4, что свидетельствует об
тренней координационной сферы иона меди(II), и
участии атомов кислорода гидроксильной и кар-
лиганд L становится бидентатным. Элементный
бонильной групп в координации с ионом меди(II).
анализ выделенного комплекса 1 подтверждает со-
Время накопления сигналов углеродных атомов
став 1:1.
составляет более 5 ч, поэтому методом ЯМР 13С
Для установления донорных центров лиганда
было зарегистрировано образование комплекса 2 с
в образующихся комплексах в начальный момент
бидентатным лигандом L.
времени реакции выделен первый комплекс, вто-
Дополнительная информация о составе образу-
рой - через 60 мин. Для этих комплексов зареги-
ющихся комплексов получена методом масс-спек-
стрированы ИК спектры (табл. 1). В спектре ком-
трометрии. В масс-спектре реакционной массы в
плекса 1 наблюдается смещение полосы поглоще-
ацетонитриле регистрируются как пики комплек-
ния валентных колебаний связи С-ОН на 19 см-1
сов ацетонитрила с ионами меди [Cu+(МеCN)2],
и незначительное смещение полосы поглощения
[Cu+(МеCN)3] с m/z 144.9 и 186.1 соответственно,
валентных колебаний карбонильной группы. В
так и пик с m/z 260.0 комплекса [Cu+L(МеCN)], что
спектре комплекса 2, кроме смещения полосы по-
подтверждает образование комплекса состава 1:1.
глощения валентных колебаний связи С-ОН на
19 см-1, наблюдается и значительное смещение
Таблица 1. Отнесение характеристических полос по-
полосы поглощения валентных колебаний кар-
глощения в ИК спектрах 2,3-диметил-5-гидрокси-6-
бонильной группы на 100 см-1 в низкочастотную
аминопиримидин-4(3Н)-она (L) и его комплексов с
область. В спектрах обоих комплексов появляет-
Сu(II)
ся полоса поглощения валентных колебаний связи
Отнесение
L
Комплекс 1
Комплекс 2
Сu-O при 497 см-1.
(C=O)
1739 с
1710 с
1638 с
Для установления донорных центров лиганда,
(C5-C6)
1634 с
1622 c
1623 с
участвующих в образовании донорно-акцептор-
ных связей с ионами меди(II), были записаны спек-
(C-OH)
1260 ср
1241 ср
1241 ср
тры ЯМР 13С растворов 2,3-диметил-5-гидрок-
(Cu-O)
-
497 сл
498 сл
си-6-аминопиримидин-4(3Н)-она и в присутствии
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
1562
МИШИНКИН и др.
Таблица 2. Химические сдвиги атомов углерода (м. д.) в спектрах ЯМР 13С 2,3-диметил-5-гидрокси-6-аминопири-
мидин-4(3Н)-она и его комплекса с Cu(II) в ДМСО-d6
Соединение
С2
С4
С5
С6
СН3-С2
СН3-N3
L
149.94
156.65
147.72
118.34
21.88
30.04
Комплекс
152.68
155.47
143.25
118.99
20.07
30.88
Δδ
+2.74
-1.18
-4.47
+0.65
-1.81
+0.84
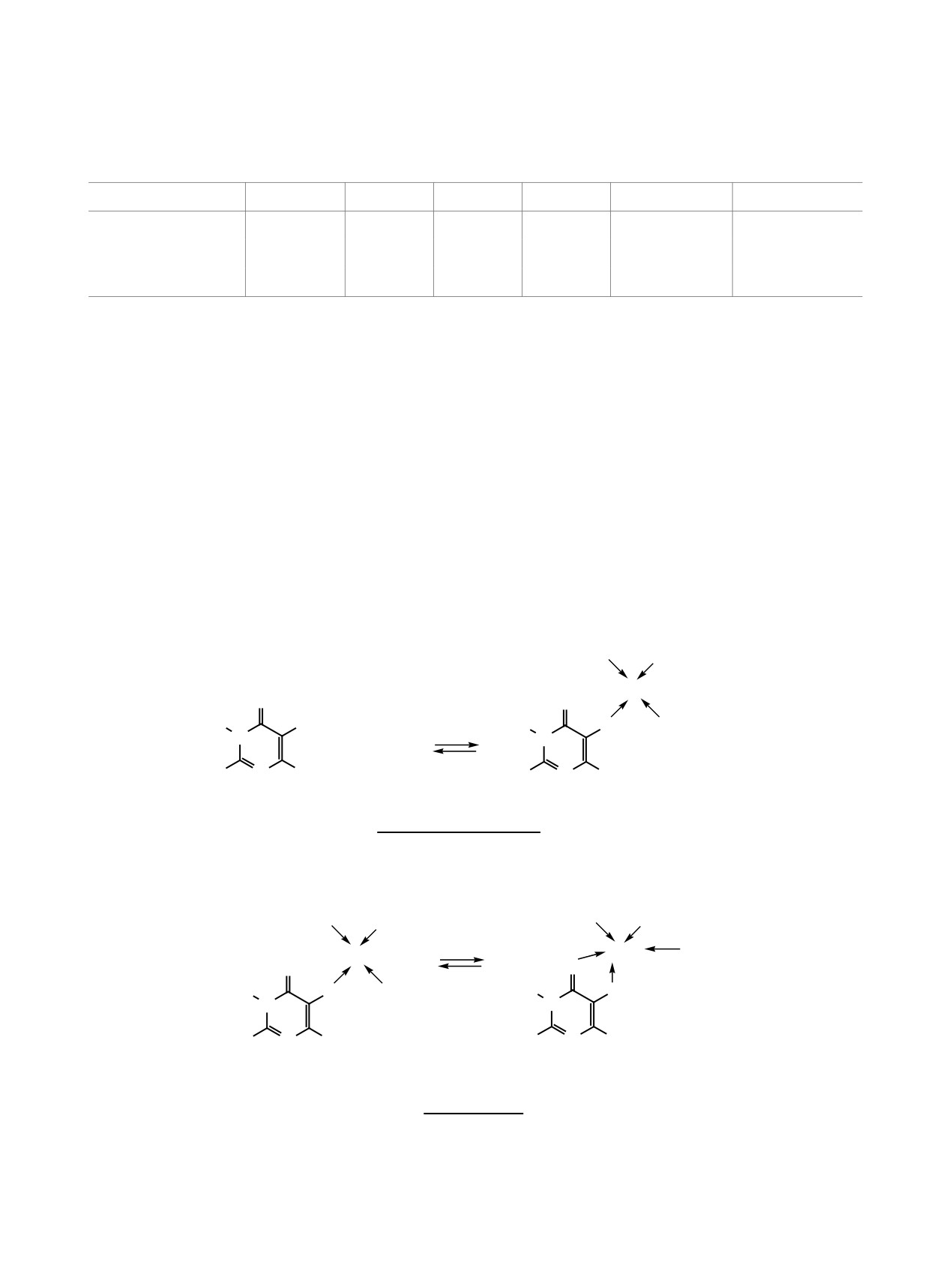
Основываясь на данных работ [14, 15] о том,
и
(6.9±0.6)×107 соответственно. Вычисленные
что ионы меди(II) в растворе ДМСО и ацетони-
значения согласуются со значениями констант
трила преимущественно образуют четырехкоор-
устойчивости четырехкоординационных комплек-
динационные комплексы состава 1:4 с молекулами
сов меди(II) c ДМСО и ацетонитрилом [14, 15], в
растворителя, а также на основании эксперимен-
растворе которых изучено комплексообразование.
тальных данных мы предположили, что комплек-
Определены константы равновесия Kр между
сообразование
2,3-диметил-5-гидрокси-6-амино-
четырех- и пятикоординационным комплексами
пиримидин-4(3Н)-она с ионами меди(II) происхо-
(схема 2).
дит по схеме 1.
Значения Kр равны 2.6±0.2 и 2.8±0.3 в растворе
Рассчитанные с использованием спектрофото-
ДМСО и ацетонитрила, соответственно. Исходя
метрического метода значения констант K1 реак-
из полученных значений констант комплексо-
ций комплексообразования ионов меди(II) c лиган-
образования K1 и констант равновесия Kр, оцене-
дом L в ДМСО и ацетонитриле равны (2.2±0.5)×107
ны константы комплексообразования K2 = K1Kр =
Схема 1.
Solv
Solv
2+
Cu
O
O
H3C
OH
K1
H3C
OH
Solv
N
N
+ [Cu(Solv)4]2+
+ Solv
H3C
N NH2
H3C
N NH2
{[CuL(Solv)3]2+}[Solv]
K1 =
{[CuL(Solv)4]2+}[L]
Схема 2.
Solv
Solv
Solv
Solv
Kp
Solv
Cu2+
Cu2+
O
O
H3C
OH
Solv
H3C
OH
N
N
H3C
N NH2
H3C
N NH2
[Ʉɨɦɩɥɟɤɫ 2]
Kp =
[Ʉɨɦɩɥɟɤɫ 1]
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
КОМПЛЕКСООБР
АЗОВАНИЕ 2,3-ДИМЕТИЛ-5-ГИДРОКСИ-...
1563
(5.7±1.4)×107 (ДМСО) и (1.7±0.2)×108 (CH3CN)
Масс-спектры ионизации получены на квадру-
и величины энергии Гиббса процесса образова-
польном жидкостном хромато-масс-спектрометре
ния пятикоординационных комплексов ΔG°T =
LCMS-2010 EV (Shimadzu) методом электрорас-
-RTlnK2=
-43.5
кДж/моль (ДМСО) и
пыления (элюент - ацетонитрил, скорость пото-
–46.7 кДж/моль(CH3CN). Рассчитанная энергия
ка - 0.1 мл/мин) в режиме регистрации положи-
Гиббса свидетельствует о самопроизвольном об-
тельных ионов при потенциале капилляра 4.5 кВ.
разовании пятикоординационного комплекса с
Температура нагревателя - 200°С, температура ис-
бидентатным лигандом L.
парителя - 230°С, скорость потока распыляющего
газа (азот) - 1.5 л/мин.
Таким образом, с использованием методов элек-
тронной, 13С ЯМР, ИК спектроскопии и масс-спек-
Изучение комплексообразования 2,3-диме-
трометрии изучено комплексообразование 2,3-ди-
тил-5-гидрокси-6-аминопиримидин-4(3Н)-она с
метил-5-гидрокси-6-аминопиримидин-4(3Н)-она с
ионами меди(II). Состав образующихся комплек-
ионами меди(II) в неводных растворах. Впервые
сов определяли спектрофотометрическим методом
наблюдали самопроизвольный переход четырех-
мольных отношений. Из свежеприготовленных
координационного комплекса меди(II) в пятико-
растворов лиганда (0.005 М.) и CuCl2 (0.005 М.)
ординационный, с изменением дентатности ли-
в ДМСО готовили серию растворов с разным со-
ганда. Определен состав комплексов, равный 1:1.
отношением концентраций, в которой концентра-
Установлены донорные центры лиганда, участву-
ция CuCl2 была постоянной, а концентрация ли-
ющие в комплексообразовании - атомы кислорода
ганда изменялась в пределах 2.5×10-5-4.0×10-4 М.
гидроксильной и карбонильной групп. Рассчитаны
Оптическую плотность растворов измеряли в мак-
константы образования четырехкоординационно-
симумах полос поглощения при 420 нм и 665 нм.
го комплекса K1 ионов меди(II) c 2,3-диметил-5-ги-
Для регистрации спектров ЯМР 13С растворы
дрокси-6-аминопиримидин-4(3Н)-оном в ДМСО и
CuCl2·2H2O (27.5 мг в 0.4 мл ДМСО-d6) и лиган-
ацетонитриле и оценены значения констант равно-
да (25 мг в 0.4 мл ДМСО-d6) в течение 15 мин
весия между четырех- и пятикоординационными
продували аргоном для предотвращения окис-
комплексами, а также величина энергии Гиббса
ления
2,3-диметил-5-гидрокси-6-аминопирими-
процесса образования пятикоординационных ком-
дин-4(3Н)-она и переносили в предварительно
плексов.
продутую аргоном ампулу.
Синтез комплексов
2,3-диметил-5-гидрок-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
си-6-аминопиримидин-4(3Н)-она с ионами
2,3-Диметил-5-гидрокси-6-аминопиримидин-
Cu(II) (1, 2). Смешивали предварительно проду-
4(3Н)-он получен по ранее описанной методике
тые аргоном и дегазированные растворы лиган-
[9]. Использовали CuCl2∙2H2O (ХЧ). Ацетонитрил
да (0.0775 г в 150 мл безводного ацетонитрила)
и ДМСО предварительно сушили над молекуляр-
и CuCl2∙2H2O (0.0852 г в 10 мл безводного аце-
ными ситами 3 Å.
тонитрила). Реакционная смесь окрашивалась
в ярко-зеленый цвет. Для получения комплекса
Электронные спектры поглощения регистри-
1 растворитель удаляли в вакууме сразу после
ровали на UV-Vis спектрофотометре Shimadzu
смешения растворов, остаток сушили в вакууме.
UV-2600 с термостатируемым кюветодержателем
Комплекс 1. Выход 82%, аморфный темно-зеле-
в области 200-900 нм с использованием кварце-
ный порошок. Найдено, %: C 26.6; H 2.8; N 14.5.
вых кювет толщиной 1 см. Температуру поддер-
C8H12Cl2CuN4O2. Вычислено, %: C 29.0; H 3.6; N
живали с помощью термостата LOIP LT-205a. ИК
16.9.
спектры регистрировали на спектрофотометре IR
Prestige-21 (Shimadzu Corp.) для образцов в виде
Комплекс 2 получали аналогично. Полученный
суспензии в вазелиновом масле в диапазоне 4000-
раствор ярко-зеленого цвета перемешивали 60-
400 см-1. Спектры ЯМР 13С записаны на спектро-
70 мин при 20°С, при этом окраска раствора посте-
метре Bruker Avance 500 (125.75 МГц) с использо-
пенно становилась темно-синей. Ацетонитрил от-
ванием тетраметилсилана в качестве внутреннего
гоняли в вакууме. Выход 73%, аморфное вещество
стандарта.
черного цвета.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
1564
МИШИНКИН и др.
Константа комплексообразования
2,3-диме-
СПИСОК ЛИТЕРАТУРЫ
тил-5-гидрокси-6-аминопиримидин-4(3Н)-она с
1. Holm R.H., Kennepohl P., Solomon E.I. // Chem. Rev.
ионами меди(II) K1 рассчитана на основании дан-
1996. Vol. 96. N 7. P. 2239. doi 10.1021/cr9500390
ных, полученных методом спектрофотометрии
[16]. Были записаны электронные спектры погло-
2. Bissaro B., Røhr Е.K., Müller G., Chylenski P., Skau-
щения растворов, содержащих лиганд и хлорид
gen M., Forsberg Z., Horn S.J., Vaaje-Kolstad G.,
меди(II) с различным соотношением концентра-
Eijsink V.G. // Nature Chem. Biol. 2017. Vol. 13.
P. 1123. doi 10.1038/nchembio.2470
ций, при постоянной концентрация хлорида ме-
ди(II). Для каждого из соотношений рассчитывали
3. Chowdhury B., Maji M., Biswas B. // J. Chem. Sci.
константу комплексообразования по уравнению (1).
2017. Vol. 129. N 10. P. 1627. doi 10.1007/s12039-
017-1379-y
[CuL]
(1)
K1 =
4. Solomon E.I., Heppner D.E., Johnston E.M., Gins-
[Cu2+][L]
bach J.W, Cirera J., Qayyum M., Kieber-Emmons M.T.,
Молярный коэффициент экстинкции рассчиты-
Kjaergaard C.H., Hadt R.G., Tian L. // Chem. Rev.
вали при допущении, что в момент выхода кривой
2014. Vol. 114. P. 3659. doi 10.1021/cr400327t
(см. рисунок) на плато все ионы меди(II) находятся
в комплексе 1.
5. Liu J.J., Diaz D.E., Quist D.A., Karlin K.D. // Isr.
J. Chem. 2017. Vol. 56. N 9-10. P. 1. doi 10.1002/
A
(2)
ijch.201600025
HCuL =
c(Cu2+)l
6. Ribeiro da Silva M.A.V., Amaral L.M.P.F., Szter-
Равновесную концентрацию комплекса опреде-
ner P.// J. Chem. Thermodyn. 2011. Vol. 43. P. 1763. doi
ляли по уравнению (3).
10.1016/j.jct.2011.06.003
'A
(3)
7. Муринов Ю.И., Мишинкин В.Ю., Акчурина О.В.,
CuL =
HCuLl
Грабовский С.А., Кабальнова Н.Н. // ЖОХ. 2017.
Здесь ΔА - изменение оптической плотности при
Т. 87. № 8. С. 1252.; Murinov Yu.I., Mishinkin V.Yu.,
образовании комплекса; l - длина оптического
Akchurina O.V., Grabovskii S.A., Kabal’nova N.N. //
Russ. J. Gen. Chem. 2017. Vol. 87. N 8. P. 1667. doi
пути.
10.1134/S1070363217080047
Аналогично определяли концентрацию ком-
8. Мишинкин В.Ю., Грабовский С.А., Кабальнова Н.Н.,
плекса 2.
Муринов Ю.И. // ЖОХ. 2017. Т.87. №7. С. 1149;
Равновесные концентрации лиганда и ионов
Mishinkin V.Yu., Grabovskii S.А., Kabal’nova N.N.,
меди(II) вычисляли по уравнениям (4), (5).
Murinov Yu.I. // Russ. J. Gen. Chem. 2017.Vol. 87. N 7.
[L] = cL - [CuL],
(4)
P. 1542. doi 10.1134/S1070363217070167
[Cu2+] = c(Cu2+) - [CuL].
(5)
9. Мишинкин В.Ю., Грабовский С.А., Кабальнова Н.Н.,
Из полученных констант комплексообразова-
Муринов Ю.И. // ЖОХ. 2019. Т. 89. № 3. С. 372.;
ния вычисляли среднее значение.
Mishinkin V.Yu., Grabovskii S.А., Kabal’nova N.N.,
Murinov Yu.I. // Russ. J. Gen. Chem. 2019.Vol. 89. N 3.
ФОНДОВАЯ ПОДДЕРЖКА
P. 405. doi 10.1134/S107036321903006X
Работа выполнена в рамках научно-исследова-
10. Lever A.B.P. Inorganic Electronic Spectroscopy.
тельских работ Уфимского института химии РАН
Amsterdam: Elsevier, 1984. 863 p.
(№ госрегистрации АААА-А17-117011910033-1,
11. Abbas G., Mir M., Hassan A., Irfan A., Mariya-Al-
АААА-А17-117011910035-5) с использованием
Rashida, Wu G. // ЖСХ. 2015. Т. 56. № 1. С. 99; Ab-
оборудования Центра коллективного пользования
bas G., Mir M., Hassan A., Irfan A., Mariya-Al-Rashi-
«Химия» Уфимского института химии Российской
da, Wu G. // J. Struct. Chem. 2015. Vol. 56. N 1. P. 92.
академии наук
doi 10.1134/S0022476615010138
КОНФЛИКТ ИНТЕРЕСОВ
12. Derrick J.S., Kim Y., Tak H., Park K., Cho J., Kim S.H.,
Авторы заявляют об отсутствии конфликта ин-
Lim M.H. // Dalton Trans. 2017. Vol. 46. P. 13166. doi
тересов.
10.1039/c7dt01489a
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
КОМПЛЕКСООБР
АЗОВАНИЕ 2,3-ДИМЕТИЛ-5-ГИДРОКСИ-...
1565
13. Tordin E., List M., Monkowius U., Schindler S.,
kin M.Yu., Mereshchenko A.S. // Chem. Phys. 2018.
Vol. 503. P. 14. doi 10.1016/j.chemphys.2018.01.020
Knör G. // Inorg. Chim. Acta. 2013. Vol. 402. P. 90. doi
15. Elleb M., Meulemeestre J., Schwing-Weill M.-J.,
10.1016/j.ica.2013.03.034
Vierling F. // Inorg. Chem. 1982. Vol. 21. P. 1477. doi
14. Olshin P.K., Myasnikova O.S., Kashina M.V., Gorbu-
10.1021/ic00134a042
nov A.O., Bogachev N.A., Kompanets V.O., Cheka-
16. Бек М., Надьпал И. Исследование комплексообразо-
lin S.V., Pulkin S.A., Kochemirovsky V.A., Skrip-
вания новейшими методами. М.: Мир, 1989. 413 с.
Complex Formation of 2,3-Dimethyl-5-hydroxy-
6-aminopyrimidin-4(3H)-one with Copper(II) Ions
in Non-Aqueous Solutions
V. Yu. Mishinkin, S. A. Grabovskii, N. N. Kabalnova, and Yu. I. Murinov*
Ufa Institute of Chemistry, Ufa Federal Research Center of the Russian Academy of Sciences,
pr. Oktyabrya 69, Ufa, 450054 Russia
*e-mail: murinov@anrb.ru
Received April 15, 2019; revised April 15, 2019; accepted April 19, 2019
The complexation of 2,3-dimethyl-5-hydroxy-6-aminopyrimidine-4(3H)-one with copper(II) ions in non-aque-
ous solutions was studied by electronic, NMR, IR spectroscopy and mass spectrometry. The sequential for-
mation of four- and five-coordination copper(II) complexes was observed, in which mono- and bidentate
coordination of the ligand was determined. Composition of the obtained complex was determined by the spec-
trophotometric method of molar ratios. The donor sites in the ligand molecule, which participate in coordina-
tion with copper(II) ions, were established and complexation constants were calculated.
Keywords: 2,3-dimethyl-5-hydroxy-6-aminopyrimidine-4(3Н)-one, four-coordination and five-coordination
complexes, copper(II) ions
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019