ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 10, с. 1572-1579
УДК 546.98:547-304.7:547.794.3
ПОЛУЧЕНИЕ И СВОЙСТВА С,N-ХЕЛАТНЫХ
КАРБЕНОВЫХ КОМПЛЕКСОВ ПАЛЛАДИЯ(II) C
2-АМИНОБЕНЗО[d]ТИАЗОЛЬНЫМ ФРАГМЕНТОМ
© 2019 г. А. С. Михердовa, *, С. В. Байковa, И. К. Проскуринаb, А. А. Шетневb, А. Д. Котовb
a Санкт-Петербургский государственный университет,
Университетская наб. 7-9, Санкт-Петербург, 199034 Россия
*e-mail: asm93@yandex.ru
b Центр трансфера фармацевтических технологий имени М. В. Дорогова,
Ярославский государственный педагогический университет имени К. Д. Ушинского, Ярославль, Россия
Поступило в Редакцию 18 июля 2019 г.
После доработки 18 июля 2019 г.
Принято к печати 24 июля 2019 г.
Взаимодействие бис(циклогексилизоцианидного) комплекса Pd(II) с замещенными бензо[d]тиазол-2-
аминами в присутвии триэтаноламина в качестве основания приводит к образованию депротониро-
ванных С,N-хелатных карбеновых комплексов со структурой, подобной описанной ранее для продук-
тов реакции c незамещенным бензо[d]тиазол-2-амином. Комплексы были выделены в чистом виде и
охарактеризованы с помощью методов масс-спектрометрии высокого разрешения, ИК и ЯМР спек-
троскопии (1H, 13C{1H}, 1H-1H COSY, 1H–1H NOESY, 1H-13C HSQC, 1H-13C HMBC). Полученные
комплексы проявляют умеренную антибактериальную активность в отношении чувствительных штам-
мов грамотрицательных бактерий E. coli (C600) и P. fluorescens (P218), грамположительных бактерий
S. aureus (ATCC-25923) и B. subtillis (ВКМ В3142Д), а также грибов С. albicans (ВКПГУ-401/885-653).
Ключевые слова: ациклические диаминокарбеновые комплексы, хелатные комплексы палладия, изо-
цианидные лиганды, антимикробная активность, бензо[d]тиазол-2-амины
DOI: 10.1134/S0044460X19100123
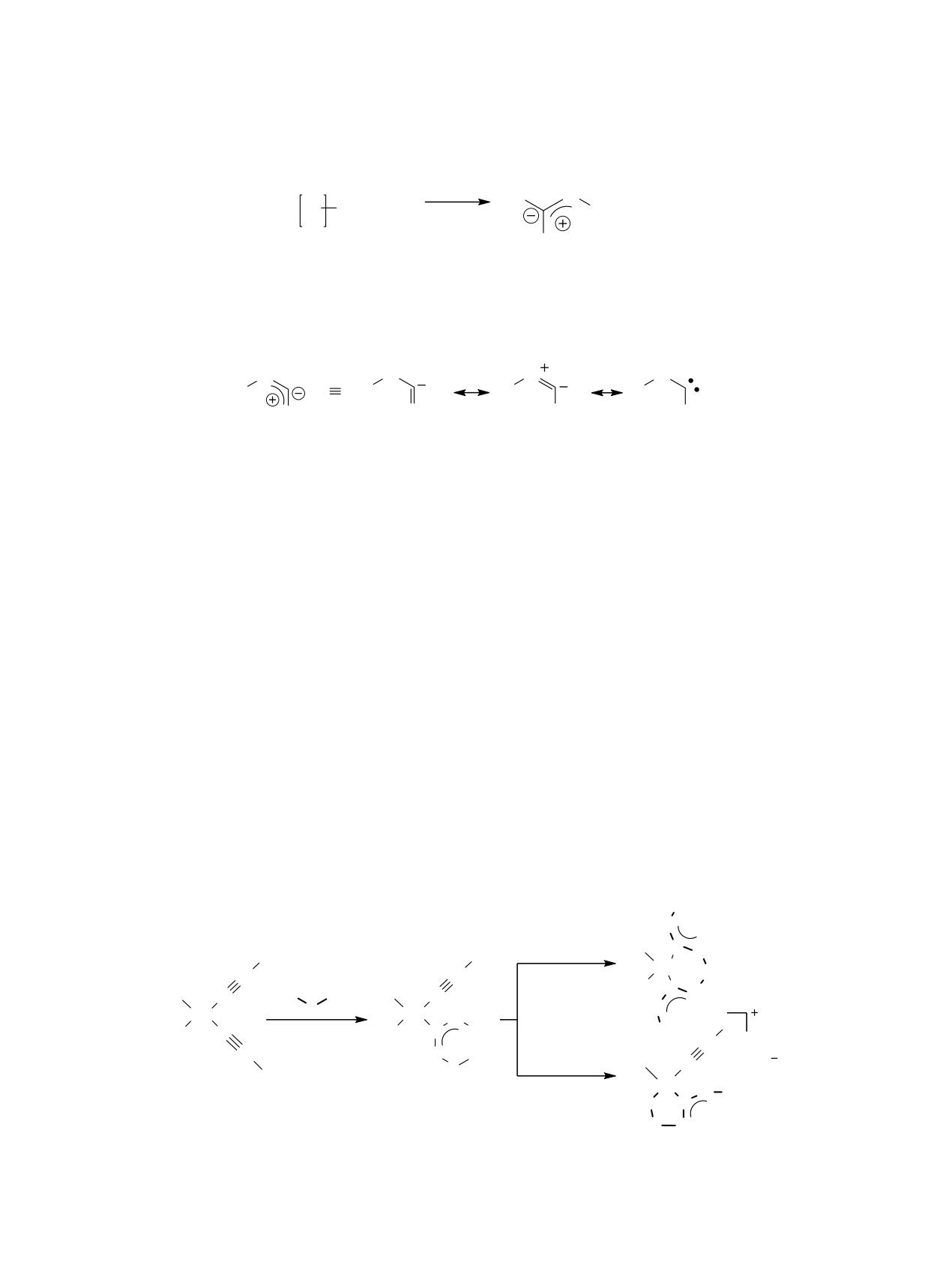
Особенности реакции нуклеофильного присо-
При этом следует отметить, что реакции
единения N-нуклеофилов к изоцианидным лиган-
N-нуклеофилов с одним нуклеофильным центром
дам в координационной сфере переходных метал-
изучены достаточно хорошо и протекают, как пра-
лов (прежде всего, палладия, платины и золота) в
вило, с образованием исключительно комплексов
настоящее время стало предметом пристального
M-ADC. В то же время, полинуклеофилы (Nu-L-
внимания исследователей [1-6]. Причина этого
Nu) реагируют более сложным образом, образуя
заключается в уникальных каталитических свой-
(помимо комплексов M-ADC) хелатные карбено-
ствах продуктов этого взаимодействия - диами-
вые комплексы различных типов. На примере ком-
нокарбеновых комплексов переходных металлов
плексов палладия это показано на схеме 2.
(M-ADC, схема 1). Эти частицы обладают уни-
На первом этапе реакции образовавшиеся
кальными каталитическими свойствами, не усту-
ациклические монокарбеновые продукты (Pd-
пающими таковым у наиболее популярных в наше
ADC) претерпевают либо атаку другим нуклео-
время комплексов с гетероциклическими карбено-
фильным центром амбидентного нуклеофила по
выми лигандами (NHC) [7-20]. Кроме того, они
свободному изоцианидному лиганду с образовани-
проявляют и интересные биологические свойства,
ем нейтрального N,N-хелатного комплекса (путь а)
позволяющие предполагать в подобных комплек-
[23], либо внутримолекулярное замещение одного
сах заметный фармакологический потенциал [21, 22].
из анионных лигандов с образованием катионного
1572
ПОЛУЧЕНИЕ И СВОЙСТВА С,N-ХЕЛАТНЫХ КАРБЕНОВЫХ КОМПЛЕКСОВ ПАЛЛАДИЯ(II)
1573
Схема 1.
H
R2
2
NH
M
N
+
M
C N R1
R1
NR2
2
M-CNR
M-ADC
R1 = Alk, Ar; R2 = H, Alk, Ar, NR2.
Ⱦɢɚɦɢɧɨɤɚɪɛɟɧɨɜɵɣ ɥɢɝɚɧɞ (ADC)
H
H
H
H
N
N
N
N
R1
R1
R1
R1
NHR2
NR2
NR2
NH2R2
2
2
2
2
+
C,N-хелатного комплекса (путь б) [23-26], который
1 c незамещенным 1,3-тиазол-2-амином приводит
потом, в принципе, может депротонироваться и
к образованию моноядерного C,N-хелатного ком-
вступать в дальнейшие превращения, например, с
плекса 2a (R1=R2 = Н=H) с депротонированным
образованием биядерных структур [27-32]. Более
карбеновым фрагментом (схема 3). Такой же тип
того, если в полинуклеофиле нуклеофильные цен-
взаимодействия наблюдается и при переходе от
тры различны, то следует учитывать образование
1,3-тиазол-2-амина к бензо[d]тиазол-2-амину (R1 ,
хелатных региоизомеров. Такая разнообразная
R2 = бензо). В то же время при введении в струк-
реакционная способность открывает перед хими-
туру 1,3-тиазол-2-амина арильных заместителей
ками-синтетиками возможность получения целого
в положение 4 реакция приводит к образованию
набора структур, резко отличающихся по своим
классических отрытоцепных диаминокарбеновых
свойствам.
комплексов 3 (R1 = H, R2 = Ar) (схема 3).
Одним из видов подобных амбидентных ну-
Причины такого различия могут быть связаны
клеофилов, который привлек в последние годы
как с пространственными, так и с электронными
наше внимание, являются аминоазогетероциклы
факторами. В работе [26] этот вопрос подробно не
[26-32], для которых характерно образование всех
описанных выше видов карбеновых комплексов.
изучался. Поэтому в данной статье мы иследовали
Недавно мы обнаружили [26], что взаимодействие
особенности взаимодействия комплекса 1 с бен-
бис(циклогексилизоцианидного) комплекса пал-
зо[d]тиазол-2-аминами 4-8, содержащими различ-
ладия(II) cis-[PdCl2(CNCy)2] (Cy = циклогексил)
ные заместители в положениях 5 и 6 (схема 4).
Схема 2.
R
HN
Cl
C
NuH
R
R
ɚ
Pd
N
N
L
Cl C
NuH
Cl
C
Nu
Nu
Cl
C
L
H
HN
Pd
Pd
N
R
Cl
C
Cl
C
R
R
N
N
HNu
Nu
L
ɛ
Cl
C
Cl
R
H
Pd
N R
Nu C
Pd-ADC
L
NuH
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
1574
МИХЕРДОВ и др.
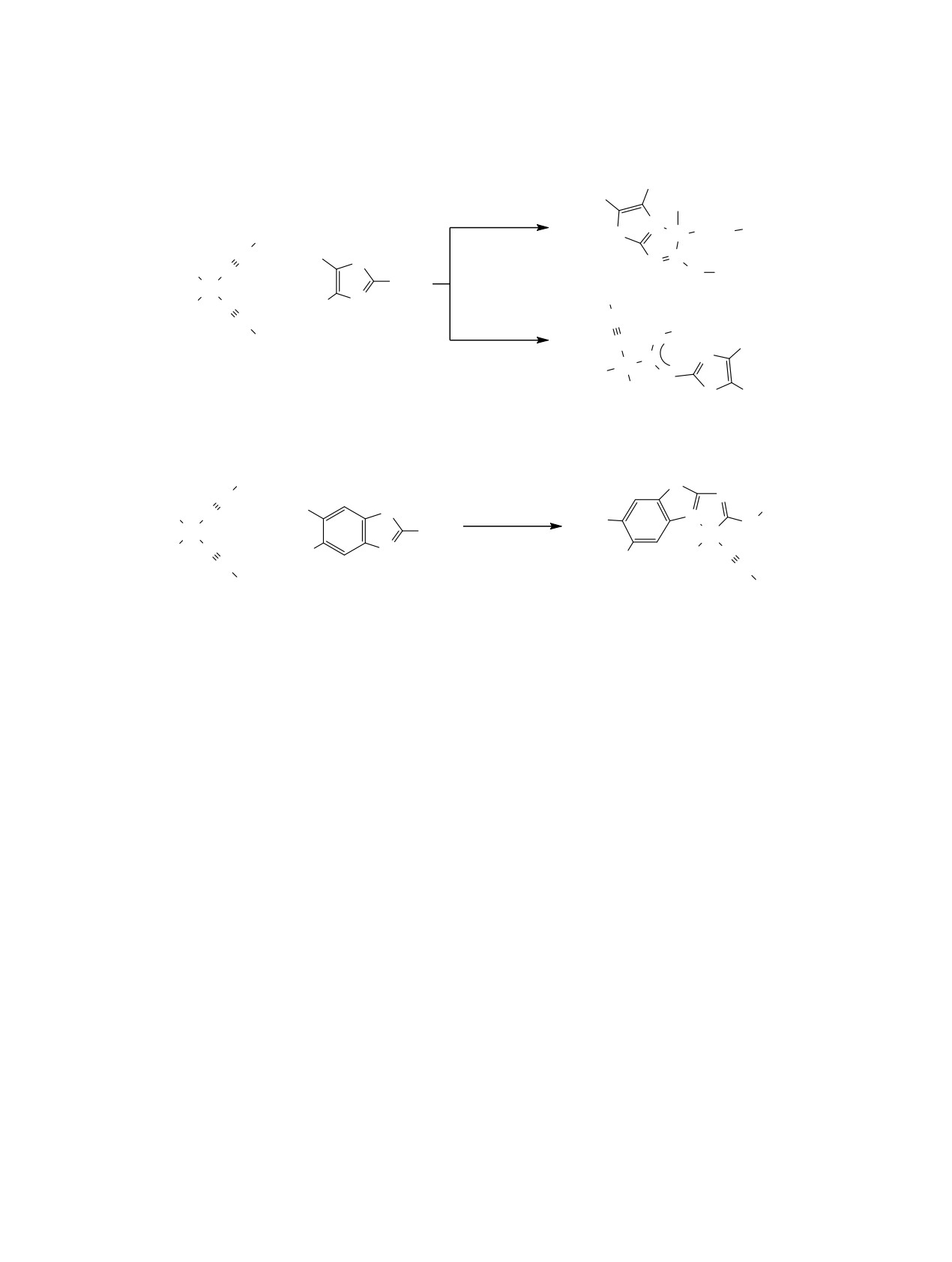
Схема 3.
R2
R1
Cl
R1, R2
+ ɛɟɧɡɨ
N
S
Pd
C N Cy
Cy
N
R1
S
N
C
Cl
C
N
Cy
+
NH2
H
Pd
Cy
2a, ɛ
N
Cl
C
R2
N
N
Cy
Cy
HN
C
R2
R1 = H, R2 = Ar
N
1
C
Pd
Cl
N
Cl
H SR1
3
Схема 4.
Cy
S
N
N
R1
Cy
Cl
C
S
N(C2H4OH)3
R1
N
N
Pd
+
NH2
Pd
H
-N(C2H4OH)3·HCl
Cl
C
N
Cl
C
R2
N
R2
N
Cy
Cy
1
9-13
83-98%
R1 = Me, R2 = H (4, 9); R1 = F, R2 = H (5, 10); R1 = CO2Me, R2 = H (6, 11);
R1 = NO2, R2 = H (7, 12); R1 = Me, R2 = Cl (8, 13).
В данной работе для получения целевых кар-
ющие продуктам фрагментации с отщеплением
беновых комплексов 9-11 и 13 мы использовали
хлорид-аниона [М - Cl]+. Во всех случаях пики
модифицированную методику [26], отличающу-
имеют характерное изотопное распределение, что
юся применением основания - триэтаноламина.
указывает на количество атомов палладия и хлора
Использование данного подхода позволило сокра-
в ионах, соответствующее предполагаемым струк-
тить время реакции до 15 мин и упростило выде-
турам. В ИК спектрах всех комплексов 9-13 на-
ление целевого продукта. Это позволило синте-
блюдается одна интенсивная полоса поглощения
зировать новые комплексы 9-11 и 13 с высокими
валентных колебаний связи C≡N, максимум кото-
выходами. При получении комплекса 12 из-за худ-
рой расположен около 2220 см-1.
шей растворимости исходного 6-нитробензо[d]-
В спектрах ЯМР 1H наблюдаются характерные
тиазол-2-амина 6 и целевого продукта реакцию
сигналы протонов СH и CH2 циклогесильных за-
проводили в 1,2-дихлорэтане при кипячении.
местителей, NH-протона карбенового фрагмента,
а также сигналы протонов тиагетероциклического
Образовавшиеся продукты выделяли путем
фрагмента. Характеристичные ипсо-CH протоны
фильтрации реакционной смеси с последующим
циклогексильных заместителей регистрируют-
ее упариванием при нормальном давлении. Они
ся в виде двух раздельных или перекрывающих-
были охарактеризованы методами масс-спектро-
ся мультиплетов в области 3.9-4.2 м. д. Наличие
метрии высокого разрешения с ионизацией элек-
только одиного сигнала NH-протона в области
трораспылением, ИК и ЯМР спектроскопии (1H,
5.2-5.7 м. д. в виде дублета свидетельствует о мо-
13C,
19F, 1H-1H COSY, 1H-1H NOESY, 1H-13C
но-депротонировании карбенового фрагмента, а
HSQC, 1H-13C HMBC). В масс-спектрах получен-
также о соседстве NH-протона с ипсо-CH-прото-
ных комплексов наблюдаются пики, соответству-
ном циклогексильного заместителя.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
ПОЛУЧЕНИЕ И СВОЙСТВА С,N-ХЕЛАТНЫХ КАРБЕНОВЫХ КОМПЛЕКСОВ ПАЛЛАДИЯ(II)
1575
Значения минимальной подавляющей концентрации (МПК) комплексов 2a, б и 9-13 в отношении чувствительных
штаммов микроорганизмов
МПК, мкг/мл
№
грамотрицательные
грамположительные
грибы
E. coli
P. fluorescens
S. aureus
B. subtillis
C. albicans
2a (R1 = R2 = Н)
100
100
100
>200
>200
2б (R1, R2 = бензо)
>200
>200
25
100
>200
9
100
>200
100
>200
>200
10
200
200
200
200
200
11
>200
200
>200
>200
>200
12
100
100
>200
>200
>200
13
>200
>200
>200
>200
>200
Пефлоксацин
0.008
0.008
0.008
<0.1
-
Миконазол
-
-
-
-
1
Нитрофурантоин
8
16
16
8
-
В спектрах ЯМР 13C присоединение бензо[d]-
мы определили антимикробную активность со-
тиазол-2-аминов к координированному цикло-
единений 9-13, а также полученных нами ранее
гексилизоцианиду проявляется в изменении хи-
комплексов 2a, б (R1, R2 = Н, бензо). Вещества
мического сдвига четвертичного атома углерода
были протестированы на антибактериальную ак-
изоцианидного лиганда, который превращается в
тивность в отношении чувствительных штаммов
карбеновый атом углерода. Это приводит к появ-
грамотрицательных бактерий E. coli (C600), P.
лению сигнала в области 183 м. д. (по сравнению c
fluorescens (P218) и грамположительных бактерий
116 м. д. в спектре соединения 1). Во всех случа-
S. aureus (ATCC-25923), B. subtillis (ВКМ В3142Д),
ях наблюдаемый сигнал находится в области, ха-
а также грибов С. albicans (ВКПГУ-401/885-653).
рактерной для карбеновых атомов углерода в ком-
Результаты антимикробного тестирования пред-
плексах палладия с С,N-хелатными диаминокарбе-
ставлены в таблице.
новыми лигандами (δC 160-224 м. д.) [26-31].
Комплексы 2, 9 и 10 проявили умеренную ан-
Полученые спектральные данные говорят о
тимикробную активность, которая, тем не менее,
том, что комплексы 9-13 являюся монодепрото-
оказалась существенно ниже, чем у контрольных
нированными формами С,N-хелатных карбеновых
соединений (пефлоксацин, нитрофурантоин).
комплексов палладия(II). Кроме того, полученные
Комплекс
2б показал избирательную способ-
данные свидетельствуют об отсутствии влияния
ность угнетать рост грамположительных бакте-
заместителя на тип образующегося продукта.
рий S. aureus (ATCC-25923) (МПК 25 мкг/мл) и B.
Такое отсутствие является косвенным свидетель-
subtillis (ВКМ В3142Д) (МПК 100 мкг/мл) и мо-
ством в пользу того, что различия в реакционной
жет быть рекомендован для дальнейшего изучения
способности тиазол-2-аминов, отмеченные в рабо-
и проведения медицинско-химической модифика-
те [26], обусловлены стерическим фактором, а не
ции. Следует отметить, что активность комплекса
электронным.
2б против чувствительного штамма золотистого
Учитывая интерес, который в последние годы
стафиллококка оказалась близкой к значениям
проявляется к биологической активности кар-
МПК для котрольного соединения (нитрофуранто-
беновых комплексов переходных металлов [33],
ин, МПК 16 мкг/мл). Комплекс 12 проявил изби-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
1576
МИХЕРДОВ и др.
рательную активность в отношении штаммов гра-
страции 50-3000 Да. Спектры ЯМР 1H, 13C{1H} и
мотрицательных бактерий (E. coli и P. fluorescens)
19F{1H} были зарегистрированы на спектрометре
при значении МПК 100 мкг/мл.
Bruker 400 МГц Avance. Корреляционные спек-
тры (COSY, NOESY, HSQC, HMBC) были сня-
Три соединения - комплексы 2a, 9 и 10 - про-
явили умеренную активность в отношении штам-
ты на спектрометре Bruker Avance II+ 500 MHz
мов S. aureus (ATCC-25923) и E. coli (C600) в высо-
(UltraShield Magnet). Измерения проводили в
CDCl3 при комнатной температуре.
кой концентрации (МПК 100 мкг/мл). Комплексы
11 и 13 не проявили антибактериальных свойств
Исследование антимикробной активности вы-
в отношении исследуемых штаммов в диапазоне
полнено методом двойных серийных разведений
концентраций 0.8-200 мкг/мл. Только одно соеди-
с использованием турбидиметрического метода
нение (комплекс 10) проявило фунгистатическую
контроля роста микроорганизмов в соответствии
активность против С. albicans в максимальной те-
с рекомендациями [34]. Изменение интенсивно-
стовой концентрации 200 мкг/мл.
сти светопропускания при воздействии растворов
Таким образом, взаимодействие бис(циклогек-
исследуемых веществ в диапазоне концентраций
силизоцианидного) комплекса Pd(II) с замещен-
0-200 мкг/мл проводили с использованием спек-
ными бензо[d]тиазол-2-аминами в присутвии три-
трофотометра 512 UV/VIS Bibby Scientific Jenway
этаноламина приводит к образованию депротони-
6715. Для сравнения использовали пефлоксацина
рованных С,N-хелатных карбеновых комплексов,
мезилат дигидрат.
котрые проявляют умеренную антибактериальную
Получение С,N-хелатных карбеновых ком-
активность в отношении бактерий Е. coli, S. aureus,
плексов
9-11,
13. Раствор cis-[PdCl2(CNCy)2]
P. fluorescens, B. subtillis и грибов C. albicans.
1 (30 мг, 7.5 ммоль) с триэтаноламином (11 мг,
7.5 ммоль) в CH2Cl2 (3 мл) добавляли к соответ-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ствующему бензо[d]тиазол-2-амину (7.5 ммоль).
Органические и неорганические реагенты
Реакционную смесь перемешивали на воздухе при
и растворители, если это не оговорено отдель-
комнатной температуре в течение 15 мин. Цвет ре-
но, были получены из коммерческих источников
акционной смеси изменялся от бледно-желтого к
(Aldrich) и использовались без дополнительной
интенсивному лимонно-желтому, и наблюдалось
очистки. Комплекс cis-[PdCl2(CNCy)2] 1 был полу-
образование белого осадка гидрохлорида триэта-
чен по методике [26]. Образцы эталонных штам-
ноламина. Полученный раствор фильтровывали,
мов S. aureus (ATCC-25923) получены из аме-
упаривали при комнатной температуре и нормаль-
риканской коллекции типовых культур (АТСС),
ном давлении. Полученный осадок промывали
B. subtillis (ВКМ В3142Д) и грибов С. albicans
Et2O (3×1 мл) и сушили на воздухе при комнатной
(ВКПГУ-401/885-653) получены из всероссийской
температуре и нормальном давлении.
коллекции микроорганизмов (ВКМ), штаммы E.
Комплекс 9. Выход 39 мг (98%). ИК спектр, ν,
coli (C600) и P. fluorescens (P218) предоставлены
см-1: 2934 с (C-H), 2231 с (C≡N), 1522, 1466, 1421
лабораторией молекулярной биологии Института
с (N=C), 884 ср [δ(C-H)]. Спектр ЯМР 1H, δ, м. д.:
биохимии и физиологии микроорганизмов им. Г.К.
1.05-2.23 м (20H, CH2, Cya и Cyb), 2.36 с (3H, CH3),
Скрябина РАН. Для культивации микроорганиз-
3.97-4.17 м (2H, CH, Cya и Cyb), 5.60 д (1H, NH,
мов использовали питательные среды LB Бульон
3JHH = 7.4 Гц), 7.11 д (1H, C5H, 3JHH = 8.4 Гц), 7.30
(Леннокс) и LB Агар производства «ДИАЭМ»
с (1H, C7H), 8.73 д (1H, C4H, 3JHH = 8.4 Гц). Спектр
(Обнинск).
ЯМР 13С, δС, м. д: 21.21 (CH3), 22.7 (2CH2, Cy), 24.6
ИК спектры записаны на спектрометре Shimadzu
(2СH2, Cy), 25.4 (2CH2, Cy), 32.0 (2CH2, Cy), 33.0
FTIR-Spectrum 8400S (4000-400 см-1) для образ-
(2CH2, Cy), 52.8 (CH, Cya), 55.5 (CH, Cyb), 118.8
цов, таблетированных с KBr. Масс-спектры были
(C7, CH, бензотиазол), 121.3 (C4, CH, бензотиазол),
получены на спектрометре Bruker micrOTOF с элек-
127.9 (C5, CH, бензотиазол), 129.5 (C, CNCyb),
трораспылительной ионизацией. Растворитель -
130.5 (C6, бензотиазол), 132.4 (C7а, бензотиазол),
MeOH или смесь MeOH-CH2Cl2, область реги-
147.2 (C3а, бензотиазол), 183.2 (С, карбен), 184.0
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
ПОЛУЧЕНИЕ И СВОЙСТВА С,N-ХЕЛАТНЫХ КАРБЕНОВЫХ КОМПЛЕКСОВ ПАЛЛАДИЯ(II)
1577
(C2, бензотиазол). Масс-спектр, m/z: 487.1152 [M -
13C, δC, м. д.: 20.1 (CH3), 22.7 (2CH2, Cy), 24.4
Cl]+ (вычислено для C22H29N4PdS+: 487.1143).
(2CH2, Cy), 24.6 (2CH2, Cy), 24.7 (CH2, Cy), 25.4
Комплекс 10. Выход 38 мг (95%). ИК спектр, ν,
(CH2, Cy), 32.0 (2CH2, Cy), 32.9 (2CH, Cy), 53.0
(CH, Cyа), 55.6 (CH, Cyb), 119.0 (C4, CH, бензоти-
см-1: 2932 с (C-H), 2227 с (C≡N), 1519, 1473, 1419
азол), 122.5 (C7, CH, бензотиазол), 129.0 (C5, бен-
с (N=C), 878 ср [δ(C-H)]. Спектр ЯМР 1H, δ, м. д.:
зотиазол), 129.1 (CN, Cyb), 130.2 (C6, бензотиазол),
1.11-2.20 м (20H, CH2, Cya и Cyb), 4.03-4.11 м (2H,
133.0 (C7a, бензотиазол), 148.2 (C3а, бензотиазол),
CH, Cya и Cyb), 5.62 д (1H, NH, 3JHH = 7.4 Гц), 7.02
д. д. д (1H, C5H, 3JHF = 9.0, 3JHH = 9.0, 4JHH = 2.6 Гц),
183.8 (С, карбен), 185.1 (C2, бензотиазол). Масс-
спектр, m/z: 521.0763 [M - Cl]+ (вычислено для
7.21 д. д (1H, C7H, 3JHF = 9.0, 4JHH = 2.6 Гц), 8.84 д.
C22H28N4ClPdS+: 521.0753).
д (1H, C4H, 3JHH = 9.0, 4JHF = 4.9 Гц). Спектр ЯМР
13C, δС, м. д.: 22.7 (2CH2, Cy), 24.6 (2CH2, Cy), 25.4
Комплекс 12. Раствор cis-[PdCl2(CNCy)2]
1
(2CH2, Cy), 31.9 (2CH2, Cy), 33.0 (2CH2, Cy), 52.9
(30 мг, 7.5 ммоль) с триэтаноламином (11 мг,
(CH, Cyа), 55.6 (CH, Cyb), 107.9 д (C5, CH, бензо-
7.5 ммоль) в C2H4Cl2 (5 мл) добавляли к 6-ни-
тиазол, 2JCF = 27.0 Гц), 114.4 д (C7, CH, бензотиа-
тробензо[d]тиазол-2-амину 7 (15 мг, 7.5 ммоль).
зол, 2JCF = 23.5 Гц), 120.0 д (C4, CH, бензотиазол,
Реакционную смесь кипятили при перемеши-
3JCF = 8.4 Гц), 129.1 (C, CN, Cyb), 131.3 д (C7a, бен-
вании в течение 30 мин. Цвет реакционной сме-
зотиазол, 3JCF = 10.5 Гц), 145.7 (C3а, бензотиазол),
си изменялся от бледно-желтого к интенсивному
158.7 д (C6, бензотиазол, 1JCF = 242.3 Гц), 183.3 (С,
лимонно-желтому, и наблюдалось образование
карбен), 184.4 (C2, бензотиазол). Спектр ЯМР 19F:
белого осадка гидрохлорида триэтаноламина.
δF 119.58 м. д. Масс-спектр, m/z: 491.0878 [M - Cl]+
Полученный горячий раствор фильтровывали,
(вычислено для C21H26N4FPdS+: 491.0892).
упаривали при комнатной температуре и нормаль-
ном давлении. Полученный желто-зеленый осадок
Комплекс 11. Выход 40 мг (93%). ИК спектр,
ν, см-1: 2930 с (C-H), 2230 с (C≡N), 1721 c (C=O),
промывали Et2O (3×1 мл) и сушили на воздухе
при комнатной температуре и нормальном давле-
1526, 1474, 1420 с (N=C), 891 ср [δ(C-H)]. Спектр
нии. Выход 35 мг (83%). ИК спектр, ν, см-1: 2932
ЯМР 1H, δ, м. д.: 1.08-2.22 м (20H, СH2, Cya и
с (C-H), 2226 с (C≡N), 1522, 1470, 1416 с (N=C),
Cyb), 3.88 с (3H, CH3), 4.02-4.10 м (2H, СH, Cya
868 ср [δ(C-H)]. Спектр ЯМР 1H, δ, м. д.: 1.10-2.14
и Cyb), 5.83 д (1H, NH, 3JHH = 7.0 Гц), 7.96 д. д
(1H, C5H,3JHH = 8.7, 4JHH = 1.7 Гц), 8.21 д (1H, C7H,
м (20H, СH2, Cya и Cyb), 4.06-4.13 м (1H, СH,
Cyb), 4.17-4.23 м (1H, СH, Cya), 5.81 д (1H, NH,
4JHH = 1.6 Гц), 8.87 д (1H, C4H, 3JHH = 8.7 Гц).
3JHH = 6.1 Гц), 8.20 д. д (1H, C5H,3JHH = 9.1, 4JHH =
Спектр ЯМР 13С, δC, м. д: 21.2 (CH3), 22.7 (2CH2,
2.3 Гц), 8.48 д (1H, C7H, 4JHH = 2.3 Гц), 8.97 д (1H,
Cy), 24.6 (2CH2, Cy), 24.6 (CH2, Cy), 25.3 (CH2,
C4H, 3JHH = 9.1 Гц). Спектр ЯМР 13С, δC, м. д: 22.7
Cy), 32.0 (2CH2, Cy), 32.9 (2CH2, Cy), 52.1 (CH3),
53.2 (CH, Cya), 55.7 (CH, Cyb), 118.5 (C4, CH, бен-
(2CH2, Cy), 24.6 (2CH2, Cy), 24.6 (CH2, Cy), 25.3
(CH2, Cy), 32.0 (2CH2, Cy), 33.0 (2CH2, Cy), 53.4
зотиазол), 123.4 (C7, CH, бензотиазол), 124.2 (C6,
(CH, Cya), 55.8 (CH, Cyb), 118.0 (C7, CH, бензоти-
бензотиазол), 128.4 (C5, CH, бензотиазол), 128.5
азол), 118.6 (C4, CH, бензотиазол), 122.9 (C5, CH,
(CNCyb), 130.5 (C7а, бензотиазол), 152.8 (C3а, бен-
бензотиазол), 129.9 (CNCyb), 130.9 (C7а, бензоти-
зотиазол), 166.7 (COOMe), 184.2 (С, карбен), 186.7
(C2, бензотиазол). Масс-спектр, m/z:
531.1046
азол), 142.8 (C6, бензотиазол), 154.0 (C3а, бензоти-
азол), 184.8 (С, карбен), 187.7 (C2, бензотиазол).
[M
- Cl]+ (вычислено для C23H29N4O2PdS+:
Масс-спектр, m/z: 518.0848 [M - Cl]+ (вычислено
531.1041).
для C21H26N5O2PdS+: 518.0837).
Комплекс 13. Выход 40 мг (95%). ИК спектр,
ν, см-1: 2931 с (C-H), 2228 с (C≡N), 1524, 1476,
ФОНДОВАЯ ПОДДЕРЖКА
1420 с (N=C), 887 ср [δ(C-H)]. Спектр ЯМР 1H,
δ, м. д.: 1.05-2.17 м (20H, CH2, Cya и Cyb), 2.36 с
Работа выполнена при финансовой поддерж-
(3H, CH3), 3.94-4.05 м (1H, CH, Cya), 4.05- 4.17
ке Российского научного фонда (грант № 19-13-
м (1H, CH, Cyb), 5.70 д (1H, NH, 3JHH = 7.3 Гц),
00008) с использованием оборудования ресурсных
7.33 с (1H, C7H), 8.91 с (1H, C4H). Спектр ЯМР
центров Санкт-Петербургского государственного
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
1578
МИХЕРДОВ и др.
университета «Магнитнорезонансные методы ис-
13. Valishina E.A., Guedes da Silva M.F.C., Kinzhalov
следования», «Методы анализа состава вещества»
M.A., Timofeeva S.A., Buslaeva T.M., Haukka M., Pom-
и Образовательного ресурсного центра по направ-
beiro A.J.L., Boyarskiy V.P., Kukushkin V.Y., Luzya-
лению «Химия».
nin K.V. // J. Mol. Catal. A: Chem. 2014. Vol. 395.
P. 162. doi 10.1016/j.molcata.2014.08.018
КОНФЛИКТ ИНТЕРЕСОВ
14. Timofeeva S.A., Kinzhalov M.A., Valishina E.A., Luzyanin
K.V., Boyarskiy V.P., Buslaeva T.M., Haukka M.,
Авторы заявляют об отсутствии конфликта
Kukushkin V.Y. // J. Catal. 2015. Vol. 329. P. 449. doi
интересов.
10.1016/j.jcat.2015.06.001
СПИСОК ЛИТЕРАТУРЫ
15. Mikhaylov V.N., Sorokoumov V.N., Korvinson K.A.,
Novikov A.S., Balova I.A. // Organometallics. 2016.
1. Vignolle J., Catton X., Bourissou D. // Chem. Rev. 2009.
Vol. 35. N 11. P. 1684. doi 10.1021/acs.organomet.6b00144
Vol. 109. N 8. P. 3333. doi 10.1021/cr800549j
16. Anisimova T.B., Kinzhalov M.A., Guedes da Silva
2. Boyarskiy V.P., Luzyanin K.V., Kukushkin V.Y. // Coord.
M.F.C., Novikov A.S., Kukushkin V.Yu., Pombeiro A.J.L.,
Chem. Rev. 2012. Vol. 256. N 17-18. P. 2029. doi
Luzyanin K.V. // New J. Chem. 2017. Vol. 41. P. 3246.
10.1016/j.ccr.2012.04.022
doi 10.1039/C7NJ00529F
3. Slaughter L.M. // ACS Catal. 2012. Vol. 2. N 8 P. 1802.
17. Chay R.S., Rocha B.G.M., Pombeiro A.J.L., Kukush-
doi 10.1021/cs300300y
kin V.Yu., Luzyanin K.V. // ACS Omega. 2018. Vol. 3.
4. Handa S., Slaughter L.M. // Angew. Chem. Int. Ed. 2012.
N 1. P. 863. doi 10.1021/acsomega.7b01688
Vol. 51. N 12. P. 2912. doi 10.1002/anie.201107789
18. Mikhaylov V.N., Sorokoumov V.N., Liakhov D.M.,
5. Boyarskiy V.P., Bokach N.A., Luzyanin K.V., Kukush-
Tskhovrebov A.G., Balova I.A. // Catalysts. 2018.
kin V.Y. // Chem. Rev. 2015. Vol. 115. N 7. P. 2698. doi
Vol. 8. N 4. P. 141. doi 10.3390/catal8040141
10.1021/cr500380d
19. Singh C., Prakasham A.P., Gangwar M.K., Butcher R.J.,
6. Кинжалов М.А., Боярский В.П. // ЖОХ. 2015. T. 85.
Ghosh P. // ACS Omega. 2018. Vol. 3. N 2. P. 1740. doi
Вып. 10. C. 1681; Kinzhalov M.A., Boyarskii V.P. //
10.1021/acsomega.7b01974
Russ. J. Gen. Chem. 2015. Vol. 85. N 10. P. 2313. doi
10.1134/S1070363215100175
20. Singh C., Prakasham A. P., Ghosh P. // Chem. Select.
2019. Vol. 4. N 1. P. 329. doi 10.1002/slct.201803292
7. Tšupova S., Rudolph M., Rominger F., Hashmi A.S.K. //
Adv. Synth. Catal. 2016. Vol. 358. N 24. 3999. doi
21. Williams M., Green A.I., Fernandez-Cestau J.,
10.1002/adsc.201600615
Hughes D.L., O’Connell M.A., Searcey M., Bertrand B.,
Bochmann M. // Dalton Trans. 2017. Vol. 46. P. 13397.
8. Luzyanin K.V., Tskhovrebov A.G., Carias M.C.,
doi 10.1039/C7DT02804K
Guedes da Silva M.F.C., Pombeiro A.J.L., Kukush-
kin V.Y. // Organometallics. 2009. Vol. 28. P. 6559. doi
22. Bertrand B., Romanov A.S., Brooks M., Davis J.,
10.1021/om900682v
Schmidt C., Ott I., O’Connell M., Bochmann M. //
Dalton Trans. 2017. Vol. 46. N 45. P. 15875. doi
9. Kinzhalov M.A., Luzyanin K.V., Boyarskiy V.P.,
10.1039/C7DT03189K
Haukka M., Kukushkin V.Y. // Organometallics. 2013.
Vol. 32. P. 5212. doi 10.1021/om4007592
23. Kinzhalov M.A., Timofeeva S.A., Luzyanin K.V., Boyar-
skiy V.P., Yakimanskiy A.A., Haukka M., Kukush-
10. Miltsov S.A., Karavan V.S., Boyarsky V.P., Gómez
kin V.Yu. // Organometallics 2016. Vol. 35. N 2. P. 218.
de Pedro S., Alonso-Chamarro J., Puyol M. // Tet-
doi 10.1021/acs.organomet.5b00936
rahedron Lett. 2013. Vol. 54. P. 1202. doi 10.1016/j.
tetlet.2012.12.060
24. Luzyanin K.V., Pombeiro A.J.L., Haukka M., Kukush-
kin V.Y. // Organometallics 2008. Vol. 27 N 20. P. 5379.
11. Ryabukhin D.S., Sorokoumov V.N., Savicheva E.A.,
doi 10.1021/om800517c
Boyarskiy V.P., Balova I.A., Vasilyev A.V. // Tetrahedron
Lett. 2013. Vol. 54. P. 2369. doi 10.1016/j.tetlet.2013.02.086
25. Singh C., Prakasham A.P., Gangwar M.K., Ghosh P. //
Chem. Select. 2018. Vol. 3. N 32. P. 9361. doi 10.1002/
12. Savicheva E.A., Kurandina D.V., Nikiforov V.A., Boyar-
slct.201801667
skiy V.P. // Tetrahedron Lett. 2014. Vol. 55. P. 2101. doi
10.1016/j.tetlet.2014.02.044
26. Mikherdov A.S., Novikov A.S., Kinzhalov M.A., Boyar-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
ПОЛУЧЕНИЕ И СВОЙСТВА С,N-ХЕЛАТНЫХ КАРБЕНОВЫХ КОМПЛЕКСОВ ПАЛЛАДИЯ(II)
1579
skiy V.P., Starova G.L., Ivanov A.Y., Kukushkin V.Y. //
31. Михердов А.С., Тюфтяков Н.Ю., Полукеев
Inorg. Chem. 2018. Vol. 57. N 6. P. 3420. doi 10.1021/
В.А., Боярский В.П. // ЖОХ. 2018. T. 88. Вып. 4.
acs.inorgchem.8b00190
C. 631; Mikherdov A.S., Tiuftiakov N.Yu., Polukeev V.A.
27. Tskhovrebov A.G., Luzyanin K.V., Dolgushin F.M.,
Boyarskii V.P. // Russ. J. Gen. Chem. 2018. Vol. 88.
Guedes da Silva M.F.C., Pombeiro A.J.L , Kukush-
N. 4. P. 713. doi 10.1134/S1070363218040151
kin V.Y. // Organometallics 2011. Vol. 30. N 12. P 3362.
32. Михердов А.С., Орехова Ю.А., Боярский В.П. // ЖОХ.
doi 10.1021/om2002574
2018. T. 88. Вып. 10. C. 1677; Mikherdov A.S., Orek-
28. Mikherdov A.S., Kinzhalov M.A., Novikov A.S.,
hova Yu.А., Boyarskii V.P. // Russ. J. Gen. Chem. 2018.
Boyarskiy V.P. , Boyarskaya I.A., Dar’in D.V., Staro-
Vol. 88. N. 10. P. 2119. doi 10.1134/S1070363218100158
va G.L., Kukushkin V.Y. // J. Am. Chem. Soc. 2016.
33. Hindi K. M., Panzner M. J., Tessier C. A., Cannon C. L.,
Vol. 138. N 42. P. 14129. doi 10.1021/jacs.6b09133
Youngs W. J. // Chem. Rev. 2009. Vol. 109. N 8. P. 3859.
29. Mikherdov A.S., Kinzhalov M.A., Novikov A.S.,
doi 10.1021/cr800500u
Boyarskiy V.P., Boyarskaya I.A., Avdontceva M.S.,
Kukushkin V.Yu. // Inorg. Chem. 2018. Vol. 57. N 11.
34. CLSI, Methods for Dilution Antimicrobial Susceptibil-
P. 6722. doi 10.1021/acs.inorgchem.8b01027
ity Tests for Bacteria that Grow Aerobically, Approved
30. Mikherdov A.S., Novikov A.S., Kinzhalov M.A.,
Standard, 9th ed., CLSI document M07-A9, Clinical and
Zolotarev A.A., Boyarskiy V.P. // Crystals. 2018. Vol. 8.
Laboratory Standards Institute, 950 West Valley Road,
N 3. P. 112. doi 10.3390/cryst8030112
Suite 2500, Wayne, Pennsylvania 19087, USA, 2012.
Synthesis and Properties of C,N-Chelated Carbene
Complexes of Palladium(II)
with 2-Aminobenzo[d]thiazole Fragment
A. S. Mikherdova, *, S. V. Baikova, I. K. Proskurinab, A. A. Shetnevb, and A. D. Kotovb
a St. Petersburg State University, Universitetskaya nab. 7-9, St. Petersburg, 199034 Russia
*e-mail: asm93@yandex.ru
b M. Dorogov Center for the Transfer of Pharmaceutical Technologies,
K.D. Ushinskii Yaroslavl State Pedagogical University, Yaroslavl, Russia
Received July 18, 2019; revised July 18, 2019; accepted July 24, 2019
The reaction of bis(cyclohexylisocyanide) complex of Pd(II) with substituted benzo[d]thiazole-2-amines in the
presence of triethanolamine as the base leads to the formation of deprotonated C,N-chelated carbene complexes
with a structure similar to that described previously for the reaction products with unsubstituted benzo[d]-
thiazole-2-amine. The complexes were isolated in pure form and characterized using high resolution mass
spectrometry, IR and NMR spectroscopy (1H, 13C{1H}, 1H-1H COSY, 1H-1H NOESY, 1H-13C HSQC, 1H-13C
HMBC). The resulting complexes exhibit moderate antibacterial activity against sensitive strains of gram-neg-
ative bacteria E. coli (C600) and P. fluorescens (P218), gram-positive bacteria S. aureus (ATCC-25923) and
B. subtillis (VKM B3142D), as well as fungi C. albicans (VKPGU-401/885-653).
Keywords: acyclic diaminocarbene complexes, palladium chelate complexes, isocyanide ligands, antimicro-
bial activity, benzo[d]thiazole-2-amines
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019