ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 10, с. 1587-1594
УДК 661.887
СИНТЕЗ НАНОКРИСТАЛЛИЧЕСКИХ МАТЕРИАЛОВ
НА ОСНОВЕ СИСТЕМЫ Bi2O3-TiO2
© 2019 г. Н. А. Ломановаa, *, М. В.Томковичa, А. В. Осиповb, В. Л. Уголковb
a Физико-технический институт имени А. Ф. Иоффе, ул. Политехническая 26, Санкт-Петербург, 194021 Россия
*e-mail: natus@mail.ioffe.ru
b Институт химии силикатов имени И. В. Гребенщикова Российской академии наук, Санкт-Петербург, Россия
Поступило в Редакцию 22 июля 2019 г.
После доработки 22 июля 2019 г.
Принято к печати 25 июля 2019 г.
Термической обработкой соосажденной композиции синтезированы нанокристаллические тита-
наты висмута Bi2Ti4O11 (115±5 нм), Bi4Ti3O12 (60±5 нм), Bi2Ti2O7 (105±5 нм), Bi8TiO14 (82±5 нм),
Bi12TiO20 (102±5 нм). Установлено, что размер кристаллитов целевого продукта определяется ми-
нимальным размером кристаллитов первой кристаллизующейся фазы в реакционной системе. Опре-
делено, что технологические параметры синтеза и спекания материалов зависят от температуры
плавления поверхностной (неавтономной) фазы. Показано, что на формирование материалов основ-
ное влияние оказывает кинетический фактор, влияние структурных особенностей менее выражено.
Ключевые слова: нанокристаллы, титанат висмута, термическое поведение
DOI: 10.1134/S0044460X19100147
Структурное разнообразие, широкий спектр
му варианту фазовой диаграммы системы Bi2O3-
физико-химических и функциональных свойств
TiO2 [1], Bi4Ti3O12 претерпевает перитектическое
у реализующихся в системе Bi2O3-TiO2 соеди-
разложение при температуре порядка 1210°С с об-
нений дают возможность получать материалы на
разованием Bi2Ti4O11. По более поздним данным
их основе для самых разнообразных технических
[3], точка разложения Bi4Ti3O12 находится немного
приложений. Фазовые соотношения в системе
ниже (1200°С) и это соединение разлагается с об-
Bi2O3-TiO2 описаны в работах [1-3]. В настоящее
разованием Bi2Ti2O7.
время в этой системе установлено наличие следу-
Соединение Bi8TiO14 описано в работе [2], но
ющих соединений: Bi2Ti4O11, Bi4Ti3O12, Bi2Ti2O7,
в ряде других работ (например, [4]) о нем не сооб-
Bi8TiO14, Bi12TiO20.
Соединение Bi2Ti4O11
щается. Авторы [9] наблюдают это соединение до
имеет самую высокую температуру перитекти-
температуры 600°С, выше которой оно разлагается
ческого разложения (1275°С [1]). Существует две
на Bi4Ti3O12 и Bi12TiO20. Проблема обнаружения
модификации этого соединения: низкотемператур-
этого соединения связана с близостью его струк-
ная моноклинная α-форма, которая переходит при
туры к Bi12TiO20 и их сложно различить рентге-
температуре около 233°C в β-форму [4]. По своим
нографически. Поэтому существование Bi8TiO14 в
физическим свойствам α-Bi2Ti4O11 является анти-
достаточно устойчивой форме в настоящее время
сегнетоэлектриком, а в β-фазе находится в пара-
является спорным. Соединение Bi12TiO20 имеет
электрическом состоянии [5, 6].
структуру силленита [10, 11] и разлагается при
температуре около 865°С [2]. Оптические и фото-
Титанат висмута Bi4Ti3O12, имеющий слоистую
перовскитоподобную структуру типа фаз
каталитические свойства силленитов представля-
ют большой интерес и обсуждаются во многих ра-
Ауривиллиуса Am -1Bi2MmO3m+3 (m = 3) с тре-
ботах (см., например, [11]).
мя монооктаэдрическими слоями в перовскито-
подобном блоке [7], применяется как высоко-
Соединение Bi2Ti2O7 со структурой кубическо-
температурный сегнетоэлектрик. Согласно ранне-
го пирохлора [12] в ряде работ [13-15] указыва-
1587
1588
ЛОМАНОВА и др.
Данные об особенностях фазообразования в системе Bi2O3-TiO2
Целевая фаза
Bi:Ti
VZ
Ts, °C
d, нм
Промежуточная фаза
T1, °C
d1, нм
Bi2Ti4O11
2.1:3.9
230
700
115±5
Bi2Ti2O7
600
70±5
Bi2Ti2O7
2.1:1.9
141
650
105±5
Bi2Ti2O7
550
74±5
Bi4Ti3O12
4.3:3.1
237
500
60±5
Bi4Ti3O12
450
35±5
Bi8TiO14
7.8:1.2
520
550
82±5
Bi2O2CO3
400
57±5
Bi12TiO20
11.7:1.1
521
600
102±5
Bi2O2CO3
350
34±5
ется как нестехиометрическое. В работах [13-17]
причиной ошибочных данных о свойствах соеди-
отмечалась ограниченная температурная область
нений. В частности, материалам на основе пирох-
стабильности этого соединения и показано, что
лора Bi2Ti2O7 приписывают сегнетоэлектрические
при 650–700°C оно разлагается с образованием
свойства из-за наличия в продуктах реакции сегне-
Bi4Ti3O12 и Bi2Ti4O11. В работе [18] показана воз-
тоэлектрика Bi4Ti3O12 [25].
можность устойчивого существования Bi2Ti2O7 до
Изучению влияния химической предыстории
750°С.
реакционной системы на фазообразование и по-
Традиционным методом синтеза титанатов
иску физико-химических и термодинамических
висмута является твердофазный [9, 19-23], кото-
факторов, влияющих на формирование и устойчи-
рый, однако, не позволяет получать материалы
вость нанокристаллов различной структуры, в том
при низких температурах, что может нарушать
числе на основе системы Bi2O3-TiO2, посвящены
однородность по составу и строению материалов
работы [32-34]. Дальнейший анализ условий, обе-
вследствие испарения оксида висмута. Особенно
спечивающих получение однофазных материалов
это касается самого высокотемпературного соеди-
на основе титанатов висмута, является актуальной
нения Bi2Ti4O11, твердофазная реакция формиро-
задачей.
вания которого активно протекает выше 1000°С.
Целью представленной работы является опре-
Механическая гомогенизация исходной компози-
деление особенностей формирования нанокри-
ции также может приводить к внесению примесей
сталлов Bi2Ti4O11, Bi4Ti3O12, Bi2Ti2O7, Bi8TiO14,
и неоднородности состава материалов, что ухуд-
Bi12TiO20 и установление параметров синтеза
шает их микроволновые свойства [23]. Как пока-
нанокристаллических материалов на их основе.
зано в работе [24], соединение Bi2Ti2O7 со струк-
Методом термической обработки соосажденной
турой пирохлора сложно получить методом твер-
композиции получены нанопорошки на основе
дофазных химических реакций из-за неопределен-
системы Bi2O3-TiO2. Результаты элементного ана-
ности с областью его устойчивого существования.
лиза (см. таблицу) показали, что соотношение Bi-
В работах [22, 25-31] рассмотрены особенности
Ti хорошо соответствует формулам соединений
низкотемпературных методик синтеза нано-
Bi2Ti4O11, Bi4Ti3O12, Bi2Ti2O7, Bi8TiO14, Bi12TiO20.
кристаллов на основе системы Bi2O3-TiO2.
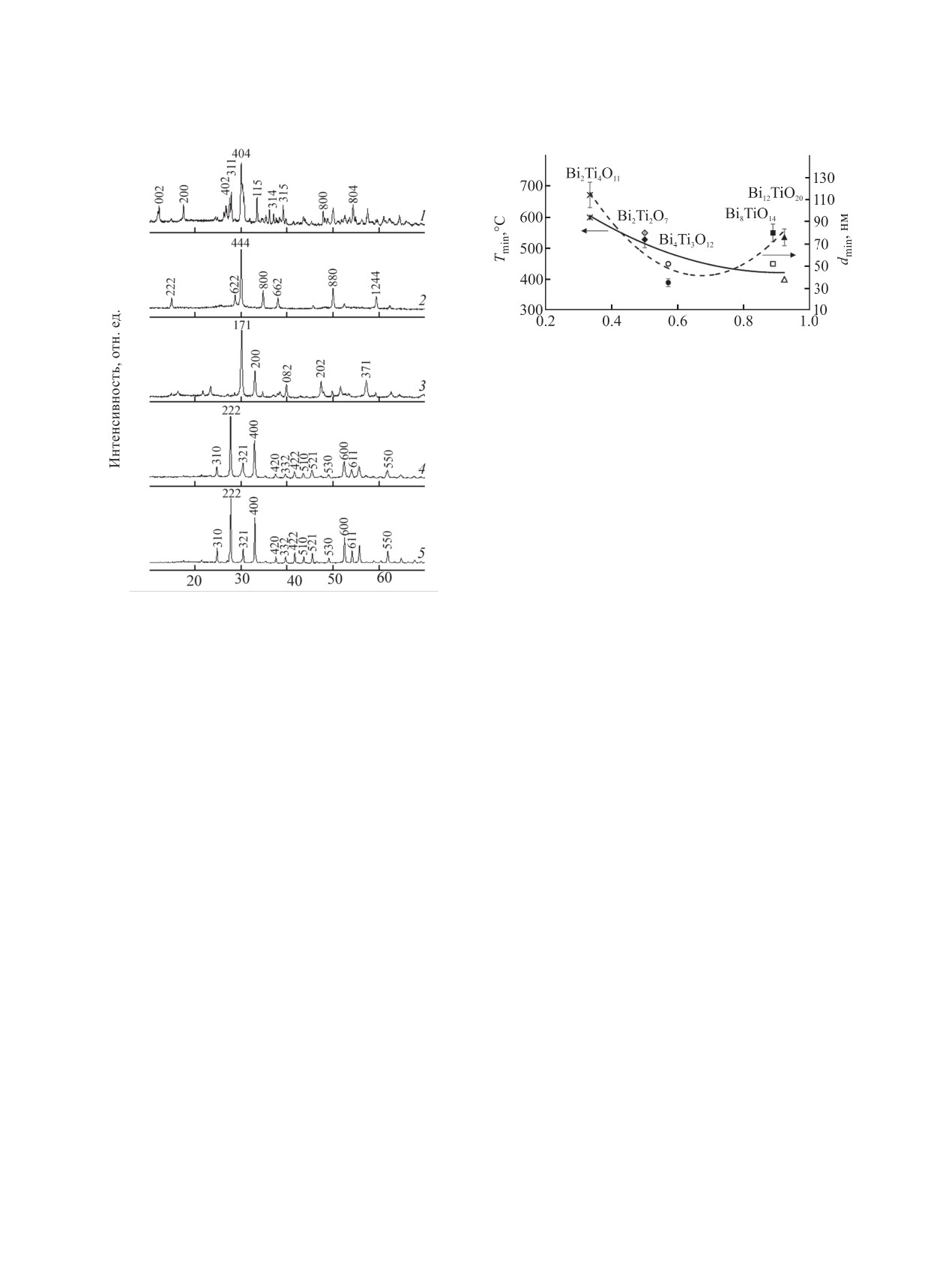
По данным рентгеновской дифрактометрии,
Несмотря на возможность существенного пони-
образцы соосажденных композиций являлись
жения температуры формирования соединения из
рентгеноаморфными. На рис.
1 приведены
нанокристаллической композиции, зачастую его
рентгеновские дифрактограммы образцов после
получают при избыточно высоких температурах
завершающей стадии синтеза, длительность
для того, чтобы избежать формирования вторич-
которой составляла 5 ч, а температура синтеза
ных фаз, влияющих на функциональные свойства
(Ts) определялась индивидуально для каждого
материала. Противоречивая информация о меха-
образца с целью получить нанопорошки
низмах формирования и устойчивости нанокри-
c наименьшим размером кристаллитов d
сталлов Bi2O3-TiO2 затрудняет получение одно-
(см. таблицу). Основные рефлексы на дифракто-
фазных материалов на их основе, а также является
граммах проиндексированы: Bi2Ti4O11 (PDF
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
СИНТЕЗ НАНОКРИСТАЛЛИЧЕСКИХ МАТЕРИАЛОВ
1589
Bi2O3, мол. доля
Рис. 2. Зависимость минимального размера кристал-
литов dmin целевой фазы и температуры ее образова-
ния Tmin от объема формульной единицы содержания
висмута в структуре. x, ӿ - Bi2Ti4O11; ♦, ◊ - Bi2Ti2O7;
●, ○ - Bi4Ti3O12; ■, □ - Bi8TiO14; ▲, ∆ -Bi12TiO20.
промежуточных стадиях синтеза. Так, например,
формирование соединения Bi2Ti4O11 с наиболь-
шим размером кристаллитов (d = 115±5 нм, см.
таблицу) происходит при 700°С через проме-
жуточное соединение со структурой пирохлора
Bi2Ti2O7 (d1 = 70±3 нм, см. таблицу), которое
2θ, град
образовалось в системе при T1 = 600°С. В соот-
Рис.
1. Рентгеновские дифрактограммы образцов
ветствии с этим, величина d целевого продукта
Bi2Ti4O11 (1), Bi2Ti2O7 (2), Bi4Ti3O12 (3), Bi8TiO14 (4),
определяется температурой синтеза Ts и больше
Bi12TiO20 (5).
у тех материалов, синтез которых сопровождался
образованием промежуточной фазы с другой
83-672), Bi2Ti2O7 (PDF 32-118), Bi4Ti3O12 (PDF
структурой и с большей величиной d1.
35-795), Bi8TiO14 (PDF 34-97), Bi12TiO20 (PDF
На рис. 2 показаны зависимости минимально-
34-97). Данные об объеме формульной единицы
(VZ = V/Z, где V - объем элементарной ячейки,
го размера кристаллитов целевого продукта dmin
и температуры его формирования Tmin от содер-
Z - число формульных единиц в элементарной
жания висмута в структуре. Величина Tmin слабо
ячейке) приведены в таблице.
убывает при увеличении содержания висмута в
По данным РФА, формирование Bi2Ti4O11,
системе и для большинства соединений близка к
Bi8TiO14, Bi12TiO20 происходит через серию
температуре плавления поверхностной (двумер-
промежуточных фаз, когда на начальной
ной неавтономной) фазы частиц (450±50°С [35,
стадии в реакционной системе присутствует
36]). При этом наименьшее значение dmin= d1 =
значительное количество рентгеноаморфного
35 нм наблюдается у Bi4Ti3O12, формирование ко-
вещества. На рентгеновских дифрактограммах
торого происходило вблизи этой температуры и
Bi4Ti3O12 и Bi2Ti2O7 после всех этапов синтеза
не сопровождалось образованием промежуточных
другие кристаллические фазы не фиксировались.
фаз (см. таблицу). Соответственно, на заверша-
Данные о сформировавшейся в реакционной
ющей стадии синтеза материал на основе Bi4Ti3O12
системе первой кристаллической фазе, ее тем-
также имеет наименьшее значение d.
пературе кристаллизации (T1) и размерах
Для определения оптимальных условий
кристаллитов (d1) приведены в таблице. Можно
получения материалов на основе системы Bi2O3-
видеть, что от величин T1 и d1 зависят величины
TiO2 были проанализированы зависимости, отра-
Ts и d (характеризующие целевую фазу), т. к. они
жающие изменения относительного среднего
определяются особенностями фазообразования на
объема кристаллитов (υ) и рост доли целевой
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
1590
ЛОМАНОВА и др.
(а)
(б)
T, °C
T, °C
(в)
(г)
T, °C
T, °C
(д)
T, °C
Рис. 3. Изменение степени превращения α и объемной доли υ при увеличении температуры: а - Bi2Ti4O11, б - Bi2Ti2O7,
в - Bi4Ti3O12, г - Bi8TiO14, д-Bi12TiO20. ● - α, ○ - υ.
фазы (α) при повышении температуры (рис. 3).
системы Bi2O3-TiO2, происходит при 450 и 550°С
Полученные закономерности показывают, что
соответственно, и определяется ростом нано-
начало активного образования целевого продукта
кристаллов за счет кристаллизации на них рент-
происходит выше 400°С, т. е. при температурах
геноаморфного вещества (рис. 3). При повышении
выше температуры плавления поверхностной
температуры увеличение доли целевого продукта
(неавтономной) фазы частиц [37, 38], при которой
происходит за счет роста кристаллов. Соединения
активируется массоперенос по границам зерен [39].
Bi12TiO20 и Bi8TiO14 образуются из нанокристал-
Самое высокотемпературное соединение
лического оксикарбоната висмута Bi2O2CO3 и
Bi2Ti4O11 нарушает общую тенденцию, так как
аморфного диоксида титана TiO2 (см. таблицу).
его формирование происходит при повышенных
Начало их кристаллизации происходит при темпе-
температурах вследствие взаимодействия амор-
ратурах около 400 и 450°С соответственно.
фного TiO2 с образовавшимся при более низкой
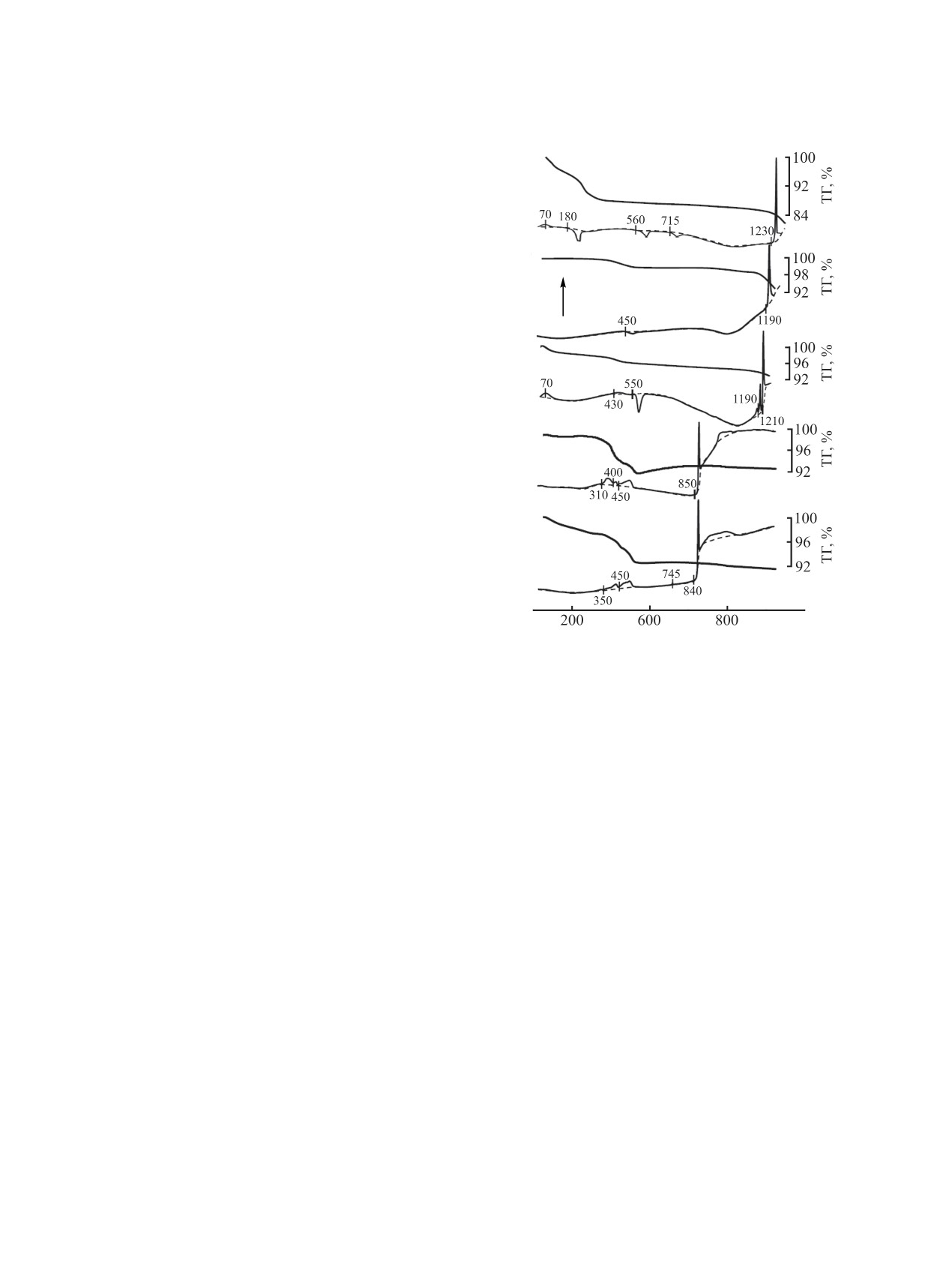
На рис. 4 представлены термограммы (кри-
температуре Bi2Ti2O7. При этом роста кристал-
вые ДСК, ТГ) образцов исходных компози-
ловBi2Ti4O11 за счет процесса перекристаллизации
ций для синтеза соединений Bi2Ti4O11 (1, 1'),
практически не наблюдается (рис. 3а).
Bi2Ti2O7 (2, 2'), Bi4Ti3O12 (3, 3'), Bi8TiO14 (4, 4'),
Образование Bi4Ti3O12 и Bi2Ti2O7, следующих
Bi12TiO20 (5, 5'). Кривая 1, характеризующая про-
по степени термической устойчивости соединений
цесс формирования Bi2Ti4O11, имеет наиболь-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
СИНТЕЗ НАНОКРИСТАЛЛИЧЕСКИХ МАТЕРИАЛОВ
1591
шее количество термических эффектов. Экзо-
1'
термический эффект при 180°С, сопровождаю-
щийся потерей массы (кривая 1'), по-видимому,
связан с процессом окисления оставшихся в ре-
1
акционной системе органических компонентов.
Экзотермические эффекты при 560 и 715°С корре-
2'
лируют по температуре эффектов с данными РФА
(см. таблицу) и свидетельствуют о последователь-
ɷɧɞɨ
ной кристаллизации Bi2Ti2O7 и Bi2Ti4O11 соответ-
2
ственно. Процесс перитектического плавления
3'
Bi2Ti4O11 начинается при 1230°С, сопровождаясь
интенсивным эндотермическим эффектом (кривая
3
1) и потерей массы (кривая 1'). Кристаллизация
Bi4Ti3O12 сопровождается небольшим экзотер-
4'
мическим эффектом при 450°С (кривая 2) после
потери массы (кривая 2'). Интенсивный эндотер-
мический эффект при 1190±5°С, совместно с поте-
4
рей массы, соответствует началу перитектическо-
5'
го плавления этого соединения. Кристаллизация
Bi2Ti2O7 сопровождается экзотермическим пиком
при 550°С (кривая 3), наблюдающимся после поте-
ри массы образцом (кривая 3'). В этой же области
5
температур наблюдается размытый эндотермиче-
ский эффект (430°С), по-видимому, связанный с
T, °C
переходом поверхностной (неавтономной) фазы
Рис.
4. Термический анализ (ДСК/ТГ) исходных
частиц Bi2O3 в жидкоподобное состояние [35, 36].
композиций: 1, 1' - Bi2Ti4O11; 2, 2' - Bi2Ti2O7; 3, 3' -
Данный процесс активирует массоперенос в реак-
Bi4Ti3O12; 4, 4' - Bi8TiO14; 5, 5'- Bi12TiO20.
ционной системе, обеспечивающий начало хими-
ческого взаимодействия компонентов. Следует от-
существенных отличий. В области температур
метить, что при увеличении содержания висмута в
350-450°С совместно с потерей массы (кривые
системе, эндотермические эффекты вблизи 400°С
4', 5') наблюдаются эндотермические эффекты
становятся более выраженными (на кривых ДСК
(кривые
4,
5), связанные с разложением
соединений Bi8TiO14, Bi12TiO20 - кривые 4, 5 со-
остаточных
количеств
нитратов
и с
ответственно), так как увеличивается доля обога-
вышеуказанным переходом поверхностной фазы
щенной высмутом поверхностной фазы.
частиц в жидкоподобное состояние. Начало
Температуры интенсивных эндотермических
кристаллизации этих фаз, судя по данным
эффектов на кривой 3 при 1190 и 1210°С связаны,
РФА, также лежит в этой температурной
по-видимому, с перитектическим плавлением
области, а экзотермический эффект, по-
Bi4Ti3O12 и Bi2Ti2O7 соответственно. Наличие в
видимому, не фиксируется из-за его наложения
образце некоторого количества примесной фазы
с эндотермическим эффектом. На кривой
5
Bi4Ti3O12, вероятно, связано с кристаллизацией
соединения Bi12TiO20 при 745°С присутствует
обогащенной оксидом висмута межзеренной
слабый эндотермический эффект, связанный,
(неавтономной)
фазы вследствие роста
возможно, с фазовым переходом α-β-Bi2O3.
кристаллитов Bi2Ti2O7.
Интенсивные эндотермические эффекты в при
Температурное поведение образцов, состав
840-850°С связаны с плавлением Bi8TiO14 и
которых соответствовал обогащенным висмутом
Bi12TiO20. Следует отметить, что результаты
соединениям Bi8TiO14 и Bi12TiO20, не имеет
термического анализа образцов коррелируют
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
1592
ЛОМАНОВА и др.
115 нм, зависящими от условий термообработ-
ки и минимального размера кристаллитов пер-
вой образующейся фазы в реакционной системе.
Определено, что оптимальные условия синтеза и
спекания материалов на их основе зависят от тем-
пературы плавления поверхностной (неавтоном-
ной) фазы. Показано, что на формирование мате-
риалов основное влияние оказывает кинетический
фактор, а влияние структурных особенностей
менее выражено.
T, °C
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
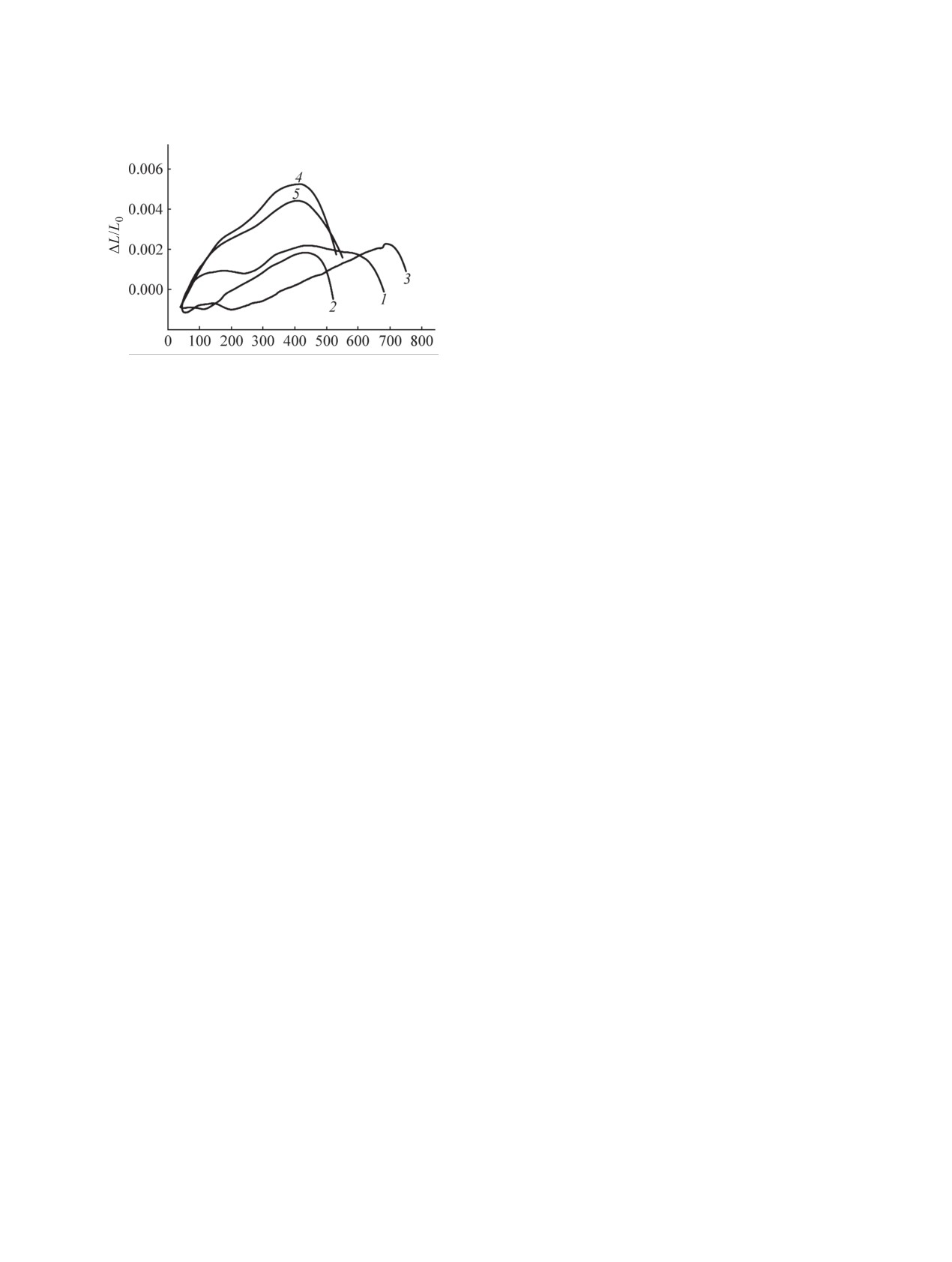
Рис. 5. Дилатометрический анализ образцов Bi2Ti4O11
(1), Bi2Ti2O7 (2), Bi4Ti3O12 (3), Bi8TiO14 (4), Bi12TiO20
Синтез образцов проводили термическим раз-
(5).
ложением смесей, полученных при совместном
соосаждении раствора солей пятиводного нитрата
с данными о фазовых равновесиях в системе
висмута (Ч) и изопропоксида титана (97%) в 25%-
Bi2O3-TiO2 [1-3].
ном водном растворе NH4OH. При этом соотноше-
Спекание полученных материалов исследо-
ние Bi-Ti задавали в соответствии с формулами со-
валось методом дилатометрии (рис. 5). На кри-
единений Bi2Ti4O11, Bi4Ti3O12, Bi2Ti2O7, Bi8TiO14,
вой
∆L/L0 соединения Bi2Ti4O11 наблюдается
Bi12TiO20. Предварительно, нитрат висмута рас-
α-β переход II рода при 230°C (Ts = 233°C [13]).
творяли в разбавленной азотной кислоте с кон-
Из зависимости температуры активации спека-
центрацией 0.1 М. (pH < 2). Изопропоксид титана
ния (Ts*) порошков, определенной по максиму-
растворяли в этиловом спирте, чтобы предотвра-
му кривой ∆L/L0, от величины d целевой фазы
тить преждевременный гидролиз, и добавляли к
следует, что для соединений с d ~100 нм зна-
раствору нитрата висмута до стехиометрического
чение Ts* находится в диапазоне
410-450°C,
соотношения. В приготовленный таким образом
т. е. вблизи температуры плавления поверхност-
прозрачный раствор медленно вливали раствор
ной фазы. Материал на основе Bi4Ti3O12, имею-
аммиака при постоянном перемешивании и вы-
щий наименьшую величину d, начинает спекаться
держивании значения pH > 8 до полного выпаде-
при более высокой температуре, что, по-видимо-
ния осадка. Полученные осадки промывали ди-
му, связано с наложением процесса перекристал-
стиллированной водой и сушили, затем образцы
лизации.
подвергали термообработке в режиме нагрев-изо-
Полученные данные показывают, что на фор-
термическая выдержка-охлаждение в диапазоне
мирование материалов на основе титанатов висму-
350-750°С в зависимости от степени завершенно-
та различной структуры преимущественное влия-
сти синтеза.
ние оказывает кинетический фактор. Для получе-
Микроструктуру и элементный состав образцов
ния нанокристаллических материалов на основе
определяли методом сканирующей электронной
системы Bi2O3-TiO2 целесообразно проводить
микроскопии и энергодисперсионного микроана-
синтез в диапазоне 450-550°С, т. е. вблизи темпе-
лиза (сканирующий электронный микроскоп FEI
ратуры плавления поверхностной фазы. Влияние
Quanta 200 с приставкой EDAX) до их термообра-
структурного фактора проявляется в особенностях
ботки и после нее. Фазовое состояние образцов
фазообразования на различных этапах термообра-
определяли по данным рентгеновской дифракции
ботки, так как размер нанокристаллов целевого
(дифрактометр Shimadzu XRD-7000, излучение
продукта определяется размером кристаллитов
CuKα, λ = 1.54056 Å). Расчет параметров элемен-
промежуточных фаз.
тарных ячеек проводили с использованием про-
Синтезированы нанокристаллы титанатов
граммного комплекса PDWin 4.0. Средние разме-
висмута различной структуры с размерами 60-
ры кристаллитов определяли по формуле Шеррера
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
СИНТЕЗ НАНОКРИСТАЛЛИЧЕСКИХ МАТЕРИАЛОВ
1593
по основным рефлексам. Термическое поведение
9. Joung M.R., Jeong B.-J., Kim J.-S., Woo S.-R., Park
исследовали методом синхронного термического
H.-M., Nahm S. // J. Am. Ceram. Soc. 2014. Vol. 97. P.
2491. doi 10.1111/jace.12959
анализа, включающем дифференциально-сканиру-
ющую калориметрию (ДСК) и термогравиметрию
10. Радаев С.Ф., Симонов В.И. // Кристаллография.
1992. Т. 37. С. 914; Radaev S.F., Simonov V.I. //
(ТГ) на анализаторе NETZSCH STA 429 в диапа-
Kristallografiya. 1992. Vol. 37. P. 914.
зоне 40-1250°С в воздушной среде со скоростью
11. Сарин В.А., Rider E.E., Kanepit V.N., Буданов Н.Н.,
нагрева 10 град/мин. Изменение линейного разме-
Волков В.В., Каргин Ю.Ф., Скориков В.М. //
ра образца определяли на дилатометре NETZSCH
Кристаллография. 1989. Т. 34. С. 628;Sarin V.A.,
DIL 402 E в воздушной среде при скорости нагре-
Rider E.E., Kanepit V.N., Bydanov N.N., Volkov V.V.,
ва 10 град/мин. Использовали образец в форме та-
Kargin Yu.F., Skorikov V.M. // Kristallografiya. 1989.
блетки диаметром 5 мм и толщиной 3 мм.
Vol. 34. P. 628.
ФОНДОВАЯ ПОДДЕРЖКА
12. Hector A.L., Wiggin S.B. // J. Solid State Chem. 2004.
Vol. 177. P. 139. doi 10.1016/S0022-4596(03)00378-5
Работа выполнена при поддержке Российского
13. Kahlenberg V., Bohm H. // J. Alloys Compd. 1995. Vol.
научного фонда (проект № 16-13-10252).
223. P. 142. doi 10.1107/S0108768194004386
КОНФЛИКТ ИНТЕРЕСОВ
14. Watanabe T., Kojima T., Sakai T., Funakubo H., Osada M.,
Noguchi Y., Miyayama M. // J. Appl. Phys. 2002.
Авторы заявляют об отсутствии конфликта
Vol. 92. N 3. P. 1518. doi 10.1063/1.1491594
интересов.
15. Cagnon J., Boesch D.S., Finstrom N.H., Nergiz S.Z.,
Keane S.P., Stemmer S. // J. Appl. Phys. 2007. Vol. 102.
СПИСОК ЛИТЕРАТУРЫ
P. 044102. doi 10.1063/1.2769777
1. Сперанская Е.И., Рез И.С., Козлова Л.В., Скори-
16. Jiang A.Q., Hu Z.X., Zhang L.D. // J. Appl. Phys. 1999.
ков В.М., Славов В.И. // Изв. АН СССР. Сер. Не-
Vol. 85. P. 1739. doi 10.1063/1.369340
орг. матер. 1965. Т. 1. № 2. С. 232; Speranskaya E.I.,
17. Toyoda M., Payne D.A. // Mater. Lett. 1993. Vol. 18.
Rez I.S., Kozlova L.V., Skorikov V.M., Slavov V.I. // Izv.
N 1-2. P. 84. doi 10.1016/0167-577X(93)90062-3
Akad. Nauk SSSR, Ser. Neorg. Mater. 1965. Vol. 1. N
18. Ломанова Н.А., Томкович М.В., Соколов В.В., Угол-
2. P. 232.
ков В.Л. // ЖОХ. 2018. Т. 88. № 12. С. 1937; Lomano-
2. Lu C.-D., Chang L.-S., Lu Y.-F., Lu F.-H. //
va N.A., Tomkovich M.V., Sokolov V.V., Ugolkov V.L. //
Ceram. Int. 2009. Vol. 35. P. 2699. doi 10.1016/j.
Russ. J. Gen. Chem. 2018. Vol. 88. N 12. P. 2459. doi
ceramint.2009.03.001
10.1134/S1070363218120010
3. Esquivel-Elizondo J.R., Hinojosa B.B., Nino J.C. //
19. Морозов М.И., Мезенцева Л.П., Гусаров В.В. // ЖОХ.
Chem. Mater. 2011. Vol. 23. P. 4965. doi 10.1021/
2002. Т. 72. № 7. С. 1038; Morozov M.I., Mezentse-
cm202154c
va L.P., Gusarov V.V. // Russ. J. Gen. Chem. 2002.
4. Lopez-Martineza J., Romero-Serranoa A., Hernandez-
Vol. 72. N 7. P. 1038. doi 10.1023/A:1020734312307
Ramireza A., Zeifert B., Gomez-Yaneza C., Martinez-
20. Fu B.J., Zhang Y.C., Hong M., Jiang F., Cao J.L. // J.
Sanchez R. // Thermochim. Acta 2011. Vol. 516. P. 35.
Mater. Sci. 2013. Vol. 24. P. 3240. doi 10.1007/s10854-
doi 10.1016/j.tca.2011.01.008
013-1234-y
5. Bohm H. // J. Eur. Ceram. Soc. 2007. Vol. 27. N 3-4.
21. Zhou J., Zou Zh., Ray A.K., Zhao X.S. // Ind. Eng. Chem.
P. 887. doi 10.1016/j.jeurceramsoc.2006.04.059
Res. 2007. Vol. 46. N 3. P. 745. doi 10.1021/ie0613220
6. Zhang Y., Zhang Y., Fu B., Hong M., Xiang M. //
22. Ломанова Н.А., Морозов М.И., Уголков В.Л., Гуса-
Ceram. Int. 2015. Vol. 41. P. 10243. doi 10.1016/j.
ров В.В. // Неорг. матер. 2006. Т. 42. № 2. С. 225;
ceramint.2015.04.137
Lomanova N.A., Morozov M.I., Ugolkov V.L., Gusa-
7. Fu B., Zhang Y., Hong M., Jiang F., Cao J. // J. Mater.
rov V.V. // Russ. J. Inorg. Mater. 2006. Vol. 42. N 2.
Sci. 2013. Vol. 24. P. 3240. doi 10.1007/s10854-013-
P. 189. doi 10.1134/S0020168506020142
1234-y
23. Zhang Y., Zhang Y., Fu B., Hong M., Xiang M. //
8. Aurrivillius B. // Ark. Kemi. 1949. Bd 1. N 1. P. 463.
Ceram. Int. 2015. Vol. 41. P. 10243. doi 10.1016/j.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019
1594
ЛОМАНОВА и др.
ceramint.2015.04.137
10.17586/2220-8054-2016-7-3-433-450
24. Knop O., Brisse F. // Can. J. Chem. 1969. Vol. 47.
32. Альмяшева О.В., Гусаров В.В. // ЖОХ. 2010. Т. 80.
P. 971. doi 10.1139/v69-155#.W1cjMMLWi70
№ 3. С. 359; Almjasheva O.V., Gusarov V.V. // Russ.
25. Kolesnik I.V., Lebedev V.A., Garshev A.V. //
J. Gen. Chem. 2010. Vol. 80. N 3. P. 385. doi
Nanosystems: Phys. Chem. Math. 2018. Vol. 9. N 3.
10.17586/2220-8054-2018-9-5-641-662
P. 401. doi 10.17586/2220-8054-2018-9-3-401-409
33. Kovalenko A.N., Tugova E.A. // Nanosystems: Phys.
26. Hou Y., Wang M., Xu X.H., Wang D., Wang H.,
Chem. Math. 2018. Vol. 9. N 5. P. 641. doi 10.1134/
Shang S.X. // J. Am. Ceram. Soc. 2002. Vol. 85. P. 3087.
S0012501609020031
doi 10.1111/j.1151-2916.2002.tb00585.x
34. Almjasheva O.V., Lomanova N.A., Popkov V.I., Pros-
27. Ломанова Н.А., Томкович М.В., Уголков В.Л., Гуса-
kurina O.V., Tugova E.A., Gusarov V.V. // Nanosystems:
ров В.В. // ЖПХ. 2017. Т. 90. № 6. С. 673; Lomano-
Phys. Chem. Math. 2019. Vol. 10. N 4. P. 428. doi
va N.A., Tomkovich M.V., Ugolkov V.L., Gusarov V.V. //
10.17586/2220-8054-2019-10-4-428-437
Russ. J. Appl. Chem. 2017. Vol. 90. N 6. P. 831. doi
35. Ломанова Н.А., Гусаров В.В. // ЖОХ. 2013. Т. 83.
10.1134/S1070427217060015
№ 12. С. 1999; Lomanova N.A., Gusarov V.V. // Russ. J.
28. Valeeva A.A., Kostenko M.G. // Nanosystems: Phys.
Gen. Chem. 2013. Vol. 83. N 12. P. 2251. doi 10.1134/
Chem. Math. 2016. Vol. 8. N 6. P. 816. doi 10.17586/
S1070363213120049
2220-8054-2017-8-6-816-822
36. Lomanova N.A., Gusarov V.V. // Nanosystems: Phys.
29. Almjasheva O.V. // Nanosystems: Phys. Chem. Math.
Chem. Math. 2013. Vol. 4. N 5. P. 696.
2016. Vol. 7. N 6. P. 1031. doi 10.17586/2220-8054-
37. Гусаров В.В., Суворов С.А. // ЖПХ. 1990. Т. 63.
2016-7-6-1031-1049
№ 8. С. 1689; Gusarov V.V., Suvorov S.A. // Russ. J.
30. Ивичева С.Н., Каргин Ю.Ф., Куцев С.В., Ашма-
Appl. Chem. 1990. Vol. 63. N 8. Р. 1479.
рин А.А. // ЖНХ. 2015. Т. 60. № 11. С. 1439; Iviche-
va S.N., Kargin Yu F., Kutsev S.V., Ashmarin A.A. //
38. Gusarov V.V. // Thermochim. Acta. 1995. Vol. 256. N 2.
Russ. J. Inorg. Chem. 2015. Vol. 60. N 11. P.1317. doi
P. 467. doi 10.1016/0040-6031(94)01993-Q
10.1134/S003602361511008X
39. Гусаров В.В. // ЖОХ. 1997. Т. 67. № 12. С. 1959;
31. Bespalova Zh.I., Khramenkova A.V. // Nanosystems:
Gusarov V.V. // Russ. J. Gen. Chem. 1997. Vol. 67.
Phys. Chem. Math. 2016. Vol. 7. N 3. P. 433. doi
N 12. P. 1846. doi 1070-3632/97/6712-1846
Synthesis of Nanocrystalline Materials Based
on the Bi2O3-TiO2 System
N. A. Lomanovaa, *, M. V. Tomkovicha, A. V. Osipovb, and V. L. Ugolkovb
a Ioffe Institute, ul. Politekhnicheskaya 26, St. Petersburg, 194021 Russia
*e-mail: natus@mail.ioffe.ru
bGrebenshchikov Institute of Silicates Chemistry of the Russian Academy of Sciences, St. Petersburg, Russia
Received July 22, 2019; revised July 22, 2019; accepted July 25, 2019
Nanocrystalline bismuth titanates Bi2Ti4O11 (115±5 nm), Bi4Ti3O12 (60±5 nm), Bi2Ti2O7 (105±5 nm), Bi8TiO14
(82±5 nm), Bi12TiO20 (102±5 nm) were synthesized by heat treatment of the coprecipitated composition. It was
established that the crystallites sizes of the obtained materials are determined by the minimum crystallite size
of the first phase, which crystallizes in the reaction system. It was determined that the technological parameters
of the synthesis and sintering of materials depend on the melting point of the surface (non-autonomous) phase.
It is shown that the formation of materials is mainly influenced by the kinetic factor, the influence of structural
features is less pronounced.
Keywords: nanocrystals, bismuth titanate, thermal behavior
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 10 2019