ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 11, с. 1643-1650
УДК 547.518
АЛКИЛИРОВАНИЕ БЕНЗОЛА ЦИКЛООЛЕФИНАМИ
ПОД ДЕЙСТВИЕМ ИОННОЙ ЖИДКОСТИ
[Et3NH]+[Al2Cl7]-
© 2019 г. Р. И. Аминов*, А. С. Мазитова, Р. И. Хуснутдинов
Институт нефтехимии и катализа Российской академии наук, пр. Октября 141, Уфа, 450075 Россия
*e-mail: inklab4@gmail.com
Поступило в Редакцию 19 апреля 2019 г.
После доработки 19 апреля 2019 г.
Принято к печати 25 апреля 2019 г.
Впервые осуществлено алкилирование бензола моно- и бициклическими олефинами под действием
неорганической ионной жидкости [Et3NH]+[Al2Cl7]- с образованием циклоалкилпроизводных бензола
с выходом 58-98%. Установлено, что с увеличением размера цикла олефина повышается селективность
реакции по моноциклоалкилпроизводным.
Ключевые слова: алкилирование, катализ, циклоолефины, бензол, ионные жидкости
DOI: 10.1134/S0044460X19110015
Одной из важных реакций ароматических со-
и сложность выделения целевых продуктов из-за
единений является алкилирование олефинами.
необходимости разложения и нейтрализации реак-
Классическим катализатором алкилирования яв-
ционной массы, что приводит к снижению выхода
ляется безводный хлорид алюминия. В частности,
циклоалкилбензолов. Например, в случае алкили-
AlCl3 используется промышленном синтезе этил-
рования бензола циклопентеном в присутствии
и изопропилбензолов. Так, процесс алкилирова-
AlCl3 выход циклопентилбензола не превышает
ния бензола пропиленом в присутствии AlCl3 про-
70% [10].
ходит при повышенной температуре 130-140°С
В настоящей работе установлено, что неорга-
что способствует протеканию побочных реакций
ническая ионная жидкость [Et3NH]+[Al2Cl7]- явля-
олиго- и полимеризации олефина.
ется эффективным катализатором алкилирования
В последние годы установлено, что альтернати-
бензола моноциклическими (циклопентен, цикло-
вой AlCl3 в реакциях алкилирования, ацилирова-
гексен, циклооктен, циклододецен) и бицикли-
ния могут служить ионные жидкости на его осно-
ческим (норборнен) олефинами с образованием
ве, так как фактически алюминатная ионная жид-
моно-, ди-, три- и тетрациклоалкилпроизводных
кость - это кислота Льюиса, иммобилизованная в
бензола в зависимости от природы субстрата, ус-
фазе ионной жидкости [1-9].
ловий реакции и мольного соотношения исходных
Согласно литературным данным, алкилирова-
реагентов и катализатора.
ние бензола циклоолефинами изучено мало, в боль-
Основные закономерности алкилирования
шинстве случаев реакции проводят с использова-
бензола с помощью циклоолефинов под дей-
нием таких катализаторов, как AlCl3, BF3/H3PO4
ствием неорганической ионной жидкости
[10], Pt-Ag [11], Sc(OTf)3 [12], в больших концен-
[Et3NH]+[Al2Cl7]- изучены на примере циклопен-
трациях (0.2-0.4 моль относительно субстрата).
тена 1. Алкилирование проводили при 0-40°С в
Наиболее часто используемый катализатор
течение 0.5-8 ч при мольном соотношении [1]:[ион-
AlCl3 имеет несколько недостатков: низкая рас-
ная жидкость]:[бензол]
=
(10-30):1:(30-90).
творимость в углеводородах, осмоление олефина
Продуктами реакции являются циклопентилбен-
1643
1644
АМИНОВ и др.
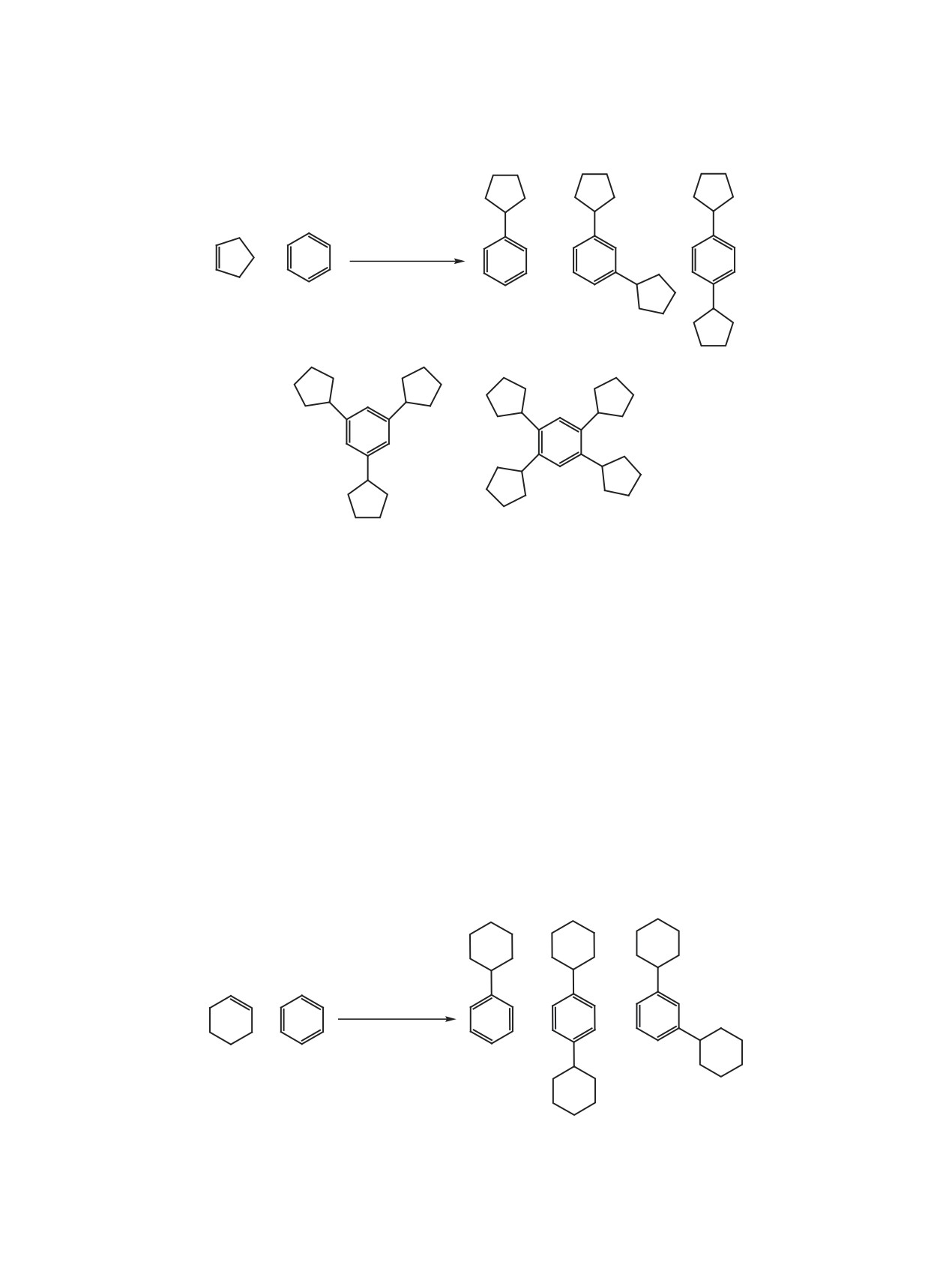
Схема 1.
[Et3NH]+[Al2Cl7]
+
+
+
1
2
3
4
+
+
5
6
зол 2, 1,3- (3) и 1,4-дициклопентилбензолы (4),
ход (69%) соединения 6 наблюдается при моль-
1,3,5-трициклопентилбензол 5, а также 1,2,4,5-те-
ном соотношении [1]:[ионная жидкость] = 100:1
трациклопентилбензол 6 (схема 1), соотношение
(табл. 1, оп. № 5). Следует особо отметить, что
которых зависит от условий реакции и концентра-
данные о синтезе и физико-химических свойствах
ции исходных реагентов.
1,2,4,5-тетрациклопентилбензола 6 в литературе
отсутствуют.
Установлено, что при проведении реакции при
0°С в течение 8 ч при мольном соотношении оле-
На следующем этапе работы мы исследовали
фина 1 к ионной жидкости, равном 10:1, наблюда-
алкилирование бензола с помощью циклогексе-
ется максимальный выход циклопентилбензола 2,
на 7 под действием [Et3NH]+[Al2Cl7]- (схема 2).
93% (табл. 1, оп. № 3). При увеличении концен-
Максимальный выход циклогексилбензола 8 (58%)
трации циклопентена 1 {[1]:[ионная жидкость]
был достигнут при проведении реакции при 20°С
= (10–100):1} происходит снижение выхода ци-
в течение 8 ч при мольном соотношении циклогек-
клопентилбензола 2 до 13% и увеличение выхода
сена 7 к ионной жидкости, равном 100:1 (табл. 2,
тетрациклопентилбензола 6. Максимальный вы-
оп. № 9). Кроме циклогексилбензола 8, в реакци-
Схема 2.
[Et3NH]+[Al2Cl7]
+
+
+
7
8
9
10
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
АЛКИЛИРОВАНИЕ БЕНЗОЛА ЦИКЛООЛЕФИНАМИ
1645
Таблица 1. Алкилирование бензола циклопентеном под действием [Et3NH]+[Al2Cl7]-
Выход, % а
№ опыта
Соотношение [1]:[ионная жидкость]
Т, °С
Время, ч
2
3+4
5
6
1
2:1
0
0.5
79
20
1
-
2
2:1
0
1.0
95
5
-
-
3
2:1
0
8.0
98
2
-
-
4
10:1
0
0.5
49
23
28
-
5
10:1
0
1.0
52
22
26
-
6
10:1
0
2.0
61
19
20
-
7
10:1
0
8.0
93
6
1
-
8
10:1
20
0.5
46
35
19
-
9
10:1
20
1.0
49
33
18
-
10
10:1
20
2.0
53
32
15
-
11
10:1
20
8.0
56
31
13
-
12
10:1
40
0.5
66
23
11
-
13
10:1
40
1.0
93
7
-
-
14
10:1
40
2.0
98
2
-
-
15
10:1
40
8.0
99
1
-
-
16
100:1
0
0.5
6
10
23
61
17
100:1
0
1.0
8
7
22
63
18
100:1
0
2.0
11
4
21
64
19
100:1
0
8.0
13
5
13
69
а Определяли с помощью ГЖХ-анализа с использованием н-бутилбензола в качестве внутреннего стандарта.
онной смеси присутствуют 1,4- (9) и 1,3- дицикло-
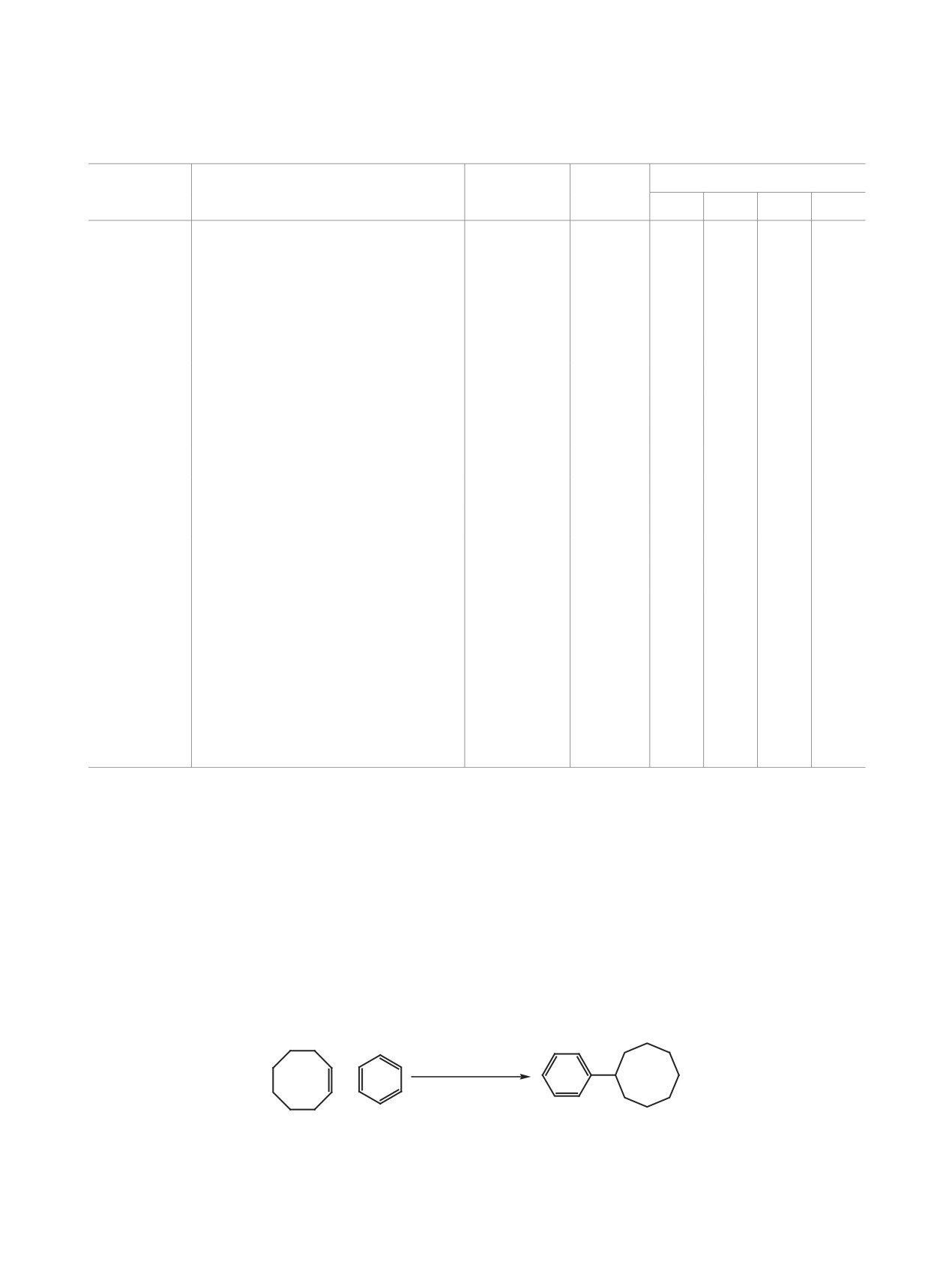
вании бензола циклооктеном 11 (схема 3). Реакция
гексилбензолы (10), общий выход которых состав-
циклооктена 11 с бензолом отличается высокой се-
ляет 42%. Высокий выход бензолов 9 и 10 (72%)
лективностью по [1+1]-аддукту 12. Оптимальными
был достигнут при выдерживании реакционной
условиями алкилирования бензола циклооктеном
массы при 0°С в течение 30 мин (табл. 2, оп. № 10).
11 являются: температура - 20°С, время реак-
Дальнейшими исследованиями, установлено,
ции - 0.5 ч, мольное соотношение [углеводород
что ионная жидкость [Et3NH]+[Al2Cl7]- может слу-
11]:[ионная жидкость] = 30:1 (табл. 3, оп. № 2). В
жить эффективным катализатором при алкилиро-
этих условиях выход соединения 12 составил 82%.
Схема 3.
[Et3NH]+[Al2Cl7]
+
11
12
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
1646
АМИНОВ и др.
Таблица 2. Алкилирование бензола циклогексеном под
Таблица 3. Алкилирование бензола циклооктеном под
действием [Et3NH]+[Al2Cl7]-
действием [Et3NH]+[Al2Cl7]-
а
Соотношение
Выход, %
№
Соотношение [11]:
Т,
Время,
Выход 12,
№
Время,
[7]:[ионная
Т, °С
опыта
[ионная жидкость]
°С
ч
%
опыта
ч
жидкость]
8
9+10
1
10:1
20
8.0
72
1
10:1
20
3.0
44
66
2
30:1
20
0.5
82
2
10:1
20
8.0
47
53
3
30:1
20
1.0
65
3
30:1
20
1.0
30
70
4
30:1
20
3.0
60
5
30:1
20
6.0
57
4
30:1
20
2.0
45
55
6
30:1
20
8.0
31
5
30:1
20
8.0
56
44
7
50:1
0
0.5
33
6
30:1
0
0.5
38
62
8
50:1
0-5
1.0
38
7
30:1
0
1.5
42
58
9
50:1
0-5
2.0
44
8
30:1
0
8.0
45
55
10
100:1
20
0.5
55
11
100:1
20
1.5
48
9
100:1
20
8.0
58
42
12
100:1
20
2.0
43
10
100:1
0
0.5
28
72
13
100:1
0
0.5
19
11
100:1
0
2.0
45
55
14
100:1
0
1.5
21
12
100:1
0
3.0
54
46
15
100:1
0
8.0
29
13
100:1
0
8.0
57
43
16
100:1
40
8.0
20
а По данным ГЖХ-анализа.
17
200:1
20
2.0
12
При уменьшении соотношения [11]:[ионная жид-
при мольном соотношении
[циклододецен]:
кость] = (10-200):1 наблюдается снижение выхода
[ионная жидкость]:[бензол] = (10-30):1:(30-90)
соединения 12 до 12 % из-за осмоления и образо-
(табл. 4).
вания побочных продуктов.
Максимальный выход
(98%) циклододецил-
Следует отметить, что в литературе отсутству-
бензола 14 наблюдается при проведении реакции
ют примеры синтеза циклооктилбензола 12 пря-
при 40°С в течение 6 ч при мольном соотношении
мой реакцией циклооктена с бензолом.
[13]:[ионная жидкость] = 20:1 (табл. 4, оп. № 5).
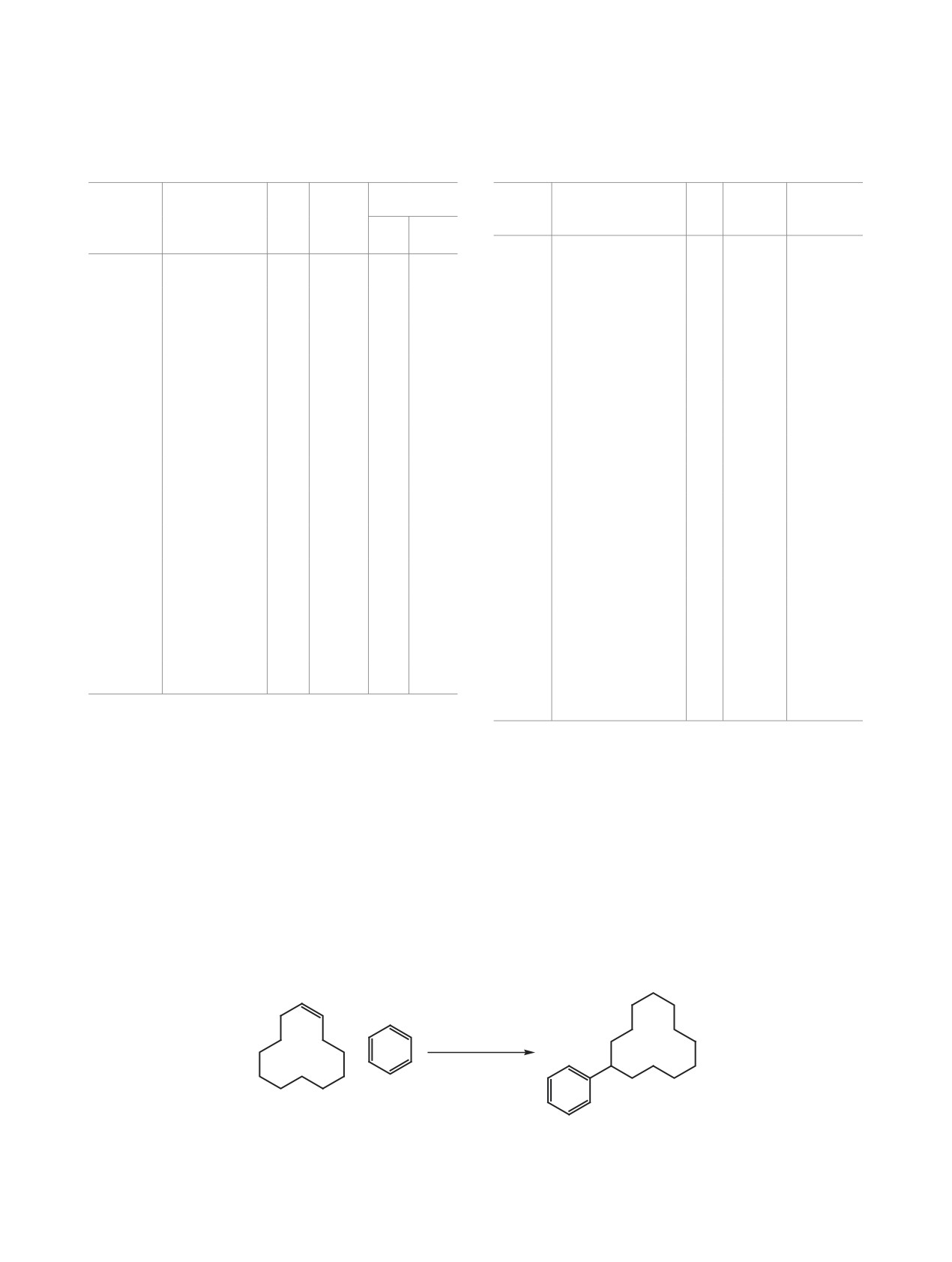
Очень активно реагирует с бензолом в присут-
При уменьшении количества ионной жидкости
ствии [Et3NH]+[Al2Cl7]- циклододецен 13 (схема 4).
{[ионная жидкость]:[13] = 1:(50-100)} происходит
Реакции проходят при 20-40°С в течение 6-8 ч
снижение выхода соединения 14, а при увеличе-
Схема 4.
[Et3NH]+[Al2Cl7]
+
ɰɢɫ ɬɪɚɧɫ 13
14
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
АЛКИЛИРОВАНИЕ БЕНЗОЛА ЦИКЛООЛЕФИНАМИ
1647
Таблица 4. Алкилирование бензола циклододеценом
Таблица 5. Алкилирование бензола норборненом под
под действием [Et3NH]+[Al2Cl7]-
действием [Et3NH]+[Al2Cl7]-
№
Соотношение [13]:
Т,
Время,
Выход 14,
№
Соотношение [15]:
Т,
Время,
Выход 16,
опыта
[ионная жидкость]
°С
ч
%
опыта
[ионная жидкость]
°С
ч
%
1
10:1
20
8
55а
1
10:1
20
0.03
53а
2
10:1
40
8
62а
2
10:1
20
0.50
53а
3
20:1
20
8
94
3
10:1
20
6.00
78а
4
20:1
20
16
95
4
10:1
40
8.00
47а
5
20:1
40
6
98
5
50:1
20
8.00
44а
6
20:1
40
8
83а
6
50:1
0
0.50
46
7
50:1
20
8
30
7
50:1
0
1.00
78
8
50:1
40
8
25
8
50:1
0
8.00
49а
9
100:1
20
8
15
9
100:1
0
0.50
55
10
100:1
40
8
20
10
100:1
0
1.00
46
11
100:1
80
8
22
11
100:1
0
8.00
40а
а Осмоление.
а Образование побочных продуктов.
нии (1:10) возрастает выход смолообразных про-
алкилирование нафталина и антрацена при
дуктов.
20-40°C в течение 8 ч не проходит. Образование
незначительных количеств (~10%) циклопентил-
Описанный в литературе синтез циклододе-
нафталина и циклопентилантрацена наблюдается
цилбензола 14 основан на алкилировании бензо-
ла циклододецилмезилатом, который получают в
в жестких условиях (120°С, 10 ч). При этом 50%
циклопентена превращается в димеры, тримеры
3 стадии из циклододецена (эпоксидирование, ги-
и высшие олигомеры, что затрудняет выделение
дрирование, метансульфонирование) [13].
целевых циклоалкилпроизводных нафталина и ан-
Таким образом, экспериментально установле-
трацена. Попытка алкилирования пиридина была
но, что при алкилировании бензола под действием
также неудачной из-за образования комплекса с
ионной жидкости с увеличением размера цикла
катализатором и его дезактивации.
олефина наблюдается повышение селективности
Таким образом, впервые осуществлено алкили-
реакции по моноциклоалкилпроизводным, что,
рование бензола с помощью циклопентена, цикло-
возможно, связано со стерическими факторами.
гексена, циклооктена, циклододецена и норборне-
В дальнейшем было интересно выяснить, как
на под действием неорганической ионной жидко-
поведут себя в аналогичной реакции бицикличе-
сти [Et3NH]+[Al2Cl7]- с образованием циклоалкил-
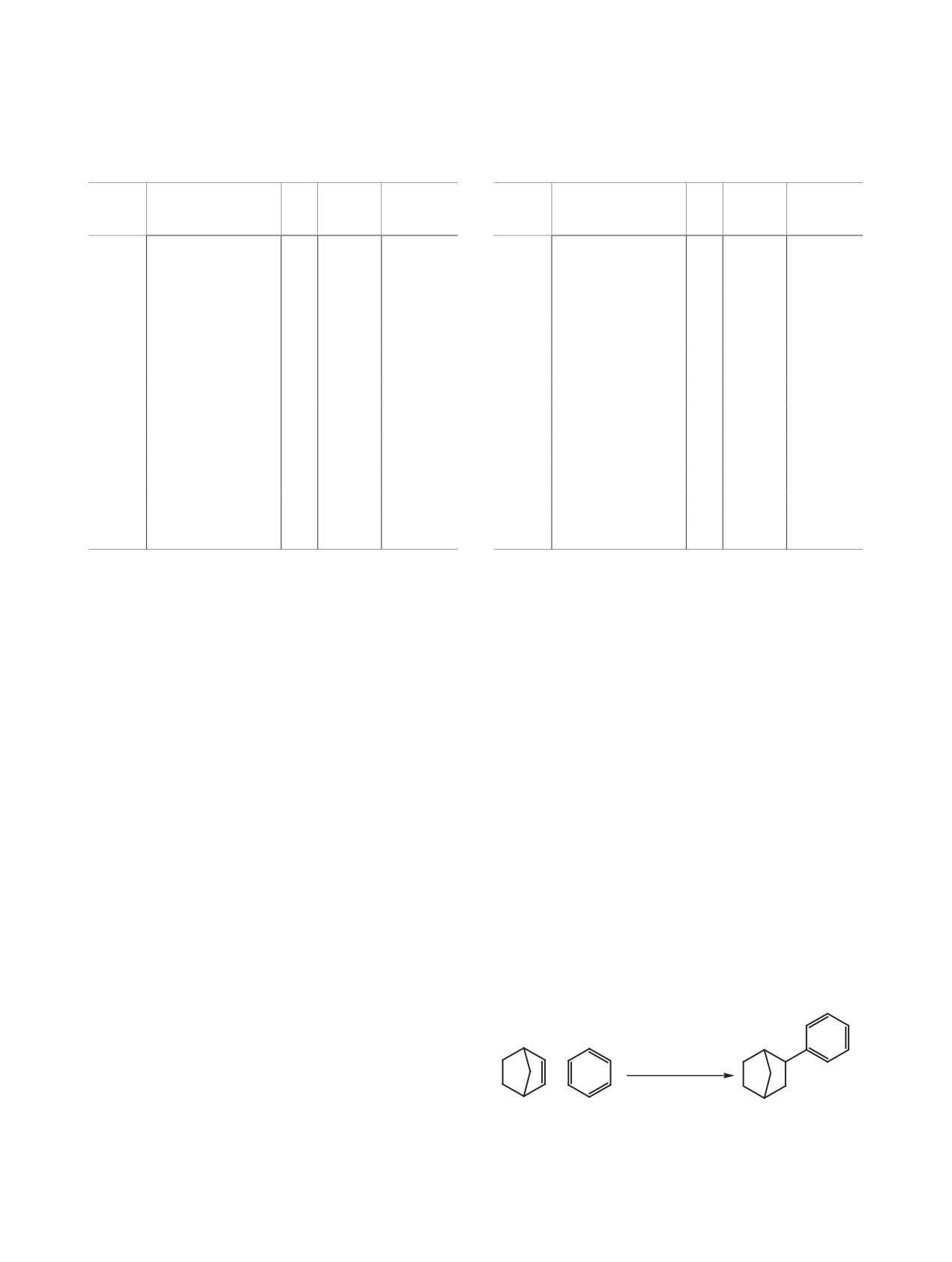
ские олефины. Установлено, что при взаимодей-
производных бензола с выходом 58-98%.
ствии бицикло[2.2.1]гепт-2-ена (норборнена) 15 с
бензолом под действием неорганической ионной
жидкости [Et3NH]+[Al2Cl7]- образуется 2-норбор-
Схема 5.
нилбензол 16 (схема 5). Максимальный выход сое-
динения 16 составляет 78% при проведении реак-
ции при 20°С в течение 6 ч (табл. 5).
[Et3NH]+[Al2Cl7]
Далее мы попытались осуществить алкилиро-
+
вание циклопентеном нафталина, антрацена и пи-
ридина под действием [Et3NH]+[Al2Cl7]-. Однако
15
16
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
1648
АМИНОВ и др.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1,3-Дициклопентилбензол (3). Спектр ЯМР
), 1.84-1.88
1Н, δ, м. д.: 1.61-1.69 м (8Н, С3,4,14,15Н2
Спектры ЯМР 1H, 13С зарегистрированы на
м (8Н, С2,5,13,16Н2), 3.10-3.23 м (2Н, С1,12Н), 6.84-
приборе Bruker Avance-III 400 Ascend [400 (1Н) и
7.39 м (4Н, С7,9,10,11Н). Спектр ЯМР 13С, δС, м. д.:
100 МГц (13С)] в CDCl3. Масс-спектры сняты на
28.27 (С3,4,14,15), 32.43 (С2,5,13,16), 42.37 (С1,12),
приборе Shimadzu GCMS-QP2010Plus (капилляр-
124.96 (С7), 125.18 (С9,11), 128.51 (С10),
143.21
ная колонка SPB-5 30 м × 0.25 мм, газ носитель -
(С8,6). Масс-спектр, m/z (Iотн, %): 214(66) [M]+,
гелий, температура программирования от 40 до
172(9), 159(9), 146(30), 145(100), 129(16), 128(15),
300°С со скоростью 8 град/мин, температура испа-
115(21), 69(18), 41(20).
рения - 280°С, температура ионного источника -
1,4-Дициклопентилбензол (4). Спектр ЯМР
200°С, энергия ионизации - 70 эВ). Ход реакции и
1Н, δ, м. д.: 1.84-1.88 м (8Н, С3,4,14,15Н2), 1.98 м
чистоту полученных соединений контролировали
(8Н, С2,5,13,16Н2), 2.89-2.98 м (2Н, С1,12Н), 6.65-
методом газо-жидкостной хроматографии на при-
7.48 м (4Н, С7,8,10,11Н). Спектр ЯМР 13С, δС, м.
боре Shimadzu GC-9A, GC-2014 [колонка 2 м × 3 мм,
д.: 27.72 (С3,4,14,15), 33.38 (С2,5,13,16), 47.71 (С1,12),
неподвижная фаза
- силикон SE-30
(5%) на
127.16 (С7,8,10,11), 142.16 (С9,6). Масс-спектр, m/z
Chromaton N-AW-HMDS, температурный режим
(Iотн, %): 214(52) [M]+, 172(10), 146(23), 145(100),
от 50 до 270°С со скоростью 8 град/мин, газ-
129(15), 117(53), 115(17), 91(46), 67(9), 41(14).
носитель - гелий (47 мл/мин)], внутренний стан-
дарт н-бутилбензол. Элементный состав образцов
Найдено, %: C 90.04; H 9.96. C16H22. Вычислено,
%: C 89.65; H 10.35.
определяли на элементном анализаторе Carlo Erba
1106.
1,3,5-Трициклопентилбензол (5) [17]. Выход
Хлоралюминантную ионную жидкость получа-
13%, т. кип. 150-156°С (0.5 мм рт. ст.). Спектр
ли по известной методике [14, 15].
ЯМР 1Н, δ, м. д.: 1.65-1.79 м (12Н, С3,4,14,15,19,20Н2),
1.87-2.07 м (12Н, С2,5,13,16,18,21Н2), 2.89-3.01 м (3Н,
Общая методика алкилирования бензола
С1,12,17Н), 6.81 с (3Н, С7,9,11Н). Спектр ЯМР13С,
с помощью циклических олефинов под дей-
δС, м. д.: 23.83 (С3,4,14,15,19,20), 32.04 (С2,5,13,16,18,21),
ствием неорганической ионной жидкости
41.86 (С1,12,17), 122.53 (С7,9,11), 142.15 (С6,8,10).
[Et3NH]+[Al2Cl7]-. В стеклянный реактор (V =
Масс-спектр, m/z (Iотн, %): 282(85) [M]+, 227(5),
50 мл) под аргоном загружали 2-100 ммоль цикли-
213(100), 212(6), 214(24), 159(10), 145(39), 91(18),
ческого олефина и 1 ммоль неорганической ион-
69(29), 41(20).
ной жидкости [Et3NH]+[Al2Cl7]-. Реакцию прово-
дили в бензоле при постоянном перемешивании
1,2,4,5-Тетрациклопентилбензол (6). Выход
при 0-40°С в течение 0.5-8 ч. После окончания ре-
68%, т. пл. 259-263°С. Спектр ЯМР 1Н, δ, м. д.:
акции смесь фильтровали через слой оксида алю-
1.63 м (16Н, С3,4,14,15,19,20,24,25Н2), 1.86 м (16Н,
миния. Растворитель отгоняли, жидкие продукты
С2,5,13,16,18,21,23,26Н2), 2.81 м (4Н, С1,12,17,22Н), 6.94
реакции выделяли из реакционной массы вакуум-
м (2Н, С8,11Н). Спектр ЯМР 13С, δС, м. д.: 27.48
ной перегонкой, твердые - перекристаллизацией.
(С3,4,14,15,19,20,24,25), 33.25 (С2,5,13,16,18,21,23,26), 38.95
Циклопентилбензол
(2)
[16]. Выход
94%,
(С1,12,17,22), 124.83 (С8,11), 139.80 (С6,7,9,10). Масс-
т. кип. 51-52°С (1 мм рт. ст.). Спектр ЯМР 1Н, δ,
спектр, m/z (Iотн, %): 350(100) [M]+, 321(4), 281(60),
м. д.: 1.66-1.79 м (4H, С3,4H2), 1.87-2.00 м (4Н,
145(17), 129(11), 69(22), 67(12), 41(19). Найдено,
С2,5H2), 3.01-3.18 м (1Н, С1Н), 7.23-7.44 м (5Н,
%: C 88.94; H 11.06. C26H38. Вычислено, %: C
С7-11Н). Спектр ЯМР13С, δС, м. д.: 27.72 (С3,4),
89.07; H 10.93.
32.82 (С2,5), 42.88 (С1), 126.31 (С9), 127.58 (С7,11),
Циклогексилбензол
(8)
[13]. Выход
58%,
128.41 (С8,10), 145.82 (С6). Масс-спектр, m/z (Iотн,
т. кип. 63-65°С (1 мм рт. ст.). Спектр ЯМР 1Н, δ,
%): 146(55) [M]+, 145 (3), 131 (11), 118 (22), 117
м. д.: 1.42 м (6Н, С2,4,6Н2), 1.86 м (4Н, С3,5Н2), 2.56
(100), 116 (6), 115 (20), 104 (99), 91 (47), 78 (13).
м (1Н, С1Н), 7.26 м (5Н, С8-12Н). Спектр ЯМР 13С,
1,3-Дициклопентилбензол (3) и 1,4-дицикло-
δС, м. д.: 26.55 (С4), 27.3 (С3,5), 35.1 (С2,6), 45.2 (С1),
пентилбензол (4). Выход 31%, т. кип. 111-116°С
126.1 (С10), 127.3 (С8,12), 128.4 (С9,11), 147.8 (С7),
(0.8 мм рт. ст.).
Масс-спектр, m/z (Iотн, %): 160(49) [M]+, 117(59),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
АЛКИЛИРОВАНИЕ БЕНЗОЛА ЦИКЛООЛЕФИНАМИ
1649
115(14), 105(15), 104(100), 103(8), 91(45), 78(8),
м (2Н, С6Н2), 2.20 м (2Н, С1,4Н), 2.94 м (1Н, С2Н),
77(6), 41(6).
7.09-7.16 м (5Н, С9-13Н). Спектр ЯМР 13С, δС, м. д.:
28.81 (С6), 29.59 (С7), 34.54 (С3), 36.34 (С4), 39.24
1,4-Дициклогексилбензол (9) и 1,3-дицикло-
гексилбензол (10) [18]. Выход 42%, т. кип. 133-
(С5), 40.90 (С2), 41.12 (С1), 126.19 (С11), 127.08
138°С (0.5 мм рт. ст.).
(С9,13), 128.05 (С10,12), 145.77 (С8). Масс-спектр,
m/z (Iотн, %): 172(38) [M]+, 129(11), 117(12), 115(16),
1,4-Дициклогексилбензол (9). Спектр ЯМР 1Н,
105(20), 104(100), 92(47), 81(32), 79(10), 67(19).
δ, м. д.: 1.35 м (4Н, С4,16Н2), 1.57 м (8Н, С2,6,14,18Н2),
1.83 м (8Н, С3,5,15,17Н2), 2.49 м (2Н, С1,3Н), 7.14 м
ФОНДОВАЯ ПОДДЕРЖКА
(4Н, С8,9,11,12Н). Спектр ЯМР 13С, δС, м. д.: 26.3
(С4,16), 27.1 (С3,5,15,17), 34.6 (С2,6,14,18), 44.2 (С1,13),
Работа выполнена при финансовой поддержке
126.5 (С8,9,11,12), 145.3 (С7,10). Масс-спектр, m/z
Российского фонда фундаментальных исследова-
(Iотн, %): 242(100) [M]+, 243(18), 186(19), 173(13),
ний (№17-43-020155 р_а) в рамках государствен-
160(15), 159(67), 129(13), 105(13), 91(44), 41(14).
ного задания Министерства образования и науки
1,3-Дициклогексилбензол (10). Спектр ЯМР
(№ АААА-А19-119022290009-3) и Программы
1Н, δ, м. д.: 7.15 м (4Н), 2.49 т (2Н, J = 7.2 Гц),
для поддержки молодых российских ученых -
1.87 м (8Н), 1.55 м (8Н), 1.36 м (4Н). 1.36 м (4Н,
стипендия Президента Российской Федерации
С4,16Н2), 1.55 м (8Н, С2,6,14,18Н2), 1.87 м (8Н,
(СП-1601.2018.1). Исследование структуры синте-
С3,5,15,17Н2), 2.49 т (2Н, С1,13Н, J = 7.6 Гц), 7.15 м
зированных соединений выполнено с использова-
(4Н, С8,10-12Н). Спектр ЯМР 13С, δС, м. д.: 26.77
нием оборудования Регионального центра коллек-
(С4,16), 27.86 (С3,5,15,17), 35.76 (С2,6,14,18),
43.47
тивного пользования «Агидель» (Институт нефте-
(С1,13), 124.08 (С8), 124.74 (С10,12), 128.69 (С11),
химии и катализа РАН).
144.44 (С7,9). Масс-спектр, m/z (Iотн, %): 242(100)
КОНФЛИКТ ИНТЕРЕСОВ
[M]+, 186(16), 173(9), 159(61), 129(18), 117(63),
91(47), 83(28), 55(26), 41(12).
Авторы заявляют об отсутствии конфликта
Циклооктилбензол
(12)
[19]. Выход
70%,
интересов.
т. кип. 94-96°С (1 мм рт. ст.). Спектр ЯМР 1Н, δ,
СПИСОК ЛИТЕРАТУРЫ
м. д.: 1.16 м (4Н, С4,6Н2), 1.23 м (4Н, С3,7Н2), 1.48
м (2Н, С5Н2), 1.93 м (4Н, С2,8Н2), 2.59 м (1Н, С1Н),
1. Koch V.R., Miller L.L., Osteryoung R.A. // J. Am. Chem.
7.20 м (5Н, С10-14Н). Спектр ЯМР 13С, δС, м. д.:
Soc. 1976. Vol. 98. P. 5277. doi 10.1021/ja00433a037
26.49 (С5), 26.83 (С6,4), 26.96 (С3,7), 34.62 (С2,8),
2. Qiao K., Deng Y. // J. Mol. Catal. (A). 2001. Vol. 17.
37.92 (С1), 125.45 (С12), 126.96 (С10,14),
128.26
P. 81. doi 10.1016/s1381-1169(01)00107-8
(С11,13), 145.96 (С9). Масс-спектр, m/z (Iотн, %):
3. Wilkes J.S., Frye J.S., Reynolds G.F. // Inorg. Chem.
188(80) [M]+, 131(31), 118(27), 117(40), 104(100),
1983. Vol. 22. P. 3870. doi 10.1021/ic00168a011
92(31), 91(84).
4. Xin H., Wu Q., Han M., Wang D., Jin Y. // Appl.
Циклододецилбензол (14) [13]. Выход 98%,
Catal. (A). 2005. Vol. 292. P. 354. doi 10.1016/j.
т. пл. 42-43°С. Спектр ЯМР 1Н, δ, м. д.: 0.74 м
apcata.2005.06.012
(6Н, С6,7,8Н2), 0.95 м (4Н, С5,9Н2), 1.10-1.12 м (8Н,
5. Sun X.W., Thao S.Q. // Pet. Sci. 2011. Vol. 8. P. 495. doi
С3,4,10,11Н2), 1.89 м (4Н, С2,12Н2), 2.55 м (1Н, С1Н),
10.1007/s12182-011-0167-4
7.19-7.22 м (5Н, С14-18Н). Спектр ЯМР 13С, δС,
6. Kim D.S., Ahn W.S. // Korean J. Chem. Eng. 2003.
м. д.: 22.75 (С7), 23.22 (С5,9), 23.51 (С6,8), 23.90
Vol. 20. P. 39. doi 10.1007/bf02697182
(С4,10), 23.97 (С3,11), 31.59 (С2,12), 47.30 (С1), 127.32
7. Boon J.A., Levisky J.A., Pflug J.L., Wilkes J.S. // J. Org.
(С16), 127.66 (С14,18), 128.08 (С15,17), 144.81 (С13).
Chem. 1986. Vol. 51. P. 480. doi 10.1021/jo00354a013
Масс-спектр, m/z (Iотн, %): 244(80) [M]+, 131(31),
8. Adams C.J., Earle M.J., Seddon K.R. // Chem. Commun.
118(27), 117(40), 104(100), 92(31), 91(84).
1998. P. 2097. doi 10.1039/a805599h
2-Норборнилбензол
(16)
[19]. Выход
78%,
9. Xin-hua Y., Min C., Qi-xun, D., Xiao-nong C. //
т. кип. 123°С (10 мм рт. ст.). Спектр ЯМР 1Н, δ,
Chem. Eng. J. 2009. Vol. 146. P. 266. doi 10.1016/j.
м. д.: 1.21 м (4Н, С3,7Н2), 1.56 м (2Н, С5Н2), 1.78
cej.2008.09.022
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
1650
АМИНОВ и др.
10. Завгородний С.В., Овчинников В.Г., Овчинникова Г.К.,
15. Kumara R., Kumarb A., Khannab A. // Catal. Ind. 2015.
Мраморнова С.А., Басс С.И. // Нефтехимия 1972.
Vol. 7. P. 188. doi 10.1134/S2070050415030095
Т. 12. С. 201.
16. Bedford R.B., Brenner P.B., Carter E., Carvell T.W.,
11. Karshtedt D., Bell A.T., Tilley T.D. // Organometallics
Cogswel, P.M., Gallagher T., Pye D.R. // Chem. - A Eur. J.
2004. Vol. 18. P. 4169. doi 10.1021/om0495325
2014. Vol. 20. P. 7935. doi 10.1002/chem.201402174
12. Qiao K., Yokoyama C. // Chem. Lett. 2004. Vol. 33.
17. Salvi L., Davis N.R., Ali S.Z., Buchwald S.L. // Org. Lett.
P. 472. doi 10.1246/cl.2004.472
2011. Vol. 14. P. 170. doi 10.1021/ol202955h
13. Singh R.P., Kamble R.M., Chandra K.L., Saravanan
18. Kloppenburg L., Jones D., Bunz U.H.F. // Macromol.
P., Singh V.K. // Tetrahedron. 2001. Vol. 57. P. 241. doi
10.1016/s0040-4020(00)01005-x
1999. Vol. 32. P. 4194. doi 10.1021/ma9900535
14. Fang M.-H., Wang L.-S. // Int. J. Mol. Sci. 2007. Vol. 8.
19. Powell D.A., Fu G.C. // J. Am. Chem. Soc. 2004.
P. 470. doi 10.3390/i8060470
Vol. 126. P. 7788. doi 10.1021/ja047433c
Benzene Alkylation by Cycloolefins under Action
of [Et3NH]+[Al2Cl7]- Ionic Liquid
R. I. Aminov*, A. S. Mazitova, and R. I. Khusnutdinov
Institute of Petrochemistry and Catalysis of the Russian Academy of Sciences, pr. Oktyabrya 141, Ufa, 450075 Russia
*e-mail: inklab4@gmail.com
Received April 19, 2019; revised April 19, 2019; accepted April 25, 2019
For the first time, benzene was alkylated with mono- and bicyclic olefins under the action of an inorganic ionic
liquid [Et3NH]+[Al2Cl7]- with the formation of cycloalkyl derivatives of benzene in 58-98% yield. It was found
that with an increase in the size of the olefin cycle, the selectivity towards monocycloalkyl derivatives increases.
Keywords: alkylation, catalysis, cycloolefins, benzene, ionic liquids
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019