ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 11, с. 1732-1737
УДК 544.142.3:546.273;543.426
СИНТЕЗ, СТРОЕНИЕ И ЛЮМИНЕСЦЕНТНЫЕ
СВОЙСТВА КОМПЛЕКСА БОРА
С 4-БРОМ-2-(1H-ИМИДАЗО[4,5-f][1,10]ФЕНАНТРОЛИН-
2-ИЛ)ФЕНОЛЯТНЫМ ЛИГАНДОМ
© 2019 г. А. В. Рожков*, А. С. Новиков
Санкт-Петербургский государственный университет, Университетская наб. 7-9, Санкт-Петербург, 199034 Россия
*e-mail: iomcrozhkov@gmail.com
Поступило в Редакцию 13 мая 2019 г.
После доработки 13 мая 2019 г.
Принято к печати 16 мая 2019 г.
Получен комплекс бора с 4-бром-2-(1H-имидазо[4,5-f][1,10]фенантролин-2-ил)фенолятным лигандом.
Изучены его фотолюминесцентные свойства в растворе и твердой фазе. Строение комплекса установ-
лено методом РСА. В структуре обнаружен неклассический тип межмолекулярного взаимодействия
(галогенная связь) между атомами брома и фтора.
Ключевые слова: борсодержащий комплекс, фотолюминесценция, галогенная связь
DOI: 10.1134/S0044460X19110143
Комплексы бора с N,N-, N,O-, O,O-хелатными
комплекса бора с
4-бром-2-(1H-имидазо[4,5-f]-
лигандами проявляют эффективные фото- и элек-
[1,10]фенантролин-2-ил)фенолятным лигандом.
тролюминесцентные свойства [1-3]. Цвет эмиссии
Синтез
4-бром-2-(1H-имидазо[4,5-f][1,10]фе-
борорганических комплексов охватывает весь ви-
нантролин-2-ил)фенолятного лиганда 1 проводи-
димый диапазон, а также ближнюю ИК область
ли конденсацией 1,10-фенантролин-5,6-диона с
[4]. По сравнению с наиболее эффективными в
5-бромсалициловым альдегидом в присутствии
настоящее время эмиттерами на основе соеди-
ацетата аммония в уксусной кислоте по известной
нений платины [5] и иридия [6] комплексы бора
методике [9] (схема 1).
выгодно отличаются несравненно более низкой
Реакцией фенола 1 с гидроксидом калия полу-
стоимостью, менее трудозатратным синтезом и от-
чена соответствующая калиевая соль, которая при
сутствием токсичных свойств. В этой связи иссле-
взаимодействии с BF3·Et2O при комнатной тем-
дования по синтезу и изучению люминесцентных
пературе дает комплекс 2 (схема 1). Продукт ре-
соединений бора постоянно развиваются. Цвет и
акции выделен с хорошим выходом (72%) в виде
эффективность эмиссии борорганических люми-
мелкокристаллического желто-зеленого вещества,
нофоров главным образом определяется лиганд-
устойчивого на воздухе, растворимого в ДМСО,
ным окружением атома бора. Кроме того, большое
влияние на люминесцентные свойства в твердой
ДМФА, ацетонитриле. Перекристаллизацией из
фазе оказывают межмолекулярные взаимодей-
ацетонитрила удалось вырастить монокристалл,
ствия в кристалле комплекса. Ранее было показа-
пригодный для РСА.
но, что комплексы бора с лигандами, содержащие
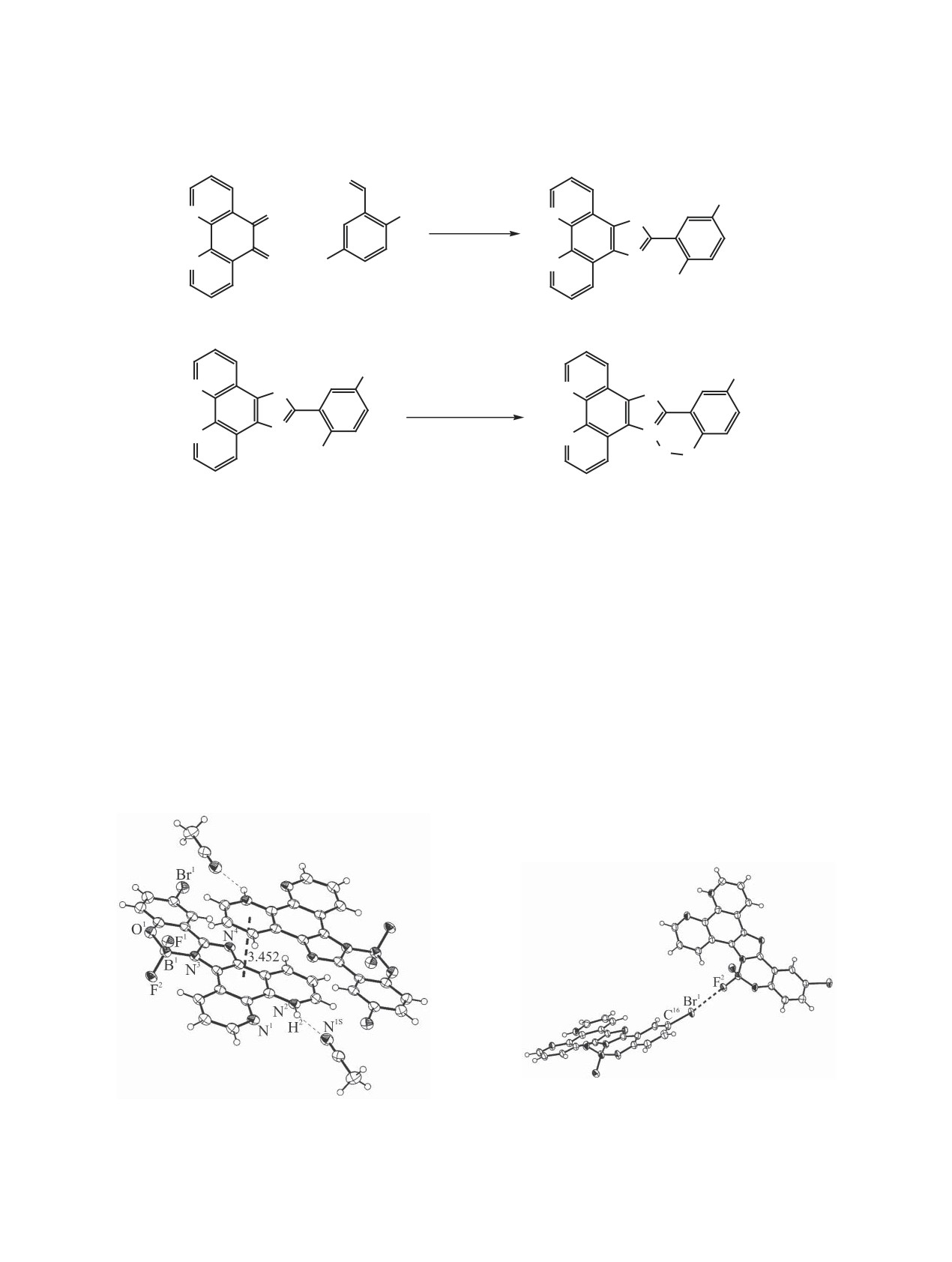
В кристаллической упаковке молекула комплек-
имидазофенолятный фрагмент, проявляют интен-
са образует сокристаллизат с молекулой ацетони-
сивную фото- и электролюминесценцию [7, 8].
трила в соотношении 1:1 за счет образования водо-
В настоящей работе сообщается о синтезе, фо-
родной связи N1S···H2 (рис. 1). Координационная
толюминесцентных свойствах и строении нового
сфера атома бора представляет собой тетраэдр.
1732
СИНТЕЗ, СТРОЕНИЕ И ЛЮМИНЕСЦЕНТНЫЕ СВОЙСТВА КОМПЛЕКСА БОР
А
1733
Схема 1.
O
Br
H
N
O
OH
N
NH4OAc
N
+
AcOH, 120qC
N
O Br
N
N
HO
1
Br
Br
H
H
N
N
N
N
(1) KOH, ȾɆɋɈ
N
(2) BF3·Et2O,
N
N
N
ɞɢɦɟɬɨɤɫɢɷɬɚɧ
HO
F2B
O
2
Углы между заместителями при атоме бора
ментов молекулы с расстоянием в стеке 3.452 Å
варьируются в диапазоне 108.263(3)-109.2936(16)°.
(рис. 1). Также в кристалле были обнаружены сла-
Расстояние B1-N3 [1.55555(5) Å] соответствует
бые межмолекулярные нековалентные взаимодей-
сумме ковалентных радиусов B и N (1.55 Å [10]).
ствия через образование галогенной связи I типа
Длина связи B1-O1 [1.45025(5) Å] несколько мень-
[11] F2···Br1 (рис. 2).
ше суммы ковалентных радиусов B и O (1.50 Å
Расстояние F2···Br1
[2.9665(15) Å] меньше
[10]). Длины связей B1-F1 [1.40407(3) Å] и B1-F2
суммы ван-дер-ваальсовых радиусов соответству-
[1.39656(4) Å] близки к сумме ковалентных ради-
ющих атомов (3.32 Å [12]). Угол C16-Br1···F2 со-
усов бора и фтора (1.41 Å [10]). Двугранный угол
ставляет 156.54(10)°. Для подтверждения наличия
между фенолятным и имидазольным фрагментами
критической точки связи (3, -1) между соответ-
составляет
8.0°. Межмолекулярное взаимодей-
ствующими атомами фтора и брома были проведе-
ствие в кристалле осуществляется посредством
ны квантово-химические расчеты в рамках теории
π-π-стекинга фенантролинимидазольных фраг-
функционала плотности и топологический анализ
Рис. 1. Фрагмент кристаллической упаковки комплекса
Рис. 2. Галогенная связь C16-Br1···F2 в кристалле ком-
2 в представлении эллипсоидами 30%-ной вероятности.
плекса 2.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
1734
РОЖКОВ, НОВИКОВ
Значения электронной плотности [ρ(r)], лапласиана электронной плотности [2ρ(r)], суммарной плотности энергии
(Hb), плотности потенциальной энергии [V(r)] и лагранжиана кинетической энергии [G(r)] в критической точке связи
(3, -1), соответствующей межмолекулярному контакту I типа галоген-галоген Br···F в кристалле 2, а также энергия
этого контакта (Eint), оцененная различными методами
ρ(r),
ρ(r),
Hb,
V(r),
G(r),
Eint,
Eint,
Eint,
Eint,
Метод/базис
ат. ед.
ат. ед.
ат. ед.
ат. ед.
ат. ед.
ккал/мольa
ккал/мольб
ккал/мольв
ккал/мольг
M06/DZP-DKH
0.010
0.048
0.002
-0.007
0.010
2.2
2.7
2.5
3.6
ωB97XD/DZP-DKH
0.010
0.048
0.002
-0.007
0.010
2.2
2.7
2.5
3.6
a Eint = -V(r)/2 [13]. б Eint = 0.429G(r) [14]. в Eint = 0.58[-V(r)] [15] (данная корреляция постулирована специально для нековалентных
взаимодействий с участием атомов брома). г Eint = 0.57G(r) [15] (данная корреляция постулирована специально для нековалентных
взаимодействий с участием атомов брома).
распределения электронной плотности по теории
тронной плотности в BCP, а также энергия Br···F
Бейдера (QTAIM). Результаты квантово-химиче-
взаимодействия не зависят от функционала (M06
ских расчетов приведены в таблице.
или ωB97XD), выбранного для проведения кванто-
во-химических расчетов. Отношение -G(r)/V(r) =
Топологический анализ распределения элек-
1.43 >> 1 в BCP свидетельствует о том, что вклад
тронной плотности по теории Бейдера (QTAIM)
ковалентной компоненты в Br···F взаимодействие
свидетельствует о наличии критической точки
пренебрежимо мал [16].
связи (BCP, bond critical point) (3, -1) для межмоле-
кулярного контакта галоген-галоген I типа Br···F.
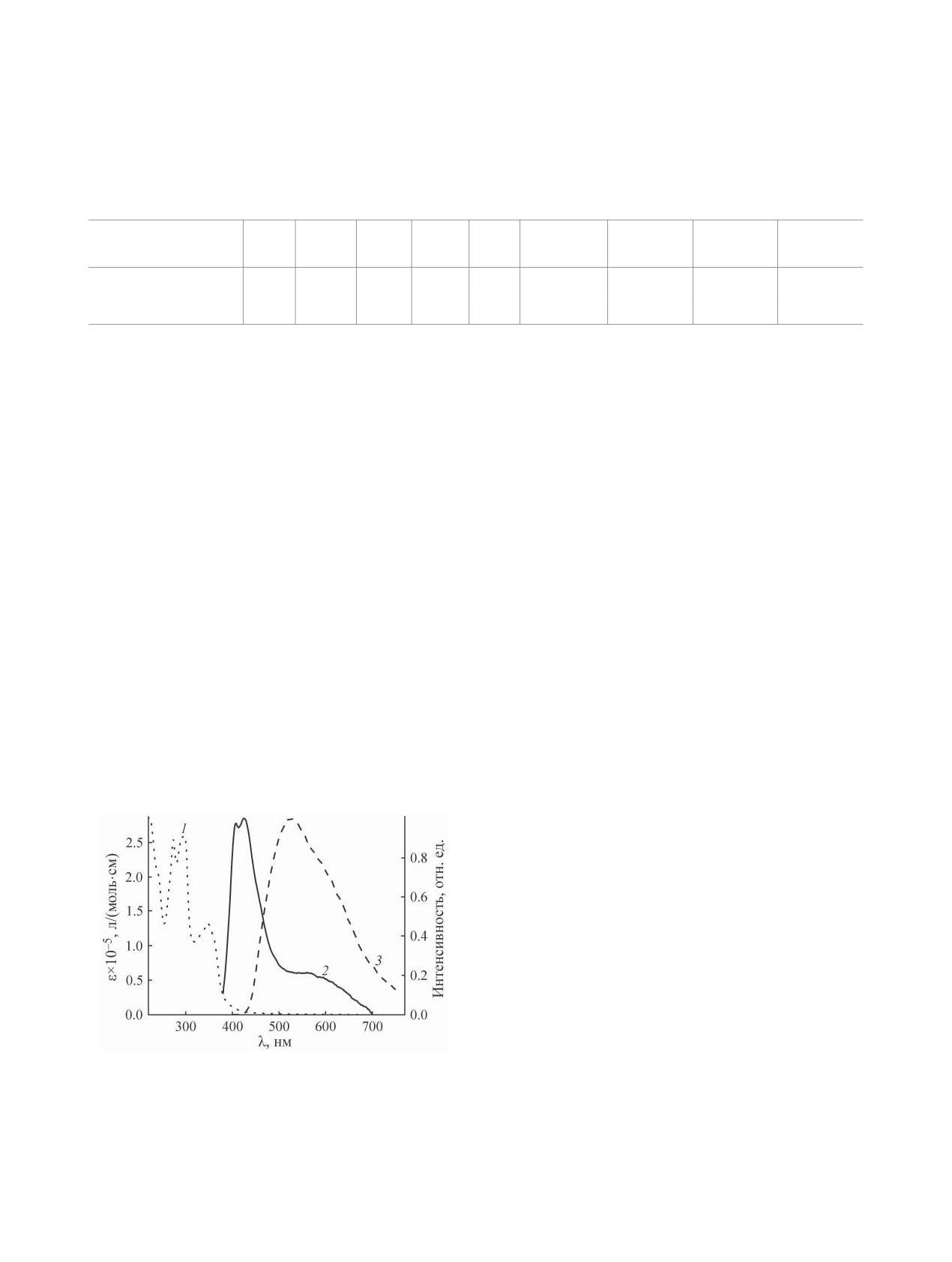
Изучение фотофизических свойств комплекса 2
показало, что спектр поглощения в растворе аце-
Низкая величина электронной плотности, положи-
тельное значение лапласиана электронной плот-
тонитрила содержит полосы, которые можно отне-
ности и близкое к нулю значение положительной
сти к π→π* и n→π* переходам в ароматических
системах лиганда (рис. 3).
суммарной плотности энергии в BCP являются
типичными признаками нековалентных взаимо-
Спектр фотолюминесценции комплекса 2 со-
действий. Энергия межмолекулярного контакта
держит два интенсивных пика с максимумами при
галоген-галоген I типа Br···F была оценена по раз-
407 и 424 нм, которые могут быть отнесены к пе-
личным предложенным в литературе корреляциям
реходам в изолированной молекуле комплекса, а
(см. таблицу), она лежит в диапазоне от 2.2 до
также широкую полосу низкой интенсивности с
3.6 ккал/моль. Стоит отметить, что свойства элек-
максимумом 570 нм, которая может быть отнесена
к свечению эксимеров. Спектр фотолюминесцен-
ции в твердой фазе сдвинут в красную область по
сравнению со спектром в растворе ацетонитрила
и представлен широкой бесструктурной полосой
с максимумом при 525 нм. Сдвиг в красную об-
ласть связан, прежде всего, с сильным межмоле-
кулярным взаимодействием в твердой фазе за счет
π-π-стекинга и образования галогенной связи.
Таким образом, получен новый комплекс диф-
торида бора с 4-бром-2-(1H-имидазо[4,5-f][1,10]-
фенантролин-2-ил)фенолом. Соединение струк-
турно охарактеризовано методом РСА. Анализ
кристаллической упаковки показал наличие ме-
Рис. 3. Спектры поглощения (1) в растворе ацетони-
жмолекулярных контактов за счет π-π-стекинга
трила и испускания в растворе ацетонитрила (2) и
и образования галогенной связи Br···F, наличие
твердой фазе (3) комплекса 2 при комнатной темпера-
туре (λвозб = 360 нм).
которой было дополнительно подтверждено те-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
СИНТЕЗ, СТРОЕНИЕ И ЛЮМИНЕСЦЕНТНЫЕ СВОЙСТВА КОМПЛЕКСА БОР
А
1735
оретически, с помощью проведения квантово-
плекс OLEX2 [18]. Поправка на поглощение вве-
химических расчетов и топологического анализа
дена в программном комплексе CrysAlisPro [19].
распределения электронной плотности по теории
Позиции атомов водорода органических молекул
Бейдера (QTAIM). Соединение проявляет фотолю-
рассчитаны по алгоритмам, заложенным в про-
минесценцию в растворе и твердой фазе.
граммном комплексе SHELX. Полные кристалло-
графические данные соединения 2 депонированы
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
в Кембриджскую базу рентгеноструктурных дан-
Работа выполнена с использованием оборудо-
ных (CCDC 1914231).
вания ресурсных центров Санкт-Петербургского
Квантово-химические расчеты выполнены с
государственного университета
«Магнитно-
помощью программного пакета Gaussian-09 [20].
резонансные методы исследования», «Методы ана-
Использовали функционалы M06 и ωB97XD, ре-
лиза состава вещества», «Рентгенодифракционные
лятивистский гамильтониан Дугласа-Кролла-
методы исследования».
Гесса 2-го порядка и базисные наборы DZP-DKH
4-Бром-2-(1H-имидазо[4,5-f][1,10]фенантро-
для всех атомов [21-24]. Топологический анализ
лин-2-ил)фенол [9] синтезировали в соответствии
распределения электронной плотности по теории
с литературными методиками. BF3·Et2O (Aldrich)
Бейдера (QTAIM) [25] выполнен с помощью про-
использовали без дополнительной очистки.
граммы Multiwfn [26].
Спектры ЯМР 1H, 13C, 11B и 19F получены на
Комплекс 2. К раствору 4-бром-2-(1H-имидазо-
спектрометре Bruker ACF-400 в (CD3)2SO при
[4,5-f][1,10]фенантролин-2-ил)фенола
(0.2
г,
комнатной температуре [400 (1Н), 125 (13С), 160.43
0.51 ммоль) в 5 мл ДМСО прибавляли гидроксид
(11B), 470.50 МГц (19F)] с использованием сиг-
калия (0.04 г, 0.71 ммоль). Смесь нагревали при
налов остаточных протонов дейтерированного
80°С при постоянном перемешивании в течение
растворителя (1H и 13C) в качестве стандарта или
4 ч, затем раствор отделяли от осадка, раство-
внешнего стандарта - BF3·Et2O (11B), CFCl3 (19F).
ритель удаляли в вакууме. Остаток растворяли в
Отнесение сигналов проведено с использованием
10 мл диметоксиэтана. К полученному раствору
градиентной 2D-спектроскопии GE-COSY и GE-
калиевой соли при 0°С при постоянном перемеши-
HSQC. ИК спектры получены на спектрометре
вании прибавляли BF3·Et2O (0.08 г, 0.56 ммоль).
Shimadzu IRPrestige-21 в таблетках KBr. Масс-
Смесь постепенно доводили до комнатной тем-
спектры зарегистрированы в МеОН на приборе
пературы и перемешивали 8 ч. Осадок отделяли,
Bruker microTOF; указан наиболее интенсивный
промыли диметоксиэтаном, сушили и экстрагиро-
пик в изотопном распределении; ионизация элек-
вали ацетонитрилом. После удаления раствори-
трораспылением. Электронные спектры поглоще-
теля остаток сушили в вакууме при 50°С. Выход
ния записаны на спектрометре Shimadzu UV-1800.
0.16 г (72%), желто-зеленые кристаллы. ИК спектр,
Спектры фотолюминесценции получены на флуо-
ν, см-1: 3543, 3207, 3185, 3151, 3098, 1619, 1573,
ресцентном спектрометре Fluorolog 3 (Horiba Jobin
1548, 1500, 1480, 1457, 1321, 1256, 1056, 1032,
Yvon), λ = 360 нм.
949. Спектр ЯМР 1Н, δ, м. д.: 9.07 д. д (2H, H1,6,
Монокристаллический образец соединения 2
J
= 4.8, 1.1 Гц), 8.99 д (2H, H3,4, JHH = 8.1 Гц),
HH
получен кристаллизацией из ацетонитрила путем
8.14 д. д (2H, H2,5, JHH = 8.2, 4.9 Гц), 7.62 д (1H,
медленного упаривания раствора при комнатной
H9, JHH = 2.3 Гц), 7.24 д. д (1H, H8, JHH = 8.8,
температуре. Исследование образца проводили на
2.3 Гц), 6.82 с (1H, NH), 6.64 д (1H, H7, JHH =
дифрактометре Agilent Technologies Supernova, ос-
8.7 Гц). Спектр ЯМР 13C, δC, м. д.: 156.15, 150.04,
нащенном плоским детектором отраженных рент-
145.89, 135.51, 135.37, 134.40, 128.00, 126.20,
геновских лучей Atlas CCD. Измерения проводили
121.85,
119.60,
115.04,
113.87,
110.78. Спектр
при 100 K с использованием монохроматического
ЯМР 11B, δB, м. д.: -1.27÷-1.31 м. Спектр ЯМР
излучения CuKα (λ = 1.54184 Å). Структура реше-
19F, δF, м. д.: -148.16, -148.21. УФ спектр (ацето-
на прямыми методами и уточнена с использовани-
нитрил), λmax, нм [ε×10-5, л/(моль·см)]: 273 [2.55],
ем программы SHELXL [17], встроенной в ком-
293 [2.58], 350 [1.30]. Масс-спектр (ESI+), m/z:
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
1736
РОЖКОВ, НОВИКОВ
439.0104 [M + H]+. Найдено, %: С 51.90; Н 2.39; N
J. Comp. Chem. 2012. Vol. 33. P. 2303. doi 10.1002/
12.59. C19H10BBrF2N4O. Вычислено, %: С 51.98; Н
jcc.23062
2.30; N 12.76.
15. Барташевич Е.В., Цирельсон В.Г. // Усп. хим. 2014.
Т. 83. C. 1181; Bartashevich E.V., Tsirelson V.G. //
ФОНДОВАЯ ПОДДЕРЖКА
Russ. Chem. Rev. 2014. Vol. 83. P. 1181. doi 10.1070/
Работа выполнена при финансовой поддержке
RCR4440
Российского научного фонда (проект № 17-73-
16. Espinosa E., Alkorta I., Elguero J., Molins E. // J. Chem.
10078).
Phys. 2002. Vol. 117. P. 5529. doi 10.1063/1.1501133
17. Sheldrick G. // Acta Crystallogr. (A). 2015. Vol. 71.
КОНФЛИКТ ИНТЕРЕСОВ
P. 3. doi 10.1107/S2053273314026370
Авторы заявляют об отсутствии конфликта
18. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
интересов.
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
Vol. 42. P. 339. doi 10.1107/S0021889808042726
СПИСОК ЛИТЕРАТУРЫ
19. CrysAlisPro, Version 1.171.136.120.
1. Li D., Zhang H., Wang Y. // Chem. Soc. Rev. 2013.
20. Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
Vol. 42. P. 8416. doi 10.1039/C3CS60170F
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
2. Mukherjee S., Thilagar P. // J. Mater. Chem. (C). 2016.
Mennucci B., Petersson G.A., Nakatsuji H., Caricato M.,
Vol. 4. P. 2647. doi 10.1039/C5TC02406D
Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G.,
3. Ahn D.H., Kim S.W., Lee H., Ko I.J., Karthik D.,
Sonnenberg J.L., Hada M., Ehara M., Toyota K.,
Lee J.Y., Kwon J.H. // Nature Photonics. 2019. doi
Fukuda R., Hasegawa J., Ishida M., Nakajima T.,
10.1038/s41566-019-0415-5
Honda Y., Kitao O., Nakai H., Vreven T., Montgo-
4. Sassi M., Buccheri N., Rooney M., Botta C., Bruni F.,
mery J.A., Jr., Peralta J.E., Ogliaro F., Bearpark M.,
Giovanella U., Brovelli S., Beverina L. // Sci. Rep. 2016.
Heyd J.J., Brothers E., Kudin K.N., Staroverov V.N.,
Vol. 6. P. 34096. doi 10.1038/srep34096
Keith T., Kobayashi R., Normand J., Raghavachari K.,
5. Li K., Ming Tong G.S., Wan Q., Cheng G., Tong W.-Y.,
Rendell A., Burant J.C., Iyengar S.S., Tomasi J.,
Ang W.-H., Kwong W.-L., Che C.-M. // Chem. Sci. 2016.
Cossi M., Rega N., Millam J.M., Klene M., Knox J.E.,
Vol. 7. P. 1653. doi 10.1039/C5SC03766B
Cross J.B., Bakken V., Adamo C., Jaramillo J., Gom-
6. Zysman-Colman E. Iridium(III) in Optoelectronic and
perts R., Stratmann R.E., Yazyev O., Austin A.J., Cammi R.,
Photonics Applications. New York: Wiley, 2017. P. 679.
Pomelli C., Ochterski J.W., Martin R.L., Morokuma K.,
7. Zhang Z., Zhang H., Jiao C., Ye K., Zhang H., Zhang J.,
Zakrzewski V.G., Voth G.A., Salvador P., Dannen-
Wang Y. // Inorg. Chem. 2015. Vol. 54. P. 2652. doi
berg J.J., Dapprich S., Daniels A.D., Farkas O.,
10.1021/ic502815q
Foresman J.B., Ortiz J.V., Cioslowski J., Fox D.J.
8. Zhang Z., Zhang Z., Zhang H., Wang Y. // Dalton Trans.
Gaussian 09, Revision C.01. 2010, Gaussian, Inc.,
2018. Vol. 47. P. 127. doi 10.1039/C7DT03702C
Wallingford, CT.
9. Liu R., Huang M.-M., Yao X.-X., Li H.-H., Yang F.-L.,
21. Barros C.L., de Oliveira P.J.P., Jorge F.E., Canal
Li X.-L. // Inorg. Chim. Acta. 2015. Vol. 434. P. 172. doi
Neto A., Campos M. // Mol. Phys. 2010. Vol. 108. P.
10.1016/j.ica.2015.05.019
1965. doi 10.1080/00268976.2010.499377
10. Cordero B., Gómez V., Platero-Prats A.E., Revés M.,
Echeverría J., Cremades E., Barragán F., Alvarez S. //
22. Canal Neto A., Jorge F.E. // Chem. Phys. Lett. 2013.
Dalton Trans. 2008. Vol. P. 2832. doi 10.1039/B801115J
Vol. 582. P. 158. doi 10.1016/j.cplett.2013.07.045
11. Cavallo G., Metrangolo P., Milani R., Pilati T., Pri-
23. de Berrêdo R.C., Jorge F.E. // J. Mol. Struct. 2010.
imagi A., Resnati G., Terraneo G. // Chem. Rev. 2016.
Vol. 961. P. 107. doi 10.1016/j.theochem.2010.09.007
Vol. 116. P. 2478. doi 10.1021/acs.chemrev.5b00484
24. Jorge F.E., Neto A.C., Camiletti G.G., Machado S.F. //
12. Bondi A. // J. Phys. Chem. 1964. Vol. 68. P. 441. doi
J. Chem. Phys. 2009. Vol. 130. P. 064108. doi
10.1021/j100785a001
10.1063/1.3072360
13. Espinosa E., Molins E., Lecomte C. // Chem. Phys.
25. 25. Bader R.F.W. // Chem. Rev. 1991. Vol. 91. P. 893.
Lett. 1998. Vol. 285. P. 170. doi 10.1016/S0009-
doi 10.1021/cr00005a013
2614(98)00036-0
26. Lu T., Chen F. // J. Comp. Chem. 2012. Vol. 33. P. 580.
14. Vener M.V., Egorova A.N., Churakov A.V., Tsirelson V.G. //
doi doi10.1002/jcc.22885
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
СИНТЕЗ, СТРОЕНИЕ И ЛЮМИНЕСЦЕНТНЫЕ СВОЙСТВА КОМПЛЕКСА БОР
А
1737
Synthesis, Structure, and Luminescent Properties
of a Boron Complex with 4-Bromo-2-(1H-imidazo[4,5-f]-
[1,10]phenanthrolin-2-yl)phenolate Ligand
A. V. Rozhkov* and A. S. Novikov
St. Petersburg State University, Universitetskaya nab. 7-9, St. Petersburg, 199034 Russia
*e-mail: iomcrozhkov@gmail.com
Received May 13, 2019; revised May 13, 2019; accepted May 16, 2019
A complex of boron with 4-bromo-2-(1H-imidazo[4,5-f][1,10]phenanthrolin-2-yl)phenolate ligand was
obtained. Its photoluminescent properties in solution and solid phase were studied. Structure of the complex
was determined by single crystal X-ray diffraction method. A nonclassical type of intermolecular interaction
(halogen bond) between bromine and fluorine atoms was revealed.
Keywords: boron complex, photoluminescence, halogen bond
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019