ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 11, с. 1738-1746
УДК 541.572.128
ВЛИЯНИЕ КИСЛОТНО-ОСНОВНОГО
ВЗАИМОДЕЙСТВИЯ НА
КОМПЛЕКСООБРАЗУЮЩУЮ СПОСОБНОСТЬ
β-ЗАМЕЩЕННЫХ ПОРФИРАЗИНОВ С СОЛЯМИ
МАГНИЯ В ПРОТОНОАКЦЕПТОРЫХ СРЕДАХ
© 2019 г. О. А. Петров*
Ивановский государственный химико-технологический университет,
пр. Шереметевский 7, Иваново, 153000 Россия
*е-mail: poa@isuct.ru
Поступило в Редакцию 12 марта 2019 г.
После доработки 25 марта 2019 г.
Принято к печати 26 апреля 2019 г.
Анализ комплексообразующей способности β-замещенных порфиразинов с ацетатом и ацетилацетонатом
магния в системax диметилсульфоксид-бензол (хлорбензол) и азотистое основание-бензол показал, что
кислотно-основное взаимодействие играет ключевую роль при комплексообразовании порфиразинов с
солями магния в различных по основности протоноакцепторных средах. Обсуждаются механизм обра-
зования комплекса магния с порфиразинами, строение и устойчивость кислотно-основных комплексов
порфиразинов с диметилсульфоксидом и азотистыми основаниями в бензоле (хлорбензоле).
Ключевые слова: β-замещенные порфиразины, кислотно-основное взаимодействие, азотсодержащие
основания, диметилсульфоксид, ацетат магния, ацетилацетонат магния
DOI: 10.1134/S0044460X19110155
Порфиразины (тетраазапорфирины) представ-
являются в регулировании ряда метаболических
ляют собой класс ароматических макрогетеро-
процессов [2], макроциклический комплекс маг-
циклических соединений, которые благодаря раз-
ния-хлорофилл играет ключевую роль в фотосин-
нообразной модификации их структуры находят
тезе, принимая непосредственное участие в окис-
широкое применение в качестве электро- и фото-
лительно-восстановительной цепи [3].
катализаторов окисления и восстановления, жид-
На комплексообразование порфиразинов (Ра)
кокристаллических веществ, химических сенсо-
достаточно сильное влияние оказывают протоно-
ров и фотосенсибилизаторов [1]. Создание супра-
акцепторные свойства среды, которые вносят су-
молекулярных структур на основе порфиразинов
щественный вклад не только в кинетику процесса,
позволяет получать материалы с новыми полез-
но и определяют механизм введения Mg2+ в коор-
ными свойствами. Для расширения возможностей
динационный центр порфиразинового макроцик-
практического применения этих макроциклов не-
ла.
обходимо всестороннее изучение их физико-хими-
Порфиразины в протоноакцепторных средах.
ческих свойств.
β-Замещенные порфиразины [H2PaR] (схема 1)
К числу наиболее важных свойств порфирази-
относятся к числу ароматических макроцикличе-
нов относится их способность к комплексообразо-
ских амфолитов. Они имеют два протонодонор-
ванию с солями металлов, среди которых важное
ных центра NH пиррольного типа и шесть прото-
место занимает магний. Его особые свойства про-
ноакцепторных центров: два внутрициклических
1738
ВЛИЯНИЕ КИСЛОТНО-ОСНОВНОГО ВЗАИМОДЕЙСТВИЯ
1739
Схема 1.
R2
R1
N
R1
R2
NH
N
N
N
N
HN
R2
R1
N
R1
R2
[H2PaR]
R1 = R2 = C6H4Br [H2Pa(C6H4Br)8]; R1 = R2 = C6H4NO2 [H2Pa(C6H4NO2)8];
R1 = H; R2 = Br [H2PaBr4]; R1 = H; R2 = Cl [H2PaCl4].
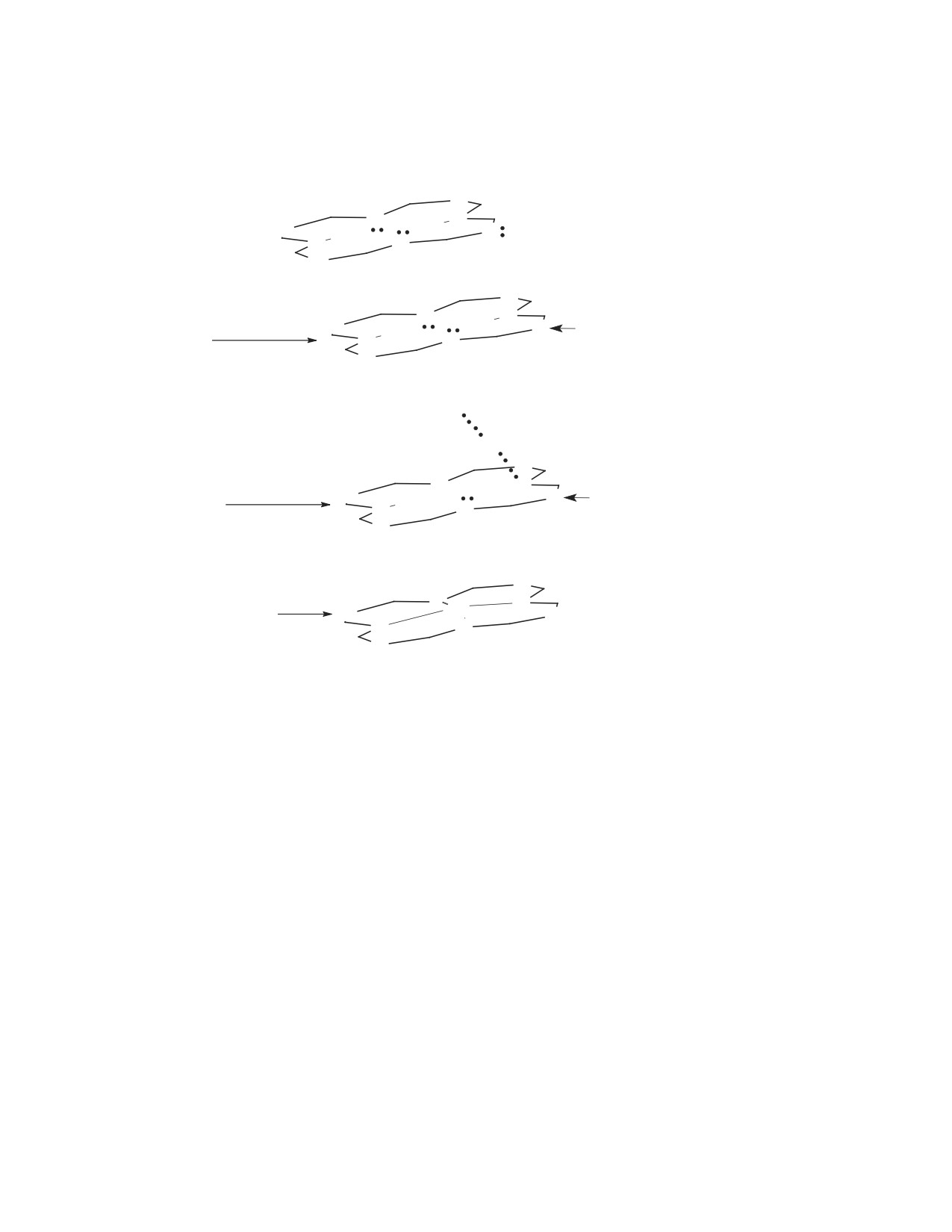
пирролениновых атома азота и четыре мезо-атома
заполненными молекулярными орбиталями π1 и
азота. Электроноакцепторное действие последних
π2, а также вырождение двух низших свободных
повышает кислотные свойства порфиразина по
молекулярных орбиталей π*1,2 приводит к повыше-
сравнению с порфином на 10 ед. [4]. Дальнейшее
нию симметрии π-хромофора молекулы от D2h до
увеличение кислотности происходит при переходе
D4h (см. рисунок).
от порфиразина к окта(п-бромфенил)порфирази-
Таким образом, окта(п-нитрофенил)порфира-
ну [H2Pa(C6H4Br)8], окта(п-нитрофенил)порфира-
зин, тетрахлорпорфиразин и тетрабромпорфи-
зину
[H2Pa(C6H4NO2)8], тетрабромпорфиразину
разин в реакции с диметилсульфоксидом про-
[H2PaBr4] и тетрахлорпорфиразину [H2PaCl4] [5].
являют свойства двухосновной NH-кислоты и
Благодаря выраженной кислотности внутрици-
образуют устойчивые во времени комплексы с
клических связей N-H порфиразины вступают в
переносом протонов: H2Pa(C6H4NO2)8∙2DMSO,
нехарактерные для порфиринов кинетически кон-
тролируемые кислотно-основные взаимодействия
в протоноакцепторных средах с образованием
комплексов с переносом протонов, которые обла-
дают различной устойчивостью во времени.
Взаимодействие H2Pa(C6H4NO2)8, H2PaBr4 и
H2PaCl4 с диметилсульфоксидом в бензоле (хлор-
бензоле) наблюдается только в условиях значи-
тельного избытка ДМСО [6-8]. Картина спек-
тральных изменений в ходе реакции не зависит от
природы заместителей в макроцикле, а также от
свойств растворителя (бензола, хлорбензола).
При кислотно-основном взаимодействии с
участием порфиразинового макроцикла происхо-
дит повышение энергии низшей свободной мо-
лекулярной орбитали π1* и высшей заполненной
орбитали π1, в то время как энергия высшей за-
полненной молекулярной орбитали π2 и низшей
Изменение энергии высшей заполненной молеку-
свободной молекулярной орбитали π2* не претер-
лярной орбитали и низшей свободной молекулярной
певает существенных изменений [9]. Уменьшение
орбитали π1 при кислотно-основном взаимодействии
энергетической разности между двумя высшими
порфиразинового макроцикла [9].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
1740
ПЕТРОВ
Схема 2.
Схема 3.
H3C
CH3
B+
S
H
O
H
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
H
B+
2
H
уменьшение интенсивности полос поглощения λI
O
и λII. Одновременно появляется низкоинтенсивная
S
полоса в области 500 нм. Изменение интенсивно-
H3C CH3
сти полос при 500 и 613 нм, а также полосы Соре,
1
свидетельствует об участии в комплексообразо-
H2PaCl4∙2DMSO и H2PaBr4∙2DMSO [6-8]. В этих
вании пиррольных фрагментов порфиразинового
комплексах пиррольные атомы водорода, выведен-
макроцикла. Аналогичная картина наблюдается
ные из плоскости макроцикла и связанные с моле-
для комплексов H2Pa(C6H4NO2)8∙2В (В = Morph,
кулами диметилсульфоксида и внутрициклически-
Pip, BuNH2, t-BuNH2)
[12]. Кинетическая не-
ми атомами азота водородными связями, распо-
устойчивость комплексов H2PaCl4∙2В, H2PaBr4∙2В
лагаются над и под плоскостью порфиразиновой
и H2Pa(C6H4NO2)8∙2В в системе азотистое ос-
молекулы. Степень переноса протонов от кислоты
нование-бензол проявляется в самопроизволь-
к основанию ограничивается стадией образования
ном распаде макроцикла и образовании низко-
H-комплекса (Н-ассоциата 1, схема 2) [5, 10].
молекулярных бесцветных продуктов реакции
[5,
11,
12]. Исключение составляет комплекс
В системе ДМСО-бензол (хлорбензол) Н-комп-
H2Pa(C6H4Br)8∙2BuNH2, который не подвергается
лексы с участием H2Pa(C6H4Br)8 не образуются из-
распаду длительное время [13].
за слабовыраженной протонодонорной способно-
сти окта(п-бромфенил)порфиразина [10].
Степень переноса протонов в комплексах
H2Pa(C6H4Br)8∙2BuNH2,
H2Pa(C6H4NO2)8∙2В,
Галогенозамещенные порфиразины достаточ-
H2PaCl4∙ 2В и H2PaBr4∙2В зависит от протоно-
но легко вступают в кислотно-основные взаимо-
донорных и протоноакцепторных свойств моле-
действия с азотистыми основаниями в бензоле с
кул-партнеров и в среде бензола ограничивается
образованием комплексов с переносом протонов
либо стадией образования Н-комплекса 1, либо
H2PaCl4∙2В и H2PaBr4∙2В, где В - пиридин (Py),
ионного комплекса (ион-ионного ассоциата), пред-
2-метилпиридин (MePy), морфолин (Morph), пипе-
ставляющего собой Н-связанную ионную пару 2
ридин (Pip), бутиламин, трет-бутиламин, диэтила-
(схема 3) [5, 10].
мин и триэтиламин. Спектрально контролируемое
взаимодействие H2PaCl4 и H2PaBr4 с основанием
Особенности комплексообразования порфи-
В не зависит от природы галогена в макроцикле,
разинов с ацетатом магния в системе диметил-
а также от строения азотистого основания [11]. В
сульфоксид-бензол (хлорбензол). При концен-
электронном спектре поглощения с течением вре-
трации диметилсульфоксида менее 0.16 моль/л в
мени первоначально наблюдается возрастание ин-
бензоле (хлорбензоле) спектрально-фиксируемое
тенсивности полосы поглощения при λ = 613 нм и
взаимодействие порфиразинов с ацетатом магния
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
ВЛИЯНИЕ КИСЛОТНО-ОСНОВНОГО ВЗАИМОДЕЙСТВИЯ
1741
Схема 4.
N
N
N
H
N
N
H
N
N
N
N
N
N
H
Mg(OAc)2, k1
N
N
Mg(OAc)2
N H
N
N
(ȾɆɋɈ )2
H
N
ȾɆɋɈ2, k2
N
N
N
N
Mg(OAc)2
N H
N
N
3
N
k3
N
N
Mg
ȾɆɋɈ $F2+
N
N
N
N
N
k1 >> k2 << k3
[Mg(OAc)2] отсутствует. Изменение электронно-
Несмотря на то, что образование комплексов
го спектра поглощения, указывающее на обра-
MgPaR описывается кинетическим уравнением
зование комплекса MgPaR, наблюдается только
третьего порядка, лимитирующая стадия имеет
в интервале концентраций диметилсульфоксида
бимолекулярный характер (схема 4).
от 0.16 до 1.15 моль/л в бензоле (хлорбензоле)
Сначала молекула порфиразина за счет одного
[7, 14]. Спектральные изменения в ходе реакции
из четырех мезо-атомов азота, имеющих неподе-
не зависят от природы заместителей в порфира-
ленную электронную пару, вступает в относи-
зиновом макроцикле и инертного растворителя и
тельно слабое координационное взаимодействие
аналогичны изменениям в ходе кислотно-основно-
с Mg(OAc)2 с образованием спектрально не реги-
го взаимодействия порфиразинов с диметилсуль-
стрируемого промежуточного комплекса аминно-
фоксидом в среде инертного растворителя. Однако
го типа, который не выделяется из раствора [15].
интенсивность полосы поглощения Mg-комплекса
На второй стадии димеризующийся в бензоль-
гораздо выше, чем у комплекса с переносом прото-
ном растворе диметилсульфоксид (ДМСО)2 [16]
нов порфиразинов.
вступает в кислотно-основное взаимодействие
Во всех изученных случаях комплексообразо-
с одним из двух внутрициклических протонов с
вание не зависит от концентрации соли металла и
образованием спектрально не регистрируемого
описывается кинетическим уравнением (1).
реакционноспособного комплекса
3. Благодаря
-d[H2PaR]/dτ = k[H2PaR]c2дмсо.
(1)
этому уменьшается наиболее энергоемкая состав-
Здесь H2PaR - H2PaBr4, H2PaCl4, H2Pa(C6H4NO2)8,
ляющая разрыва связи N-H и облегчается мигра-
k - константа скорости реакции третьего порядка.
ция иона Mg2+ в координационный центр порфи-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
1742
ПЕТРОВ
Таблица 1. Кинетические параметры образования комплексов MgPaR в системе порфиразин (Ра)-Mg(OAc)2а-диме-
тилсульфоксид-бензолб (хлорбензолв) [7, 14, 17]
c0ДМСО, моль/л
kэ298×104, c-1
k298×102, л2/(моль2∙с)
Ea, кДж/моль
-∆S≠, Дж/(моль∙K)
MgPaBr4
0.16
2.04
1.38
28
230
0.32
20.90
2.87
26
217
0.81
74.95
1.22
27
203
1.15
200.53
1.45
26
198
1.78
96.00
30.30г
36
171
3.40
19.20
1.70г
49
141
6.63
2.90
0.06г
47
163
9.87
1.53
0.02г
45
175
MgPaCl4
0.16
1.94
1.32
26
237
0.32
23.00
3.16
29
206
0.81
92.34
1.51
26
205
1.15
316.12
2.30
28
188
1.78
120.40
38.00г
26
203
3.40
30.00
2.60г
45
150
6.63
5.35
0.12г
53
137
9.87
1.52
0.01г
50
158
MgPa(C6H4NO2)8
0.16
0.20
4.50г
67
118
0.32
0.70
4.85г
62
124
0.81
3.35
4.80г
63
108
1.15
6.60
5.70г
63
102
1.78
5.10
1.60г
63
104
3.40
2.15
0.20г
69
91
6.63
1.30
0.03г
70
92
9.87
0.75
0.007г
67
107
MgPa(C6H4Br)8
0.90
0.01
0.01г
71
131
1.71
0.03
0.01г
70
123
3.33
0.12
0.01г
71
109
6.57
0.45
0.01г
74
88
7.50
0.71
0.01г
70
97
9.80
1.34
0.01г
68
99
а [Mg(OAc)2] = 1.8×10-4 моль/л. б Для H2
Pa(C6H4NO2)8 и H2Pa(C6H4Br)8 (с = 0.3×10-5 моль/л).
в Для H2PaBr4 и H2PaCl4 (с =
0.5×10-5 моль/л). г k298×104.
разина. Аналогичный механизм образования ме-
H2Pa(C6H4NO2)8, H2PaBr4 и H2PaCl4 соответствен-
таллокомплекса реализуется при взаимодействии
но (табл. 1), при этом величины Еа и ΔS≠ не претер-
H2Pa(C6H4Br)8 с Mg(OAc)2 в системе диметил-
певают существенных изменений.
сульфоксид-бензол [17].
При дальнейшем увеличении концентра-
Увеличение концентрации ДМСО в бензоле
ции ДМСО в бензоле (хлорбензоле) от 1.15 до
(хлорбензоле) в ~7.2 раза приводит к возрас-
9.87 моль/л происходит постепенное ингибирова-
танию наблюдаемой константы скорости ком-
ние комплексообразования. Величина kэ298 умень-
плексообразования kэ298 в ~30, 98 и 163 раза для
шается в ~9, 131 и 208 раз для H2Pa(C6H4NO2)8,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
ВЛИЯНИЕ КИСЛОТНО-ОСНОВНОГО ВЗАИМОДЕЙСТВИЯ
1743
Таблица 2. Кинетические параметры образования комплексов MgPaR в системе порфиразин (Pa)-азотистое осно-
вание-бензол [19]а
Основание
kэ298×104, c-1
k298×102, л2/(моль2∙с)
Ea, кДж/моль
-∆S≠, Дж/(моль∙K)
MgPaCl4
Пиридин
5.81
9.60
20
248
2-Метилпиридин
1.45
2.86
32
219
MgPaBr4
Пиридин
12.90
4.80
29
224
2-Метилпиридин
0.27
0.69
48
179
а [H2PaBr4] = [H2PaCl4] = 0.7×10-5 моль/л, [Mg(acac)2] = 1.1×10-4 моль/л, с0Py = 0.55 моль/л, с0MePy = 0.46 моль/л.
H2PaBr4 и H2PaCl4 соответственно (табл. 1). В этом
тральных изменений аналогична изменениям при
интервале концентраций диметилсульфоксида су-
образовании комплексов MgPaR в системе диме-
щественно увеличивается скорость образования
тилсульфоксид-бензол (хлорбензол).
кислотно-основного комплекса 1 [5]. Поскольку два
Если в качестве азотистого основания высту-
внутрициклических протона групп NH в комплексе
пают пиридин или 2-метилпиридин, образование
1 находятся вне плоскости макроцикла, это долж-
комплекса 3 описывается кинетическим уравне-
но было бы способствовать миграции иона Mg2+
нием (2).
в координационный центр порфиразина с мезо-
-d[H2PaR]/dτ = k[H2PaR][Mg(acac)2]cВ.
(2)
атомами азота. Однако молекулы диметилсульфок-
Здесь H2PaR - H2PaBr4 и H2PaCl4, k - константа
сида, связанные с атомами водорода, экранируют
скорости реакции третьего порядка.
фронтальную и тыльную стороны макроцикла и
Лимитирующая стадия
- образование кис-
препятствуют сближению реакционных центров
лотно-основного комплекса H2PaR∙В, в котором
взаимодействующих молекул и образованию Mg-
один из двух внутрициклических протонов групп
комплекса с H2PaBr4, H2PaCl4 и H2Pa(C6H4NO2)8
NH, связанный с молекулой Py (MePy) посред-
С соединением H2Pa(C6H4Br)8 образования кис-
ствам водородной связи, выведен из плоскости
лотно-основного комплекса 1 не происходит [10],
макроцикла, как в промежуточном комплексе 3.
и в интервале концентраций диметилсульфоксида
Для спектрально не регистрируемого комплекса
от 0.9 до 9.80 моль/л в бензоле наблюдается линей-
H2PaR∙В характерна более высокая реакционная
ная зависимость между kэ298 и сДМСО (табл. 1).
способность по сравнению с молекулярной фор-
Анализ экспериментальных данных (табл. 1)
мой порфиразина. При взаимодействии с ацетила-
показывает, что по мере возрастания кислот-
цетонатом магния образуются однозарядный ани-
ных свойств молекулы в ряду H2Pa(C6H4Br)8 <
он HPaR- и кинетически активный моноацетила-
H2Pa(C6H4NO2)8 < H2PaCl4 ≈ H2PaBr4 облегчается
цетонат магния [Mg(acac)]+ [18]. На завершающей
образование промежуточного кислотно-основного
стадии происходит быстрое удаление оставшегося
комплекса 3, в результате чего скорость комплек-
внутрициклического протона и включение Mg2+ в
сообразования c Mg(OAc)2, судя по величинам
координационный центр порфиразина с образова-
k298, возрастает в ~140 раз на фоне уменьшения
нием комплекса MgPaR [19].
величин Еа и ΔS≠.
При замене атомов хлора на бром в H2PaR про-
Комплексы магния с порфиразина-
исходит уменьшение скорости образования ком-
ми в системе азотистое основание-бензол.
плекса MgPaR и возрастание значений Еа и ΔS≠
Комплексообразование порфиразинов с ацетатом
(табл. 2). Аналогичное влияние оказывает природа
магния в системе азотсодержащее основание-бен-
азотистого основания. При переходе от пиридина
зол не происходит в виду ограниченной раствори-
(pKа = 5.23 [20]) к близкому по основности 2-ме-
мости соли металла. При замене ацетата магния
тилпиридину (pKа = 5.97 [20]) величина k298 изме-
на ацетилацетонат магния Mg(acac)2 картина спек-
няется в ~3 и 7 раза для H2PaCl4 и H2PaBr4 соот-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
1744
ПЕТРОВ
Таблица 3. Кинетические параметры образования MgPaR в системе порфиразин (Pa)-азотистое основание-бензола
[21, 22]
Основание
c0B, моль/л
kэ298×105, с-1
k298×103, л2.5/(моль2.5∙с)
Ea, кДж/моль
Пиридин
1.20
0.43
0.40
62
2-Метилпиридин
2.10
0.14
0.03
93
Бутиламин
1.09
0.61
0.60
101
Диэтиламин
3.05
0.06
0.007
94
Пиридин
1.20
18.00
18.00
59
2-Метилпиридин
1.20
4.10
4.10
88
Бутиламин
1.01
11.20
11.20
76
Диэтиламин
0.96
1.90
9.20
78
а [H2Pa(C6H4Br)8] = 0.4×10-5 моль/л, [H2Pa(C6H4NO2)8] = 0.5×10-5 моль/л, [Mg(acac)2] = 1.1×10-4 моль/л.
ветственно на фоне значительного возрастания ак-
-d[H2PaR]/dτ = k[H2PaR][Mg(acac)2]0.5cВ2.
(3)
тивационных параметров образования комплекса
В этом случае молекулы азотистого основа-
MgPaR. Это не является неожиданным, если при-
ния постадийно вступают во взаимодействие с
нять во внимание, что неподеленная электронная
пиррольными группами NH порфиразина. Из-за
пара атома азота в MePy пространственно экрани-
слабовыраженной кислотности H2Pa(C6H4Br)8 и
рована в большей степени, чем в Py. В результа-
H2Pa(C6H4NO2)8 образования комплекса 2 не про-
те затрудняется образование кислотно-основного
исходит, а лишь увеличивается степень поляриза-
комплекса H2PaR∙В и, как следствие, образование
ции связей N-H. Из-за стерических помех, созда-
MgPaR.
ваемых п-бромфенильными (п-нитрофенильными)
При концентрации пиридина и 2-метилпириди-
заместителями в порфиразиновом макроцикле, ре-
на в бензоле более 1.5 и 2.0 моль/л, соответствен-
акционноспособный монолигандный ацетилаце-
но, комплекс магния с тетрагалогенопорфиразина-
тонат магния [Mg(acac)]+, возникающий в резуль-
ми образуется практически мгновенно со скоро-
тате диссоциации Mg(acac)2, вступает в координа-
стями, не позволяющими измерить их обычными
ционный центр порфиразина с образованием ком-
спектрофотометрическими методами.
плексов MgPa(C6H4Br)8 [21] и MgPa(C6H4NO2)8
В средах с более выраженной протоноакцептор-
[22].
ной способностью образование MgPaR из тетра-
По мере увеличения кислотных свойств
галогенопорфиразинов и ацетилацетоната магния
не происходит. Реакция ограничивается образова-
молекулы при переходе от H2Pa(C6H4Br)8 к
нием кислотно-основного комплекса 2, который в
H2Pa(C6H4NO2)8 скорость образования Mg-комп-
результате протекания конкурентной реакции за
лекса существенно возрастает, а величины Еа и
протон приводит к неустойчивому во времени диа-
ΔS≠ уменьшаются (табл. 3). Напротив, замена бу-
ниона [PaR]2- [19]. В системе бутиламин (диэтила-
тиламина (pKа = 10.60 [20]) на близкий по основ-
мин)-бензол регистрируется аналогичная картина
ности диэтиламин (pKа = 10.84 [20]), как и пири-
спектральных изменений, как и в случае кислот-
дина (pKа = 5.23 [20]) на 2-метилпиридин (pKа =
но-основного взаимодействия H2PaCl4 и H2PaBr4 с
5.97 [20]), приводит к уменьшению значений k298.
ациклическими азотистыми основаниями в бензо-
Ингибирующее действие диэтиламина и 2-метил-
ле, а значения k298, Еа и ΔS≠ образования комплек-
пиридина связанно с пространственным экрани-
са MgPaR совпадают с таковыми для образования
рованием неподеленной электронной пары атома
комплекса 2 [5].
азота объемистыми алкильными заместителями
Если в комплексообразовании с Mg(acac)2 уча-
(CH3, C2H5). Экранрование затрудняет кислот-
ствуют H2Pa(C6H4Br)8 и H2Pa(C6H4NO2)8 в систе-
но-основное взаимодействие H2Pa(C6H4Br)8 и
ме бутиламин (диэтиламин, пиридин, 2-метилпи-
H2Pa(C6H4NO2)8 с Et2NH (MePy) и, как следствие,
ридин)-бензол, кинетическое уравнение реакции
противодействует образованию комплекса магния
имеет следующий вид (3).
с порфиразинами.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
ВЛИЯНИЕ КИСЛОТНО-ОСНОВНОГО ВЗАИМОДЕЙСТВИЯ
1745
КОНФЛИКТ ИНТЕРЕСОВ
11. Петров О.А. // Коорд. хим. 2003. Т. 29. № 2. С. 144;
Petrov O.A. // Russ. J. Coord. Chem. 2003. Vol. 29.
Авторы заявляют об отсутствии конфликта
N 2. P. 135. doi 10.1023/A:1022346303496
интересов.
12. Петров О.А., Чижова Н.В. // ЖФХ. 1999. Т. 73. № 3.
СПИСОК ЛИТЕРАТУРЫ
С. 450.
1. The Porphyrins Handbook. Applications: Past, Present
13. Петров О.А. // ЖФХ. 2000. Т. 74. № 5. С. 838; Petrov O.A. //
and Future / Eds K.M. Kadish, M.K. Smith, R. Guilard.
Russ. J. Phys. Chem. (A). 2000. Vol. 74. N 5. P. 737.
San-Diego; San-Francisco; New York; Boston; London;
14. Петров О.А, Чижова Н.В., Березин Б.Д., Сыр-
Sydney; Tokio: Aсademic Press, 2000. Vol. 6. 346 p.
бу С.А. // ЖОХ. 2000. Т. 70. Вып. 5. С. 825; Pet-
2. Березов Т.Т., Коровкин Б.Ф. Биологическая химия.
rov O.A., Chizhova N.V., Berezin B.D., Syrbu S.A. //
М.: Медицина. 1998. 704 с.
Russ. J. Gen. Chem. 2000. Vol. 70. N 5. P. 771.
3. Фотосинтез / Под. ред. Р. Говинджи. М.: Мир, 1987.
15. Успехи химии порфиринов / Под. ред. О.А. Голубчи-
Т. 1, 2.
кова. СПб: СПбГУ, 1997. Т. 1. С. 150.
4. Stuzhin P.A. // J. Porph. Phthalocyan. 2003. Vol. 7. N 12.
16. Получение и свойства органических соединений
P. 813. doi 10.1142/S1088424603001014
серы / Под. ред. Л.И. Беленького. М.: Химия, 1998.
5. Петров О.А. // ЖОХ. 2013. Т. 83. Вып. 4. С.681;
557 с.
Petrov O.A. // Russ. J. Gen. Chem. 2013. Vol. 83. N 4.
P. 762. doi 10.1134/S1070363213040269
17. Петров О.А., Чижова Н.В. // ЖОХ. 2002. Т. 72.
Вып. 2. С. 320; Petrov O.A., Chizhova N.V. // Russ.
6. Петров О.А, Хелевина О.Г., Чижова Н.В., Бере-
J. Gen. Chem. 2002. Vol. 72. N 2. P. 299. doi
зин Б.Д. // Коорд. хим. 1994. Т. 20. № 11. С. 876.
10.1023/A:1015450407975.
7. Петров О.А., Чижова Н.В., Карасева Н.А. // Коорд. хим.
1999. Т. 25. № 6. С. 415; Petrov O.A., Chizhova N.V.,
18. Неорганическая биохимия / Под. ред. Г. Эйхгорна.
Karaseva N.A. // Russ. J. Coord. Chem. 1999. Vol. 25.
М.: Мир, 1978. Т. 1. 711 с.
N 6. P. 388.
19. Петров О.А., Киселев Р.Ю. // Коорд. хим. 2000.
8. Петров О.А. // ЖОХ. 2013. Т.83. Вып. 6. С. 1006;
Т. 26. № 3. С. 169.
Petrov O.A. // Russ. J. Gen. Chem. 2013. Vol. 83. N 6.
20. The Handbook of Chemistry and Physics / Ed. W.M.
P. 1136. doi 10.1134/S1070363213060224
Haynes. Boca Raton; London; New York: Taylor &
9. Stuzhin P., Khelevina O., Berezin B. // Phthalocyanines:
Francis, 2013. 2668 p.
Properties and Applications. New York: VCH Publ. Inc.,
21. Петров О.А, Березин Б.Д., Чижова Н.В., Семей-
1996. Vol. 4. P. 23.
кин А.С. // Коорд. хим. 1999. Т. 25. № 9. С. 675.
10. Петров О.А. Автореф. дис. … докт. хим. наук.
Иваново: ИГХТУ, 2004. 38 c.
22. Петров О.А. // Коорд. хим. 2000. Т. 26. № 9. С. 652.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
1746
ПЕТРОВ
Effect of Acid-Base Interaction on Complexing Ability
of β-Substituted Porphyrazines with Magnesium Salts
in Proton-Acceptor Media
O. A. Petrov*
Ivanovo State University of Chemical Technology, pr. Sheremetevskii 7, Ivanovo, 153000 Russia
*e-mail: poa@isuct.ru
Received March 12, 2019; revised March 25, 2019; accepted April 26, 2019
Analysis of the complexing ability of β-substituted porphyrazines with magnesium acetate and acetylacetonate
in the dimethyl sulfoxide-benzene (chlorobenzene) and nitrogen-containing base-benzene systems showed that
the acid-base interaction plays a key role in the complex formation of porphyrazines with magnesium salts in
proton-acceptor media of different basicities. The mechanism of the formation of a complex of magnesium with
porphyrazines, the structure and stability of acid-base complexes of porphyrazines with dimethyl sulfoxide and
nitrogen bases in benzene (chlorobenzene) are discussed.
Keywords: β-substituted porphyrazines, acid-base interaction, nitrogen-containing bases, dimethyl sulfoxide,
magnesium acetate, magnesium acetylacetonate
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019