ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 11, с. 1755-1765
УДК 541.49; 544.18; 546.742
ФОРМИРОВАНИЕ ОЛИГОЯДЕРНЫХ
КАРБОКСИЛАТНЫХ КОМПЛЕКСОВ НИКЕЛЯ(II)
С АЗОТСОДЕРЖАЩИМИ ЛИГАНДАМИ.
КВАНТОВО-ХИМИЧЕСКОЕ МОДЕЛИРОВАНИЕ
© 2019 г. Н. С. Панинаa, *, А. А. Никифоровa, b, Д. О. Блиновa, Е. Н. Дубровa, А. И. Поняевa,
А. В. Ереминc, А. Н. Беляевa
a Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
*e-mail: nataliepanina2707@gmail.com
b Институт высокомолекулярных соединений Российской академии наук, Санкт-Петербург, Россия
c Санкт-Петербургский политехнический университет имени Петра Великого, Санкт-Петербург, Россия
Поступило в Редакцию 10 мая 2019 г.
После доработки 10 мая 2019 г.
Принято к печати 16 мая 2019 г.
Методом DFT PBE0/6-31G(d,p) в газовой фазе и с учетом растворителя исследовано формирование
би- и пентаядерных комплексов Ni(II) с карбоксилатнымии и N-содержащими лигандами, проведена
оценка ∆G° их образования из простых соединений. Выявлена функциональная роль мостиковых групп
и водородных связей в формировании полиядерных структур. Предложена модель самоорганизации
пентаядерных координационных соединений [NiII(O2CR)8L2n(μ-OH)2]0 из биядерных [Ni2II(O2CR)4Ln(μ-
H2O)]0, в структуру которых внедряются моноядерные катионы NiII и промотируют перенос протонов
с мостиковых аква-лигандов.
Ключевые слова: никель, карбоксилатные комплексы, олигоядерные структуры, DFT-моделирование
DOI: 10.1134/S0044460X19110179
В последнее десятилетие возрос интерес к син-
динений d-элементов - важный этап в построении
тезу и исследованию полиядерных металлоком-
концепции стабилизации надмолекулярных обра-
плексов из-за их неординарных свойств - магнит-
зований. Сопоставление теоретических расчетов
ных [1], каталитических [2], спектральных и мно-
с экспериментальными данными позволяет полу-
чить информацию о характере химических связей
гих других, а также из-за возможности их практи-
в исследуемых соединениях, о путях их возможных
ческого применения [3].
превращений, а также об их магнитных свойствах.
Структурные исследования би- и полиядерных
Последнее особенно важно для 3d8-соединений
комплексов никеля(II) направлены на установление
никеля(II), способных в зависимости от природы
взаимных переходов между отдельными формами
поля лигандов формировать различные коорди-
комплексов и факторов, определяющих их устой-
национные структуры - синглетные, триплетные,
чивость [4-6]. В настоящий момент нет достаточ-
квинтетные и более высокой мультиплетности, ча-
но четко установленных обобщенных и система-
сто значительно различающиеся геометрическим
тизированных закономерностей, определяющих
строением [8].
структуру образующихся комплексов в зависимо-
Нами исследованы особенности и пути форми-
сти от условий синтеза и природы лигандов [7].
рования би- и пентаядерных комплексов Ni(II) с
Квантово-химическое исследование взаимных
карбоксилатными и азотсодержащими лигандами
превращений полиядерных координационных сое-
и выявлена роль мостиковых лигандов в форми-
1755
1756
ПАНИНА и др.
Таблица 1. Энергии Гиббса соединений в газовой фазе и в растворителе CH3CN и сольватационный вклад
-G°газ, a. е.
-G°МеCN,
-∆G°МеCN,
Соединение
(мультиплетность)
кДж/моль
кДж/моль
H2O
76.332891(1)
76.340170а
19.11а
76.339996а
18.65а
H3O+
76.608271(1)
76.731698aа
324.04а
76.729769а
318.98а
CH3CN
132.572076(1)
132.579929а
20.62
C6H5COOH
420.274863(1)
420.282450а
19.92а
C6H5COO-
419.716782 (1)
419.811489а
248.64а
tmeda
347.149173 (1)
347.153137а
10.41а
Py
247.933983 (1)
247.938970а
13.09
PyPz
511.906427 (1)
511.921254а
38.93а
HPyPz+
512.296190 (1)
512.365663а
182.39а
[O2CCH(CH3)2]1-
306.718406 (1)
306.813860а
250.60а
[Ni(H2O)6]2+
1965.411336 (1)
1965.694473а
743.34а
1965.686657а
722.82а
[(H2O)4Ni(μ-OH)2Ni(H2O)4]2+
3777.581000(1)
3777.831984а
658.92а
3777.823611б
636.94б
[(H2O)4Ni(μ-O)Ni(H2O)4]2+
3701.186743(1)
3701.441231а
668.12а
3701.431100б
641.52б
[Ni(CH3CN)6]2+
2302.923894(3)
2303.123527а
524.11а
2302.877628(1)
[Ni2(O2CCHMe2)4(tmeda)2(μ-H2O)]0 (1)
5013.421141(5)
5013.432910а
30.90а
[Ni2(O2CCHMe2)4(tmeda)2(μ-H2O)]0
5013.313136(1)
[Ni2(O2CCH(CH3)2)4(cis-Py)4(μ-H2O)]0 (2)
5310.842239(5)
5310.864596а
58.70а
[Ni2(O2CCHMe2)4(cis-Py)4(μ-H2O)]0
5310.744656(1)
[Ni2(O2CCHMe2)4(PyPz)2(μ-H2O)]0 (3)
5342.964687(5)
5342.990379а
67.45а
[Ni2(O2CCHMe2)4(PyPz)2(μ-H2O)]0
5342.854890(1)
[Ni2(O2CC6H5)4(PyPz)2(μ-H2O)]0 (4)
5794.92301(5)
5794.957870а
91.52а
5794.821460(1)
[Ni5(O2CC6H5)8(PyPz)4(μ-OH)2]0 (5)
13096.636838 (11)
13096.692378а
145.81а
13096.609724 (9)
13096.581579 (3)
13096.380919 (1)
а В воде. б В этаноле.
ровании полиядерных структур. Для прогнозиро-
DFT PBE0 [9] с использованием относительно
вания реакций, приводящих к образованию поли-
простого базиса 6-31G(d,p) [10, 11] и программно-
ядерных карбоксилатных комплексов никеля(II),
го комплекса GAUSSIAN’16 [12]. Ввиду важности
использован метод квантово-химического модели-
учета влияния растворителя, в различной степени
рования формирования продукта. В связи с необ-
стабилизирующего нейтральные молекулярные
ходимостью расчетов больших олигоядерных си-
системы и разнозарядные ионы, в рамках модели
стем, требующих значительных временных затрат,
поляризуемого континуума [13, 14] рассчитаны
квантово-химические расчеты проводили методом
энергии сольватации соединений.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
ФОРМИРОВАНИЕ ОЛИГОЯДЕРНЫХ КАРБОКСИЛАТНЫХ КОМПЛЕКСОВ НИКЕЛЯ(II)
1757
Формирование координационных соединений
синглетных на 2.7-3.0 эВ (табл. 1). Помимо боль-
рассматривается как самосборка из центрального
шой энергетической разницы между энергиями
иона и окружающих лигандов. К реакциям, при-
спиновых изомеров, заключение о высокоспи-
водящим к образованию конечного продукта, при-
новом характере образующихся координацион-
менен классический критерий изменения энергии
ных соединений подтверждается их структурами.
Гиббса (∆G°) в ходе образования структур: чем
Согласно проведенному DFT-моделированию, в
меньше эта величина, тем устойчивее координа-
низкоспиновом состоянии каждый ион никеля(II)
ционное соединение. Результаты квантово-хими-
находится не в октаэдрическом, а в близком к пло-
ческих расчетов представлены в табл. 1.
скоквадратному окружении атомами лигандов, в
котором отсутствуют связи с мостиковыми кар-
При растворении синтетического хельерита
боксилатными лигандами. Причина такого строе-
NiCO3∙5.5H2O [15] в смеси карбоновая кислота-
ния диамагнитных координационных образований
органический растворитель существует возмож-
ионов Ni(II) объясняется отталкиванием связыва-
ность образования некоторого количества аква-
ющих электронных пар лигандов, находящихся в
комплексных катионов [Ni(H2O)n(Solv)6-n]2+ (n =
аксиальных положениях, от электронов более вы-
1-6). Источниками молекул воды при получении
тянутой эллипсоидальной синглетной d8-оболочки
карбоксилатных комплексов Ni(II) в растворителе
иона металла [19]. Полученные данные позволили
могут быть как исходный синтетический хельерит,
при оценке термодинамической возможности про-
так и остаточная вода растворителя и(или) влага
текания реакций, участвующих в формировании
воздуха [16]. Продукты гидролиза этих катионов
биядерных координационных соединений, рассма-
теоретически могли бы положить начало форми-
тривать изменение энергии Гиббса этих реакций
рования биядерных координационных соединений
только для высокоспиновых комплексов.
с молекулой воды в мостиковом положении [17].
Однако, по результатам расчетов термодинами-
Структуры биядерных координационных
ческих характеристик реакций гидролиза, анало-
соединений
[Ni2(O2CCHМе2)4(tmeda)2(μ-H2O)]
гичных рассмотренным в работе [18] для акваком-
(1),
[Ni2(O2CCHМе2)4(cis-Py)4(μ-H2O)]
(2),
плексов железа(II,III), образованию соответству-
[Ni2(O2CCHМе2)4(PyPz)2(μ-H2O)]
(3)
и
ющих биядерных гидроксо- и оксо-мостиковых
[Ni2(O2CC6H5)4(PyPz)2(μ-H2O)]0
(4)
[tmeda
-
соединений никеля(II) соответствуют большие по-
N,N,N',N'-тетраметилэтилендиамин,
PyPz
-
ложительные значения энергии Гиббса ∆G° как в
2-(5-метил-1H-пиразол-3-ил)пиридин], оптимизи-
газовой фазе, так и с учетом растворителя: ∆G°газ =
рованные методом DFT в газовой фазе, представ-
65.98, ∆G°H2O = 245.64 (кДж/моль) (1); ∆G°газ =
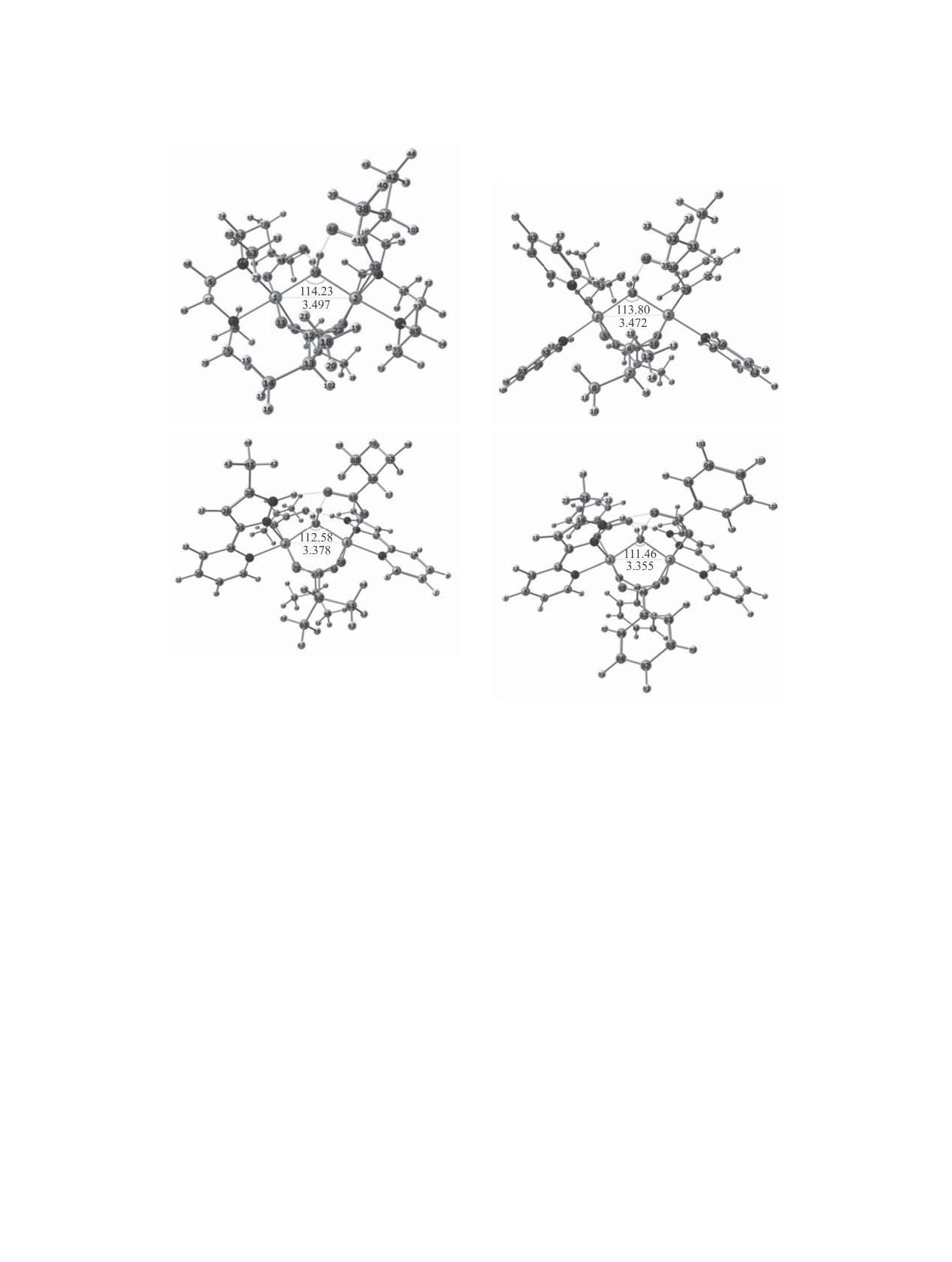
лены на рис. 1. Значения длин важнейших связей
161.11, ∆G°H2O = 132.80 (кДж/моль) (2).
и валентных углов в газовой фазе и в растворителе
2[Ni(H2O)6]2+ →← [(H2O)4Ni(μ-OH)2Ni(H2O)4]2+
CH3CN представлены в табл. 2. Каждый ион ни-
келя(II) в исследуемых комплексах имеет окру-
+ 2Н3О+,
(1)
жение, состоящее из двух атомов азота одного
[(H2O)4Ni(μ-OH)2Ni(H2O)4]2+
бидентатно координированного азотсодержащего
→
[(H2O)4Ni(μ-O)Ni(H2O)4]2+ + H2O.
(2)
←
лиганда (или двух монодентатных), атома кисло-
Полученные данные свидетельствуют о том,
рода монодентатно координированного карбокси-
что рассматриваемые продукты гидролиза катио-
латного аниона, а также двух мостиковых атомов
нов [Ni(H2O)6]2+ могут образоваться лишь в ни-
кислорода карбоксилатых анионов, связывающих
чтожных количествах и не влияют на формирова-
атомы металла друг с другом. Дополняет окруже-
ние биядерных соединений ионов этого металла.
ние ионов никеля(II) до октаэдрического мостико-
Квантово-химические исследования биядерных
вая молекула Н2О. Полученные квантово-химиче-
азотсодержащих комплексов Ni(II) с карбоксилат-
ские результаты соответствуют кристаллографи-
ными лигандами и координированной молекулой
ческим данным комплексов 1, 2 и 5, депонирован-
Н2О позволили сделать вывод о наибольшей ста-
ным в Кембриджском банке рентгеноструктурных
бильности исследуемых соединений в высокоспи-
данных [CCDC 1840763 (1),1913469 (2), 1900941
новых квинтетных состояниях, отличающихся от
(5)].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
1758
ПАНИНА и др.
Таблица 2. Данные DFT-оптимизации соединений в газовой фазе и в CH3CN: межатомные расстояния r(A-B), углы
центральных фрагментов Ni1ONi2 и НОН
r(A-B), Å (валентный угол, град)
Cоединение
Связь, угол
газовая фаза
CH3CN
1
r(Ni1-N3), r(Ni2-N8)
2.178, 2.178
2.175, 2.175
r(Ni1-N6), r(Ni2-N7)
2.209, 2.209
2.194, 2.194
r(Ni1-O11), r(Ni2-O34)
2.020, 2.020
2.023, 2.023
r(Ni1-O23), r(Ni2-O22)
2.020, 2.020
2.027, 2.027
r(Ni1-O47), r(Ni2-O35)
2.066, 2.066
2.071, 2.071
r(Ni1-O59), r(Ni2-O59)
2.082, 2082
2.103, 2.103
r(O59-H60), r(O59-H61)
1.026, 1.026
1.021, 1.021
r(O46-H60), r(O58-H61)
1.493, 1.493
1.517, 1.517
r(Ni1-Ni2)
3.497
3.533
Ni1O59Ni2, Н60O59Н61
(114.23, 106.40)
(114.31, 105.18)
2
r(Ni1-N80), r(Ni2-N3)
2.108, 2.108
2.109, 2.109
r(Ni1-N91), r(Ni2-N4)
2.094, 2.094
2.090, 2.090
r(Ni1-O5), r(Ni2-O28)
2.022, 2.022
2.024, 2.024
r(Ni1-O17), r(Ni2-O16)
2.027, 2.027
2.042, 2.042
r(Ni1-O41), r(Ni2-O29)
2.058, 2.058
2.063, 2.063
r(Ni1-O53), r(Ni2-O53)
2.072, 2.072
2.075, 2.075
r(O53-H54), r(O53-H55)
1.023, 1.023
1.022, 1.022
r(O40-H54), r(O52-H55)
1.515, 1.515
1.514, 1.514
r(Ni1-Ni2)
3.472
3.492
Ni1O53Ni2, Н54O53Н55
(113.80, 111.18)
(114.57, 108.65)
3
r(Ni1-N3), r(Ni2-N25)
2.085, 2.085
2.086, 2.086
r(Ni1-N19), r(Ni2-N20)
2.082, 2.082
2.075, 2.075
r(Ni1-O45), r(Ni2-O70)
2.023, 2.021
2.037, 2.037
r(Ni1-O58), r(Ni2-O57)
2.009, 2.010
2.012, 2.012
r(Ni1-O84), r(Ni2-O71)
2.087, 2.088
2.107, 2.107
r(Ni1-O97), r(Ni2-O97)
2.031, 2.030
2.028, 2.028
r(O97-H98), r(O97-H99)
1.022, 1.021
1.024, 1.024
r(O83-H98), r(O96-H99)
1.494, 1.494
1.480, 1.480
r(Ni1-Ni2)
3.378
3.401
Ni1O97Ni2, Н98O97Н99
(112.58, 110.58)
(113.97, 109.50)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
ФОРМИРОВАНИЕ ОЛИГОЯДЕРНЫХ КАРБОКСИЛАТНЫХ КОМПЛЕКСОВ НИКЕЛЯ(II)
1759
Таблица 2. (Продолжение)
r(A-B), Å (валентный угол, град)
Cоединение
Связь, угол
газовая фаза
CH
3
CN
4
r(Ni1-N3), r(Ni2-N25)
2.083, 2.083
2.084, 2.084
r(Ni1-N19), r(Ni2-N20)
2.070, 2.070
2.067, 2.067
r(Ni1-O45), r(Ni2-O50)
2.032,2.032
2.041, 2.041
r(Ni1-O54), r(Ni2-O51)
2.089, 2.089
2.105, 2.105
r(Ni1-O48), r(Ni2-O47)
2.002, 2.002
2.011, 2.011
r(Ni1-O57), r(Ni2-O57)
2.030, 2.030
2.030, 2.030
r(O57-H58), r(O57-H59)
1.022, 1.022
1.023, 1.023
r(O53-H58), r(O56-H59)
1.491, 1.491
1.487, 1.487
r(Ni1-Ni2)
3.355
3.393
Ni1O57Ni2, Н58O57Н59
(111.46, 109.84)
(113.37, 109.35)
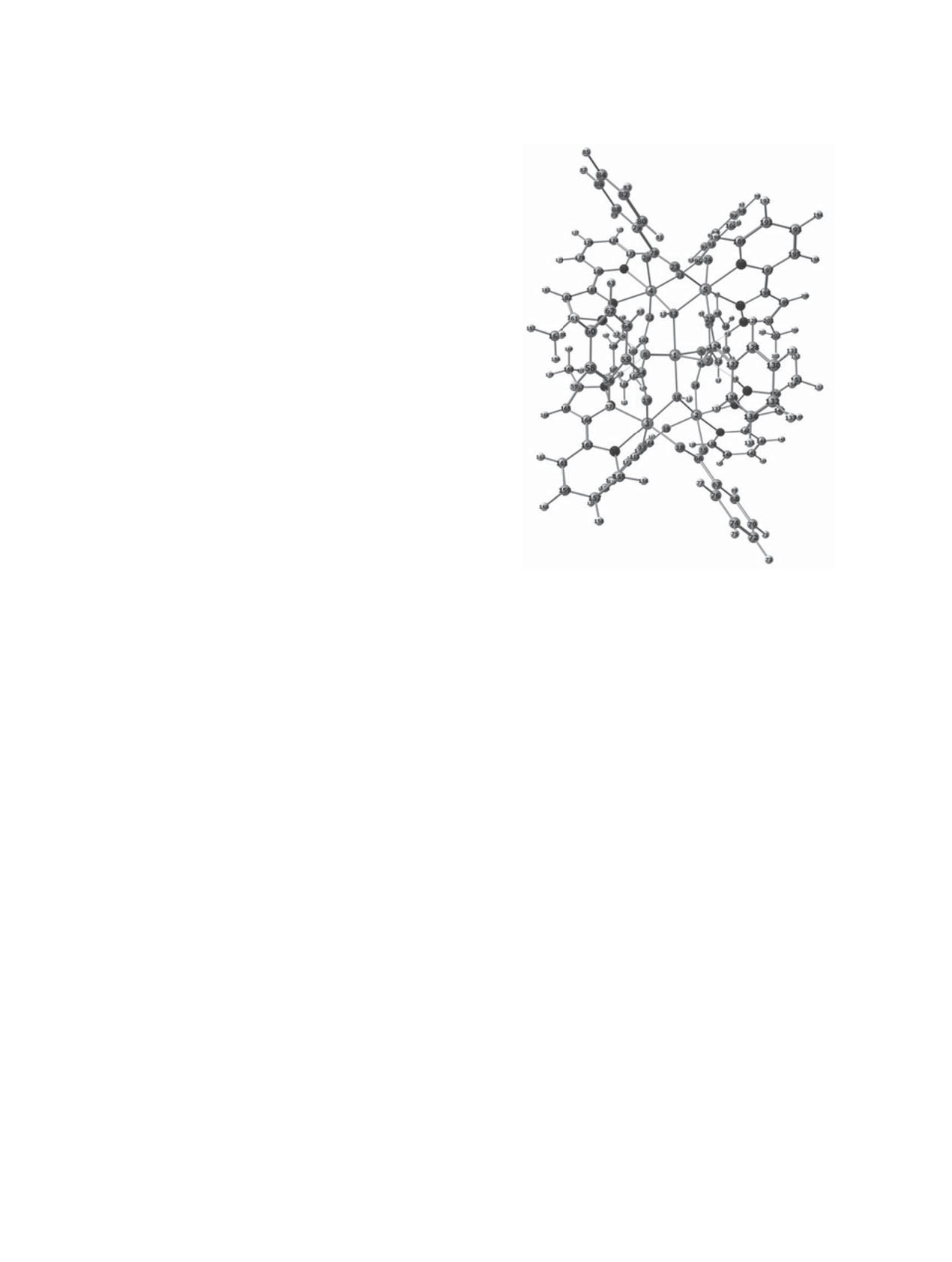
5
r(Ni1-O6), r(Ni2-O7)
2.043, 2.111
2.045, 2.114
r(Ni1-O8), r(Ni2-O9)
2.110, 2.043
2.112, 2.049
r(Ni1-O10), r(Ni1-O12)
2.041, 2.041
2.047, 2.045
r(Ni2-O14), r(Ni2-O15)
2.046, 2.072
2.053, 2.080
r(Ni2-O16), r(Ni2-O10)
2.010, 2.015
2.021, 2.021
r(Ni2-N26), r(Ni2-N27)
2.141, 2.090
2.138, 2.082
r(Ni3-O17), r(Ni3-O18)
2.044, 2.029
2.053, 2.037
r(Ni3-O19), r(Ni2-O10)
2.017, 2.036
2.076, 2.042
r(Ni3-N30), r(Ni3-N31)
2.123, 2.062
2.125, 2.061
r(Ni4-O20), r(Ni4-O21)
2.072, 2.010
2.082, 2.019
r(Ni4-O22), r(Ni4-O12)
2.046, 2.015
2.057, 2.020
r(Ni4-N34), r(Ni4-N35)
2.141, 2.090
2.139, 2.081
r(Ni5-O23), r(Ni5-O24)
2.029, 2.043
2.038, 2.056
r(Ni5-O25), r(Ni5-O12)
2.070, 2.036
2.072, 2.044
r(N5-N38), r(Ni5-N39)
2.123, 2.062
2.125, 2.058
r(Ni2-Ni3), r(Ni4-Ni5)
3.319
3.338, 3.336
Ni2μOHNi3, Ni4μOHNi5
(110.01)
(110.36, 110.49)
Образование биядерных структур 1-4 Ni(II) с
C6H5 (4); n = 2 (tmeda, PyPz), 4 (Рy).
карбоксилатными и азотсодержащими лигандами
Полученные на основе квантово-химических
представлено общим уравнением (3).
данных (табл. 1) величины изменений энергий
2[Ni(CH3CN)6]2+ + 4(O2CR)1- + nL + H2O
Гиббса с учетом растворителя ∆G°МеCN для ре-
→
←
[Ni2(O2CR)4Ln(H2O)]0 + 12CH3CN,
(3)
акции (3) составляют
-638.73
(1),
-591.69
(2),
L = tmeda (1), Рy (2), PyPz (3); R = CH(CH3)2 (1-3),
-694.48 (3), -634.03 кДж/моль (4). При форми-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
1760
ПАНИНА и др.
(а)
(б)
(в)
(г)
Рис. 1. Оптимизированные методом DFT структуры биядерных координационных соединений(а)
[Ni2(O2CCHМе2)4·
(tmeda)2(μ-H2O)] 1, (б) [Ni2(O2CCHМе2)4(cis-Py)4(μ-H2O)] 2, (в) [Ni2(O2CCHМе2)4(PyPz)2(μ-H2O)] 3, (г) [Ni2(O2CC6H5)4·
(PyPz)2(μ-H2O)] 4.
ровании комплексов (1-3), которые различают-
азотсодержащий лиганд добавляют после полно-
ся только N-содержащими лигандами, величины
го протекания реакции исходного NiCO3∙5.5H2O
∆G°МеCN уменьшаются в следующем порядке: 3 >
с карбоновой кислотой, было сделано предполо-
1 > 2. Отмеченная тенденция согласуется с наи-
жение о том, что при формировании координа-
более короткими межатомными расстояниями
ционных полиэдров Ni(II) с карбоксилатными и
r(Ni-N) в этом ряду для соединения 3 (табл. 2).
азотсодержащими лигандами 1-4 первоначально
Анализ энергетических эффектов в соединениях 3
формируются промежуточные структуры с кар-
и 4, различающихся карбоксилатными лигандами,
боксилатными лигандами и координированными
позволил сделать вывод о том, что алифатический
молекулами растворителя, а в присутствии воды
изобутиратный лиганд в большей мере стабили-
в реакционной системе - с ее координированны-
зирует комплекс, чем ароматический бензоатный.
ми молекулами. Впоследствии эти лабильные
Если в реакции (3) в качестве исходного координа-
молекулы могут легко замещаться донорными
ционного соединения рассматривать не сольвати-
N-содержащими лигандами [20-22].
рованный катион [Ni(CH3CN)6]2+, а аквакомплекс
Результаты моделирования показывают, что в
[Ni(H2О)6]2+, то тенденции изменений рассчитан-
формировании устойчивых карбоксилатных ком-
ных значений ∆G°МеCN сохраняются.
плексов большую роль играют водородные связи
Исходя из условий синтеза, согласно которым
между координирующимися лигандами. В моноя-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
ФОРМИРОВАНИЕ ОЛИГОЯДЕРНЫХ КАРБОКСИЛАТНЫХ КОМПЛЕКСОВ НИКЕЛЯ(II)
1761
дерных структурах [Ni(O2CR)2(H2O)4] образуются
прочные внутримолекулярные водородные связи
НОН∙∙∙OC(O)R, которые тормозят образование
двух пар карбоксилатных мостиков между ионами
металла. В отсутствие воды или других донорных
молекул, способных к образованию Н-связей, та-
кие мостики приводят к формированию систем
геометрии «китайского фонарика» с характерны-
ми короткими расстояниями NiII∙∙∙NiII, например,
2.361-2.621 Å в [Ni2(μ-O2CCH3)4(O-DMSO)2] [23].
В соединениях 1-4, в которых два лиганда -O2CR
«стягивают» пару ионов Ni(II) мостиковыми свя-
зями, а остальные два лигада -O2CR - терминаль-
ные, формируется биядерный остов с расстояния-
ми металл-металл, превышающими 3.35 Å (рис. 1).
Между ионами металлов находится одна молекула
μ-H2O, завершающая октаэдрическое окружение
каждого иона Ni(II) и блокирующая их сближе-
ние на более близкое расстояние. В соединениях
3 и 4 терминальные лиганды PyPz дополнительно
стабилизируют структуру биядерного остова об-
Рис.
2. Оптимизированная структура комплекса
разованием водородных связей >NH∙∙∙OC(O)R, в
[Ni5(O2CC6H5)8(PyPz)4(μ-OH)2] 5.
которых участвуют карбоксилатные лиганды, мо-
нодентатно координированные к соседним ионам
5[Ni(CH3CN)6]2+ +10 -O2CC6H5 + 4PyPz + 2H2O
NiII (рис. 1).
→
←
[Ni5(O2CC6H5)8(PyPz)4(μ-OH)2]
Из
оптимизации
геометрии
пента-
+ 2C6H5COOH + 30CH3CN.
(4)
ядерного
координационного
соединения
Пентаядерный комплекс
[Ni5(O2CC6H5)8·
[Ni5(O2CC6H5)8(PyPz)4(μ-OH)2] 5 различной муль-
(PyPz)4(μ-OH)2] 5 получен в условиях, аналогич-
типлетности следует, что, как и в случае биядер-
ных условиям синтеза биядерного аквамости-
ных структур, комплекс 5 имеет значительно более
кового комплекса 4. Поэтому в качестве одного
низкую энергию в максимально возможном высо-
из наиболее вероятных путей его формирования
коспиновом состоянии (табл. 1).
можно рассматривать самосборку из биядер-
При моделировании образования пентаядер-
ных фрагментов, в которых происходит перенос
ного дигидроксомостикового координационного
протонов с лигандов μ-H2O и образование групп
соединения 5 (рис. 2) из простых структур следу-
μ-OH. Определяющую роль в этом процессе могут
ет учесть перенос двух протонов на частицы-ак-
играть некоординированные сольватированные
цепторы, содержащиеся в реакционной системе.
ионы Ni(II).
В рассматриваемом случае возможно протониро-
вание некоординированных анионов -O2СC6H5,
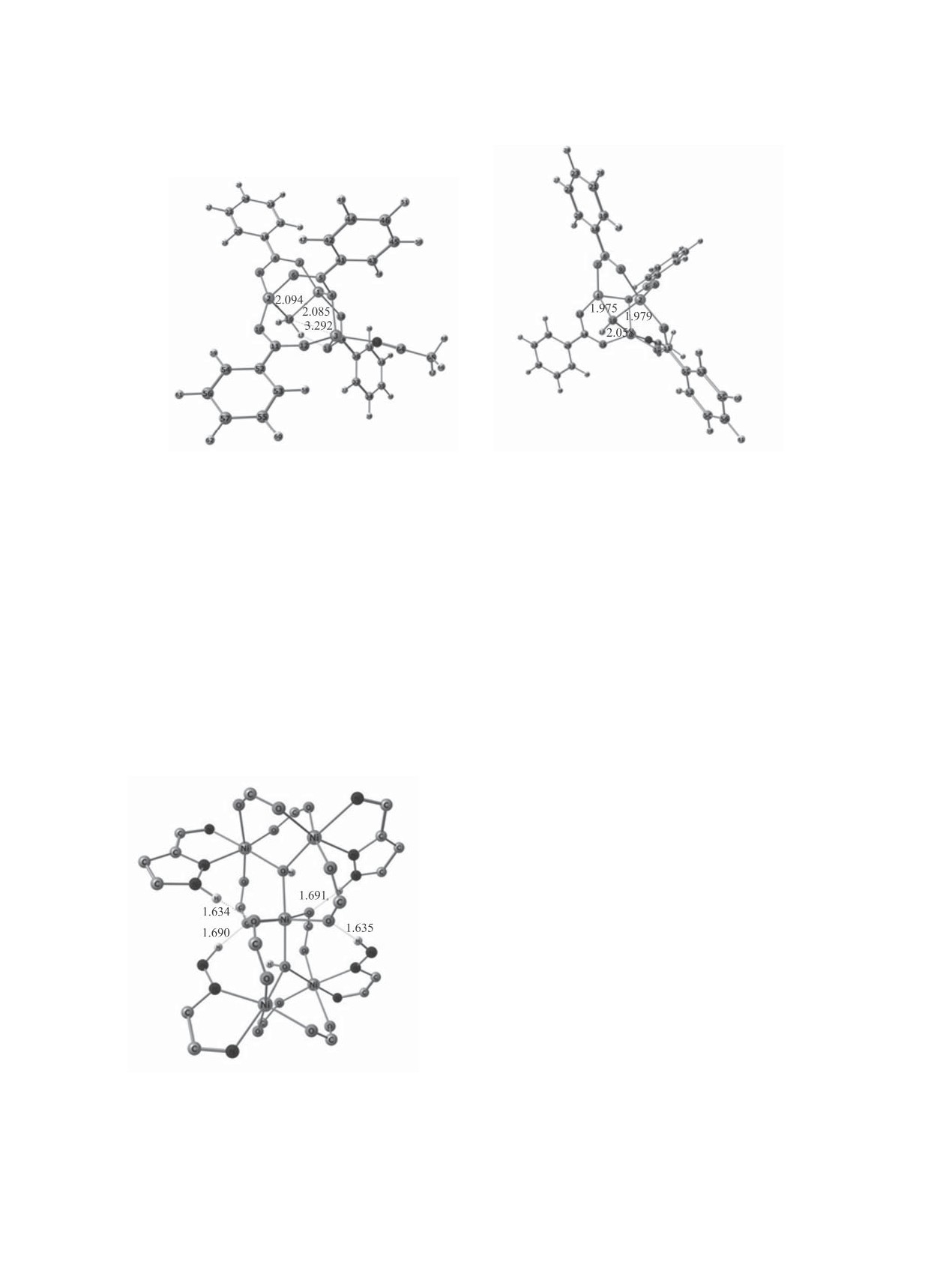
В модельном биядерном комплексе
азотсодержащего соединения PyPz, а также
{Ni2(O2CC6H5)4(μ-H2O)[Ni(3)CH3CN]}2+,
пред-
молекул H2O и(или) неводного растворителя.
ставленном на рис. 3а, в целях упрощения и боль-
Проведенные на основании данных табл. 1 расче-
шей наглядности отсутствуют затрудняющие
ты ∆G°газ и ∆G°МеCN для реакции (4) показали, что
восприятие объемистые азотсодержащие лиган-
наибольшая стабилизация системы в ходе форми-
ды. Монодентатно координированные анионы
рования координационного соединения 5 соответ-
-O2CC6H5 вторыми атомами кислорода замещают
ствует переносу протона на некоординированный
большинство лигандов сольватной оболочки иона
анион -O2СC6H5 с образованием свободной карбо-
металла и подтягивают подходящий к ним катион
новой кислоты.
[Ni(3)CH3CN]2+ на близкое расстояние. Эта опти-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
1762
ПАНИНА и др.
(а)
(б)
Рис. 3. Модельные оптимизированные структуры биядерных комплексов. (а) {Ni2(O2CC6H5)4(μ-H2O)[Ni(3)CH3CN]}2+,
(б) {NiII2(O2CC6H5)4(μ-OH)[NiII(3)CH3CN]}+.
мизированная структура характеризуется относи-
трила, бензоат-аниона или азотсодержащего ли-
тельно малыми значениями r[Ni(1)-OH2] = 2.085,
ганда) в оптимизированном модельном трехъядер-
r[Ni(2)-OH2] = 2.094 Å и большим r[Ni(3)∙∙∙OH2] =
ном образовании (рис. 3б), сходным с трехядерны-
3.292 Å. Увеличение последнего межатомного рас-
ми гомо- и гетерометаллическими пивалатными
стояния вызвано электростатическим отталкива-
комплексами кобальта и никеля [24], межатомное
нием входящего катиона [Ni(3)CH3CN]2+ от поло-
расстояние r[NiII(3)-OH2] = 2.058 Å резко умень-
жительно заряженного атома Н молекулы μ-Н2О,
шено по сравнению с его значением в структуре,
которое препятствует образованию связи с атомом
изображенной на рис. 3а. Это обусловлено не
кислорода.
только различиями в донорной способности мо-
В отсутствие в трехъядерном катионе
стиковых лигандов Н2О и НО-, но и электростати-
{Ni2(O2CC6H5)4(μ-OH)[Ni(3)CH3CN]}1+ атома Н
ческим притяжением входящего катиона Ni(II)(3) к
молекулы μ-H2O (его переноса в виде протона на
центральному лиганду НО-.
одну из внешнесферных молекул - воды, ацетони-
При неизменности внешних условий перенос
протона является следствием некоторого внутрен-
него процесса. В качестве такового в предлагаемой
модели формирования олигоядерного комплекса
рассматривается конкурентное замещение встра-
ивающихся сольватированных моноядерных ка-
тионов Ni(II), имеющих больший положительный
заряд (в оценке по Малликену 1.06 e), чем у атомов
Н молекулы μ-H2O (0.41 и 0.44 e). Входящий ка-
тион Ni(II) во внутренней координационной сфере
на близком расстоянии способен промотировать
перенос протона молекулы μ-H2O на внешнесфер-
ные акцепторы и при этом образовать прочную
связь Ni(3)-μ-OH (рис. 3б).
В сформировавшемся трехъядерном катионе
Рис. 4. Стабилизация остова координационного сое-
{Ni2(O2CC6H5)4(μ-OH)[Ni(3)CH3CN]}1+ 5 практи-
динения [Ni5(O2CC6H5)8(PyPz)4(μ-OH)2]0 5 лигандами
PyPz (часть атомов С и Н лигандов PyPz и -O2CC6H5
чески весь положительный заряд (0.99 е) по-преж-
не показана).
нему сосредоточен на атоме Ni(3). Поэтому он
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
ФОРМИРОВАНИЕ ОЛИГОЯДЕРНЫХ КАРБОКСИЛАТНЫХ КОМПЛЕКСОВ НИКЕЛЯ(II)
1763
и далее способен притягивать атомы кислоро-
Am. Chem. Soc. 2017. Vol. 139. P. 6919. doi 10.1021/
да монодентатно координированных карбокси-
jacs.7b01625
латных лигандов другого биядерного полиэдра
4. Eremenko I.L., Nefedov S.E., Sidorov A.A.,
[Ni2(O2CC6H5)4(μ-H2O)], замещать ими оставшу-
Golubnichaya M.A., Danilov P.V., Ikorskii V.N.,
юся сольватную оболочку и промотировать пере-
Shvedenkov Yu.G., Novotortsev V.M., Moiseev I.I. //
нос протона с образованием еще одной группы
Inorg. Chem. 1999. Vol. 38. N 17. P. 3764. doi 10.1021/
μ-OH. Дополнительную роль в стабилизации пен-
ic981292w
таядерного комплекса 5, также как и биядерных
5. Сидоров А.А., Фомина И.Г., Талисманов С.С., Алек-
соединений 3 и 4, играют пиррольные атомы Н ли-
сандров Г.Г., Новоторцев В.М., Нефедов С.Е., Ере-
гандов PyPz, связывающие водородными связями
менко И.Л. // Коорд. хим. 2001. Т. 27. № 8. С. 584;
атомы кислорода лигандов -O2CC6H5 соседнего
Sidorov A.A., Fomina I.G., Talismanov S.S., Aleksand-
би(трех)ядерного фрагмента (рис. 4).
rov G.G., Novotortsev V.M., Nefedov S.E., Eremen-
Таким образом, по результатам квантово-хи-
ko I.L. // Russ. J. Coord. Chem. 2001. Vol. 27. P. 548.
мического моделирования полиядерных коорди-
doi 10.1023/A:1011349727749
национных соединений различной мультиплет-
6. Гоголева Н.В., Александров Г.Г., Кискин М.А., Си-
ности [Ni2(O2CR)4Ln(μ-H2O)]0 и [Ni5(O2CR)8Ln(μ-
доров А.А., Еременко И.Л. // Коорд. хим. 2018.
OH)2]0, где L - азотсодержащие лиганды, комплек-
Т. 44. № 5. С. 283; Gogoleva N.V., Aleksandrov G.G.,
сы Ni(II) находятся в наиболее высокоспиновых
Kiskin M.A., Sidorov A.A., Eremenko I.L. // Russ. J.
состояниях. В формировании устойчивых поли-
Coord. Chem. 2018. Vol. 44. N 10. P. 585. doi 10.1134/
ядерных карбоксилатных комплексов большую
S1070328418100044.
роль играют водородные связи между координи-
7. Perlepe P.S., Cunha-Silva L., Bekiari V., Gagnon K.J.,
рованными лигандами.
Teat S.J., Escuer A., Stamatatos T.C. // Dalton Trans.
Рентгеновские исследования проведены в ре-
2016. Vol. 45. N 25. P. 10256. doi 10.1039/c6dt01162d
сурсном центре Санкт-Петербургского государ-
8. Панина Н.С., Еремин А.В., Беляев А.Н. // ЖОХ.
ственного университета «Рентгенодифракционные
2015. Т. 85. Вып. 7. С. 1131; Panina N.S., Eremin A.V.,
методы исследования».
Belyaev A.N. // Russ. J. Gen. Chem. 2015. Vol. 85. N 7.
P. 1655. doi 10.1134/S1070363215070142
ФОНДОВАЯ ПОДДЕРЖКА
9. Adamo C., Barone V. // J. Chem. Phys. 1999. Vol. 110.
Работа выполнена при финансовой поддерж-
N 13. P. 6158. doi 10.1063/1.478522
ке Министерства науки и высшего образования
10. Hehre W.J., Ditchfield R., Pople J.A. // J. Chem. Phys.
Российской Федерации в рамках госзадания и
1972. Vol. 56. N 5. P. 2257. doi 10.1063/1.1677527
Российского фонда фундаментальных исследова-
11. Rassolov V.A., Pople J.A., Ratner M., Windus T.L. //
ний (проект № 19-08-01232).
J. Chem. Phys. 1998. Vol. 109. N 4. P. 1223. doi
КОНФЛИКТ ИНТЕРЕСОВ
10.1063/1.476673
12. Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
Авторы заявляют об отсутствии конфликта
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
интересов.
Petersson G.A., Nakatsuji H. Li X., Caricato M.,
СПИСОК ЛИТЕРАТУРЫ
Marenich A.V., Bloino J., Janesko B.G., Gomperts R.,
Mennucci B., Hratchian H.P., Ortiz J.V., Izmaylov A.F.,
1. Ward A.J., MastersA.F., Maschmeyer T. // Compr. Inorg.
Sonnenberg J.L., Williams-Young D., Ding F., Lippa-
Chem. II. New York: Elsevier, 2013. Vol. 8. P. 191. doi
rini F., Egidi F., Goings J., Peng B., Petrone A.,
10.1016/b978-0-08-097774-4.00825-1
Henderson T., Ranasinghe D., Zakrzewski V.G., Gao J.,
2. Ward A.J., Masters A.F., Maschmeyer T. // Compr. Inorg.
Rega N., Zheng G., Liang W., Hada M., Ehara M.,
Chem. II. New York: Elsevier, 2013. Vol. 6. P. 665. doi
Toyota K., Fukuda R., Hasegawa J., Ishida M.,
10.1016/B978-0-08-097774-4.00630-6
Nakajima T., Honda Y., Kitao O., Nakai H., Vreven T.,
3. Margossian T., Larmier K., Kim S.M., Krumeich F.,
Throssell K., Montgomery J.A., Jr., Peralta J.E.,
Fedorov A., Chen P., Müller C. R., Copéret C. // J.
Ogliaro F., Bearpark M.J., Heyd J.J., Brothers E.N.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
1764
ПАНИНА и др.
Kudin K.N., Staroverov V.N., Keith T.A., Kobayashi R.,
Molecular Geometry. Boston: Allyn & Bacon, 1991.
Normand J., Raghavachari K., Rendell A.P., Bu-
P. 185.
rant J.C., Iyengar S.S. Tomasi J., Cossi M., Millam J.M.,
20. Chattopadhyay P.K., Kratochvil B. // Canad. J. Chem.
Klene M., Adamo C., Cammi R., Ochterski J.W., Mar-
2011. Vol. 55. N 19. P. 3449. doi 10.1139/v77-483
tin R.L., Morokuma K., Farkas O., Foresman J.B.,
Fox D.J. Gaussian, Inc., Wallingford CT, 2016.
21. Coetzee J.F., KarakatsanisC.G. // Inorg. Chem. 1976.
13. Miertus S., Scrocco E., Tomasi J. // Chem. Phys. 1981.
Vol. 15. N 12. P. 3112. doi 10.1021/ic50166a036
Vol. 55. N 1. P. 117. doi 10.1016/0301-0104(81)85090-2
22. Griend D.A.V., Bediako D.K.,DeVries M.J., DeJong N.A.,
14. Tomasi J., Persico M. // Chem. Rev. 1994. Vol. 94. N 7.
Heeringa L.P.// Inorg. Chem. 2008. Vol. 47. N 2. P. 656.
P. 2027. doi 10.1021/cr00031a013
doi 10.1021/ic700553d
15. Bette S., Rincke C., Dinnebier R.E., Voigt W. // Z.
anorg. allg. Chem. 2016. Vol. 642. N 9-10. P. 652. doi
23. Панина Н.С., Еремин А.В., Герасимова Л.С., Ники-
10.1002/zaac.201600044
форов А.А.,Беляев А.Н. // ЖОХ. 2012. Т. 82. Вып. 9.
16. Николаевский С.А., Кискин М.А., Старикова А.А,,
С. 1417; Panina N.S., Eremin A.V., Gerasimova L.S.,
Ефимов Н.Н., Сидоров А.А,, Новоторцев В.М., Ере-
Nikiforov A.A., Belyaev A.N. // Russ. J. Gen. Chem.
менко И.Л. // Изв. АН. Сер. хим. № 12. С. 2812;
2012. Vol. 82. N 9. P. 1476. doi
10.1134/
Nikolaevskii S.A., Kiskin M.A., Starikova A.A., Efi-
mov N.N., Sidorov A.A., Novotortsev V.M., Eremenko I.L.//
S1070363212090034
Russ. Chem. Bull. 2016. Vol. 65. N 12. P. 2812. doi
24. Александров Г.Г., Фомина И.Г., Сидоров А.А., Ми-
10.1007/s11172-016-1661-z
хайлова Т.Б., Жилов В.И., Икорский В.Н., Новотор-
17. Spiccia L. // Inorg. Chim. Acta. 2004. Vol. 357. P. 2799.
цев В.М., Еременко И.Л., Моисеев И.И. // Изв. АН.
doi 10.1016/j.ica.2003.12.036
18. Панина Н.С., Беляев А.Н., Еремин А.В., Давидо-
Сер. хим. № 6. С. 1153; Aleksandrov G.G., Fomina I.G.,
вич П.Б. // ЖОХ. 2010. Т. 80. Вып. 5. С. 719; Pani-
Sidorov A.A., Mikhailova T.B., Zhilov V.I., Ikorski V.N.,
na N.S., Belyaev A.N., Eremin A.V, Davidovich P.B. //
Novotortsev V.M., Eremenko I.L., Moiseev I.I. // Russ.
Russ. J. Gen. Chem. 2010. Vol. 80. N 5. P. 889. doi
Chem.Bull. 2004. Vol. 53. N 6. P. 1200. doi 10.1023/B:
10.1134/S1070363210050038
19. Gillespie R.J., Hargittai I. The VSEPR Model of
RUCB.0000042274.55766.35
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
ФОРМИРОВАНИЕ ОЛИГОЯДЕРНЫХ КАРБОКСИЛАТНЫХ КОМПЛЕКСОВ НИКЕЛЯ(II)
1765
Formation of Oligo-Nuclear Carboxylate Nickel(II) Complexes
with Nitrogen-Containing Ligands. Quantum-Chemical Modeling
N. S. Paninaa, *, A. A. Nikiforova, b, D. O. Blinoua, E. N. Dubrova, A. I. Ponyaeva,
A. V. Ereminc, and A. N. Belyaeva
a St. Petersburg State Institute of Technology (Technical University), Moskovskii pr. 26, St. Petersburg, 190013 Russia
*e-mail: nataliepanina2707@gmail.com
b Institute of Macromolecular Compounds of the Russian Academy of Sciences, St.Petersburg, Russia
c St. Petersburg Polytechnic University, St. Petersburg, Russia
Received May 10, 2019; revised May 10, 2019; accepted May 16, 2019
Using the DFT method PBE0/6-31G(d, p) in the gas phase and taking into account the solvent, the formation of
bi- and pentahedral Ni(II) complexes with carboxylate and N-containing ligands was studied, and ΔG° of their
formation from simple compounds was estimated. The functional role of bridge groups and hydrogen bonds in
the formation of polynuclear structures is revealed. A model of self-organization of penta-nuclear coordination
compounds [NiII5(O2CR)8L2n(μ-OH)2]0 from binuclear complex [NiII2(O2CR)4Ln(μ-H2O)]0 is proposed, into
the structure of which mononuclear NiII cations are introduced and promote proton transfer from bridged aqua
ligands.
Keywords: nickel, carboxylate complexes, oligonuclear structures, DFT modeling
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019