ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 11, с. 1766-1779
УДК 54-386;546.492;546.593;543.442.3;544.016.2
ДВОЙНЫЕ ПСЕВДОПОЛИМЕРНЫЕ КОМПЛЕКСЫ
ЗОЛОТА(III)-РТУТИ(II) СОСТАВА [Au(S2CNR2)2]nX
[R2 = (CH2)6, (CH2)4O], ВКЛЮЧАЮЩИЕ АНИОНЫ
([HgCl3]-)n, [HgCl4]2-, [Hg2Cl6]2-: ХЕМОСОРБЦИОННЫЙ
СИНТЕЗ, ПРИНЦИПЫ СУПРАМОЛЕКУЛЯРНОЙ
САМООРГАНИЗАЦИИ И ТЕРМИЧЕСКОЕ ПОВЕДЕНИЕ
© 2019 г. О. В. Лосева, Т. А. Родина, А. В. Иванов*
Институт геологии и природопользования Дальневосточного отделения Российской академии наук,
пер. Рёлочный 1, Благовещенск, 675000 Россия
*e-mail: alexander.v.ivanov@chemist.com
Поступило в Редакцию 19 апреля 2019 г.
После доработки 19 апреля 2019 г.
Принято к печати 17 мая 2019 г.
Получены и структурно охарактеризованы новые псевдополимерные комплексы золота(III)-
ртути(II) с циклическими алкилендитиокарбаматными лигандами: ([Au{S2CN(CH2)6}2][HgCl3])n,
([Au{S2CN(CH2)6}2]2[HgCl4]∙H2O)n и ([Au{S2CN(CH2)4O}2]2[Hg2Cl6])n. Сложноорганизованная супра-
молекулярная структура полученных соединений реализуется за счет вторичных взаимодействий Au···S
невалентного типа и в качестве структурных единиц включает моноядерные и биядерные катионы и
анионы, а также катионные и анионные полимерные цепи. Термическое поведение полученных ком-
плексов изучено методом синхронного термического анализа. Продуктами термических превращений
комплексов являются восстановленное элементное золото и HgCl2.
Ключевые слова: дитиокарбаматы ртути(II), хемосорбционная активность, дитиокарбаматно-хлоридные
комплексы золота(III)-ртути(II), супрамолекулярная самоорганизация
DOI: 10.1134/S0044460X19110180
Дитиокарбаматы и их производные находят
состава [Hg2(S2CNR2)4] {R2 = (CH2)6 [15], (CH2)5
широкое промышленное применение во флота-
[16]; R = iso-C3H7 [17]} и [Hg{S2CN(CH2)4O}2]n
ционном обогащении сульфидных руд цветных
[18]1. Кроме того, при исследовании взаимодей-
металлов (реагенты-собиратели) [1] и производ-
ствия дитиокарбаматов ртути(II) c золотом(III)
стве резины (вулканизирующие добавки)
[2].
установлено эффективное связывание последне-
Дитиокарбаматы металлов являются удобными
го из растворов в твердую фазу с формированием
прекурсорами для получения полупроводнико-
супрамолекулярных гетероядерных комплексов
вых нанокристаллических порошков и пленочных
Au(III)-Hg(II) [16, 17, 21].
сульфидов металлов [3-8], а также гетерометал-
Целью настоящей работы явилось выявление
лических сульфидов [9]. В свою очередь, для ком-
плексов золота(III), включающих дитиокарбамат-
хемосорбционной активности комплексов рту-
ные лиганды, характерно проявление противоопу-
ти(II) с циклогексаметилен- и морфолиндитио-
холевой активности [10-12], a дитиокарбаматы зо-
карбаматными лигандами в отношении [AuCl4]-/
лота(I) обнаруживают люминесцентные свойства
HCl (2 M.), препаративное выделение комплексов
[13, 14].
1 Подробно систематика структурно охарактеризованных ди-
Ранее нами был получен и структурно охаракте-
тиокарбаматных комплексов ртути(II) рассматривается в
ризован ряд дитиокарбаматных комплексов ртути(II)
работах [19, 20].
1766
ДВОЙНЫЕ ПСЕВДОПОЛИМЕРНЫЕ КОМПЛЕКСЫ ЗОЛОТА(III)-РТУТИ(II)
1767
(а)
(б)
ɦɤɦ
ɦɤɦ
Рис. 1. Размер, форма частиц и энергодисперсионные
спектры комплексов состава [Hg{S2CN(CH2)4O}2] (а) и
[Au{S2CN(CH2)4O}2]2[Hg2Cl6] (б).
Au(III)-Hg(II) как индивидуальных форм связыва-
разцов Au и Cl (рис. 1б). Изменение химического
ния золота, а также изучение их структурной орга-
состава комплексов-хемосорбентов при связыва-
низации и термического поведения.
нии золота из раствора в твердую фазу является
Двойные
ионно-полимерные
соедине-
прямым свидетельством образования в исследуе-
мых хемосорбционных системах гетероядерных
ния
состава
([Au{S2CN(CH2)6}2][HgCl3])n
(1),
([Au{S2CN(CH2)6}2]2[HgCl4]·H2O)n
(2)
и
соединений Au(III)-Hg(II).
([Au{S2CN(CH2)4O}2]2[Hg2Cl6])n
(3) были по-
Хемосорбционное взаимодействие циклогек-
лучены в результате хемосорбционного связы-
саметилендитиокарбамата ртути(II) с H[AuCl4]
вания золота(III) из солянокислых растворов
в основном приводит к образованию соединения
дитиокарбаматными комплексами ртути(II).
1, среди пластинчатых кристаллов которого были
Свежеосажденные циклогексаметилен- и морфо-
отобраны единичные игольчатые кристаллы ком-
линдитиокарбаматы ртути(II) представляют собой
плекса 2. Таким образом, связывание золота(III) из
объемные творожистые осадки светло-желтого
раствора может быть описано двумя гетерогенны-
цвета с высокоразвитой поверхностью. По дан-
ми реакциями (1) и (2).
ным растровой электронной микроскопии, они
[Hg2{S2CN(CH2)6}4] + 2H[AuCl4]
представлены округлыми частицами диаметром
= 2[Au{S2CN(CH2)6}2][HgCl3] (1) + 2HCl,
(1)
~0.5 мкм; энергодисперсионные спектры, отража-
[Hg2{S2CN(CH2)6}4] + 2H[AuCl4]
ющие качественный элементный состав исходных
= [Au{S2CN(CH2)6}2]2[HgCl4] (2) + HgCl2 + 2HCl.
(2)
комплексов, представлены пиками Hg, C, N и S (на
Индивидуальной формой связывания зо-
рис. 1а приведены данные для [Hg{S2CN(CH2)4O}2]n).
лота(III) из растворов хемосорбентом состава
Взаимодействие дитиокарбаматов ртути(II) с рас-
[Hg{S2CN(CH2)4O}2]n является комплекс 3 (3).
творами H[AuCl4] сопровождается быстрым изме-
2[Hg{S2CN(CH2)4O}2] + 2H[AuCl4]
нением цвета хемосорбентов на интенсивно-жел-
= [Au{S2CN(CH2)4O}2]2[Hg2Cl6] (3) + 2HCl.
(3)
тый уже в первые минуты при одновременном
Реакции (1) и (3) формально сводятся к хемосор-
обесцвечивании рабочих растворов. Параллельно
бционному связыванию молекулы AuCl3 каждым
отмечается переформирование осадков с укруп-
моноядерным фрагментом [Hg(S2CNR)2] комплек-
нением и изменением формы частиц: округлые
сов. В реакции (2) связывание золота(III) сопрово-
частицы исходных комплексов преобразуются в
ждается частичным ионным обменом с выходом
преимущественно удлиненные (6.8-8.3 мкм, ди-
1/2 ртути(II) в раствор.
аметром 1.4-2.5 мкм) для продуктов реакции.
Энергодисперсионные спектры последних указы-
В ИК спектрах исследуемых кристаллических
вают на дополнительное присутствие в составе об-
комплексов высокоинтенсивные одиночные по-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
1768
ЛОСЕВА и др.
(а)
лученные данные позволяют предположить мень-
шую длину связей N-C(S)S в структуре 3.
Кроме того, у комплексов золота(III)-ртути(II)
полосы тиоуреидной группы в большей степени
смещены в высокочастотную область колебаний,
нежели у исходных дитиокарбаматов ртути(II):
[Hg2{S2CN(CH2)6}4] и
[Hg{S2CN(CH2)4O}2]n,
а также у соответствующих натриевых солей.
Отсюда можно сделать вывод, что перераспределе-
ние дитиокарбаматных групп из координационной
сферы ртути(II) в сферу золота(III) сопровождает-
(б)
ся возрастанием вклада двоесвязанности и, следо-
вательно, уменьшением длины связей N-C(S)S в
комплексах 1 и 3 по сравнению с дитиокарбамата-
ми ртути(II).
Полосы поглощения средней интенсивности
при 1063 (1), 1059 см-1 (3) и 972 (1), 993 см-1 (3)
отнесены к асимметричным (νas) и симметричным
(νs) валентным колебаниям групп C(S)S соответ-
ственно [23, 26]. Слабые полосы в области 538-
652 см-1 относятся к колебаниям ν(C-S) [27]. На
область 2851-2926 см-1 приходятся полосы погло-
(в)
щения, обусловленные симметричными и асим-
метричными валентными колебаниями связей
С-H в метиленовых группах дитиокарбаматных
лигандов. В спектре соединения 1 полоса погло-
щения при 749 см-1 характеризует маятниковые
деформационные колебания СН2-групп и указы-
вает на присутствие полиметиленовых цепочек в
составе циклических фрагментов -N(CH2)6, а до-
полнительно регистрируемая полоса средней ин-
тенсивности при 959 см-1 относится к валентным
колебаниям связей С-С [28]. Интенсивная полоса
с экстремумом при 1103 см-1 в спектре соедине-
Рис. 2. Упаковка структурных единиц в кристаллах со-
ния 3 отнесена к валентным колебаниям поляр-
единений 1 (а), 2 (б) и 3 (в).
ной группы С-О-С в шестичленном гетероцикле
N(CH2)4О [28].
лосы поглощения при 1522 (1) и 1537 (3) см-1 от-
Кристаллические структуры полученных
несены к валентным колебаниям связей N-C(S)S
соединений установлены методом РСА. Элемен-
[22, 23]. Однако эти значения ν(С-N) не попадают
тарные ячейки гетероядерных ионно-полимер-
в диапазоны валентных колебаний ни ординарных
ных комплексов 1-3 включают 4, 2 и 1 формуль-
С-N (1250-1360 см-1), ни двойных связей С=N
ные единицы соответственно: [Au{S2CN(CH2)6}2]∙
(1640-1690 см-1). Занимая промежуточное поло-
[HgCl3],
[Au{S2CN(CH2)6}2]2[HgCl4]∙H2O
и
жение, обсуждаемые величины существенно сме-
[Au{S2CN(CH2)4O}2]2[Hg2Cl6] (табл. 1, рис. 2).
щены в высокочастотную область, что указывает
В отличие от комплекса
1, центросимме-
на частично двойной характер формально орди-
тричные катионы [Au{S2CN(CH2)6}2]+ которого
нарной связи N-C(S)S [24, 25]. Таким образом, по-
структурно эквивалентны, в соединениях 2 и 3
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
ДВОЙНЫЕ ПСЕВДОПОЛИМЕРНЫЕ КОМПЛЕКСЫ ЗОЛОТА(III)-РТУТИ(II)
1769
Таблица 1. Кристаллографические данные, параметры эксперимента и уточнения структуры комплексов 1-3
Значение
Параметр
1
2
3
Брутто-формула
C14H24AuCl3HgN2S4
C28H50Au2Cl4HgN4OS8
C20H32Au2Cl6Hg2N4O4S8
М
852.50
1451.52
1656.79
Сингония
Моноклинная
Триклинная
Триклинная
Пространственная группа
C2/c
P-1
P-1
a, Å
20.9361(17)
10.0563(5)
8.0591(4)
b, Å
12.0006(7)
12.7103(7)
10.7044(5)
c, Å
8.8201(5)
17.4503(11)
11.9505(6)
α, град
90.00
94.268(2)
92.9340(10)
β, град
97.433(3)
100.991(2)
98.9860(10)
γ, град
90.00
99.500(2)
93.9650(10)
V, Å3
2197.4(3)
2146.6(2)
2118.1(2)
Z
4
2
1
dвыч, г/см3
2.577
2.246
2.714
μ, мм-1
14.395
11.053
15.602
F(000)
1584
1372
760
Размер кристалла, мм
0.15×0.12×0.03
0.42×0.04×0.01
0.36×0.14×0.02
Область сбора данных по θ
1.96-27.54
1.92-27.61
1.73-27.60
Интервалы индексов отражений
-27 ≤ h ≤ 26,
-13 ≤ h ≤ 12,
-10 ≤ h ≤ 10,
-14 ≤ k ≤ 15,
-16 ≤ k ≤ 16,
-13 ≤ k ≤ 13,
-9 ≤ l ≤ 11
-22 ≤ l ≤ 22
-1 5 ≤ l ≤ 15
Измерено отражений
6685
22175
9933
Независимых отражений
2545 (Rint = 0.0492)
9917 (Rint = 0.0386)
4674 (Rint = 0.0745)
Отражений с I > 2σ(I)
1914
7062
4279
Переменных уточнения
117
442
211
GOOF
1.029
0.977
1.050
R-Факторы по F2 > 2σ(F2)
R1 = 0.0412,
R1 = 0.0401,
R1 = 0.0333,
wR2 = 0.0703
wR2 = 0.0816
wR2 = 0.0977
R-Факторы по всем отражениям
R1 =0.0611,
R1 =0.0706,
R1 =0.0365,
wR2 = 0.0758
wR2 = 0.0887
wR2 = 0.0995
Остаточная электронная плотность
–1.654/1.829
-2.108/2.932
-1.837/2.218
(min/max), e/Å3
комплексные катионы золота(III)
представлены
(с атомом Au1), так и центросимметричные В и С
несколькими изомерными формами, соотносящи-
(Au2 и Au3), тогда как в комплексе 3 оба изомер-
мися как конформеры и выполняющими различ-
ных катиона [Au{S2CN(CH2)4O}2]+ A и В (Au1 и
ные структурные функции. При этом структура 2
включает как нецентросимметричные катионы A
Au2) центросимметричны (табл. 2).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
1770
ЛОСЕВА и др.
Таблица 2. Основные длины связей (d) валентные (ω) и торсионные углы (φ) в комплексах 1а, 2б и 3в
Соединение 1
Катион
Связь
d, Å
Связь
d, Å
Au1-S1
2.333(2)
N1-C7
1.476(10)
Au1-S2
2.346(2)
C2-C3
1.527(10)
Au1···S2b
3.647(2)
C3-C4
1.499(11)
S1-C1
1.705(8)
C4-C5
1.517(11)
S2-C1
1.749(7)
C5-C6
1.513(11)
N1-C1
1.318(9)
C6-C7
1.499(11)
N1-C2
1.486(8)
Угол
ω, град
Угол
ω, град
S1Au1S2
75.11(7)
Au1S2C1
86.1(3)
S1Au1S2a
104.89(7)
S1C1S2
111.3(4)
Au1S1C1
87.5(2)
Угол
φ, град
Угол
φ, град
Au1S1S2C1
-179.8(4)
S1C1N1C7
178.2(5)
S1Au1C1S2
-179.8(4)
S2C1N1C2
-175.8(5)
S1C1N1C2
2.2(9)
S2C1N1C7
0.2(9)
Анион
Связь
d, Å
Связь
d, Å
Hg1-Cl1
2.369(2)
Hg1-Cl2
2.7465(3)
Угол
ω, град
Угол
ω, град
Cl1Hg1Cl1c
138.10(11)
Cl2Hg1Cl2c
106.81(2)
Cl1Hg1Cl2
94.18(5)
Cl1cHg1Cl2
110.70(6)
Соединение 2
Катион А
Связь
d, Å
Связь
d, Å
Au1-S1
2.350(2)
N2-C9
1.483(8)
Au1-S2
2.341(2)
N2-C14
1.486(8)
Au1-S3
2.330(2)
C2-C3
1.483(11)
Au1-S4
2.327(2)
C3-C4
1.516(11)
Au1···S3a
3.493(2)
C4-C5
1.517(12)
S1-C1
1.739(8)
C5-C6
1.522(8)
S2-C1
1.747(7)
C6-C7
1.512(13)
S3-C8
1.728(6)
C9-C10
1.497(11)
S4-C8
1.728(7)
C10-C11
1.536(11)
N1-C1
1.289(10)
C11-C12
1.511(11)
N1-C2
1.468(9)
C12-C13
1.524(12)
N1-C7
1.476(9)
C13-C14
1.526(11)
N2-C8
1.302(9)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
ДВОЙНЫЕ ПСЕВДОПОЛИМЕРНЫЕ КОМПЛЕКСЫ ЗОЛОТА(III)-РТУТИ(II)
1771
Таблица 2. (Продолжение)
Соединение 2
Катион А
Угол
ω, град
Угол
ω, град
S1Au1S2
75.48(7)
Au1S1C1
86.8(3)
S1Au1S3
105.47(6)
Au1S2C1
86.8(3)
S1Au1S4
178.86(7)
Au1S3C8
86.7(2)
S2Au1S3
178.92(6)
Au1S4C8
86.8(2)
S2Au1S4
103.61(6)
S1C1S2
110.9(5)
S3Au1S4
75.45(6)
S3C8S4
111.1(4)
Угол
φ, град
Угол
φ, град
Au1S1S2C1
177.6(5)
S2C1N1C2
-177.1(6)
Au1S3S4C8
178.7(4)
S2C1N1C7
-0.5(11)
S1Au1C1S2
177.9(4)
S3C8N2C9
-1.2(9)
S3Au1C8S4
178.8(4)
S3C8N2C14
179.9(5)
S1C1N1C2
2.1(11)
S4C8N2C9
179.6(5)
S1C1N1C7
178.8(6)
S4C8N2C14
0.7(9)
Катион В
Катион С
Связь
d, Å
Связь
d, Å
Au2-S5
2.336(2)
Au3-S7
2.341(2)
Au2-S6
2.329(2)
Au3-S8
2.331(2)
Au2···S2a
3.702(2)
S7-C22
1.729(8)
S5-C15
1.735(7)
S8-C22
1.732(7)
S6-C15
1.723(8)
N4-C22
1.311(8)
N3-C15
1.305(9)
N4-C23
1.469(9)
N3-C16
1.473(9)
N4-C28
1.471(9)
N3-C21
1.459(9)
C23-C24
1.511(15)
C16-C17
1.534(11)
C24-C25
1.502(15)
C17-C18
1.529(12)
C25-C26
1.491(14)
C18-C19
1.510(8)
C26-C27
1.507(9)
C19-C20
1.488(12)
C27-C28
1.506(12)
C20-C21
1.503(12)
Угол
ω, град
Угол
ω, град
S5Au2S6
75.63(7)
S7Au3S8
75.23(7)
S5Au2S6a
104.37(7)
S7Au3S8b
104.77(7)
Au2S5C15
86.1(2)
Au3S7C22
86.5(2)
Au2S6C15
86.6(2)
Au3S8C22
86.8(2)
S5C15S6
111.6(4)
S7C22S8
111.0(4)
Угол
φ, град
Угол
φ, град
Au2S5S6C15
178.4(4)
Au3S7S8C22
171.8(4)
S5Au2C15S6
178.6(4)
S7Au3C22S8
172.6(4)
S5C15N3C16
-7.3(10)
S7C22N4C23
4.7(10)
S5C15N3C21
174.9(6)
S7C22N4C28
-177.3(6)
S6C15N3C16
171.5(6)
S8C22N4C23
-178.2(6)
S6C15N3C21
-6.3(10)
S8C22N4C28
-0.1(10)
Анион
Связь
d, Å
Связь
d, Å
Hg1-Cl1
2.468(2)
Hg1-Cl3
2.504(2)
Hg1-Cl2
2.534(2)
Hg1-Cl4
2.467(2)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
1772
ЛОСЕВА и др.
Таблица 2. (Продолжение)
Соединение 2
Анион
Угол
ω, град
Угол
ω, град
Cl1Hg1Cl2
104.52(7)
Cl2Hg1Cl3
110.39(8)
Cl1Hg1Cl3
106.40(8)
Cl2Hg1Cl4
109.93(7)
Cl1Hg1Cl4
116.43(8)
Cl3Hg1Cl4
109.02(7)
Соединение 3
Катион А
Катион В
Связь
d, Å
Связь
d, Å
Au1-S1
2.3245(14)
Au2-S3
2.3427(13)
Au1-S2
2.3435(14)
Au2-S4
2.3464(14)
Au1···S4b
3.5766(14)
Au2···S1
3.2998(14)
S1-C1
1.723(6)
S3-C6
1.725(6)
S2-C1
1.734(5)
S4-C6
1.736(6)
N1-C1
1.307(7)
N2-C6
1.306(7)
N1-C2
1.477(7)
N2-C7
1.479(7)
N1-C5
1.463(7)
N2-C10
1.467(7)
C2-C3
1.523(9)
C7-C8
1.519(8)
C4-C5
1.516(9)
C9-C10
1.500(8)
C3-O1
1.433(7)
C8-O2
1.429(7)
C4-O1
1.423(8)
C9-O2
1.430(7)
Угол
ω, град
Угол
ω, град
S1Au1S2
75.51(5)
S3Au2S4
75.41(5)
S1Au1S2a
104.49(5)
S3Au2S4b
104.59(5)
Au1S1C1
86.9(2)
Au2S3C6
86.5(2)
Au1S2C1
86.0(2)
Au2S4C6
86.1(2)
S1C1S2
111.5(3)
S3C6S4
111.9(3)
Угол
φ, град
Угол
φ, град
Au1S1S2C1
177.4(3)
Au2S3S4C6
176.0(3)
S1Au1C1S2
177.7(3)
S3Au2C6S4
176.5(3)
S1C1N1C2
-6.9(8)
S3C6N2C7
-4.3(8)
S1C1N1C5
176.9(4)
S3C6N2C10
-174.9(4)
S2C1N1C2
172.2(4)
S4C6N2C7
175.0(4)
S2C1N1C5
-3.9(8)
S4C6N2C10
4.4(7)
Анион
Связь
d, Å
Связь
d, Å
Hg1-Cl1
2.7106(14)
Hg1-Cl3
2.3886(15)
Hg1-Cl2
2.4021(16)
Hg1-Cl1c
2.5693(15)
Угол
ω, град
Угол
ω, град
Cl1Hg1Cl2
105.54(6)
Cl2Hg1Cl1c
106.30(6)
Cl1Hg1Cl3
96.47(5)
Cl3Hg1Cl1c
116.89(5)
Cl1Hg1Cl1c
86.99(4)
Hg1Cl1Hg1c
93.01(4)
Cl2Hg1Cl3
132.22(6)
Симметрические преобразования: a а 1 - x, 1 - y, 1 - z; b 1 - x, y, 1/2 - z; c 1 - x, y, 3/2 - z.
б a -x, 1 - y, -z; b -x, -y, 1 - z; c 1 - x, 1 - y,
-z. в a -x, -y, 1 - z; b 1 - x, -y, 1 - z; c -x, 1 - y, -z.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
ДВОЙНЫЕ ПСЕВДОПОЛИМЕРНЫЕ КОМПЛЕКСЫ ЗОЛОТА(III)-РТУТИ(II)
1773
(а)
(а)
(б)
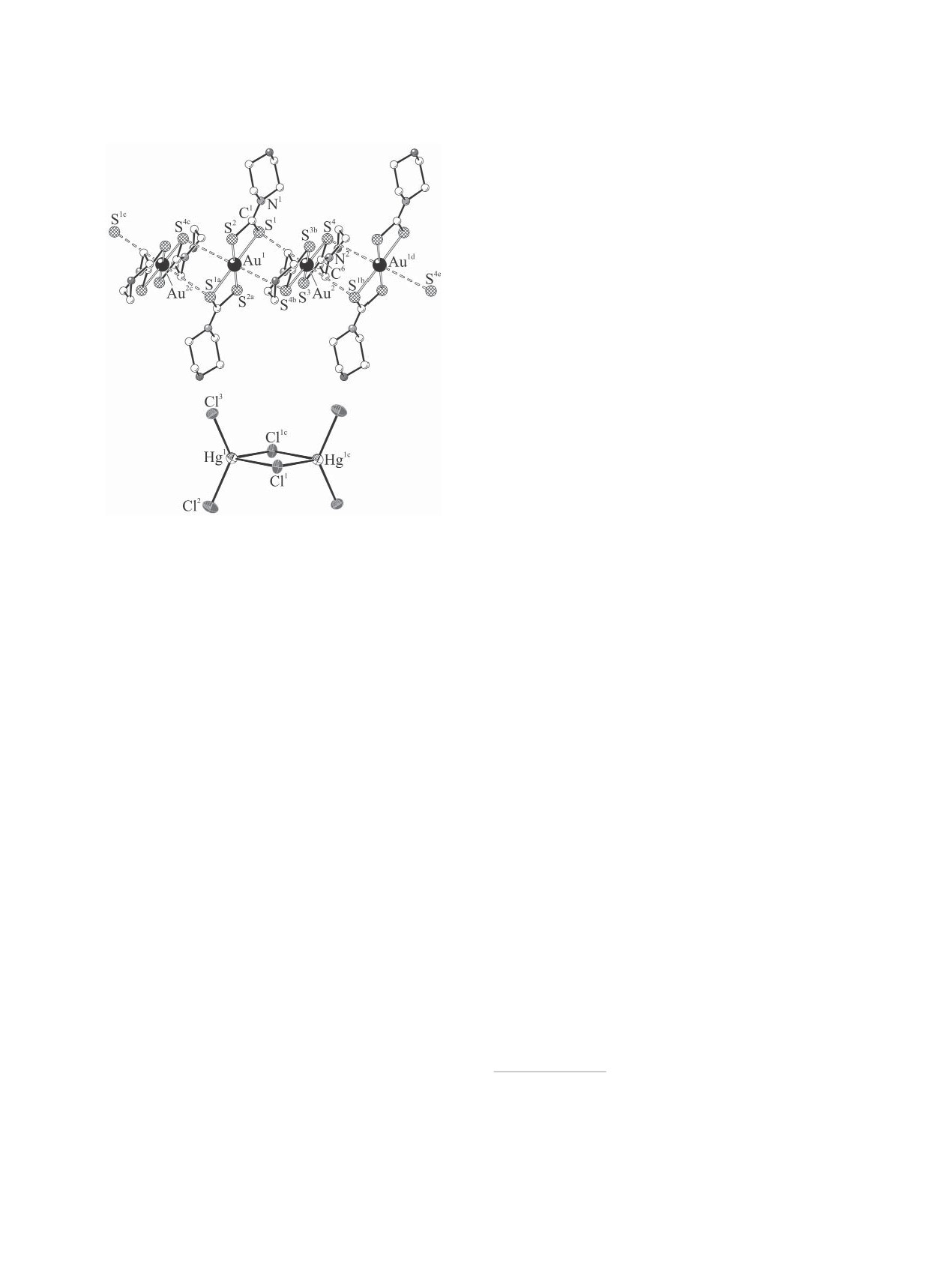
Рис. 4. Фрагмент супрамолекулярной катионной цепи
(···[А···А]···B···)n в структуре комплекса 2 (а) и ги-
дратированный анион [HgCl4]2- (б). Вторичные свя-
зи Au···S показаны двойным пунктиром; водородные
связи обозначены штриховыми линиями.
двух четырехчленных металлоциклов
[AuS2C],
связанных общим атомом металла. Копланарность
атомов в циклических фрагментах отражают зна-
чения торсионных углов AuSSC и SAuCS, близкие
к 180° (для комплексов 1-3 179.8, 171.8-178.8 и
176.0-177.7° соответственно). Некоторое откло-
(б)
нение атомов от плоскости можно представить
перегибом циклов [AuS2C] вдоль оси S-S. В ком-
плексах 1-3 внутрициклические расстояния Au-C
(2.830, 2.815-2.843, 2.818 и 2.822 Å) и S-S (2.852,
2.850-2.871, 2.858 и 2.868 Å) значительно меньше
сумм ван-дер-ваальсовых радиусов соответствую-
щих пар атомов: 3.36 и 3.60 Å [29, 30], что сви-
детельствует о малых размерах металлоциклов и
существенно сближенных позициях атомов золота
и углерода.
Рис. 3. Фрагменты катионной ([Au{S2CN(CH2)6}2]+)n
Торсионные углы SCNC, лежащие в диапазо-
(а) и анионной ([HgCl3]-)n (б) полимерных цепей в
нах 179.9-171.5 и 0.1-7.3°, указывают на близкое к
соединении 1. Пунктиром показаны вторичные связи
Au···S между комплексными катионами.
плоскостному расположение атомов в группиров-
ках C2NC(S)S дитиокарбаматных групп лигандов.
Это обстоятельство, наряду с большей прочно-
В рассматриваемых катионах атомы золота (со-
стью связей N-C(S)S (1.289-1.318 Å), в сравнении
стояние dsp2-гибридизации) образуют плоскоте-
с N-CH2 (1.459-1.486 Å), является результатом
трагональные хромофоры [AuS4] за счет связыва-
вклада двоесвязанности в формально ординарную
ния двух дитиокарбаматных групп лигандов, ко-
связь за счет примешивания sp2- к sp3-гибридно-
ординация которых близка к S,S'-изобидентатной:
му состоянию атомов азота и углерода. При этом
значения длин связей Au-S лежат в интервале
следует отметить, что, как и ожидалось из данных
2.3245-2.3496 Å (табл. 2). Обсуждаемый способ
ИК спектроскопии, связи N-C(S)S в комплексах 1
координации сопровождается формированием
(1.318 Å) и 3 (1.306, 1.307 Å) заметно короче, чем в
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
1774
ЛОСЕВА и др.
Н2О существенно неэквивалентными водородны-
(а)
ми связями O-H···Cl2 3.142 Å и O1-H···Cl1 3.414 Å
(рис. 4б). Атомы ртути в структуре 3 попарно объ-
единяются атомами μ2-Cl1,Cl1c, формируя цен-
тросимметричные биядерные анионы [Hg2Cl6]2-
(рис. 5б): в центральном четырехчленном метал-
лоцикле [Hg2Cl2] атомы копланарны, межатомное
расстояние Hg1···Hg1с 3.832 Å.
Во всех рассмотренных анионах комплексо-
образователь (состояние sp3-гибридизации) нахо-
дится в искаженно-тетраэдрическом окружении
атомов хлора. Для количественной характеристики
(б)
геометрии тетраэдрических полиэдров в соедине-
ниях 1-3 удобно использовать параметр τ4 = [360° -
(α + β)]/141° (где α и β - два наибольших угла
L-M-L) [32]. Предельные значения этого параме-
тра, предложенного для соединений с четверной
координацией комплексообразователя, указывают
Рис.
5. Фрагмент полимерной катионной цепи
на реализацию чисто тетраэдрической (τ4 = 1; α =
(···А···B···)n
(а) и структура биядерного аниона
β = 109.5°) или плоскотетрагональной (τ4 = 0; α =
]2- (б) в соединении 3. Вторичные связи Au···S
[Hg2Cl6
β = 180°) структуры. Из данных табл. 2 следует, что
между изомерными катионами показаны двойными
для комплексов 1-3 значение параметра τ4 состав-
пунктирными линиями.
ляет 0.789, 0.945 и 0.787 соответственно. Таким
образом, тетраэдр наиболее правильной формы
соответствующих исходных комплексах ртути(II):
реализуется в случае тетрахлоромеркурат(II)-иона
[Hg2{S2CN(CH2)6}4]
1.326,
1.327 Å
[15] и
(2); для двух других соединений почти одинако-
[Hg{S2CN(CH2)4O}4]n 1.335 Å [18].
вый вклад тетраэдрической составляющей в гео-
Шестичленные гетероциклы N(CH2)4О (3) ха-
метрию полиэдров ртути близок к 79%.
рактеризуются конформацией кресло, тогда как
Во всех соединениях 1-3 проявляется един-
для семичленных циклов N(CH2)6 реализуются
ственный тип невалентных вторичных связей2
конформации различного типа: кресло (1) и ско-
(Au···S). Тем не менее, для их супрамолекулярной
шенное кресло (2) [31].
организации характерны существенные различия.
Анионная часть обсуждаемых соединений
Так в структуре 1 пары симметричных вторичных
представлена полимерным комплексным ионом
связей Au1···S2b и Au1b···S2 3.647 Å объединяют
[HgCl3]- (1) или дискретными ионами [HgCl4]2- (2)
эквивалентные катионы золота(III) в линейные по-
и [Hg2Cl6]2- (3). В анионах [HgCl3]- и [Hg2Cl6]2-
лимерные цепи ([Au{S2CN(CH2)6}2]+)n, расстояние
терминальные атомы хлора образуют заметно бо-
Au···Au 4.410 Å (рис. 2а, 3а). Соседние катионы в
лее прочные связи с комплексообразователем, не-
цепи расположены относительно друг друга таким
жели мостиковые (табл. 2). В каждом из анионов
образом, что биссекторальные плоскости, проходя-
[HgCl3]- один из атомов хлора (Cl2, с мостиковой
щие через бициклические фрагменты [CS2AuS2C]
функцией) симметрично взаимодействует с сосед-
образуют угол близкий к прямому - 86.37° (рис. 2а).
ним атомом металла, повышая его КЧ до 4, в ре-
В кристаллической структуре 1 чередующиеся ка-
зультате чего формируется зигзагообразная (угол
тионные и анионные полимерные цепи направле-
Cl2Hg1Cl2c 106.81°) полимерная цепь ([HgCl3]-)n,
ны вдоль кристаллографической оси с (рис. 2а).
ориентированная вдоль кристаллографической
2 Концепция вторичных связей впервые была предложена в
оси c (рис. 2а, 3б).
работе [33] для описания взаимодействий на расстояниях,
В структуре комплекса 2 дискретные анионы
сопоставимых с суммами ван-дер-ваальсовых радиусов со-
[HgCl4]2- связаны с внешнесферными молекулами
ответствующих пар атомов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
ДВОЙНЫЕ ПСЕВДОПОЛИМЕРНЫЕ КОМПЛЕКСЫ ЗОЛОТА(III)-РТУТИ(II)
1775
В комплексее 2 нецентросимметричные изо-
катионов может быть охарактеризована углом в
мерные катионы А за счет парных вторичных
74.19°, который образуют их биссекторальные
взаимодействий Au1···S3а и Au1а···S3
3.493 Å
плоскости, проходящие через бициклические
образуют
супрамолекулярные
дикатионы
фрагменты [CS2AuS2C].
[Au2{S2CN(CH2)6}4]2+, включающие моноядер-
В супрамолекулярных структурах 1-3 атомы
ные фрагменты [Au{S2CN(CH2)6}2]+ в антипарал-
золота за счет дополнительных вторичных связей
лельной ориентации, внутридимерное расстояние
Au···S достраивают координационный полигон
Au1-Au1a 4.019 Å (рис. 4а). Менее прочные вторич-
[AuS4] до вытянутой тетрагональной пирамиды
ные связи (S2a···Au2 3.702 Å) между каждым из об-
[AuS5] (2, Au1) или вытянутого октаэдра [AuS6].
суждаемых биядерных катионов с соседними цен-
Вершинные атомы серы в рассматриваемых поли-
тросимметричными катионами В приводят к фор-
эдрах характеризует смещение с идеальных пози-
мированию зигзагообразных супрамолекулярных
ций, поскольку углы S···Au-S отклоняются от 90°.
цепей (···[А···А]···B···)n, по длине которых чере-
В искаженной пирамиде угол S3аAu1S2 составляет
дуются биядерные и моноядерные катионы: углы
85.34° (рис. 4а); соответствующие углы для ок-
Au1Au1Au2 85.55° и Au1Au2Au1 180°, межатомное
таэдров в комплексах 1-3 составляют: S2bAu1S1
расстояние Au1···Au2 4.768 Å (рис. 4а). Между це-
84.74°, S2bAu2S5 68.56°, S4сAu1S2 86.78° и S1Au2S4
пями локализованы центросимметричные дискрет-
86.37° (рис. 3а-5а).
ные катионы C (рис. 2б). Следует также отметить
Термическое поведение комплексов изучали
очевидное влияние вторичных связей Au···S на
методом синхронного термического анализа с од-
пространственную ориентацию объемных цикли-
новременной регистрацией кривых термограви-
ческих фрагментов N(CH2)6. Так, в супрамолеку-
метрии (ТГ) и дифференциальной сканирующей
лярном биядерном катионе [Au2{S2CN(CH2)6}4]2+,
калориметрии (ДСК). Исследованные соединения
вследствие проявления сил межлигандного оттал-
обнаруживают близкий характер термического по-
кивания, пары циклических фрагментов характери-
ведения, о чем свидетельствует значительное по-
зуются противоположной направленностью (рис.
добие кривых ТГ, фиксирующих формально одно-
4а); при этом в каждом из катионов циклические
стадийный процесс термолиза. Основная потеря
фрагменты находятся по одну строну от плоскости
массы комплексов 1 и 3 в 64.00 и 66.69% приходит-
хромофора [AuS4] (цис-ориентация). Напротив, в
ся на узкий температурный диапазон ~195-340 и
моноядерных катионах B и C обсуждаемые гетеро-
~230-365°C соответственно. Дифференцирование
циклы демонстрируют транс-ориентацию.
этих крутопадающих участков кривых ТГ ком-
В супрамолекулярных катионных цепях комп-
плексов 1 и 3 позволило выявить точки перегиба
лекса
3 отмечается чередование двух изо-
при 230.0 и 258.0°C соответственно, что указывает
мерных
центросимметричных
катионов
на сложный характер термолиза одновременно по
[Au{S2CN(CH2)4О}2]+: А и В (межатомное рассто-
катиону и аниону. При этом термолиз катионной
яние Au1···Au2 4.030 Å). У каждого из них во вто-
части комплексов приводит к восстановлению зо-
ричных взаимодействиях принимает участие атом
лота(III) до элементного состояния; термодеструк-
золота и два диагонально ориентированных атома
ция анионной части сопровождается высвобожде-
серы. При этом длина вторичных связей Au···S, об-
нием HgCl2 (с его последующим испарением).
разуемых неэквивалентными атомами золота, су-
Завершающие пологие участки кривых ТГ ~340-
щественно различна: Au1···S4 3.5766 Å и Au2···S1
935 и ~365-850°С отражают плавную финальную
3.2998 Å (для сравнения, сумма ван-дер-вааль-
десорбцию 12.49 и 6.98% летучих продуктов тер-
совых радиусов атомов золота и серы 3.46 Å [29,
молиза соответственно. Остаточная масса, фикси-
30]). Таким образом, при формировании линейной
руемая при 1100°С [22.89 (1) и 25.96% (3)], близка
супрамолекулярной цепи (···А···B···)n, направ-
к ожидаемой для восстановленного золота [расчет
ленной вдоль кристаллографической оси а, каж-
23.10 (1), 23.78% (3)], которое практически коли-
дый катион образует с ближайшими соседями две
чественно регенерируется в относительно мягких
пары несимметричных вторичных связей (рис. 5а).
условиях. При вскрытии тиглей обнаружены мел-
Взаимная пространственная ориентация соседних
кие шарики металлического золота.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
1776
ЛОСЕВА и др.
В низкотемпературной области кривая ДСК
растровом электронном микроскопе JSM 6390LV
комплекса 1 фиксирует два слабовыраженных эн-
JEOL (Япония), оснащенном системой микроана-
доэффекта, первый из которых с экстремумом при
лиза Oxford INCA Energy 350-Wave (Англия) с дис-
168.0°С отражает плавление образца (экстраполи-
персией по энергии и длинам волн. Качественное
рованная Tпл = 162.5°С; независимым определе-
определение химического состава выполнено ме-
нием в стеклянном капилляре плавление без при-
тодом микрозонда с применением энергодиспер-
знаков разложения установлено при 168-170°С).
сионного спектрометра. Термическое поведение
Второй тепловой эффект при 260.9°С обусловлен
комплексов 1 и 3 изучали методом СТА с одновре-
интенсивным термолизом вещества и испарением
менной регистрацией кривых термогравиметрии и
продуктов разложения. Низкотемпературная об-
дифференциальной сканирующей калориметрии.
ласть кривой ДСК соединения 3 включает един-
Исследование проводили на приборе STA 449C
ственный интенсивный эндоэффект при 256.7°С
Jupiter NETZSCH в корундовых тиглях под крыш-
(экстраполированная
температура процесса
кой с отверстием, обеспечивающим давление па-
254.6°С), относящийся к стадии основной потери
ров при термическом разложении образца в 1 атм.
массы и обусловленный термической деструкци-
Скорость нагрева составляла 5 град/мин до 1100°С
ей комплекса. Хотя кривая ДСК не фиксирует от-
в атмосфере аргона. Масса навесок 1.828-5.424 мг.
дельного эндоэффекта плавления комплекса, при
Точность измерения температуры ±0.4°С, измене-
определении в стеклянном капилляре соответству-
ния массы ±1×10-4 мг. При съемке кривых ТГ и
ющий фазовый переход установлен в температур-
ДСК использовали файл коррекции, а также кали-
ном диапазоне 252-254°С. В высокотемператур-
бровки по температуре и чувствительности для за-
ной области кривых ДСК присутствует эндоэф-
данной температурной программы и скорости на-
фект плавления восстановленного элементного зо-
грева. Независимое определение температур плав-
лота: экстраполированная Tпл = 1062.3, 1062.6°С.
ления комплексов проводили на приборе ПТП(М)
Таким образом, препаративно выделены и методом
(ОАО Химлаборприбор). Элементный анализ
образцов выполнен на автоматизированном эле-
РСА структурно охарактеризованы новые крис-
ментном анализаторе Euro EA-3000. Содержание
таллические ионно-полимерные комплексы Au(III)-
золота в растворах определяли на атомно-абсорб-
Hg(II) состава
([Au{S2CN(CH2)6}2][HgCl3])n,
ционном спектрометре iCE 3000 (Thermo Electron
([Au{S2CN(CH2)6}2]2[HgCl4]·H2O)n
и
Corporation, США). Степень связывания золота из
([Au{S2CN(CH2)4O}2]2[Hg2Cl6])n, включающие
растворов (S, %) рассчитывали по формуле: S =
три разновидности полихлоро(ди)меркурат(II)-
[(с - со)/с]×100%, где с - исходное, а со - остаточ-
ионов. В супрамолекулярной самоорганизации по-
ное содержание золота в растворе.
лученных соединений определяющую роль игра-
РСА монокристаллов 1-3 выполнен на диф-
ют вторичные взаимодействия Au···S. Условия
рактометре Bruker-Nonius X8 Apex CCD (MoKα-
количественной регенерации связанного золота
излучение, λ = 0.71073 Å, графитовый монохрома-
выявлены при изучении термического поведения
тор) при 296(2) (1) и 150(2) K (2, 3). Сбор данных
полученных соединений методом синхронного
проведен по стандартной методике: φ и ω скани-
термического анализа; сопутствующим продуктом
рование узких фреймов. Поглощение учтено эм-
термолиза является HgCl2.
пирически с использованием программы SADABS
[34]. Структуры определены прямым методом и
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
уточнены методом наименьших квадратов (по F2)
ИК спектры регистрировали на ИК спектро-
в полноматричном анизотропном приближении
метре с Фурье-преобразованием PerkinElmer
неводородных атомов. Положения атомов водо-
Spectrum 65 методом нарушенного полного вну-
рода рассчитаны геометрически и включены в
треннего отражения (НПВО) в интервале частот
уточнение в модели «наездника». В соединении 2
400-4000 см-1. Дисперсность и морфологические
водородные атомы сольватных молекул воды ло-
особенности образцов определяли методом элек-
кализованы в разностных синтезах электронной
тронной микроскопии высокого разрешения на
плотности и уточнены в изотропном приближе-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
ДВОЙНЫЕ ПСЕВДОПОЛИМЕРНЫЕ КОМПЛЕКСЫ ЗОЛОТА(III)-РТУТИ(II)
1777
нии с Uiso(H) = 1.5Ueq(O) при расстояниях O-H =
Общая методика синтеза комплексов 1-3.
0.89(2) Å и H···H = 1.45(2) Å. Сбор и редактиро-
К свежеосажденным дитиокарбаматам ртути(II)
вание данных, уточнение параметров элементар-
массой по 100 мг приливали по 10 мл раство-
ных ячеек проведены по программам APEX2 [34]
ра AuCl3 (в 2 М. HCl), содержащего 35.3 (1, 2)
и SAINT [34]. Расчеты по определению и уточне-
и 37.2 мг (3) золота, и перемешивали в течение
нию структур выполнены по комплексу программ
30 мин. Анализ растворов по завершении взаимо-
SHELXTL [34]. Координаты атомов, длины свя-
действия позволил установить, что при получении
зей и углы депонированы в Кембриджском банке
комплексов степень связывания золота из раство-
структурных данных [CCDC 1905389 (1), 1905390
ра в твердую фазу составила 99.9 (1, 2) и 99.7%
(2) и 1905391 (3)].
(3). Сформировавшиеся желтые осадки отделяли
фильтрованием, промывали и сушили на фильтре.
Исходные натриевые соли Na(S2CNR2)·2H2O
Выход 98.4 (1, 2) и 98.9% (3). При подготовке мо-
получали взаимодействием сероуглерода (Merck)
нокристаллов для РСА вещество, выделенное из
с соответствующим циклическим N-донорным ос-
хемосорбционной системы [Hg2{S2CN(CH2)6}4]-
нованием, гексаметиленимином или морфолином
H[AuCl4]/2 M. HCl, растворяли в ацетоне. Из ос-
(Aldrich), в щелочной среде [22].
новной массы прозрачных желтых пластинчатых
Na{S2CN(CH2)6}·2H2O. ИК спектр, ν, см-1:
кристаллов комплекса 1, полученных медленным
3369, 3295, 3167, 2983, 2923, 2851, 2105, 1638,
испарением растворителя, были также отобра-
1622, 1484, 1448, 1429, 1407, 1366, 1339, 1283,
ны единичные игольчатые кристаллы соединения
1258, 1244, 1187, 1168, 1095, 1067, 1046, 1009, 972,
2. Желтые пластинчатые кристаллы комплекса 3
953, 904, 850, 828, 764, 736, 678, 624, 562, 530, 479,
были выращены из раствора в метаноле.
454, 440, 408.
Трихлоромеркурат(II) бис-(N,N-циклогекса-
Na{S2CN(CH2)4O}·2H2O. ИК спектр, ν, см-1:
метилендитиокарбамато-S,S’)золота(III) (1). ИК
3350, 3271, 3190, 2966, 2903, 2853, 2469, 2112,
спектр, ν, см-1: 2977, 2919, 2851, 1522, 1499, 1463,
1641, 1623, 1585, 1458, 1417, 1385, 1347, 1323,
1428, 1351, 1270, 1232, 1200, 1177, 1158, 1096, 1064,
1300, 1260, 1211, 1182, 1110, 1063, 1023, 976, 894,
972, 959, 913, 866, 846, 819, 749, 611, 564, 511, 458,
871, 825, 676, 634, 577, 540, 482, 443, 420, 411, 403.
438, 427, 420, 406. Найдено, %: C 20.7; H 2.8; N
Исходные
дитиокарбаматные
комплек-
3.4; S 15.1. C14H24AuCl3HgN2S4. Вычислено, %: C
сы ртути(II),
[Hg2{S2CN(CH2)6}4]
[15] и
19.72; H 2.84; N 3.29; S 15.04.
[Hg{S2CN(CH2)4O}2]n [18], получали, как описано
Гексахлородимеркурат(II) бис(морфолин-
ранее, количественным осаждением ионов Hg2+ из
дитиокарбамато-S,S’)золота(III) (3). ИК спектр,
водной фазы соответствующими дитиокарбамата-
ν, см-1: 2987, 2926, 2858, 1537, 1459, 1423, 1383,
ми натрия, взятыми в 5%-ном избытке.3
1356, 1297, 1267, 1243, 1212, 1103, 1059, 1019,
[Hg2{S2CN(CH2)6}4]. ИК спектр, ν, см-1: 2977,
993, 878, 826, 652, 538, 456, 440, 428, 420, 411,
2921, 2850, 1496, 1479, 1455, 1421, 1342, 1285,
405. Найдено, %: C 14.7; H 1.9; N 3.4; S 15.7.
1261, 1243, 1193, 1157, 1090, 1050, 1003, 990, 975,
C20H32Au2Cl6Hg2N4O4S8. Вычислено, %: C 14.50,
952, 906, 875, 847, 826, 806, 765, 746, 619, 573, 536,
H 1.95, N 3.38, S 15.48.
514, 489, 471, 439, 420, 402.
Электронно-микроскопические исследования,
[Hg{S2CN(CH2)4O}2]n. ИК спектр, ν, см-1:
определение содержания золота в растворах и ре-
2968, 2910, 2871, 1468, 1455, 1441, 1423, 1346,
гистрация энергодисперсинных спектров были
1318, 1300, 1259, 1223, 1205, 1116, 1070, 1023, 993,
выполнены в Аналитическом центре минералого-
900, 873, 821, 653, 555, 536, 439, 420, 411, 402.
геохимических исследований Института геологии
3 Важно отметить, что, кроме собственно дитиокарбаматов
и природопользования Дальневосточного отделе-
ртути(II), в системах HgX2-R2NC(S)S--H2O (X = Cl, NO3)
ния РАН. Регистрация ИК спектров проведена в
могут формироваться также разнолигандные полимерные
Центре коллективного пользования Института об-
и полиядерные комплексы: [Hg2{S2CN(iso-C3H7)2}2Cl2)]n
щей и неорганической химии им. Н.С. Курнакова
[35],
[Hg4{S2CN(C3H7)2}6(NO3)2]n
[36] и циклический
[Hg4{S2CN(C3H7)2}4Cl4] [36].
РАН.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
1778
ЛОСЕВА и др.
КОНФЛИКТ ИНТЕРЕСОВ
15. Иванов А.В., Корнеева Е.В., Буквецкий Б.В., Го-
рян А.С., Анцуткин О.Н., Форшлинг В. // Коорд.
Авторы заявляют об отсутствии конфликта
xим. 2008. Т. 34. № 1. С. 61; Ivanov A.V., Kornee-
интересов.
va E.V., Bukvetskii B.V., Goryan A.S., Antzutkin O.N.,
Forsling W. // Russ. J. Coord. Chem. 2008. Vol. 34.
СПИСОК ЛИТЕРАТУРЫ
N 1. P. 59. doi 10.1007/s11173-008-1010-3
1. Kloppers L., Maree W., Oyekola O., Hangone G. //
16. Лосева О.В., Родина Т.А., Анцуткин О.Н., Ива-
Miner. Engin. 2016. Vol. 87. P. 54. 10.1016/j.
нов А.В. // ЖОХ. 2018. Т. 88. № 12. С. 2024; Lose-
mineng.2015.12.003
va O.V., Rodina T.A., Antzutkin O.N., Ivanov A.V. //
2. Nieuwenhuizen P.J. // Appl. Catal. (A). 2001. Vol. 207.
Russ. J. Gen. Chem. 2018. Vol. 88. N 12. P. 2540. doi
N 1-2. P. 55. doi 10.1016/S0926-860X(00)00613-X
10.1134/S1070363218120149
3. Onwudiwe D.C., Ajibade P.A. // Mater. Lett. 2011.
17. Loseva O.V., Rodina T.A., Smolentsev A.I., Ivanov A.V. //
Vol. 65. N 21-22. P. 3258. doi 10.1016/j.
Polyhedron. 2017. Vol. 134. P. 238. doi 10.1016/j.
matlet.2011.07.012
poly.2017.06.021
4. Sathiyaraj E., Thirumaran S. // Spectrochim. Acta (A).
18. Лосева О.В., Родина Т.А., Иванов А.В. // Коорд. xим.
2012. Vol. 97. P. 575. doi 10.1016/j.saa.2012.06.052
2019. Т. 45. № 1. С. 24; Loseva O.V., Rodina T.A.,
Ivanov A.V. // Russ. J. Coord. Chem. 2019. Vol. 45. N 1.
5. Srinivasan N., Thirumaran S. // Superlatt.
P. 22. doi 10.1134/S1070328419010068
Microstruct. 2012. Vol. 51. N 6. P. 912. doi 10.1016/j.
spmi.2012.03.006
19. Jotani M.M., Tan Y.S., Tiekink E.R.T. // Z. Kristallogr.
2016. V. 231. N 7. P. 403. doi. 10.1515/zkri-2016-1943
6. Nami S.A.A., Husain A., Ullah I. // Spectrochim.
Acta (A). 2014. Vol. 118. P. 380. doi 10.1016/j.
20. Howie R.A., Tiekink E.R.T., Wardell J.L., War-
saa.2013.08.064
dell S.M.S.V. // J. Chem. Crystallogr. 2009. V. 39. N 4.
P. 293. doi 10.1007/s10870-008-9473-0
7. Prakasam B.A., Lahtinen M., Peuronen A.,
Muruganandham M., Kolehmainen E., Haapaniemi E.,
21. Лосева О.В., Родина Т.А., Смоленцев А.И., Ива-
Sillanpӓӓ M. // Mater. Lett. 2015. Vol. 144. Р. 19. doi
нов А.В. // Коорд. xим. 2016. Т. 42. № 11. С. 683;
10.1016/j.matlet.2014.12.128
Loseva O.V., Rodina T.A., Smolentsev A.I., Ivanov A.V. //
Russ. J. Coord. Chem. 2016. Vol. 42. N 11. P. 719. doi
8. Hrubaru M., Onwudiwe D.C., Hosten E. // J. Sulfur
10.1134/S1070328416110063
Chem. 2016. Vol. 37. N 1. Р. 37. doi 10.1080/
17415993.2015.1080707
22. Бырько В.М. Дитиокарбаматы. М.: Наука, 1984. 341 с.
9. Chesman A.S.R., van Embden J., Duffy N.W., Web-
23. Беллами Л. Инфракрасные спектры сложных моле-
ster N.A.S., Jasieniak J.J. // Cryst. Growth Des. 2013.
кул. М.: ИЛ, 1963. 590 с.
Vol. 13. P. 1712. doi 10.1021/cg4000268
24. Casas J.S., Sanchez A., Bravo J., Soledad G.F.,
10. Ronconi L., Giovagnini L., Marzano C., Bettìo F.,
Castellano E.E., Jones M.M. // Inorg. Chim. Acta.
Graziani R., Pilloni G., Fregona D. // Inorg. Chem.
1989. Vol. 158. N 1. P. 119. doi 10.1016/S0020-
2005. Vol. 44. N 6. P. 1867. doi 10.1021/ic048260v
1693(00)84021-9
11. Ronconi L., Marzano C., Zanello P., Corsini M., Miolo G.,
25. Ehsan M.A., Khaledi H., Tahir A.A., Ming H.N.,
Maccà C., Trevisan A., Fregona D. // J. Med. Chem.
Wijayantha K.G.U., Mazhar M. // Thin Solid Films.
2006. Vol.49. N 5. P. 1648. doi 10.1021/jm0509288
2013. Vol. 536. P. 124. doi 10.1016/j.tsf.2013.03.092
12. Milacic V., Chen D., Ronconi L., Landis-Piwowar K.R.,
26. Yin H., Li F., Wang D. // J. Coord. Chem. 2007. Vol. 60.
Fregona D., Dou Q.P. // Cancer Res. 2006. Vol. 66.
N 11. P. 1133. doi 10.1080/00958970601008846
N 21. P. 10478. doi 10.1158/0008-5472.CAN-06-3017
27. Хитрич Н.В., Сейфуллина И.И. // Коорд. хим. 2000.
13. Mansour M.A., Connick W.B., Lachicotte R.J., Gys-
Т. 26. № 11. С. 848; Khitrich N.V., Seifullina I.I. // Russ.
ling H.J., Eisenberg R. // J. Am. Chem. Soc. 1998.
J. Coord. Chem. 2000. Vol. 26. N 11. P. 798.
Vol. 120. N 6. P. 1329. doi 10.1021/ja973216i
28. Казицына Л.Α., Куплетская Н.Б. Применение УФ-,
14. Han S., Jung O.-S., Lee Y.-A. // Trans. Met. Chem. 2011.
ИК-, ЯМР- и масс-спектроскопии в органической
Vol. 36. N 7. P. 691. doi 10.1007/s11243-011-9521-z
химии. М.: Московск. унив., 1979. 240 с.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019
ДВОЙНЫЕ ПСЕВДОПОЛИМЕРНЫЕ КОМПЛЕКСЫ ЗОЛОТА(III)-РТУТИ(II)
1779
29. Pauling L. The Nature of the Chemical Bond and the
34. Bruker, APEX2 (version 1.08), SAINT (version 7.03),
Structure of Molecules and Crystals. London: Cornell
SADABS (version 2.11), SHELXTL (version 6.12).
Univ. Press, 1960. 644 p.
Madison (WI, USA): Bruker AXS Inc., 2004.
30. Bondi A. // J. Phys. Chem. 1964. Vol. 68. N 3. P. 441.
35. Angeloski A., Rawal A., Bhadbhade M., Hook J.M.,
Schurko R.W., McDonagh A.M. // Cryst. Growth
doi 10.1021/j100785a001
Des. 2019. Vol. 19. N. 2 P. 1125. doi 10.1021/acs.
31. Bocian D.F., Pickett H.M., Rounds T.C., Strauss H.L. //
cgd.8b01619
J. Amer. Chem. Soc. 1975. Vol. 97. N 4. P. 687. doi
36. Лосева О.В., Родина Т.А., Иванов А.В., Смоленцев А.И.,
10.1021/ja00837a001
Анцуткин О.Н. // Изв. АН. Сер. хим. 2019. № 4.
32. Yang L., Powel D.R., Houser R.P. // Dalton Trans. 2007.
С. 782; Loseva O.V., Rodina T.A., Ivanov A.V.,
N 9. P. 955. doi 10.1039/b617136b
Smolentsev A.I., Antzutkin O.N. // Russ. Chem. Bull.
33. Alcock N.W. // Adv. Inorg. Chem. Radiochem. 1972.
2019. Vol. 68. N 4. P. 782. doi 10.1007/s11172-019-
Vol. 15. N 1. P. 1. doi 10.1016/S0065-2792(08)60016-3
2486-3
Double Pseudo-Polymer Gold(III)-Mercury(II) Complexes
[Au(S2CNR2)2]nX [R2 = (CH2)6, (CH2)4O]
Containing ([HgCl3]-)n, [HgCl4]2-, and [Hg2Cl6]2- Anions:
Chemisorption Synthesis, Principles of Supramolecular
Self-Assembly and Thermal Behavior
O. V. Loseva, T. A. Rodina, and A. V. Ivanov*
Institute of Geology and Nature Management, Far Eastern Branch of the Russian Academy of Sciences,
Ryolochnyi per. 1, Blagoveschensk, 675000 Russia
*e-mail: alexander.v.ivanov@chemist.com
Received April 19, 2019; revised April 19, 2019; accepted for publication May 17, 2019
New pseudo-polymer complexes of gold(III)-mercury(II) with cyclic alkylene dithiocarbamate ligands:
([Au{S2CN(CH2)6}2][HgCl3])n, ([Au{S2CN(CH2)6}2]2[HgCl4]∙H2O)n and ([Au{S2CN(CH2)4O}2]2[Hg2Cl6])n
were obtained and structurally characterized. The complicated supramolecular structure of the obtained com-
pounds is realized due to secondary non-valent Au···S interactions and includes mononuclear and binuclear
cations and anions as structural units, as well as cationic and anionic polymer chains. The thermal behavior of
the obtained complexes was studied by the method of simultaneous thermal analysis. The products of thermal
transformations of the complexes are reduced elemental gold and HgCl2.
Keywords: mercury(II) dithiocarbamates, chemisorption activity, gold(III)-mercury(II) dithiocarbamato-chlo-
rido complexes, supramolecular self-organization
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 11 2019