ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 12, с. 1820-1828
УДК 547.722.6
СИНТЕЗ, ОСОБЕННОСТИ СТРОЕНИЯ И
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
4-R-4-ОКСО-2-[2-(ФЕНИЛАМИНО)БЕНЗОИЛ]-
ГИДРАЗИНИЛИДЕН-N-ГЕТАРИЛБУТАНАМИДОВ
© 2019 г. И. А. Кизимоваa, *, Н. М. Игидовa, М. В. Дмитриевb, С. В. Чащинаa, b,
Р. Р. Махмудовb, c, А. И. Сюткинаa
a Пермская государственная фармацевтическая академия Министерства здравоохранения Российской Федерации,
ул. Екатерининская 101, Пермь, 614990 Россия
*e-mail: icekingakiratotsuka@gmail.com
b Пермский государственный национальный исследовательский университет, Пермь, Россия
c Федеральный научный центр медико-профилактических технологий управления рисками здоровью населения,
Пермь, Россия
Поступило в Редакцию 21 июня 2019 г.
После доработки 21 июня 2019 г.
Принято к печати 27 июня 2019 г.
Дециклизация N'-[5-R-2-оксофуран-3(2Н)-илиден]-2-(фениламино)бензогидразидов под действием
гетероциклических аминов приводит к образованию N-гетарил-4-R-4-оксо-2-[2-(фениламино)бензоил]-
гидразинилиденбутанамидов. Изучена антиноцицептивная и противовоспалительная активность полу-
ченных соединений.
Ключевые слова: 3-гидразинилиден(3-имино)-3H-фуран-2-оны, дециклизация, N-гетарил-4-оксо-2-[2-
(фениламино)бензоил]гидразинилиденбутанамиды, антиноцицептивная активность, противовоспали-
тельная активность
DOI: 10.1134/S0044460X19120035
3-Гидразинилиден(3-имино)-3H-фуран-2-оны
зогидразидов 1а-е с N-нуклеофилами - гетеро-
проявляют высокую реакционную способность. На
циклическими аминами. При нагревании эквимо-
их основе можно получать разнообразные ацикли-
лярных количеств реагентов в среде абсолютного
ческие и гетероциклические структуры, многие
толуола были получены продукты дециклизации -
из которых обладают биологической активностью
N-гетарил-4-R-4-оксо-2-[2-(фениламино)бензоил]-
[1-5]. Реакции гидразонов
2,3-дигидро-2,3-фу-
гидразинилиденбутанамиды 2а-т (схема 1).
рандионов с аминами приводят к дециклизации
Соединения 2а-т представляют собой желтые
с образованием биологически активных амидов
или светло-желтые кристаллические вещества. В
ацил(гидразинилиден)пировиноградных кислот
ИК спектрах 2-гидразинилиден-4-оксоалканами-
[6]. Сведения о взаимодействии ацилгидразонов
дов 2а-т наблюдаются полосы, обусловленные ва-
2,3-фурандионов, имеющих в положении 3 фура-
лентными колебаниями амино- (3168-3545 см-1) и
нового цикла фармакофорный 2-(фениламино)-
карбонильных групп (1662-1715 см-1), а также по-
бензоильный фрагмент, с гетероциклическими
лоса, характерная для валентных колебаний связей
аминами отсутствуют.
C=C и C=N при 1573-1640 см-1.
Нами изучено взаимодействие N'-[5-R-2-
Согласно данным ЯМР 1Н, в растворах соеди-
оксофуран-3(2Н)-илиден]-2-(фениламино)бен-
нений 2а-г в ДМСО-d6 наблюдается только гидра-
1820
СИНТЕЗ, ОСОБЕННОСТИ СТРОЕНИЯ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
1821
Схема 1.
NHHet
O
NHHet
R
O
R
NHHet
O
O
R
O N
NH
NH
O N
N
N
H2NHet
N
2
HN
HO
NHPh
PhHN
NHPh
O
R
O
O
O
O
NHPh
ɚ ɟ
A
Ȼ
ȼ
ɚ ɬ
R = t-Bu (1а, 2а-г), Ph (1б, 2д-з), 4-MePh (1в, 2и-л), 4-MeOС6Н4 (1г, 2м, н), 4-EtOС6Н4 (1д, 2о, п), 4-ClС6Н4 (1е,
2р-т); Het = тиазол-2-ил (2а, д, и, р), 4-(4-метилфенил)тиазол-2-ил (2б), 4-фенилтиазол-2-ил (2е), 1,3,4-тиадиа-
зол-2-ил (2в, ж, к, м, о, т), 5-этил-1,3,4-тиадиазол-2-ил (2г, з, л, н, п, с).
зонная форма А (схема 1), о чем свидетельствует
анализа медленной кристаллизацией из ацетони-
наличие сигнала протонов метиленовой группы в
трила были получены монокристаллы. Результаты
области 4.16-4.17 м. д. По данным ЯМР 1Н, соеди-
РСА подтверждают предложенную структуру сое-
нения 2и, р, с существуют в ДМСО-d6 как смесь
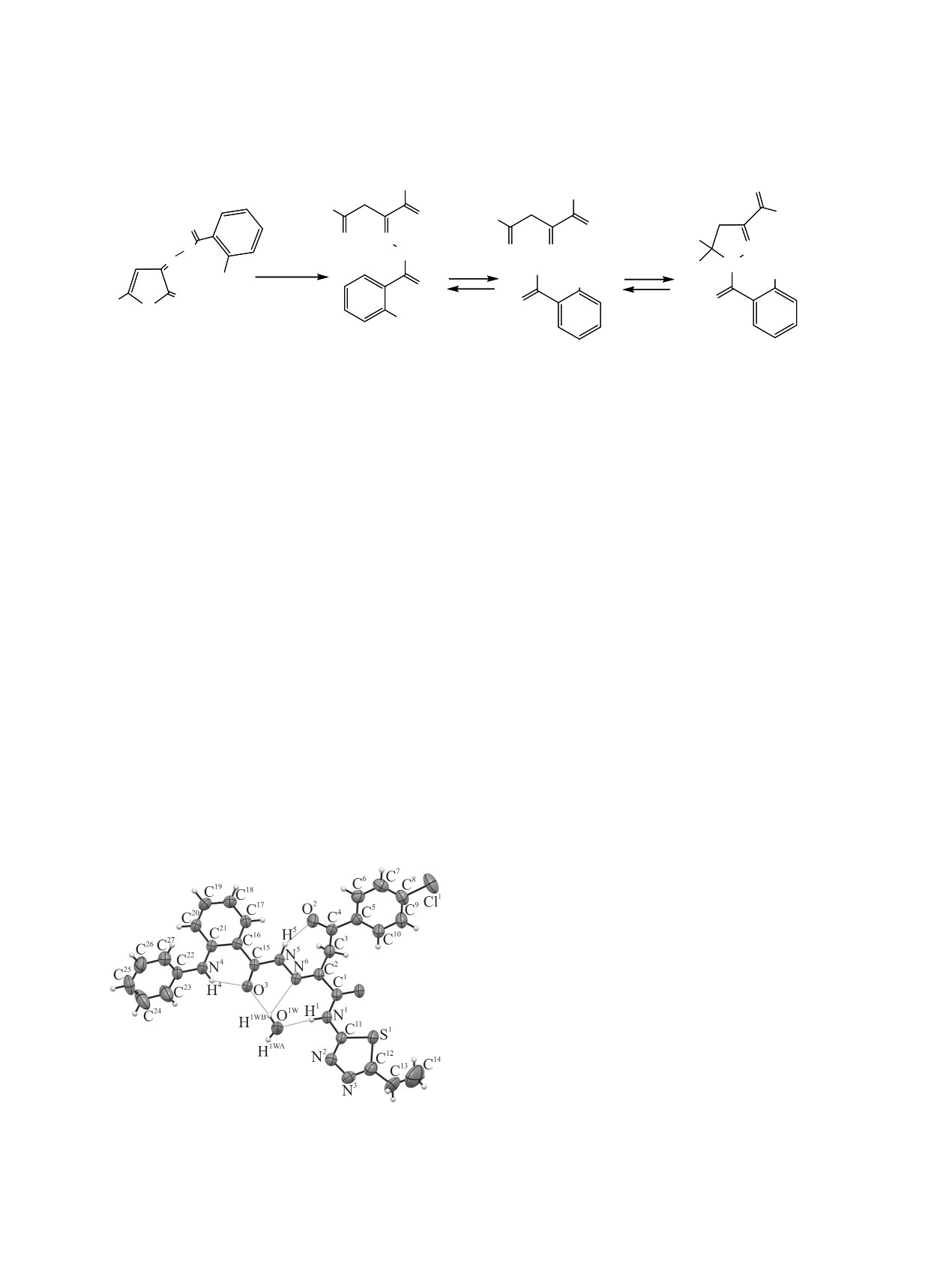
динения (cм. рисунок). Соединение 2с кристалли-
гидразонной А (от 27 до 65%) и циклической В
зуется в центросимметричной пространственной
(от 34 до 78%) таутомерных форм. В отличие от
группе триклинной сингонии в виде моногидрата.
описанных ранее родственных соединений [6], в
Длины связей и валентные углы в молекуле при-
спектрах ЯМР 1Н соединений 2д-з, к-п, т, сня-
нимают обычные для соответствующих атомов
тых в ДМСО-d6, кроме сигналов гидразонной А
значения. Этильный заместитель разупорядочен
и циклической В таутомерных форм наблюдается
по двум позициям с соотношением заселенностей
синглет протонов метиленовой группы третьей та-
0.777(8):0.223(8) (атомы минорной компоненты
утомерной формы Б при 4.40-4.49 м. д. (от 2 до
развернуты на 180° и на рисунке не изображены).
5%).
В кристаллическом состоянии молекула существу-
ет только в одной гидразонной таутомерной форме
В масс-спектре соединения 2к присутствуют
с образованием семичленного хелатного цикла c
пик молекулярного иона [M]+ с m/z 498 (4.0) и пики
участием внутримолекулярной водородной свя-
фрагментных ионов, подтверждающих структуру.
зи между группой NH гидразонного фрагмента и
Для установления пространственной структу-
карбонильной группой ароильного заместителя
ры соединения 2с методом рентгеноструктурного
(табл.
1). Конформация
2-(фениламино)бензо-
ильного фрагмента зафиксирована образованием
шестичленного хелатного цикла с участием вну-
тримолекулярной водородной связи N4-H4∙∙∙O3. В
кристалле 2 молекулы соединения 2с и 2 молекулы
воды связаны в центросимметричные димерные
ассоциаты посредством межмолекулярных водо-
родных связей трех видов (табл. 1).
Соединения
2а-т
были подвергнуты
биологическому скринингу на антиноцицептивную
и противовоспалительную активность
[14].
Первая группа соединений для выявления
антиноцицептивной активности была подвергнута
Общий вид молекулы соединения 2с в кристалле
фармакологическому скринингу по методу
(CCDC 1921232).
уксусных корчей (табл.
2). По результатам
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1822
КИЗИМОВА и др.
Таблица 1. Параметры водородных связей в молекуле соединения 2с
D-H···A
D-H, Å
H···A, Å
D···A, Å
Угол D-H···A, град
N1-H1∙∙∙O1W [x+1, y, z]
0.85(2)
1.94(2)
2.766(3)
165(2)
N4-H4∙∙∙O3
0.85(3)
1.97(3)
2.641(3)
136(2)
N5-H5∙∙∙O2
0.88(2)
2.11(2)
2.868(3)
144(2)
O1W-H1WA∙∙∙N3 [-x+2, -y+2, -z+1]
0.78(4)
2.10(4)
2.878(3)
174(3)
O1W-H1WB∙∙∙O3[x-1, y, z]
0.82(4)
2.05(4)
2.860(3)
174(4)
Таблица 2. Антиноцицептивная активность некоторых N-гетарил-4-R-4-оксо-2-[2-(фениламино)бензоил]гидразини-
лиденбутанамидов по данным метода уксусных корчей
Уменьшение корчей по
№
Количество корчей
Р по сравнению с контролем
сравнению с контролем, %
2а
18.2 ± 1.22
72.22
<0.05
2б
13.6 ± 1.32
53.97
<0.05
2в
16.6 ± 1.52
65.87
<0.05
2г
16.3 ± 1.50
64.68
<0.05
2з
36.8±5.9
-0.2
>0.05
2и
8.9±5.0
70.9
<0.05
2л
19.9±4.0
34.9
<0.05
2м
5.3±2.6
82.7
<0.05
2п
10.7±3.4
65.0
<0.05
2р
20.2±5.0
33.9
<0.05
2с
18.8±4.2
38.6
<0.05
Метамизол натрия
14.0±0.5
54.2
<0.05
Нимесулид
7.50±2.23
75.5
<0.05
Контроль
30.6±2.2
-
-
эксперимента можно сделать вывод, что
однако их активность не превышает эффектa
соединение 2м обладает наиболее выраженной
диклофенака натрия.
активностью и превосходит оба препарата
Некоторые соединения были подвергнуты ис-
сравнения (нимесулид и метамизол натрия).
пытаниям на противовоспалительную активность
Соединения 2а, и по анальгетическому эффекту
(табл. 4). Установлено, что соединения 2з, и, л, п,
сопоставимы с нимесулидом. Соединения 2б-г,
р, т превышают или сопоставимы по активности с
п превосходят препарат сравнения метамизол
нимесулидом.
натрия либо сопоставимы с ним.
Результаты эксперимента свидетельствуют о
Вторая группа соединений была исследована
перспективности поиска веществ, проявляющих
по методу горячей пластины (табл.
3).
антиноцицептивную и противовоспалительную
Установлено, что соединения 2д-ж превосходят
активность в ряду N-гетарил-4-R-4-оксо-2-[2-
по анальгетической активности метамизол натрия,
(фениламино)бензоил]гидразинилиденбутанамидов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
СИНТЕЗ, ОСОБЕННОСТИ СТРОЕНИЯ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
1823
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Таблица 3. Антиноцицептивная активность соедине-
ний 2д-ж по данным метода горячей пластины
Контроль за чистотой синтезированных сое-
Время
динений проводили методом ТСХ на пластинах
№
Доза, мг/кг
оборонительного
Silufol в системе диэтиловый эфир-бензол-ацетон
рефлекса, с
(10:9:1), детектировали парами иода и УФ светом.
2д
50
22.10±0.10
ИК спектры записывали на приборе ФСМ-1201 в
вазелиновом масле. Спектры ЯМР 1Н и ЯМР 13С
2е
50
23.30
снимали на приборе Bruker Avance III в ДМСО-d6,
2ж
50
19.60 ± 0.62
рабочие частоты 400 МГц (1H) и 100 МГц (13С),
внутренний стандарт - остаточный сигнал раство-
Контрольа
50
10.10
рителя. Элементный анализ проводили на приборе
Метамизол натрия
93 (ЕД50)
16.33
Leco CHNS-932. Температуры плавления (разло-
Диклофенак натрия
10
26.20 ± 0.96
жения) измеряли на приборе SMP40. Полученные
данные элементного анализа соответствовали рас-
а 2%-ная крахмальная слизь.
четным.
странственная группа P-1, параметры элементар-
Рентгеноструктурный анализ выполнен на
дифрактометре Xcalibur Ruby с ССD-детектором по
ной ячейки: a = 7.6621(11) Å, b = 12.5752(18) Å,
c = 15.593(2) Å, α = 104.417(12)°, β = 98.081(12)°,
стандартной методике [MoKα-излучение, 295(2) K,
ω-сканирование с шагом 1°]. Поглощение учте-
γ = 106.735(13)°, V = 1356.5(3) Å3, Z = 2, dвыч =
но эмпирически с использованием алгоритма
1.383 г/см3, μ = 0.263 мм-1. Структура расшифро-
SCALE3 ABSPACK
[7]. Сингония кристалла
вана с помощью программы SHELXS [8] и уточ-
(C27H23ClN6O3S∙H2O, M 565.04) триклинная, про-
нена полноматричным МНК по F2 в анизотропном
Таблица 4. Противовоспалительная активность соединений 2з-т
Объем стопы до
Объем стопы через 3
Прирост объема сто-
Торможение отека
№
введения флогогена,
ч, мл
пы через 3 ч, %
через 3 ч, %
мл
2з
1.44±0.11
1.65±0.11
15.45±5.43
76.75
2и
1.43±0.07
1.62±0.06
14.59±7.50
78.05
2к
1.16±0.05
1.63±0.06
41.70±4.78
37.26
2л
1.34±0.12
1.49±0.11
12.83±6.40
80.69
2м
1.36±0.06
1.79±0.04
33.09±8.70
50.22
2н
1.33±0.03
2.02±0.07
57.50±5.30
13.49
2о
1.22±0.06
1.57±0.09
29.38±2.80
55.79
2п
1.25±0.04
1.47±0.08
17.50±4.60
73.67
2р
1.50±0.05
1.78±0.05
18.74±3.41
71.81
2с
1.08±0.06
1.35±0.10
24.70±3.33
62.34
2т
1.07±0.02
1.58±0.05
48.36±6.06
27.24
Нимесулид
1.54±0.06
1,53±0,07
12.10±2.38
68.1
Метамизол натрия
0.94±0.04
1.60±0,08
71.60±9.84
7.72
Контроль
0,77±0.05
1.26±0,08
66.47±10.19
-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1824
КИЗИМОВА и др.
приближении для всех неводородных атомов с ис-
ν, см-1: 3545, 3412, 3296, 1715, 1669, 1635, 1599.
пользованием программы SHELXL [9] с графиче-
Спектр ЯМР 1Н, δ, м. д.: таутомер A (100%),1.18 с
ским интерфейсом OLEX2 [10]. Атомы водорода,
(9Н, t-Bu), 4.17 (2Н, СН2), 7.32 м (10НAr + 1Н, тиа-
связанные с гетероатомами, уточнены независи-
диазол), 8.69 уш. с (1Н, NH), 9.15 с (1Н, NH), 11.61
мо в изотропном приближении. При уточнении
с (1Н, NH). Найдено, %: C 64.43; H 5.22; N 15.54.
остальных атомов водорода использована модель
C29H28N6O3S. Вычислено, %: C 64.44; H 5.25; N
наездника. Окончательные параметры уточнения:
15.53.
R1 = 0.0555, wR2 = 0.1300 [для 4014 отражений с
5,5-Диметил-4-оксо-2-{2-[2-(фениламино)-
I > 2σ(I)], R1 = 0.0911, wR2 = 0.1565 (для всех 6323
бензоил]гидразинилиден}-N-(5-этил-1,3,4-тиа-
независимых отражений), S = 1.023. Результаты
диазол-2-ил)гексанамид (2г). Выход 1.89 г (77%),
РСА зарегистрированы в Кембриджском центре
желтые кристаллы, т. пл. 104-105°C (MeCN). ИК
кристаллографических данных (CCDC 1921232).
спектр, ν, см-1: 3458, 3383, 3299, 1688, 1667, 1640,
N-Гетарил-4-R-4-оксо-2-{2-[(2-фениламино)-
1576. Спектр ЯМР 1Н, δ, м. д.: таутомер A (100%),
бензоил]гидразинилиден}бутанамиды
(2а-с).
1.18 с (9Н, t-Bu), 1.33 т (3Н, Ме, J = 7.5 Гц), 3.02
Смесь
0.001 моль N’-[5-R-2-оксофуран-3(2Н)-
к (2Н, СН2, J = 7.5 Гц), 4.16 с (2Н, СН2), 7.14 м
илиден]-2-(фениламино)бензогидразидa
1а-е и
(9НAr), 8.71 уш. с (1Н, NH), 11.49 уш. с (1Н, NH),
0.001 моль гетероциклического амина в 20 мл
11.59 с (NH). Найдено, %: C 60.96; H 5.73; N 17.06.
абсолютного толуола нагревали 5-10 мин. Получен-
C25H28N6O3S. Вычислено, %: C 60.97; H 5.72; N
ную смесь охлаждали до 0°C. Осадок отфиль-
17.08.
тровывали и перекристализовывали из ацето-
Оксо-N-(тиазол-2-ил)-4-фенил-2-{2-[2-
нитрила.
(фениламино)бензоил]гидразинилиден}бутан-
5,5-Диметил-4-оксо-N-(тиазол-2-ил)-2-{2-
амид (2д). Выход 2.24 г (80%), желтые кристаллы,
[2-(фениламино)бензоил]гидразинилиден}-
т. пл. 143-145°C (MeCN). ИК спектр, ν, см-1: 3357
гексанамид (2а). Выход 2.26 г (84%), желтые
ш, 3191,1673 ш, 1597. Спектр ЯМР 1Н, δ, м. д.: та-
кристаллы, т. пл. 183-185°C (MeCN). ИК спектр,
утомер A (46%), 4.70 c (2Н, СН2), 7.35 м (17НAr +
ν, см-1: 3364 ш, 3173 ш, 1704, 1676, 1599. Спектр
1Н, NH + 2Н, тиазол), 8.65 уш. с (1Н, NH), 11.72 с
ЯМР 1Н, δ, м. д.: таутомер A (100%), 1.19 с (9H,
(1Н, NH); таутомер Б (5%), 4.65 c (2Н, СН2), 7.35 м
t-Bu), 4.16 (2Н, СН2), 7.28 м (11НAr + 2H, тиазол),
(17НAr + 1Н, NH + 2Н, тиазол), 8.67 уш. с (1Н, NH),
8.66 уш. с (1H, NH), 10.99 уш. с (1H, NH), 11.59 с
12.36 с (1Н, NH); таутомер В (49%), 3.42 д (1Н,
(1H, NH). Найдено, %: C 66.77; H 5.42; N 12.98.
С4Н2, J = 19.2 Гц), 3.53 д (1Н, С4Н2, J = 19.2 Гц),
C30H29N5O3S. Вычислено, %: C 66.78; H 5.43; N
7.35 м (17НAr + 1Н, ОН + 2Н, тиазол), 8.67 уш. с
12.96.
(1Н, NH), 11.22 уш. с (1Н, NH). Спектр ЯМР 13С,
5,5-Диметил-N-[4-(4-метилфенил)тиазол-
δС, м. д: 36.25, 50.47, 94.33, 114.06, 116.44, 117.96,
2-ил]-4-оксо-2-{2-[2-(фениламино)бензоил]-
118.86,
119.05,
119.68,
120.70,
121.60,
123.48,
гидразинилиден}гексанамид (2б). Выход 2.36 г
124.63,
127.30,
128.21,
128.69,
129.11,
129.20,
(75%), желтые кристаллы, т. пл.
188-189°C
130.17, 131.07, 131.49, 132.53, 133.55, 135.86,
(MeCN). ИК спектр, ν, см-1: 3294 ш, 3175 ш, 1662,
141.76, 142.55, 142.67, 162.06, 167.20, 193.79.
1599. Спектр ЯМР 1Н, δ, м. д.: таутомер A (100%),
Найдено, % : C 68.68; H 4.50; N 12.51.C32H25N5O3S.
1.20 с (9Н, t-Bu), 2.35 с (3Н, Ме), 4.17 (2Н, СН2),
Вычислено, %: C 68.69; H 4.53; N 12.52.
7.36 м (14НAr + 1H, тиазол), 8.77 уш. с (1Н, NH),
4-Оксо-4-фенил-2-{2-[2-(фениламино)бензо-
11.00 уш. с (1Н, NH), 11.63 с (1н, NH). Найдено, %:
ил]гидразинилиден}-N-(4-фенилтиазол-2-ил)-
C 70.57; H 5.60; N 11.12. C37H35N5O3S. Вычислено,
бутанамид (2е). Выход 1.70 г (61%), желтые кри-
%: C 70.58; H 5.63; N 11.14.
сталлы, т. пл. 155-156°C (MeCN). ИК спектр, ν,
5,5-Диметил-4-оксо-N-(1,3,4-тиадиазол-2-
см-1: 3335, 3273, 1665 ш, 1595, 1573. Спектр ЯМР
ил)-2-{2-[2-(фениламино)бензоил]гидразинили-
1Н, δ, м. д.: форма A (47%), 4.72 с (2Н, СН2), 7.41
ден}гексанамид (2в). Выход 2.16 г (80%), желтые
м (20НAr + 1H, NH + 1H, тиазол), 8.70 уш. с (1H,
кристаллы, т. пл. 140-141°C (MeCN). ИК спектр,
NH), 11.74 с (1H, NH); таутомер Б (5%), 4.69 с
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
СИНТЕЗ, ОСОБЕННОСТИ СТРОЕНИЯ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
1825
(2Н, СН2), 7.41 м (20НAr + 1Н, NH + 1H, тиазол),
128.68, 129.10, 129.21, 130.20, 131.07, 131.52,
8.70 уш. с (1Н, NH), 12.39 уш. с (1Н, NH); та-
132.58, 133.55, 135.85, 141.73, 142.63, 165.90,
утомер В (48 %), 3.44 д (1Н, С4Н2, J = 19.2 Гц),
167.25, 193.79. Найдено, % : C 63.27; H 4.72; N
3.56 д (1Н, С4Н2, J = 19.2 Гц), 7.41 м (20НAr + 1Н,
16.40. C27H24N6O3S. Вычислено, %: C 63.25; H
ОН + 1H, тиазол), 8.70 уш. с (1Н, NH), 11.23 уш. с
4.69; N 16.41.
(1Н, NH). Спектр ЯМР 13С, δС, м. д.: 36.32, 50.38,
4-(4-Метилфенил)-4-оксо-N-(тиазол-2-ил)-2-
94.32, 108.51, 109.16, 116.39, 117.98, 118.84, 119.13,
{2-[2-(фениламино)бензоил]гидразинилиден}-
119.73,
120.70,
121.67,
123.49,
124.64,
125.79,
бутанамид (2и). Выход 1.67 г (67%), желтые кри-
127.32, 127.91, 128.23, 128.62, 129.12, 129.21,
сталлы, т. пл. 120-122°C (MeCN). ИК спектр, ν,
130.17,
131.11,
131.53,
132.57,
133.55,
134.00,
см-1: 3345 ш, 3172, 1706, 1667, 1573. Спектр ЯМР
135.88, 141.72, 142.59, 142.71, 149.22, 156.80,
1Н, δ, м. д.: таутомер A (65%), 2.42 с (3H, Me), 4.66
162.25, 167.22, 193.77. Найдено, % : C 71.79; H
с (2Н, СН2), 7.29 м (16НAr + 1Н, NH + 2H, тиазол),
4.60; N 11.02. C38H29N5O3S. Вычислено, %: C
8.64 уш. с (1Н, NH), 11.70 с (1Н, NH); таутомер В
71.77; H 4.62; N 11.03.
(34%), 2.30 с (3H, Me), 3.39 д (1Н, С4Н2, J = 19.1
4-Оксо-N-(1,3,4-тиадиазол-2-ил)-4-фенил-2-
Гц), 3.50 д (1Н, С4Н2, J = 19.1 Гц), 7.29 м (16НAr +
{2-[2-(фениламино)бензоил]гидразинилиден}-
1H, ОН + 2H, тиазол), 8.64 уш. с (1H, NH), 11.14
бутанамид (2ж). Выход 1.64 г (68%), желтые кри-
уш. с (1H, NH). Спектр ЯМР 13С, δC, м. д: 20.51,
сталлы, т. пл. 145-146°C (MeCN). ИК спектр, ν,
21.11, 36.16, 63.54, 94.39, 114.05, 116.47, 118.02,
см-1: 3356, 3165 ш, 1706, 1673, 1596. Спектр ЯМР
118.87,
119.08,
119.62,
120.72,
121.61,
124.57,
1Н, δ, м. д.: таутомер A (44%), 4.71 с (2Н, СН2), 7.39
128.34, 129.20, 130.15, 131.04, 132.51, 133.47,
м (16НAr + 1Н, NH + 1H, тиадиазол), 8.63 уш. с
136.45, 137.85, 139.85, 141.77, 142.60, 144.02,
(1Н, NH), 11.75 с (1Н, NH); таутомер Б (5%), 4.68
157.10, 161.94, 167.15, 193.35. Найдено, % : C
с (2Н, СН2), 7.35 м (16НAr + 1Н, NH + 1H, тиадиа-
65.18; H 4.66; N 14.08. C27H23N5O3S. Вычислено,
зол), 8.66 уш. с (1Н, NH), 12.83 уш. с (1Н, NH); та-
%: C 65.20; H 4.69; N 14.06.
утомер В (51 %), 3.41 д (1Н, С4Н2, J = 19.2 Гц), 3.53
4-(4-Метилфенил)-4-оксо-N-(1,3,4-тиа-
д (1Н, С4Н2, J = 19.2 Гц), 7.35 м (16НAr + 1Н, ОН +
диазол-2-ил)-2-{2-[2-(фениламино)бензоил]-
1H, тиадиазол), 9.23 уш. с (2Н, NH). Найдено, % :
гидразинилиден}бутанамид (2к). Выход 1.35 г
C 64.43; H 5.22; N 15.54. C29H28N6O3S. Вычислено,
(54%), желтые кристаллы, т. пл.
118-120°C
%: C 64.44; H 5.21; N 15.56.
(MeCN). ИК спектр, ν, см-1: 3355 ш, 1670, 1645,
4-Оксо-4-фенил-2-{2-[2-(фениламино)бен-
1593, 1576. Спектр ЯМР 1Н, δ, м. д.: таутомер A
зоил]гидразинилиден}-N-(5-этил-1,3,4-тиади-
(79%), 2.43 с (3H, Me), 4.51 с (2Н, СН2), 7.31 м
азол-2-ил)бутанамид (2з). Выход 1.67 г (62%),
(15НAr + 1Н, NH + 1H, тиадиазол), 8.84 уш. с (1Н,
желтые кристаллы, т. пл.100-102°C (MeCN). ИК
NH), 12.02 с (1Н, NH); таутомер Б (3%), 2.39 с (3H,
спектр, ν, см-1: 3285, 1654, 1593, 1573. Спектр
Me), 4.45 с (2Н, СН2), 7.31 м (15НAr + 1Н, NH +
ЯМР 1Н, δ, м. д.: таутомер A (48%),1.31 м (3H, Me),
1H, тиадиазол), 8.66 уш. с (1Н, NH), 12.83 уш. с
3.02 к (2Н, СН2, J = 7.4 Гц), 4.70 с (2Н, СН2), 7.36
(1Н, NH); таутомер В (18%), 2.41 с (3H, Me), 3.35
м (15НAr + 1Н, NH), 8.66 уш. с (1Н, NH), 11.71 с
д (1Н, С4Н2, J = 19.3 Гц), 3.64 д (1Н, С4Н2, J =
(1Н, NH); таутомер Б (3%),1.31 м (3H, Me), 3.02
19.3 Гц), 6.63 уш. с (1Н, ОН), 7.31 м (15НAr +
к (2Н, СН2, J = 7.4 Гц), 4.48 с (2Н, СН2), 7.36 м
1Н, NH + 1H, тиадиазол), 8.66 уш. с (1Н, NH).
(15НAr + 1Н, NH), 8.66 уш. с (1Н, NH), 12.66 уш.
Масс-спектр, m/z (Iотн, %): 498 (4.0) [М]+,
398
с (1Н, NH); таутомер В (51%), 1.31 м (3H, Me),
(27.0) [M - 1,3,4-тиадиазолил-2-NH]+, 397 (100.0)
3.02 к (2Н, СН2, J = 7.4 Гц), 3.41 д (1Н, С4Н2, J =
[M - 1,3,4-тиадиазолил-2-NH - H]+, 370 (23.0)
19.3 Гц), 3.51 д (1Н, С4Н2, J = 19.3 Гц), 7.36 м
[M - 1,3,4-тиадиазолил-2-NHCO]+,
196
(100.0)
(16НAr + 1Н, NH + 1Н, ОН), 8.66 уш. с (1Н, NH).
[PhNHPhCO]+,
168
(5.0)
[PhNHPh]+,
119
(5.0)
Спектр ЯМР 13С, δС, м. д: 13.51, 13.65, 22.62, 36.57,
[MePhCO]+. Найдено, %: C 62.64; H 4.45; N 16.86.
50.44, 94.39, 116.46, 118.86, 119.07, 119.70, 120.71,
C26H22N6O3S. Вычислено, %: C 62.66; H 4.43; N
121.64, 123.47, 124.63, 127.32, 127.89, 128.20,
16.87.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1826
КИЗИМОВА и др.
4-(4-Метилфенил)-4-оксо-2-{2-[2-(фенил-
(78%),1.32 м (3Н, Ме), 3.02 к (2Н, СН2, J = 7.6),
амино)бензоил]гидразинилиден}-N-(5-этил-
3.88 с (3Н, МеО), 4.64 с (2Н, СН2), 7.24 м (14НAr +
1,3,4-тиадиазол-2-ил)бутанамид
(2л). Выход
1Н, NH), 8.67 уш. с (1н, NH), 11.71 с (1Н, NH);
1.63 г (62%), желтые кристаллы, т. пл. 134-136°C
форма Б (3%), 3.82 с (3Н, МеО), 4.44 с (2Н, СН2),
(MeCN). ИК спектр, ν, см-1: 3334, 3162, 1712, 1665,
7.28 м (14НAr + 1Н, NH), 8.67 уш. с (1Н, NH), 12.71
1576. Спектр ЯМР 1Н, δ, м. д.: таутомер A (59%),
уш. с (1Н, NH); таутомер В (19%), 3.40 д (1Н, С4Н2,
1.31 т. д (3Н, Ме, J = 7.5, 3.8 Гц), 2.42 с (3H, Me),
J = 19.2 Гц), 3.49 д (1Н, С4Н2, J = 19.2 Гц), 7.24 м
3.01 к (2Н, СН2, J = 7.5 Гц), 4.66 с (2Н, СН2), 7.24 м
(14НAr + 1Н, ОН), 8.67 уш. с (1Н, NH), 11.61 уш. с
(14НAr + 1Н, NH), 8.66 уш. с (1Н, NH), 11.71 с (1Н,
(1Н, NH). Спектр ЯМР 13С, δС, м. д: 13.72, 22.68,
NH); таутомер Б (2%), 1.31 т. д (3Н, Ме, J = 7.5,
36.25, 55.62, 94.25, 113.97, 116.52, 118.93, 119.16,
3.8 Гц), 2.39 с (3H, Me), 3.01 к (2Н, СН2, J = 7.5),
121.72, 128.90, 129.28, 130.24, 130.66, 132.65,
4.47 с (2Н, СН2), 7.24 м (14НAr + 1Н, NH), 8.66 уш.
141.80, 143.96, 157.44, 162.53, 163.53, 165.96,
с (1Н, NH), 12.62 уш. с (1Н, NH); таутомер В (39%),
192.32. Найдено, % : C 61.98; H 4.83; N 15.49.
1.31 т. д (3Н, Ме, J = 7.5, 3.8 Гц), 2.30 с (3H, Me), 3.38
C28H26N6O4S. Вычислено, %: C 61.99; H 4.84; N
д (1Н, С4Н2, J = 19.1 Гц), 3.49 д (1Н, С4Н2, J = 19.1),
15.47.
7.24 м (15НAr + 1Н, NH + 1Н, ОН), 8.66 уш. с (1Н,
4-Оксо-N-(тиазол-2-ил)-2-{2-[2-(фенил-
NH). Спектр ЯМР 13С, δС, м. д: 13.47, 13.65, 20.51,
амино)бензоил]гидразинилиден}-4-(4-этокси-
21.10, 22.61, 36.43, 94.44, 116.45, 118.04, 118.85,
фенил)бутанамид (2о). Выход 1.88 г (71%), жел-
119.09,
119.64,
120.73,
121.64,
124.58,
128.33,
тые кристаллы, т. пл. 115-117°C (MeCN). ИК
128.44, 129.09, 129.20, 130.18, 131.06, 131.45,
спектр, ν, см-1: 3459 ш, 3338 ш, 1653, 1593, 1576.
132.57, 133.44, 136.47, 139.77, 141.73, 142.63,
Спектр ЯМР 1Н, δ, м. д.: таутомер A (82%), 1.35
144.03, 162.49, 165.89, 167.26, 193.35. Найдено, % :
м (3Н, Ме), 4.16 к (2Н, СН2, J = 7.1 Гц), 4.64 с
C 63.86; H 4.98; N 15.96. C28H26N6O3S. Вычислено,
(2Н, СН2), 7.27 м (16НAr + 1Н, NH + 2Н, тиа-
%: C 63.87; H 4.96; N 15.98.
зол), 8.65 уш. с (1Н, NH), 11.70 с (1Н, NH); тауто-
4-(4-Метоксифенил)-4-оксо-N-(тиазол-2-ил)-
мер Б (3%), 1.35 м (3Н, Ме), 4.16 к (2Н, СН2, J =
2-{2-[2-(фениламино)бензоил]гидразинилиден}-
7.1 Гц), 4.45 с (2Н, СН2), 7.27 м (16НAr + 1Н, NH +
бутанамид (2м). Выход 1.96 г (76%), желтые кри-
2Н, тиазол), 8.65 уш. с (1Н, NH), 12.76 уш. с (1Н,
сталлы, т. пл. 118-120°C (MeCN). ИК спектр, ν,
NH); таутомер В (15%), 1.35 м (3Н, Ме), 3.02 к (2Н,
см-1: 3346, 3160, 1724, 1667, 1573. Спектр ЯМР
СН2, J = 7.1 Гц), 3.40 д (1Н, С4Н2, J = 19.2 Гц),
1Н, δ, м. д.: таутомер A (85%), 3.88 с (3Н, МеО),
3.50 д (1Н, С4Н2, J = 19.2), 7.27 м (16НAr + 2H,
4.65 с (2Н, СН2), 7.28 м (16НAr + 1Н, NH + 2H,
ОН + 2Н, тиазол), 8.65 уш. с (1H, NH), 11.13 уш. с
тиазол), 8.65 уш. с (1Н, NH), 11.70 с (1Н, NH);
(1H, NH). Спектр ЯМР 13С, δC, м. д: 14.41, 35.98,
таутомер В (15%), 3.40 д (1Н, С4Н2, J = 19.2 Гц),
63.66, 114.10, 114.36, 116.53, 118.94, 119.17, 121.69,
3.48 д (1Н, С4Н2, J = 19.2 Гц), 7.28 м (16НAr + 1Н,
128.77, 129.27, 130.21, 132.59, 138.01, 141.84,
ОН + 2H, тиазол), 8.66 уш. с (1Н, NH), 11.13 уш. с
143.91, 157.05, 162.12, 162.81, 192.26. Найдено, % :
(1Н, NH). Спектр ЯМР 13С, δС, м. д: 35.94, 55.55,
C 63.74; H 4.78; N 13.27. C28H25N5O4S. Вычислено,
94.25, 113.22, 114.04, 116.45, 117.97, 118.87, 119.10,
%: C 63.75; H 4.76; N 13.28.
121.63, 128.66, 129.20, 130.15, 130.60, 132.53,
4-Оксо-2-{2-[2-(фениламино)бензоил]гид-
137.92, 141.77, 143.86, 157.06, 162.06, 163.45,
разинилиден}-N-(5-этил-1,3,4-тиадиазол-
192.25. Найдено, % : C 63.15; H 4.51; N 13.64.
2-ил)-4-(4-этоксифенил)бутанамид (2п). Выход
C27H23N5O4S. Вычислено, %: C 63.16; H 4.53; N
1.73 г (62%), желтые кристаллы, т. пл. 137-128°C
13.62.
(MeCN). ИК спектр, ν, см-1: 3193, 1670, 1653,
4-(4-Метоксифенил)-4-оксо-2-{2-[2-(фенил-
1595, 1573. Спектр ЯМР 1Н, δ, м. д.: таутомер A
амино)бензоил]гидразинилиден}-N-(5-этил-
(82%), 1.31 м (3H, Me), 1.37 т (3H, Me, J = 6.9 Гц),
1,3,4-тиадиазол-2-ил)бутанамид
(2н). Выход
3.01 к (2Н, СН2, J = 7.5 Гц), 4.16 к (2Н, СН2, J =
2.14 г (79%), желтые кристаллы, т. пл. 175-
6.9 Гц), 4.64 с (2Н, СН2), 7.26 м (14НAr + 1Н, NH),
177°C (MeCN). ИК спектр, ν, см-1: 3358 ш, 1705,
8.67 уш. с (1Н, NH), 11.71 с (1Н, NH); таутомер Б
1666, 1579. Спектр ЯМР 1Н, δ, м. д.: таутомер A
(2%), 1.31 м (3H, Me), 1.37 т (3H, Me, J = 6.9 Гц),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
СИНТЕЗ, ОСОБЕННОСТИ СТРОЕНИЯ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
1827
3.01 к (2Н, СН2, J = 7.5 Гц), 4.16 к (2Н, СН2, J =
J = 7.5, 2.4 Гц), 4.68 с (2Н, СН2), 7.32 м (14НAr +
6.9 Гц), 4.46 с (2Н, СН2), 7.26 м (14НAr + 1Н, NH),
NH), 8.67 уш. с (1Н, NH), 11.72 с (1Н, NH); тауто-
8.67 уш. с (1Н, NH), 12.63 уш. с (1Н, NH); тауто-
мер В (58%), 1.30 м (3Н, Ме), 3.02 м (2Н, СН2, J =
мер В (16%), 1.31 м (3H, Me), 3.01 к (2Н, СН2, J =
7.5, 2.4 Гц), 3.42 д (1Н, С4Н2, J = 19.1 Гц), 3.50 д
7.5 Гц), 3.40 д (1Н, С4Н2, J = 19.3 Гц), 3.48 д (1Н,
(1Н, С4Н2, J = 19.1 Гц), 7.32 м (15НAr + 1Н, NH +
С4Н2, J = 19.3), 7.26 м (15НAr + 1H, NH + 1H, ОН),
1Н, ОН), 12.73 уш. с (1Н, NH). Спектр ЯМР 13С,
8.67 уш. с (NH). Спектр ЯМР 13С, δC, м. д: 13.65,
δС, м. д: 13.65, 13.69, 22.61, 50.37, 93.73, 117.75,
14.33, 22.61, 36.16, 63.58, 113.99, 116.45, 117.98,
118.48,
119.00,
119.92,
120.54,
121.59,
123.83,
119.11,
121.67,
128.67,
129.21,
130.18,
130.60,
126.76,
127.80,
128.83,
129.10,
129.23,
130.11,
132.60, 141.72, 143.94, 162.63, 165.88, 192.21.
Найдено, %: C 62.58; H 5.07; N 15.10. C29H28N6O4S.
130.99, 131.57, 131.97, 132.63, 134.49, 138.49,
Вычислено, %: C 62.55; H 5.08; N 15.11.
141.59, 141.68, 142.37, 142.85, 162.47, 165.84,
167.15, 192.88. Найдено, %: C 59.28; H 4.24; N
4-Оксо-N-(тиазол-2-ил)-2-{2-[2-(фенил-
амино)бензоил]гидразинилиден}-4-(4-хлор-
15.36. C27H23ClN6O3S. Вычислено, %: C 59.27; H
фенил)бутанамид (2р). Выход 2.1 г (81%), желтые
4.26; N 15.34.
кристаллы, т. пл. 143-145°C (MeCN). ИК спектр, ν,
Фармакологический скрининг антиноци-
см-1: 3342, 3175, 1666, 1589, 1572. Спектр ЯМР 1Н,
цептивной активности проводили по методам ук-
δ, м. д.: таутомер A (56%), 4.51 с (2Н, СН2), 7.61 м
сусных корчей [11] и горячей пластины [11, 12]. В
(15НAr, + 2H, тиазол), 8.39 уш. с (1H, NH), 11.81 с
качестве препаратов сравнения использовали ме-
(1H, NH); таутомер В (44%), 3.37 д (1Н, С4Н2, J =
тамизол натрия (ООО «Фармхимкомплект») в дозе
19.4 Гц), 3.75 д (1Н, С4Н2, J = 19.4), 5.60 уш. с (1Н,
93 мг/кг (ЕД50) и диклофенак натрия (AlfaAesar®)
ОН), 7.61 м (15НAr, + 2H, тиазол), 9.45 уш. с (1Н,
в дозе 10 мг/кг. Статистическую обработку экс-
NH), 10.08 уш. с (1Н, NH). Найдено, %: C 60.29;
H 3.89; N 13.52. C26H20ClN5O3S. Вычислено, %: C
периментального материала проводили с исполь-
60.28; H 3.87; N 13.53.
зованием критериев достоверности Стьюдента.
4-Оксо-N-(1,3,4-тиадиазол-2-ил)-2-{2-[2-
Эффект считали достоверным при P < 0.05 [13].
(фениламино)бензоил]гидразинилиден}-
Исследование противовоспалительного действия
4-(4-хлорфенил)бутанамид (2с). Выход 1.42 г
проводили по методике, описанной в работе [11].
(53%), желтые кристаллы, т. пл.
138-140°C
Препаратом сравнения служил нимесулид в дозе
(MeCN). ИК спектр, ν, см-1: 3338, 3168 ш, 1752,
50 мг/кг (ООО «Фармхимкомплект»).
1683, 1658, 1588, 1573. Спектр ЯМР 1Н, δ, м. д.:
Фармакологический скрининг антиноци-
таутомер A (59%), 4.50 c (2Н, СН2), 7.29 м (15НAr +
цептивной активности и исследование проти-
1Н, NH + 1H, тиадиазол), 8.84 уш. с (1Н, NH), 11.84
вовоспалительного действия проводили на базе
с (1Н, NH); таутомер Б (4%), 4.44 c (2Н, СН2), 7.26 м
кафедры физиологии Пермской государственной
(13HAr), 8.84 уш. с (1Н,NH), 9.19 уш. с (1Н,NH), 12.88
уш. с (1Н, NH); таутомер В (37%), 3.33 д (1Н, С4Н2,
фармацевтической академии и в научно-исследо-
J = 19.3 Гц), 3.65 д (1Н, С4Н2, J = 19.3), 6.68 уш. с
вательской лаборатории биологически активных
(1Н, ОН), 7.29 м (15НAr + 1Н, NH + 1H, тиадиазол
веществ Пермского государственного националь-
), 9.60 уш. с (1Н, NH). Найдено, %: C 57.86; H
ного исследовательского университета.
3.69; Cl 6.83; N 16.19; S 6.18. C25H19ClN6O3S.
Исследования выполнены в соответствии со
Вычислено, %: C 57.87; H 3.68; N 16.18.
всеми применимыми международными, нацио-
4-Оксо-2-{2-[2-(фениламино)бензоил]гид-
нальными и институциональными руководящими
разинилиден}-4-(4-хлорфенил)-N-(5-этил-
принципами по уходу и использованию животных.
1,3,4-тиадиазол-2-ил)бутанамид
(2т). Выход
2.16 г (79%), желтые кристаллы, т. пл. 140-
КОНФЛИКТ ИНТЕРЕСОВ
142°C (MeCN). ИК спектр, ν, см-1: 3466, 3268,
1667, 1588, 1575. Спектр ЯМР 1Н, δ, м. д.: тау-
Авторы заявляют об отсутствии конфликта
томер A (42%),1.30 м (3Н, Ме), 3.02 м (2Н, СН2,
интересов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1828
КИЗИМОВА и др.
СПИСОК ЛИТЕРАТУРЫ
5. Elkholy Y.M., Ali K.A., Farag A.M. // J. Heterocycl.
Chem. 2006. Vol. 43. N 5. P.1183. doi 10.1002/
1. Пулина Н.А., Залесов В.В., Быстрицкая О.А., Руб-
jhet.5570430508
цов А.Е., Кутковая Н.В. // Хим.-фарм. ж. 2009. Т. 43.
6. Киселев М.А., Игидов Н.М., Чернов И.Н., Токсаро-
№ 8. С. 17; Pulina N.A., Zalesov V.V., Bystritskaya O.A.,
ва Ю.С., Рубцов А.Е. // ЖОрХ. 2017. Т. 53. Вып. 6.
Rubtsov A.E., Kutkovaya N.V. // Pharm. Chem. J. 2009.
С. 903; Kiselev M.A., Igidov N.M., Toksarova Y.S.,
Vol. 43. N 8. P. 444. doi 10.1007/s11094-009-0334-8
Chernov I.N., Rubtsov A.E. // Russ. J. Org. Chem. 2017.
2. Быков Р.А., Трапезникова Н.Н., Баландина С.Ю.,
Vol. 53. N 6. P. 920. doi 10.1134/S1070428017060173
Комарова О.А., Махмудов Р.Р., Пулина Н.А., Со-
7. CrysAlisPro, Agilent Technologies, Version 1.171.37.33
бин Ф.В., Рубцов А.Е. // Хим.-фарм. ж. 2018. Т. 52.
(release 27-03-2014 CrysAlis171 .NET).
№ 5. С. 33; Bykov R.A., Trapeznikova N.N., Balandi-
8. Sheldrick G.M. // Acta Crystallogr. (A). 2008. Vol. 64.
na S.Yu., Komarova O.A., Makhmudov R.R., Pulina N.A.,
N 1. P. 112. doi 10.1107/S0108767307043930
Sobin F.V., Rubtsov A.E. // Pharm. Chem. J. 2018.
9. Sheldrick G.M. // Acta Crystallogr. (C). 2015. Vol. 71.
Vol. 52. N 5. P. 415. doi 10.1007/s11094-018-1833-2
N 1. P. 3. doi 10.1107/S2053229614024218
3. Шипиловских С.А., Махмудов Р.Р., Лупач Д.Ю.,
10. Dolomanov O.V., Bourhis L.J., Gildea R.J, Ho-
Павлов П.Т., Бабушкина Е.В., Рубцов А.Е. // Хим.-
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
фарм. ж. 2013. Т. 47. № 7. С. 26; Shipilovskikh S.A.,
Vol. 42. P. 339. doi 10.1107/S0021889808042726
Makhmudov R.R., Lupach D.Y., Pavlov P.T., Babushki-
na E.V., Rubtsov A.E. // Pharm. Chem. J. 2013. Vol. 47.
11. Миронов А.Н. Руководство по проведению докли-
N 7. P. 366. doi 10.1007/s11094-013-0960-z
нических исследований лекарственных средств. М.:
Гриф и К, 2012. Ч. 1.
4. Пулина Н.А., Кожухарь В.Ю., Кузнецов А.С., Руб-
цов А.Е., Старкова А.В. // Изв. АН. Сер. хим. 2017.
12. Eddy N.B., Leimbach D.J. // J. Pharmacol. Exp. Ther.
1953. Vol. 107. N 3. P 385.
№ 8. С. 1497; Pulina N.A., Kozhukhar V.Y., Kuzne-
tsov A.S., Rubtsov A.E. // Russ. Chem. Bull. 2017.
13. Беленький М.Л. Элементы количественной оценки
Vol. 66. N 7. P. 1497. doi 10.1007/s11172-017-1914-5
фармакологического эффекта. Л.: Медгиз, 1963. 146 с.
Synthesis, Structure, and Biological Activity
of 4-R-4-Oxo-2-[2-(phenylamino)benzoyl]hydrazinylidene-
N-hetarylbutanamides
I. A. Kizimovaa, *, N. M. Igidova, M. V. Dmitrievb, S. V. Chashchinaa, b,
R. R. Makhmudovb, c, and A. I. Siutkinaa
a Perm State Pharmaceutical Academy of the Ministry of Health of the Russian Federation,
ul. Ekaterininskaya 101, Perm, 614990 Russia
*e-mail: icekingakiratotsuka@gmail.com
b Perm State National Research University, Perm, Russia
c Federal Research Center for Medical and Preventive Health Risk Management Technologies, Perm, Russia
Received June 21, 2019; revised June 21, 2019; accepted June 27, 2019
Decyclization of N’-[5-R-2-oxofuran-3(2H)-ylidene]-2-(phenylamino)benzohydrazides under the action of
heterocyclic amines leads to the formation of N-hetaryl-4-R-4-oxo-2-[2-(phenylamino)benzoyl]hydrazinylidene-
butanamides. Antinociceptive and anti-inflammatory activity of the obtained compounds was studied.
Keywords: 3-hydrazinylidene-(3-imino)-3H-furan-2-ones, decyclization, N-hetaryl-4-oxo-2-[2- (phenylamino)-
benzoyl]hydrazinylidenebutanamides, antinociceptive activity, anti-inflammatory activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019