ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 12, с. 1829-1834
УДК 547.831.7
СИНТЕЗ И ГАЛОГЕНОЦИКЛИЗАЦИЯ
ПРОИЗВОДНЫХ 2-АЛЛИЛОКСИХИНОЛИНА
© 2019 г. Д. Г. Ким, Е. А. Вершинина*, В. В. Шарутин
Южно-Уральский государственный университет (национальный исследовательский университет),
пр. Ленина 76, Челябинск, 454080 Россия
*e-mail: enka84@mail.ru
Поступило в Редакцию 30 мая 2019 г.
После доработки 30 мая 2019 г.
Принято к печати 6 июня 2019 г.
Алкилирование 4,8-диметил- и 4,6,8-триметилхинолин-2(1Н)-она аллилбромидом в присутствии осно-
вания протекает по атомам кислорода и азота с преимущественным образованием О-изомера. Взаимо-
действие 2-аллилоксихинолинов с галогенами приводит к оксазоло[3,2-a]хинолиниевым солям. Методом
РСА установлена структура иододибромида 1-бромметил-5,7,9-триметил-1,2-дигидро[1,3]оксазоло[3,2-а]-
хинолиния.
Ключевые слова: 4,8-диметил- и 4,6,8-триметилхинолин-2(1Н)-он, аллилбромид, 2-аллилоксихинолины,
галогениды дигидро[1,3]оксазоло[3,2-а]хинолиния, интергалогенид
DOI: 10.1134/S0044460X19120047
Соединения хинолина обладают разнообраз-
О-изомеров, и выделили 2-аллилокси-4,8-диме-
ной физиологической активностью [1, 2]. Синтез
тилхинолин 2а и 2-аллилокси-4,6,8-диметилхино-
новых конденсированных гетероциклических си-
лин 2б. Соотношение О- и N-изомеров, по данным
стем с использованием атом-экономных методов
ЯМР 1Н, составляет 4:1 (схема 1). В ИК спектрах
циклообразования - актуальное направление в ор-
продуктов О-алкилирования отсутствует полоса
ганической химии.
карбонильной группы. В масс-спектрах 2-алли-
локсихинолинов 2а, б наблюдаются интенсивные
Производные хинолин-2(1Н)-она способны к
пики [M]+• и [M - Н]+, а также пики ионов, соот-
существованию в двух таутомерных формах [3] и,
как следствие, могут вступать в реакцию алкили-
ветствующие элиминированию молекулярным ио-
ном метильного и аллильного радикалов.
рования с участием как атома азота, так и атома
кислорода. Взаимодействие некоторых произво-
Спектры ЯМР 1Н N- и О-изомеров близки, но
дных хинолин-2(1Н)-она с аллилбромидом опи-
есть и различия. У производных 2-аллиоксихино-
сано в литературе, но эти данные противоречивы:
лин-2(1Н)-она 2a, б сигналы протонов Н3 и груп-
при алкилировании
4-метилхинолин-2(1Н)-она
пы =СН2 смещены на ~0.4 м. д. в область слабого
образуется только N-производное (84%) [4], а при
поля по сравнению с сигналами N-замещенных 3a,
алкилировании 3-формилхинолин-2(1Н)-она вы-
б. В спектрах ЯМР 13С соединений 2a, б наблюда-
делено О-производное (42%) [5]; производные хи-
ются сигналы атомов углерода группы ОCH2 при
нолин-2(1Н)-она, не замещенные в положении 8,
65 м. д., в то время как для группы NCH2 характер-
образуют смесь продуктов N- и О-алкилирования
ны сигналы при ~48 м. д. [9].
с преобладанием N-изомеров [6-8].
Иодирование и бромирование 4-метил-2-алли-
Мы провели алкилирование 4,8-диметил- и
локсихинолина [7] приводит к галогенидам диги-
4,6,8-триметилхинолин-2(1Н)-онов 1а, б аллил-
дро[1,3]оксазоло[3,2-а]хинолиния. Чтобы устано-
бромидом в присутствии KОН в пропан-2-оле, ко-
вить влияние на галогеноциклизацию метильной
торое протекает главным образом с образованием
группы в положении 8, нами исследованы реакции
1829
1830
КИМ и др.
Схема 1.
R
R
R
AllBr
+
KOH
N
O
-KBr
N
O
N
O
H
1a, ɛ
2a, ɛ
3a, ɛ
4 : 1
R = H (a), Me (ɛ).
Схема 2.
R
R
R
I2
–
–
Br
(1) Br2, CHCl3
ɱ
I3
+
+
(2) Me2CO
AcOH
N O
N O
N O
ɱ
Br
I
5a, ɛ
2a, ɛ
4a, ɛ
-
NaI, Me2CO
I
+
4a
N O
I
6
R = H (a), Me (ɛ).
гетероциклизации производных 2-аллиоксихино-
С целью получения монокристаллов, при-
лин-2(1Н)-она 2а, б при действии брома и иода.
годных для РСА, проведена реакция
1-бром-
В результате электрофильной гетероциклизации
метил-5,7,9-триметил-1,2-дигидро[1,3]оксазо-
(схема 2) образуются галогениды 1-галогенме-
ло[3,2-а]хинолиния бромида 5б с эквимольным
тил-1,2-дигидро[1,3]оксазоло[3,2-а]хинолиния
количеством иода в этиловом спирте. Вместо
(4a, б, 5a, б). В спектре ЯМР 1Н продуктов галоге-
ожидаемого
1-бромметил-5,7,9-триметил-1,2-ди-
нирования сигналы протонов хинолинового цикла
гидро[1,3]оксазоло[3,2-а]хинолиния бромодиио-
смещены на 0.5-1 м. д. в область слабого поля по
дида выделены кристаллы 1-бромметил-5,7,9-три-
сравнению с исходными соединениями.
метил-1,2-дигидро[1,3]оксазоло[3,2-а]хинолиния
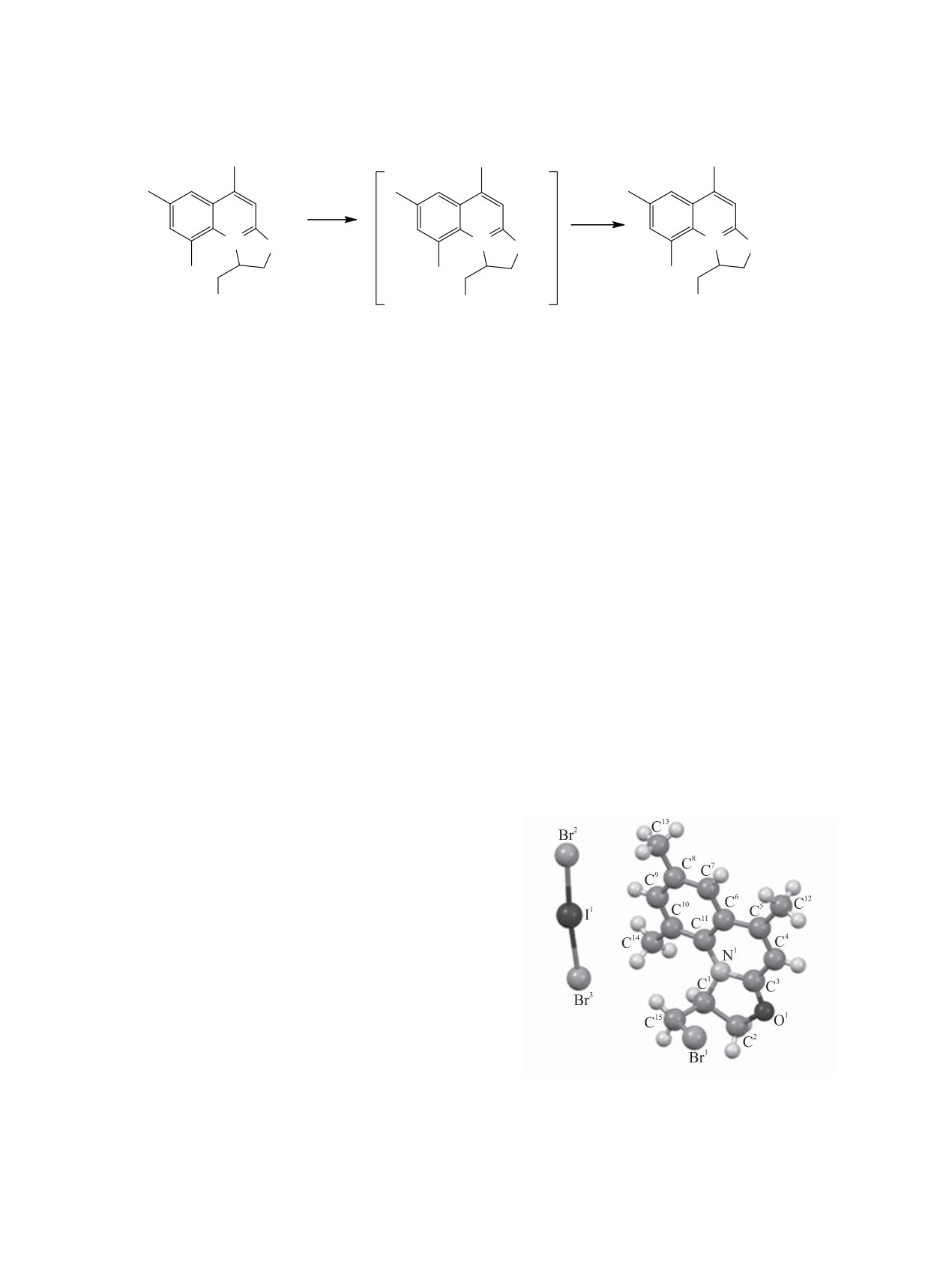
иододибромида 7 (схема 3). Соединение 7 обра-
Трииодид 4а при действии иодида натрия в
ацетоне превращается в
1-иодметил-5,9-диме-
зовалось в результате диспропорционирования в
тил-1,2-дигидро[1,3]оксазоло[3,2-а]хинолиния ио-
растворе иона I2Br¯ на ионы Br2I¯ и I3¯ [10-12].
дид 6, спектр ЯМР 1Н которого практически иден-
По данным РСА соединения 7 (см. рисунок),
тичен спектру соединения 4а.
оксазолохинолиновый фрагмент практически пло-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
СИНТЕЗ И ГАЛОГЕНОЦИКЛИЗАЦИЯ ПРОИЗВОДНЫХ
1831
Схема 3.
–
I2
–
Br
I2Br
A
IBr–
+
EtOH
+
+
_I_
N O
N O
N O
Br
Br
Br
ɛ
A
7
ский, анион BrIBr¯ имеет почти линейную геоме-
ренного в 0.5 мл воды, в 10 мл пропан-2-ола при-
трию [угол BrIBr 173.51(3)°], длины связей Br-I
бавляли 1.5 ммоль аллилбромида. Реакционную
близки между собой [2.784(2), 2.813(2) Å].
смесь кипятили 3 ч. Осадок NaBr отфильтровыва-
Таким образом, алкилирование 4,8-диметил- и
ли, растворитель отгоняли. Остаток обрабатывали
4,6,8-триметилхинолин-2(1Н)-она аллилброми-
гексаном (3×5 мл), плохо растворимые в гексане
дом протекает с образованием смеси производных
N-изомеры 3a, б отфильтровывали. После отгонки
1-аллилхинолин-2(1Н)-она и 2-аллилоксихиноли-
растворителя выделяли бесцветные маслообраз-
на с преобладанием О-изомера. Взаимодействие
ные соединения 2a, б.
производных 2-аллилоксихинолина с галогенами
2-Аллилокси-4,8-диметилхинолин
(2а).
приводит к аннелированию оксазольного цикла с
Выход 103 мг (48%). ИК спектр, ν, см-1: 1201 с
образованием неизвестных ранее галогенозаме-
(CAr-O-CH2), 1034 ср (CAr-O-CH2). Спектр ЯМР
щенных оксазоло[3,2-a]хинолиниевых солей.
1Н, δ, м. д.: 2.60 с (3Н, 8-CH3), 2.62 с (3Н, 4-CH3),
4.98 д. т (2Н, ОCH2, 3JНН = 5.4 Гц), 5.27 д. д. т (1H,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
=СН2, 3JНН = 10.4 Гц), 5.45 д. д. т (1H, =СН2, 3JНН =
Спектры ЯМР 1Н и 13C записаны на приборах
17.3 Гц), 6.16 д. д. т (1H, =СН, 3JНН = 17.2, 10.5,
Bruker AVANCE-500 (500 и 126 МГц) и Bruker
5.4 Гц), 6.91 с (1Н, Н3), 7.33 д. д (1Н, Н6, 3JНН = 8.2,
DRX-400 (400 МГц) в ДМСО-d6, внутренний
7.1 Гц), 7.53 д (1Н, Н7, 3JНН = 6.9 Гц), 7.80 д (1Н,
стандарт
- ТМС. Масс-спектры получены на
Н5, 3JНН = 8.2 Гц). Спектр ЯМР 13С, δC, м. д.: 17.7
масс-спектрометре Agilent 5973N (ЭУ, 70 эВ) с
(СН3С8), 18.4 (СН3С4), 65.9 (ОСН2), 112.2 (=СН2),
использованием газового хроматографа Agilent
117.6 (C3), 121.8 (C6), 123.5 (C5), 124.7 (C4a), 129.7
6890N. Температуры плавления определяли на ми-
кронагревательном столике Boеtius. Элементный
анализ выполняли на автоматическом анализаторе
Carlo Erba 1108. РСА кристалла соединения 7 про-
веден на дифрактометре D8 Quest Bruker (MoKα-
излучение, λ = 0.71073 Å, графитовый монохрома-
тор) при 296(2) K. Сбор, редактирование данных
и уточнение параметров элементарной ячейки, а
также учет поглощения проведены по програм-
мам SMArT и SAINT-Plus [13]. Все расчеты по
определению и уточнению структуры выполнены
по программам SHELXL/PC [14] и OLEX2 [15].
Структура определена прямым методом и уточне-
на методом наименьших квадратов в анизотроп-
ном приближении для неводородных атомов.
Общий вид молекулы 1-бромметил-5,7,9-триметил-
Cоединения (2a, б). К смеси 1 ммоль хино-
1,2-дигидро[1,3]оксазоло[3,2-а]хинолиния
иододи-
бромида 7 в кристалле (CCDC 1908747).
лин-2(1Н)-она 1a, б и 1.5 ммоль NaOH, раство-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1832
КИМ и др.
(C8), 133.8 (C7), 134.6 (C=), 144.5 (C8a), 147.7 (C4),
120 мг (80%), т. пл. 71-73°С. Спектр ЯМР 1Н, δ,
159.8 (C2). Масс-спектр, m/z (Iотн, %): 213 [M]+
м. д.: 2.53 с (3Н, СН3), 2.80 с (3Н, СН3), 2.82 с (3Н,
(91), 212 [M - Н]+ (46), 198 [M - СН3]+ (100), 184
СН3), 3.68 д (2H, СН2I, 3JНН = 3.5 Гц), 5.01 д. д (1Н,
[М - 29]+ (94), 172 [М - 41]+ (66), 157 (74), 143 (28),
OСН2, 2JНН = 9.5, 3JНН = 2.1 Гц), 5.21 т (1Н, OСН2,
128 (22), 115 (32), 102 (6), 91 (11), 77 (11), 63 (6),
2JНН = 9.0 Гц), 6.27 м (1Н, NCН), 7.76 с (1H, Н4),
51 (6), 41 (11). Найдено, %: С 78.80; Н 7.04; N 6.55.
7.83 с (1H, Н8), 8.07 с (1H, Н6). Спектр ЯМР 13С,
С14Н15NO. Вычислено, %: С 78.84; Н 7.09; N 6.57.
δС, м. д.: 8.3 (CH2I), 20.5 (СН3С9), 20.7 (СН3С7),
2-Аллилокси-4,6,8-триметилхинолин
(2б).
20.9 (СН3С5), 63.0 (С1), 75.7 (C2), 108.6 (С4), 125.3
Выход 102 мг (45%). Спектр ЯМР 1Н, δ, м. д.: 2.43 с
(C9), 126.3 (C5а), 126.9 (C7), 130.7 (C6), 137.6 (С9а),
(3Н, 6-CH3), 2.57 с (3Н, 8-CH3), 2.58 с (3Н, 4-CH3),
140.4 (C8), 161.1 (C3а), 161.6 (C5). Найдено, %: С
4.95 д. т (2Н, ОCH2, 3JНН = 5.5 Гц), 5.27 д. д. т (1H,
24.54; Н 2.35; N 1.87. С15Н17I4NO. Вычислено, %:
=СН2, 3JНН = 10.4 Гц), 5.41 д. д. т (1H, =СН2, 3JНН =
С 24.51; Н 2.33; N 1.91.
17.3 Гц), 6.16 д. д. т (1H, =СН, 3JНН = 17.2, 10.4,
Общая методика синтеза бромидов 5a, б.
5.0 Гц), 6.86 с (1Н, Н3), 7.37 с (1Н, Н5), 7.57 с (1Н,
К раствору 0.2 ммоль соединения 2a, б в хлоро-
Н7). Спектр ЯМР 13С, δC, м. д.: 17.6 (СН3С6), 18.4
форме прибавляли при перемешивании раствор
(СН3С8), 21.1 (СН3С4), 65.5 (ОСН2), 112.0 (=СН2),
0.4 ммоль (0.02 мл) брома в том же растворите-
117.4 (C3), 120.9 (C6), 124.6 (C5), 131.5 (C4a), 132.4
ле. Растворитель отгоняли, остаток обрабатывали
(C8), 133.9 (C7), 134.3 (C=), 142.8 (C8a), 146.9 (C4),
5 мл ацетона. Образовавшийся осадок отфильтро-
159.3 (C2). Масс-спектр, m/z (Iотн, %): 227 [M]+
вывали и перекристаллизовывали из этанола.
(72), 226 [M - Н]+ (43), 212 [M - СН3]+ (100), 198
Бромид
1-бромметил-5,9-диметил-1,2-диги-
(96), 186 [М - 41]+ (87), 171 (62), 156 (30), 143 (26),
дро[1,3]оксазоло[3,2-а]хинолиния
(5a). Выход
128 (19), 115 (17), 103 (6), 91 (11), 77 (9), 65 (6), 51
50 мг (66%), т. пл. 197-199°С. Спектр ЯМР 1Н,
(4). Найдено, %: С 79.31; Н 7.50; N 6.17. С15Н17NO.
δ, м. д.: 2.87 с (3Н, СН3), 2.91 с (3Н, СН3), 4.02 м
Вычислено, %: С 79.26; Н 7.54; N 6.16.
(2H, СН2Br), 5.17 д. д (1Н, OСН2, 2JНН = 9.5, 3JНН =
Общая методика синтеза трииодидов 4a, б.
2.3 Гц), 5.29 т (1Н, OСН2, 2JНН = 9.0 Гц), 6.57
К раствору 0.102 г (0.4 ммоль) иода в уксусной
м (1Н, NCН), 7.79 (2H, Н4, Н7), 7.98 д (1H, Н8,
кислоте добавляли раствор 0.2 ммоль соединения
3J = 7.1 Гц), 8.27 д (1H, Н6, 3JНН = 8.3 Гц). Спектр
2a, б в том же растворителе. Полученную смесь
ЯМР 13С, δС, м. д.: 20.6 (СН3С9), 21.4 (СН3С5), 35.6
выдерживали 24 ч при комнатной температуре.
(CH2Br), 63.1 (С1), 74.6 (C2), 108.4 (С4), 126.0 (C9),
Образовавшийся осадок отфильтровывали, про-
126.1 (C5а), 127.5 (C7), 127.7 (C6), 132.6 (С9а), 138.9
мывали растворителем и сушили.
(C8), 162.1 (C5), 162.3 (C3a). Найдено, %: С 45.10; Н
Трииодид 1-иодметил-5,9-диметил-1,2-диги-
4.01; N 3.82. С14Н15Br2NO. Вычислено, %: С 45.07;
дро[1,3]оксазоло[3,2-а]хинолиния
(4a). Выход
Н 4.05; N 3.75.
138 мг (96%), т. пл. 100-102°С. Спектр ЯМР 1Н,
Бромид 1-бромметил-5,7,9-триметил-1,2-ди-
δ, м. д.: 2.86 с (3Н, СН3), 2.91 с (3Н, СН3), 3.69
гидро[1,3]оксазоло[3,2-а]хинолиния (5б). Выход
д (2H, СН2I, 3JНН = 4.0 Гц), 5.04 д. д (1Н, OСН2,
63 мг (81%), т. пл. 205-207°С. Спектр ЯМР 1Н,
2JНН = 9.6, 3JНН = 2.3 Гц), 5.21 т (1Н, OСН2, 2JНН =
δ, м. д.: 2.53 с (3Н, СН3), 2.83 с (3Н, СН3), 2.88 с
9.0 Гц), 6.25 м (1Н, NCН), 7.79 с (2H, Н4, Н7), 7.98
(3Н, СН3), 3.98 д. д (1H, СН2Br, 3JНН = 3.8, 2JНН =
д (1H, Н8, 3JНН = 7.1 Гц), 8.27 д (1H, Н6, 3JНН =
12.0 Гц), 4.04 д. д (1H, СН2Br, 3JНН = 2.1, 2JНН =
8.3 Гц). Спектр ЯМР 13С, δС, м. д.: 8.2 (CH2I), 20.6
12.0 Гц), 5.14 д. д (1Н, OСН2, 2JНН = 9.5, 3JНН =
(СН3С9), 21.0 (СН3С5), 63.1 (С1), 75.8 (C2), 108.8
2.1 Гц), 5.27 т (1Н, OСН2, 2JНН = 9.0 Гц), 6.53 м
(С4), 126.0 (C9), 126.1 (C5а), 127.3 (C7), 127.7 (C6),
(1Н, NCН), 7.76 с (1H, Н4), 7.84 с (1H, Н8), 8.07 с
132.5 (С9а), 138.9 (C8), 161.7 (C3а), 162.1 (C5).
(1H, Н6). Спектр ЯМР 13С, δС, м. д.: 20.4 (СН3С9),
Найдено, %: С 23.30; Н 2.12; N 1.95. С14Н15I4NO.
20.6 (СН3С7), 21.2 (СН3С5), 35.6 (CH2Br), 63.0 (С1),
Вычислено, %: С 23.33; Н 2.10; N 1.94.
74.4 (C2), 108.3 (С4), 125.3 (C9), 126.2 (C5а), 127.1
Трииодид 1-иодметил-5,7,9-триметил-1,2-ди-
(C7), 130.7 (C6), 137.6 (С9а), 140.3 (C8), 161.6 (C5),
гидро[1,3]оксазоло[3,2-а]хинолиния (4б). Выход
161.8 (C3a). Найдено, %: С 46.49; Н 4.45; N 3.66.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
СИНТЕЗ И ГАЛОГЕНОЦИКЛИЗАЦИЯ ПРОИЗВОДНЫХ
1833
С15Н17Br2NO. Вычислено, %: С 46.54; Н 4.43; N
5. Онисько М.Ю., Лендел В.Г. // ХГС. 2007. Т. 43.
3.62.
№ 8. С. 1204; Onysko M.Yu., Lendel V.G. // Chem.
Heterocycl. Compd. 2007. Vol. 43. N 8. P. 1020. doi
Иодид 1-иодметил-5,9-диметил-1,2-дигидро-
[1,3]оксазоло[3,2-а]хинолиния (6). К раствору
10.1007/s10593-007-0159-x
0.110 г (0.15 ммоль) соединения 4а в ацетоне до-
6. Вершинина Е.А., Ким Д.Г. // Вестн. ЮУрГУ. Сер.
бавляли 0.070 г (0.45 ммоль) NaI. Образовавшийся
Химия. 2010. № 31. С. 10.
осадок отфильтровывали. Выход 47 мг (71%),
7. Ким Д.Г., Сашин А.В., Козловская В.А., Андреева И.Н. //
т. пл. 61-63°С. Спектр ЯМР 1Н, δ, м. д.: 2.92 с (3Н,
ХГС. 1996. Т.32. № 9. С. 1252; Kim D.G., Sashin A.V.,
СН3), 2.94 с (3Н, СН3), 3.66 д. д (1H, СН2I, 3JНН =
Kozlovskaya V.A., Andreeva I.N. // Chem. Heterocycl.
5.5, 2JНН = 11.6 Гц), 3.76 д (1H, СН2I, 2JНН =
Compd. 1996. Vol. 32. N 9. P. 1075. doi 10.1007/
10.3 Гц), 5.02 д (1Н, OСН2, 2JНН = 9.3 Гц), 5.36 т
BF01164715
(1Н, OСН2, 2JНН = 8.9 Гц), 6.35 м (1Н, NCН), 7.76
8. Украинец И.В., Березнякова Н.Л., Паршиков В.А.,
(2H, Н4, Н7), 7.96 д (1H, Н8, 3J = 7.3 Гц), 8.26 д (1H,
Н6, 3JНН = 8.2 Гц). Найдено, %: С 35.96; Н 3.26; N
Туров А.В. // ХГС. 2007. Т. 43. № 10. С. 1496; Ukra-
2.99. С14Н15I2NO. Вычислено, %: С 36.00; Н 3.24;
inets I.V., Bereznyakova N.L., Parshikov V.A., Turov A.V. //
N 3.00.
Chem. Heterocycl. Compd. 2007. Vol. 43. N 10. P. 1269.
10.1007/s10593-007-0193-8
Иододибромид 1-бромметил-5,7,9-триметил-
1,2-дигидро[1,3]оксазоло[3,2-а]хинолиния
9. Ким Д.Г., Вершинина Е.А., Овчинникова И.Г., Сле-
(7). К раствору 0.050 г (0.13 ммоль) соедине-
пухин П.А., Ежикова М.А., Кодесс М.И. // ХГС.
ния 5б в этаноле добавляли 0.033 г (0.13 ммоль)
2018. Т. 54. № 10. С. 977; Kim D.G., Vershinina E.A.,
иода. Реакционную смесь кипятили
30 мин.
Ovchinnikova I.G., Slepuhin P.A., Ezhikova M.A.,
Образовавшийся осадок отфильтровывали. т. пл.
Kodess M.I. // Chem. Heterocycl. Compd. 2018.
113-115°С. Найдено, %: С 30.37; Н 2.91; N 2.33.
Vol. 54. N 10. P. 977. doi 10.1007/s10593-018-2374-z
С15Н17Br3INO. Вычислено, %: С 30.33; Н 2.89; N
10. Gorlov M., Pettersson H., Hagfeldt A., Kloo L. //
2.36.
Inorg. Chem. 2007. Vol. 46. N 9. P. 3566. doi 10.1021/
КОНФЛИКТ ИНТЕРЕСОВ
ic062244b
11. Chernov’yants M.S., Burykin I.V., Berezova P.N.,
Авторы заявляют об отсутствии конфликта
Starikova Z.A. // Mendeleev Commun. 2010. Vol. 20.
интересов.
N 3. P. 182. doi 0.1016/j.mencom.2010.05.021
СПИСОК ЛИТЕРАТУРЫ
12. Черновьянц М.С., Бурыкин И.В., Алешина Н.В. //
ЖОХ. 2008. Т. 78. Вып. 7. С. 1109; Chernov’yants M.S.,
1. Чарушин В.Н., Носова Э.В., Липунова Г.Н., Чупа-
Burykin I.V., Aleshina N. // Russ. J. Gen. Chem. 2008.
хин О.Н. Фторхинолоны: синтез и применение. М.:
Vol. 78. N 7. P. 1345. doi 10.1134/S1070363208070104
ФИЗМАТЛИТ, 2013. С. 24.
13. SMArT and SAINT-Plus, Versions 5.0, Bruker AXS
2. Aly A.A., El-Sheref E.M., Mourad AF.E., Bakheet M.E.,
Inc., Madison, WI, USA, 1998.
Bräse S. // Mol. Diversity. 2019. doi 10.1007/s11030-
019-09952-5.
14. SHELXTL/PC, Versions 5.10, Bruker AXS Inc.,
3. Джоуль Дж., Миллс К. Химия гетероциклических
Madison, WI, USA, 1998.
соединений. М.: Мир, 2004. С. 175.
15. Dolomanov O.V., Bourhis L.J., Gildea R.J, Ho-
4. Гюльбудагян Л.В., Алексанян И.Л., Аветисян А.А. //
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
Арм. хим. ж. 1989. Т. 42. Вып. 10. С. 636.
Vol. 42. P. 339. doi 10.1107/S0021889808042726
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1834
КИМ и др.
Synthesis and Halogenocyclization
of 2-Allyloxyquinoline Derivatives
D. G. Kim, E. A. Vershinina*, and V. V. Sharutin
Southern Ural State University (National Research University), pr. Lenina 76, Chelyabinsk, 454080 Russia
*e-mail: enka84@mail.ru
Received May 30, 2019; revised May 30, 2019; accepted June 6, 2019
Alkylation of 4,8-dimethyl- and 4,6,8-trimethylquinolin-2(1H)-one with allyl bromide in the presence of a
base proceeds at the oxygen and nitrogen atoms with the predominant formation of the O-isomer. The reaction
of 2-allyloxyquinolines with halogens leads to the formation of oxazolo[3,2-a]quinolinium salts. Structure of
1-bromomethyl-5,7,9-trimethyl-1,2-dihydro[1,3]oxazolo[3,2-a]quinolinium iododibromide was established by
single crystal X-ray diffraction method.
Keywords: 4,8-dimethyl- and 4,6,8-trimethylquinolin-2(1H)-one, allyl bromide, 2-allyloxyquinolines,
dihydro[1,3]oxazolo[3,2-a]quinolinium halides, interhalide
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019