ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 12, с. 1854-1858
УДК 547.856.1
СИНТЕЗ СТАБИЛЬНЫХ σ-АДДУКТОВ ПРИ
АРИЛИРОВАНИИ ХИНАЗОЛИНА
© 2019 г. Ю. A. Aзев*, О. С. Коптяева, Е. А. Селиверстова, А. В. Ивойлова, Т. А. Поспелова
Уральский федеральный университет имени первого Президента России Б. Н. Ельцина, пр. Мира 19,
Екатеринбург, 620002 Россия
*e-mail: azural@yandex.ru
Поступило в Редакцию 21 мая 2019 г.
После доработки 21 мая 2019 г.
Принято к печати 25 мая 2019 г.
Взаимодействие хиназолина с 1,3,5-триметоксибензолом, метилзамещенными о-фенилендиаминами и
1-(4-метоксибензилиден)-2-фенилгидразином при нагревании в присутствии кислоты приводит к обра-
зованию стабильных С-С-связанных σ-аддуктов.
Ключевые слова: хиназолин, С-нуклеофилы, С-С-связывание
DOI: 10.1134/S0044460X19120084
Хиназолиновое ядро образует гетероцикличе-
в хиназолине чаще всего применяется предвари-
ский каркас ряда природных соединений и синте-
тельная активация азинов - получение четвер-
тических лекарственных препаратов (например,
тичных (например, всего N-алкильных) солей.
вазицина, фебрифунгина, эводимина, ругекарпи-
Сообщалось о присоединении С-нуклеофилов к
на) [1]. Производные хиназолина проявляют про-
3-метилхиназолинийиодиду с образованием 4-за-
тивовоспалительную [2], противоопухолевую [3],
мещенных 3,4-дигидрохиназолинов [12]. Менее
противомалярийную [4, 5], противосудорожную
распространены примеры активации азинов с ис-
[6, 7], антигипертензивную [8, 9], антигиперглике-
пользованием кислотного катализа. Существуют
мическую [10] и другие виды активности.
лишь единичные примеры использования данного
метода для получения производных хиназолина.
В связи с широкими возможностями приме-
Незамещенный хиназолин реагирует с индолом,
нения производных хиназолина активно разраба-
тываются методы их синтеза [11]. Эффективный
3-метил-1-фенилпиразол-5-оном, 1,3-диметилбар-
битуровой кислотой и пирогаллолом в присут-
синтез производных хиназолина с целью поиска
ствии кислоты с образованием 4-σ-аддуктов [13].
новых лекарственных соединений предполагает
возможность широко варьировать заместители в
Способность азинов и их катионов присоеди-
структуре базовой молекулы, что позволяет из-
нять нуклеофилы (проявление электроноакцеп-
менять физико-химические свойства (гидрофиль-
торных свойств) можно оценить, моделируя ста-
ность, липофильность и др.), а также повышать
дию нуклеофильного присоединения посредством
активность и биологическую доступность соеди-
электрохимического восстановления [14].
нений.
Для получения качественных характеристик,
При разработке удобных и доступных ме-
отражающих способность азиниевых катионов к
тодов синтеза производных хиназолина наи-
взаимодействию с нуклеофилами, нами изучено
более перспективны атом-экономные реак-
электрохимическое восстановление хиназолина и
ции присоединения нуклеофилов и замещения
его солянокислой соли методом циклической воль-
водорода, соответствующие принципам
«зеле-
тамперометрии в режиме линейной развертки по-
ной» химии. Для успешного замещения водорода
тенциала. Первый потенциал восстановления хи-
1854
СИНТЕЗ СТАБИЛЬНЫХ σ-АДДУКТОВ
1855
Схема 1.
N
N
OMe
1
OMe
N N
MeO
OMe
H
4
2
TFA, t-BuOH TFA, t-BuOH
H
N
4 ɱ, 120oC
5 ɱ, 120oC
N
+
N
NH
H
H
H
MeO
OMe
CF3COO
OMe
OMe
HN
N
3
5
назолина-основания регистрируется при -1.74 В,
нуклеофильная атака происходит нуклеофильным
что свидетельствует о его низких электроноак-
атомом C ароматического ядра. К перспективным
цепторных свойствах [14]. При добавлении к рас-
С-нуклеофилам относятся о-фенилендиамины,
твору хиназолина HCl появляется низковольтный
в которых отрицательный заряд сосредоточен в
пик восстановления фрагмента С=NН+ молекулы
пара-положении к аминогруппам. Они могут быть
cоли при потенциале -0.55 В, что указывает на
использованы для аннелирования N-гетероциклов
существенное увеличение электроноакцепторных
(триазолов, пиразинов, имидазолов).
свойств соединения и ведет к облегчению реакций
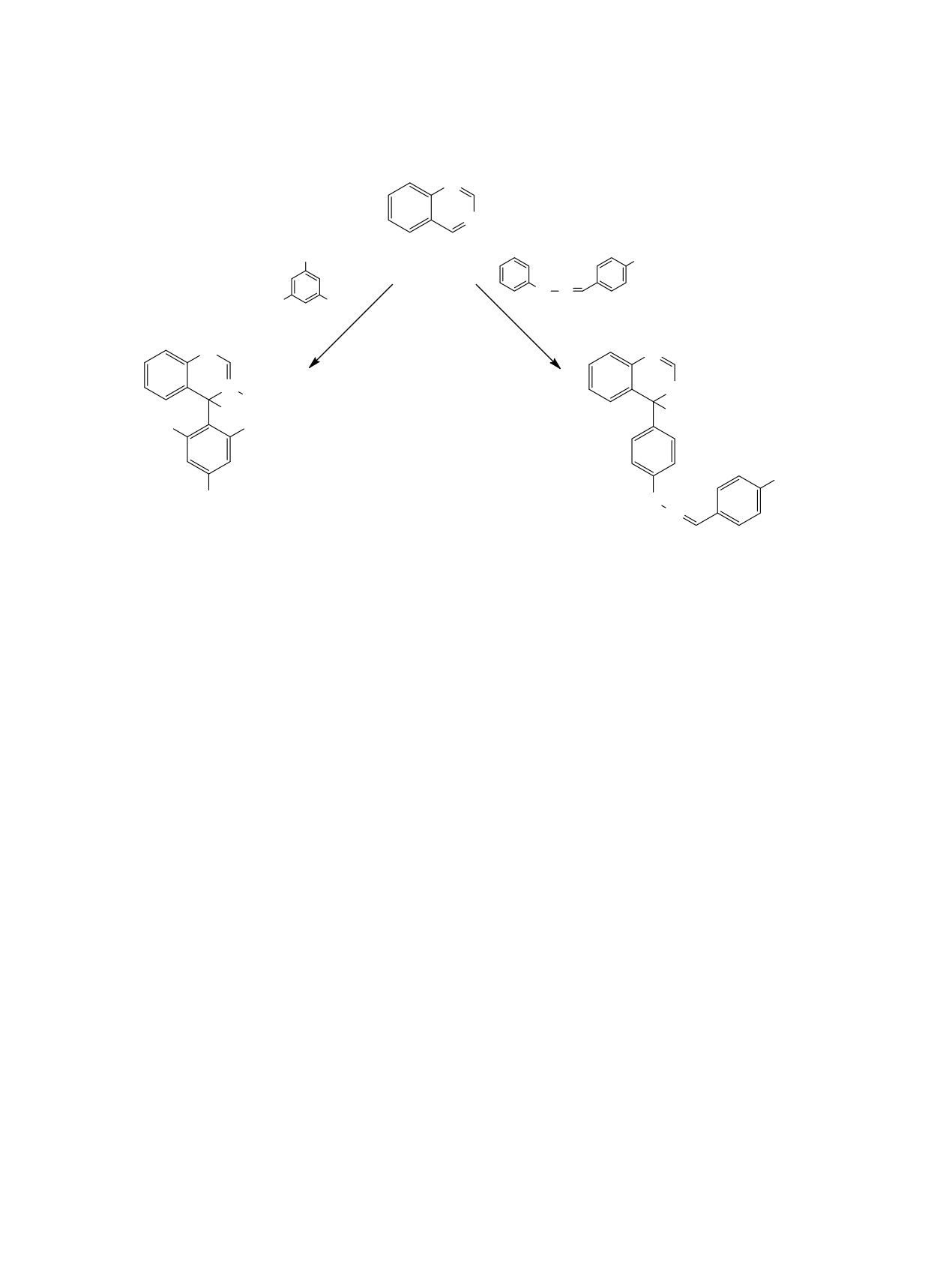
Хиназолин 1 при нагревании с 1,3,5-триме-
с нуклеофилами в данных условиях.
токсибензолом 2 в присутствии трифторуксусной
Активация азинов с помощью кислотного ка-
кислоты (TFA) превращается в соответствующий
тализа - более простой способ, в большей мере
4-σ-аддукт 3 (схема 1).
отвечающий принципам «зеленой» химии, чем
Молекулярная масса cоединения 3, определен-
предварительное получение и использование чет-
ная масс-спектрометрическим методом, соответ-
вертичных алкильных солей.
ствует расчетной. Характеристичными сигнала-
В качестве нуклеофилов для взаимодействия
ми для соединения 3 в спектре ЯМР 1Н являются
с хиназолином перспективным представляет-
синглеты протонов фрагмента СН(sp3) в области
ся использование ароматических и гетероаро-
6.42 м. д., в спектре ЯМР 13С - сигнал sp3-гибри-
матических соединений, имеющих активные
дизованного углерода в области 55.39 м. д.
С-нуклеофильные центры. Заместители в этих
При нагревании хиназолина 1 с фенилгидразо-
нуклеофилах, вызывающие локализацию отрица-
ном 4 получено соединение 5, включающее при-
тельного заряда в ароматическом ядре, в дальней-
шем сами могут использоваться для включения
соединенный к хиназолину остаток нуклеофила
новых функциональных групп или циклизации
4 (схема 1). В спектре ЯМР 1Н соединения 5 на-
фрагментов молекулы. К таким нуклеофилам отно-
ряду с парами попарно эквивалентных протонов
сятся, например, фенилгидразины, которые можно
фенильных фрагментов наблюдается характерный
использовать для получения широкого ряда гидра-
для аддукта синглет протона sp3-группы СН при
зонов. Фрагмент NH-N=CН в составе молекулы
6.02 м. д., а в спектре ЯМР 13С - сигнал sp3-гибри-
гидразона блокирует нуклеофильный центр N, и
дизованного углерода в области 54.47 м. д.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1856
AЗЕВ и др.
Схема 2.
N
N
N
N
O
F
+
F
NH
NH
O
F
1
HO
F
H
+
F
H
R1
R1
4 ɱ, 110
oC
H2O
HO
F
R2
R1
NH2
R2
R2
NH2
NH
N
NH2
NH2
CF3
7a, ɛ
6a, ɛ
R1 = Me, R2 = H (ɚ); R1 = H, R2 = Me (ɛ).
Необычные превращения обнаружены нами
рой стадии при участии трифторуксусной кислоты
при взаимодействии хиназолина
1 с метил-
происходит образование имидазольного кольца в
замещенными о-фенилендиаминами 6a, б в при-
молекуле (схема 2).
сутствии TFA. В результате реакций были получе-
Реакции замещенных о-фенилендиаминов с
ны 4-(бензимидазол-6-ил)производные хиназоли-
трифторуксусной кислотой, в ходе которых проис-
на 7a, б с трифторметильной группой в положении
ходит образование 2-трифторметилпроизводных
2 бензоимидазольного цикла (схема 2).
имидазола, широко используются для синтеза био-
В спектрах ЯМР 1Н соединений 7a, б наблюда-
логически активных соединений [15].
ются синглетные сигналы протонов sp3-групп СН
Таким образом, в условиях кислотного катализа
хиназолинового фрагмента в области 5.8-6.1 м. д.,
синтезированы стабильные С-С связанные σ-ад-
а в спектре ЯМР 13С - сигнал sp3-гибридизованно-
дукты хиназолина с нуклеофилами - триметокси-
го углерода в области 54-57 м. д. Сигналы атомов
бензолом и 1-(4-метоксибензилиден)-2-фенилги-
фтора трифторметильной группы наблюдаются
дразином. Многокомпонентная реакция хиназо-
при -(62.0-63.0) м. д.
лина с метилзамещенными о-фенилендиаминами
и трифторуксусной кислотой - перспективный и
Метильная группа в положениях 3 и 4 соеди-
удобный метод получения стабильных трифтор-
нений 6a, б не оказывает влияния на регионаправ-
метилпроизводных 1-(бензимидазол-6-ил)-3,4-ди-
ленность реакции хиназолина 1: в обоих случаях
гидрохиназолина.
присоединение проходит по положению 5 соеди-
нений 6a, б.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Можно предположить, что обнаруженное пре-
Коммерчески доступные реагенты (Sigma
вращение - многокомпонентная реакция, в кото-
Aldrich, Merck) использовали без дополнитель-
рой протекает последовательное взаимодействие
ной очистки. Протекание реакции контролирова-
компонентов. На первой стадии метилзамещен-
ли с помощью ТСХ на пластинах с силикагелем
ный о-фенилендиамин присоединяется к хиназо-
(Merck). Спектры ЯМР 1H и 13С записаны для рас-
лину, а на второй - происходит циклизация ами-
творов соединений в ДМСО-d6 на спектрометре
ногрупп полученных аддуктов с трифторуксус-
Bruker AVANCE-400, рабочие частоты: 400 (1H),
ной кислотой, которая приводит к образованию
100 МГц (13С). Внутренние стандарты: тетраме-
4-[4(5)-метил-2-(трифторметил)-1H-бензими-
тилсилан (1H), CFCl3 (19F). Масс-спектры элек-
дазол-6-ил]-3,4-дигидрохиназолинов
7a, б. По-
тронного удара (МС-ЭУ) получены на приборе
видимому, на первой стадии хиназолин образует
GCMS-QP2010 Ultra Shimadzu (70 эВ, температу-
с трифторуксусной кислотой соль, и реакция ну-
ра источника - 200°C, температура интерфейса -
клеофильного присоединения диамина 6а или 6б
150°C). Для элементного анализа использова-
по положению 4 молекулы 1 активируется. На вто-
ли CHNS/O анализатор PerkinElmer 2400 Series
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
СИНТЕЗ СТАБИЛЬНЫХ σ-АДДУКТОВ
1857
II. Циклические вольтамперометрические изме-
CH(sp3)], 6.95-7.00 м (4H, СН), 7.06 д (2Н, CHAr,
рения выполняли с использованием потенцио-
2JНН = 8.4 Гц), 7.16-7.24 м (4H, CHAr), 7.31-7.34 м
стата/гальваностата μAutolab Type III (Metrohm,
(1Н, СНAr), 7.57-7.59 д (2Н, CHAr, 2JНН = 8.8 Гц),
Швейцария) на стандартной трехэлектродной
7.84 с (1Н, NH), 8.48 с (1Н, СН), 10.31 с (1Н, NH).
ячейке. Рабочий электрод - стеклоуглеродный
Спектр ЯМР 13С, δС, м. д.: 54.47, 55.17, 111.92,
диск, впрессованный во фторопласт (диаметр
114,17, 116.83, 122.38, 127.087, 127.04, 128.09,
2.5 мм, Metrohm, Швейцария); вспомогательный
128.23, 128.45, 128.91, 129.64, 132.60, 137.47,
электрод - стержень из стеклоуглерода (Metrohm,
145.81, 147.99, 159.45. Масс-спектр, m/z (Iотн,
Швейцария). Для сравнения использовали хлорид-
%): 356 (100) [M]+, 226 (17), 222 (47), 131 (74).
Найдено, %: С 74.00; Н 5.70; N 15.42. C22H20N4O.
серебряный электрод (Metrohm, Швейцария). В ка-
Вычислено, %: С 74.14; Н 5.66; N 15.72.
честве сопутствующего реагента (фона) применя-
ли тетрабутиламмонийтетрафторборат марки ОСЧ
Общая методика синтеза соединений 7а, б.
(Panreac, Испания).
Смесь 0.5 ммоль хиназолина 1, 0.5 ммоль соот-
ветствующего диамина 6a, б и 2.0 мл трифторук-
4-(2,4,6-Триметоксифенил)-1,4-дигидрохина-
сусной кислоты нагревали 4 ч в запаянной ампу-
золин-3-ийтрифторацетат
(3). Смесь
0.065 г
ле при 110°С. Растворитель отгоняли в вакууме.
(0.5 ммоль) хиназолина 1, 0.085 г (0.5 ммоль)
Остаток растворяли в 4-5 мл этанола и подщела-
2,4,6-триметоксибензола 2, 2.0 мл бутан-1-ола и
чивали 10%-ным водным аммиаком до рН = 7-8.
0.5 мл трифторуксусной кислоты нагревали при
Наблюдалось образование смолистого осадка.
115-120°С в течение 4 ч. Растворитель отгоняли
Раствор декантировали, осадок растирали с водой
в вакууме. Твердый остаток промывали 2-3 мл
до кристаллического состояния, отфильтровывали
этанола и сушили. Выход 3 0.090 г (43%), т. пл.
и сушили.
181-182°C. Спектр ЯМР 1Н, δ, м. д.: 3.29 с (6Н,
4-[5-Mетил-2-(трифторметил)-1Н-бензими-
ОCH3), 3.80 с (3Н, ОСН3), 6.30 с (2Н, СНAr), 6.42
дазол-6-ил]-3,4-дигидрохиназолин
(7a). Выход
с [1Н,СН(sp3)], 6.79 д (1Н, СНAr, 2JНН = 7.6 Гц),
0.055 г (33%), т. пл. 256-257°C. Спектр ЯМР 1Н, δ,
7.05-7.11 м (2Н, СНAr), 7.23 т (1Н, СНAr, 3JНН =
м. д.: 2.55 с (3Н, CH3), 6.02 с [1H, CH(sp3)], 6.63 д
7.6 Гц), 8.36 с (1Н, СНHet), 10.50 уш. с (1Н, NH).
(1H, CHAr, 2JНН = 7.2 Гц), 6.87-6.93 м (3Н, СНAr),
Спектр ЯМР 13С, δC, м. д.: 45.24, 55.39, 56.00,
7.14 т (1Н, СНAr, 3JНН = 7.2 Гц), 7.27 с (2Н, СНAr),
111.23,
115.92,
122.40,
126.47,
126.59,
128.27,
7.52 с (1Н, СНHet). Спектр ЯМР 13С, δС, м. д.: 19.62,
130.67, 148.19, 161.59. Спектр ЯМР 19F, δF, м. д.:
54.76, 117.88, 118.48, 120.56, 122.91, 126.82, 128.21,
-73.56 (3F, CF3). Масс-спектр, m/z (Iотн, %): 296
131.87, 138.82, 139.83, 140.40, 145.78. Спектр ЯМР
(20), 298 (100) [M]+, 297 (88), 283 (21), 281 (19),
19F, δF, м. д.: -62.60 с (3F, CF3). Масс-спектр, m/z
168 (20), 139 (22), 131 (60). Найдено, %: С 55.38; Н
(Iотн, %): 330 (35) [M]+, 131 (100). Найдено, %: С
4.47; N 6.85. C17H18N2O3 ∙ C2O2F3. Вычислено, %:
61.60; Н 3.97; N 16.78. C17H13F3N4. Вычислено, %:
С 55.47; Н 4.38; N 6.81.
С 61.82; Н 3.97; N 16.96.
4-{4-[2-(4-Mетоксибензилиден)гидразинил]-
4-[4-Mетил-2-(трифторметил)-1Н-бензими-
фенил}-3,4-дигидрохиназолин (5). Смесь 0.065 г
дазол-6-ил]-3,4-дигидрохиназолин
(7б). Выход
(0.5 ммоль) хиназолина 1, 0.113 г (0.5 ммоль) ги-
0.050 г. (31%), т. пл. 258-259°C. Спектр ЯМР 1Н, δ,
дразона 4, 2.0 мл бутан-1-ола и 0.5 мл трифторук-
м. д.: 2.52 с (3Н, СН3), 5.85 с [1Н, СН(sp3)], 6.84 д
сусной кислоты нагревали при 115-120°С в тече-
(1Н, CHAr, 2JНН = 8.0 Гц), 6.90-6.93 м (2H, СНAr),
ние 5 ч. Растворитель отгоняли в вакууме. Остаток
7.10-7.15 м (2Н, СНAr), 7.39 с (1Н, СНAr), 7.47 с
растворяли в 5-6 мл этанола, нейтрализовали
(1Н, СНAr). Спектр ЯМР 13С, δС, м. д.: 16.74, 56.30,
водным аммиаком до рН = 7-8. К полученному
120.56, 123.06, 123.87, 124.03, 124.12, 127.27,
раствору по каплям добавляли воду до помутне-
127.77, 138.16, 140.370, 141.92, 146.46. Спектр
ния. Полученный раствор оставляли до образова-
ЯМР 19F, δF, м. д.: -62.45 (3F, CF3). Масс-спектр,
ния осадка, который отфильтровывали и сушили.
m/z (Iотн, %): 330(27) [M]+, 131 (100). Найдено, %:
Выход 0.043 г (25%), т. пл. 201-202°C. Спектр
С 61.91; Н 3.85; N 17.06. C17H13F3N4. Вычислено,
ЯМР 1Н, δ, м. д.: 3.78 с (3Н, OCH3), 6.02 c [1H,
%: С 61.82; Н 3.97; N 16.96.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1858
AЗЕВ и др.
ФОНДОВАЯ ПОДДЕРЖКА
7. Jatav V., Mishra P., Kashaw S., Stables J. // Eur. J.
Med. Chem. 2008. Vol. 43. P. 1945. doi 10.1016/j.
Работа выполнена при финансовой поддержке
ejmech.2007.12.003
Российского фонда фундаментальных исследова-
8. Al-Shamary D., Al-Alshaikh M., Kheder N., Mabkhot Y.,
ний (грант № 18-33-00727 мол_а).
Badshah S. // Chem. Cent. J. 2017. Vol. 11. P. 1. doi
КОНФЛИКТ ИНТЕРЕСОВ
10.1186/s13065-017-0272-6
9. Al-Alshaikh M., Al-Shammary D., El-Baih F. // Res.
Авторы заявляют об отсутствии конфликта
J. Chem. Environ. 2013. Vol. 17. P. 48. doi 10.1007/
интересов.
s11164-018-3612-9
СПИСОК ЛИТЕРАТУРЫ
10. Ram V., Farhanullah B., Srivastava-Tripathi A. //
Bioorg. Med. Chem. 2003. Vol. 11. P. 2439. doi 10.1016/
1. Aniszewski T. Alkaloids. Helsinki: Elsevier Science,
S0968-0896(03)00142-1
2015. 496 p.
11. Khan I., Zaib S., Batool S., Abbas N., Ashraf Z., Iqbal J.,
2. Alafeefy A., Kadi A., El-Azab A., Abdel-Hamid S.,
Saee A. // Bioorg. Med. Chem. 2016. Vol. 24. P. 2361.
Daba M. // Arch. Pharm. 2008. Vol. 34. P. 377. doi
doi 10.1016/j.bmc.2016.03.031
10.1107/S1600536813016127
12. Пиличева Т.Л., Чупахин О.Н., Постовский И.Я. //
3. Al-Obaid A., Abdel-Hamide S., El-Kashef H., Abdel-
ХГС. 1975. № 4. С. 561; Pilicheva T.L., Chupakhin
Aziz A., El-Azab A., Al-Khamees H., El-Subbagh H. //
O.N., Postovsky I.Ya. // Chem. Heterocycl. Compd. 1975.
Eur. J. Med. Chem. 2009. Vol. 44. P. 2379. doi
10.1016/j.ejmech.2008.09.015
Vol. 11. P. 496. doi 10.1007/BF00502444
4. Werbel L., Degnan M. // J. Med. Chem. 1987. Vol. 30.
13. Azev Yu.A., Shorshnev S.V., Golomozin B.V. // Tetra-
P. 2151. doi 10.1021/jm00394a038
hedron Lett. 2009. Vol. 50. P. 2899. doi 10.1016/j.
tetlet.2009.03.199
5. Kabri Y., Azas N., Dumetre A. // Eur. J. Med. Chem.
2010. Vol. 45. P. 616. doi 10.1016/j.ejmech.2009.11.005
14. Матерн А. И. Дис. …докт. хим. наук. Екатеринбург,
2007. 275 с.
6. Kashaw S., Jatav V., Mishra P., Jain N., Stable J. // Eur.
J. Med. Chem. 2009. Vol. 44. P. 4335. doi 10.1016/j.
15. Rene O., Souverneva A., Magnuson S., Fauber B.P. //
ejmech.2009.05.008
Tetrahedron Lett. 2013. Vol. 54. P. 201.
Synthesis of Stable σ-Adducts by Arylation of Quinazoline
Yu. A. Azev*, O. S. Koptyaeva, E. A. Seliverstova, A. V. Ivoilova, and T. A. Pospelova
Ural Federal University, pr. Mira 19, Yekaterinburg, 620002 Russia
*e-mail: azural@yandex.ru
Received May 21, 2019; revised May 21, 2019; accepted May 25, 2019.
The reactions of quinazoline with 1,3,5-trimethoxybenzene, methyl substituted o-phenylenediamines, and
1-(4-methoxybenzylidene)-2-phenylhydrazine in the presence of an acid leads to the formation of stable C-C-
linked σ-adducts.
Keywords: quinazoline, C-nucleophiles, C-C-binding
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019