ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 12, с. 1859-1868
УДК 542.913-977:547.569.1:546.16:547.313.2
ТЕРМИЧЕСКИЕ РЕАКЦИИ 6-БРОМ-, 6-ХЛОР- И
6-(МЕТИЛСУЛЬФАНИЛ)ОКТАФТОРИНДАН-
5-ТИОЛОВ С ТЕТРАФТОРЭТИЛЕНОМ.
СИНТЕЗ ДОДЕКАФТОР-2H,3H,5H,6H,7H-
ИНДЕНО[5,6-b]ТИОФЕНА
© 2019 г. П. В. Никульшин, А. М. Максимов, Ю. В. Гатилов, В. Е. Платонов*
Новосибирский институт органической химии имени Н. Н. Ворожцова
Сибирского отделения Российской академии наук, пр. Академика Лаврентьева 9, Новосибирск, 630090 Россия
*e-mail: platonov@nioch.nsc.ru
Поступило в Редакцию 20 мая 2019 г.
После доработки 20 мая 2019 г.
Принято к печати 25 мая 2019 г.
Сопиролизом 6-бром-, 6-хлороктафториндан-5-тиолов, а также бис(6-бром-5-перфторинданил)-
дисульфана с тетрафторэтиленом в проточной системе при 400-625°C синтезирован додекаф-
тор-2H,3H,5H,6H,7H-индено[5,6-b]тиофен в качестве основного продукта наряду с небольшим коли-
чеством тетрадекафтор-1,2,3,5,6,7-гексагидро-s-индацена. Додекафтор-2H,3H,5H,6H,7H-индено[5,6-b]-
тиофен, образующийся в реакции 6-(метилсульфанил)октафториндан-5-тиола с тетрафторэтиленом при
420°C, выделен в индивидуальном виде и его строение доказано методом рентгеноструктурного анализа.
Предложены схемы образования продуктов реакций с участием промежуточных радикалов.
Ключевые слова: полифториндантиолы, тетрафторэтилен, сопиролиз, додекафтор-2H,3H,5H,6H,7H-
индено[5,6-b]тиофен
DOI: 10.1134/S0044460X19120096
В химии полифторароматических соединений
проточной системе. При этом происходило обра-
существенное место занимают полифторарен-
зование перфтор-2,3-дигидробензо[b]тиофена с
тиолы. Сравнительная легкость их синтеза пу-
выходом 15-38% [4, 5]. Неожиданными примера-
тем нуклеофильного замещения атомов фтора в
ми такого рода стали реакции сопиролиза поли-
полифтораренах на тиольную группу позволила
фторбензол-oрто-хлортиолов с тетрафторэтиле-
исследовать происходящие превращения [1, 2].
ном в проточной системе при 600-620°C, приводя-
Среди них были найдены процессы, приводящие
щие к образованию в основном полифтор-2,3-ди-
как к сохранению атома серы, так и к замещению
гидробензо[b]тиофенов [6]. В отличие от этих ре-
тиольной группы или ее производных на другие
акций при сопиролизе пентафторбензолтиола [7],
функциональные группы, не содержащие атомы
2,3,5,6-тетрафтор-4-хлорбензолтиола
[6] и пер-
серы. Например, обработкой полифторарентио-
фтор-пара-тиокрезола [7] с тетрафторэтиленом
лов бромом в среде дымящей HNO3 или смесью
при 620°C в проточной системе в основном был
HNO3 и H2SO4 были получены полифторарен-
получен перфториндан [6, 7].
сулфонилбромиды [3]. Сохранение атома серы
При взаимодействии полифторарентиолов с
наблюдалось в реакциях пентафторбензолтиола,
Br2, Cl2 и их источниками в проточной системе
его 4-бром- и 4-(метилсульфанил)производных с
(400-500°C) или в ампулах (200-250°C) происхо-
тетрафторэтиленом в присутствии I2 при 360°C в
дила замена тиольной группы на атомы брома и
1859
1860
НИКУЛЬШИН и др.
Схема 1.
SH
SCH3
SCH3
Me2SO4
KSH
F
F
F
F
F
F
K2CO3
SH
4 (89%)
3 (73%)
хлора. Это позволило разработать новые удобные
пятичленного серосодержащего кольца. В реакци-
методы получения бром- и хлорполифтораренов
ях соединений, содержащих в полифтораромати-
[8]. Разработка метода получения перфториндана
ческом кольце в орто-положении SCH3 и SН за-
[7] cпособствовала расширению исследований его
местители, с тетрафторэтиленом можно было бы
химических свойств [8, 9], включая замену вводи-
ожидать образования полифтор-2,3-дигидробен-
мой во фторароматическое кольцо тиольной груп-
зо[b]тиофенов с атомами серы от любого из этих
пы на атомы брома и хлора [8], а также превраще-
двух заместителей (энергия связи S-Н составляет
ния этой группы в сульфонилбромидную [3].
83.5 ккал/моль [10]).
При исследовании реакций полифторарентио-
Достаточно удобными полифторароматиче-
лов с тетрафторэтиленом было предположено, что
скими соединениями, позволяющими вводить в
в образовании полифтордигидробензо[b]тиофенов
орто-положение к атомам брома и хлора тиоль-
принимают участие полифторбензолтиильные ра-
ную группу, являются 5-бром- и 5-хлорнонафто-
дикалы [2], а в образовании перфториндана -геп-
ринданы. Ранее были описаны синтезы 6-бром- (1)
тафторбензильный радикал [6, 7].
и 6-хлороктафториндан-5-тиолов (2) с высокими
Исследование реакций полифтор-орто-хлор-
выходами с помощью реакций 5-бром- и 5-хлор-
бензолтиолов с тетрафторэтиленом, приводящих
нонафторинданов с KSH [11, 12].
к получению в качестве основных продуктов ма-
Необходимый для реакции сопиролиза с те-
лодоступных полифтор-2,3-дигидробензо[b]тио-
трафторэтиленом
6-(метилсульфанил)октафто-
фенов могло бы способствовать разработке метода
риндан-5-тиол 3 был получен взаимодействием
синтеза этих соединений и выяснению закономер-
5-(метилсульфанил)нонафториндана
4 с KSH.
ностей таких реакций. В этой связи представля-
Соединение 4 синтезировано из 5-нонафториндан-
лось целесообразным исследовать термические
тиола под действием диметилсульфата в присут-
реакции тетрафторэтилена с полифторарентиола-
ствии основания (схема 1).
ми, содержащими в орто-положении к тиольной
Показано, что в реакции соединения 1 с тетраф-
группе не только атомы хлора, но и другие заме-
стители. В частности, в качестве таковых пред-
торэтиленом при 610-625°C в проточной системе
в качестве основного продукта с выходом 53% об-
ставляет интерес использовать атом брома и серо-
содержащий заместитель, например SCH3, прини-
разуется додекафтор-2H,3H,5H,6H,7H-индено[5,6-
мая во внимание меньшую прочность связи C-Br
b]тиофен 5 наряду с небольшим количеством
(83.5 ккал/моль [10]) и C-S (76 ккал/моль [10]) по
тетрадекафтор-1,2,3,5,6,7-гексагидро-s-индацена
сравнению со связью C-Cl (95 ккал/моль [10]) и
6 (схема 2). Понижение температуры реакции до
С-F (114-126 ккал/моль [10]). Эти менее прочные
500-510 и 400-410°C уменьшает выходы до 47 и
связи в орто-замещенных полифторарентиолах
40% соответственно. При этом содержание про-
могли бы способствовать процессу циклизации с
дукта 5 в реакционной смеси, полученной при
образованием сочлененного полифторированного
400-410°C, возрастает до 69% (см. таблицу, схема 2).
Схема 2.
Br
CF2=CF
2
F
F
+ F
F
F
F
F
ɩɪɨɬɨɱɧɚɹ
F
ɫɢɫɬɟɦɚ
S
SH
1
5
6
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
ТЕРМИЧЕСКИЕ РЕАКЦИИ 6-БРОМ-, 6-ХЛОР- И 6-(МЕТИЛСУ
ЛЬФАНИЛ)...
1861
Можно предположить, что образование соеди-
Влияние температуры синтеза на содержание и выход
нения 5 происходит с промежуточным участием
соединений 5 и 6
тиильного и других радикалов и элиминировани-
Содержание соединения в
№
ем атома брома, который может отрывать атом во-
смеси, % (выход, %)
Т, °С
опыта
дорода от тиольной группы соединения 1 и гене-
5
6
рировать тиильный радикал [13]. Ранее генерация
1
610-625
60.7 (53)
7.0 (6)
пентафторбензолтиильного радикала постулиро-
валась в реакции пентафторбензолтиола с тетраф-
2
500-510
57.5 (47)
6.2 (6)
торэтиленом в присутствии иода при 360°C, при-
3
400-410
69.3 (40)
4.4 (4)
водящей к образованию перфтор-2,3-дигидробен-
зо[b]тиофена [4, 5]. Известно также, что полифто-
Из арена 3 и тетрафторэтилена при 400-430°C
рарилтиильные радикалы легко образуются из со-
была получена реакционная смесь, содержащая
ответствующих бис(полифторарил)дисульфанов
соединение 5 (47.5%), но, по данным ГХ-МС, не
[14]. В этой связи нами из тиола 1 под действием
содержащая продукта 6 (схема 5).
брома при комнатной температуре был синтезиро-
Строение выделенного из этой реакционной
ван бис(6-бром-5-перфторинданил)дисульфан 7 с
смеси индивидуального соединения 5 было под-
целью его дальнейшего использования как источ-
тверждено методом рентгеноструктурного анали-
ника 6-бромперфторинданилтиильного радикала
за. Строение соединения 6 установлено методами
А в реакции с тетрафторэтиленом. Показано, что
ЯМР 19F и масс-спектрометрии смеси соединений
при взаимодействии арена 7 с тетрафторэтиленом
5 и 6.
при 405-420°C в проточной системе в основном
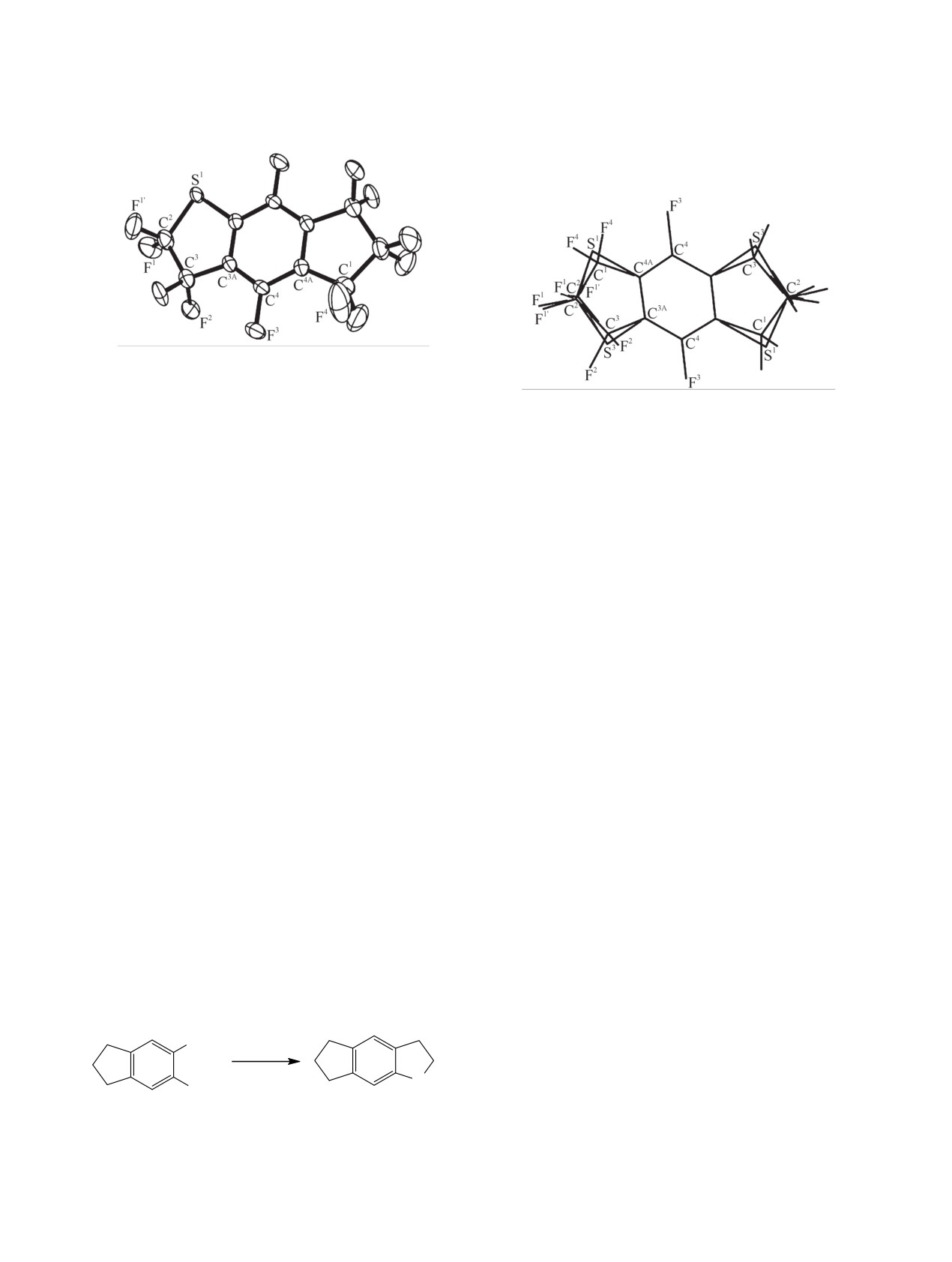
По данным РСА, молекула соединения 5 рас-
также получается соединение 5 наряду с неболь-
положена в зеркальной плоскости в центре сим-
шим количеством продукта 6 (схема 3).
метрии и разупорядочена (рис. 1). Атом серы, как
При сопиролизе арена 2 с тетрафторэтиленом
и дополняющая позицию CF2-группа, расположе-
при 400-430°C в качестве основного продукта так-
ны в 4 положениях (S1/C1, S3/C3 и центросимме-
же был получен арен 5 наряду с небольшим коли-
тричные S1/C1, S3/C3, занятости позиций S1:S3 =
чеством соединения 6 (схема 4).
0.13:0.12) (рис. 2). Кроме того, наблюдается кон-
Схема 3.
Br
Br
Br2
CF2=CF2
1
F
F
F
F
F
F
F
+ F
F
F
405 420°C
S S
S
67.8 : 3.1
5 (30%)
6 (3%)
7 (81%)
Br
'
CF
2
=CF2
F
F
F
7
2
F
F
Br
x
S
S
Ⱥ
5
Схема 4.
Cl
CF2=CF2
F
F
F
+ F
F
F
F
F
430°C
S
SH
63.6 : 4.2
2
5 (33%)
6 (4.2%)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1862
НИКУЛЬШИН и др.
Рис.
1.
Общий вид молекулы додекафтор-
2H,3H,5H,6H,7H-индено[5,6-b]тиофена
5 (CCDC
1905903). Представлены одна из четырех ориентаций
молекулы и одна из двух конформаций пятичленных
Рис. 2. Разупорядоченность молекулы додекафтор-
циклов.
2H,3H,5H,6H,7H-индено[5,6-b]тиофена 5 в кристалле.
формационная разупорядоченность с выходом
ся из σ-комплексов В и Е. Изучение этих процес-
атома С2 из зеркальной плоскости на 0.093 Å, при
сов составляет предмет отдельного исследования.
этом атом F1 экваториален, а атом F1' аксиален.
Радикалы А, реагируя с тетрафторэтиленом, пре-
На рис. 2 показано наложение в кристалле четы-
вращаются в соответствующие сульфанилтетраф-
рех ориентаций молекулы и двух конформаций
торэтильные радикалы Б, которые в результате
пятичленных циклов (разупорядоченность моле-
внутримолекулярной циклизации превращаются в
кулы). Центр симметрии расположен в центре ше-
арен 5 c промежуточным образованием радикаль-
стичленного цикла.
ных σ-комплексов В. Другим направлением пре-
вращений радикалов Б в арен 5 может быть уча-
На схемах 6 и 7 в упрощенном виде приведены
стие радикальных спиро-σ-комплексов Г с после-
предполагаемые процессы образования соедине-
дующим образованием тетрафтортиильных ради-
ний 5 и 6 из тиолов 1, 2 и дисульфана 7, а также
калов Д и затем σ-комплексов Е (ср. [6]) и элими-
соединения 5 из тиола 3 в реакциях с тетрафторэ-
нированием из них радикалов X•. Предположение
тиленом с участием промежуточных радикалов.
об участии радикалов А и Б, содержащих замести-
Участие тиильных радикалов А (X = Br, Cl,
тели X (SCH3, SH), в процессе образования арена 5
SH, SCH3) предполагается в реакциях сопиролиза
из соединения 3, подразумевает учет стерического
аренов 1-3, 7 с тетрафторэтиленом, приводящих к
эффекта группы SCH3, более объемной по сравне-
получению соединения 5 (схема 6). Генерации ти-
нию с группой SH. Так, с помощью вандервааль-
ильных радикалов А (X = Br, Cl) в реакциях тио-
совых радиусов СH3 группы (2.0 Å [15]) и атомов
лов 1 и 2 с тетрафторэтиленом видимо способству-
водорода (1.20 Å [15]) и серы (1.85 Å [15]) можно
ют отщепляющиеся из σ-комплексов В и Е атомы
сделать вывод, что группа SCH3 более объемная и
брома и хлора [6, 13]. В реакции соединения 3 с
степень взаимодействия тетрафторэтилена с ти-
тетрафторэтиленом образование радикалов А (X =
ильным радикалом А (X = SCH3) с образованием
SH, SCH3) по-видимому происходит путем гомо-
радикала Б (X= SCH3) должна быть меньше, чем
лиза связей S-Н и S-CH3, а также при действии на
с тиильным радикалом А (X = SН). Ковалентные
соединение 3 тиильных радикалов, отщепляющих-
радиусы атомов брома и хлора (1.14 и 0.99 Å)
меньше суммы ковалентных радиусов атомов серы
Схема 5.
(1.04 Å) и водорода (0.30 Å), а также атома серы и
SCH3
углерода (0.772 Å) [15]. Длина связи S-Н (1.34 Å)
CF2=CF2
F
F
F
F
F
также меньше, чем связи S-C (1.82 Å, для группы
420°C
S
SCH3) [16]. Меньший стерический эффект в аре-
SH
нах 1 и 2, чем у арена 3, должен способствовать
3
5 (23%)
образованию соединения 6 в реакциях аренов 1 и
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
ТЕРМИЧЕСКИЕ РЕАКЦИИ 6-БРОМ-, 6-ХЛОР- И 6-(МЕТИЛСУ
ЛЬФАНИЛ)...
1863
Схема 6.
F
X
X
X
S
CF2=CF2
F
x
F
F
F
F
F
F
F
F
x
Xx
x
S
S
SCF2CHF2
F
A
Ȼ
ȼ
5
Xx
'
F
F
X
X
X
X
F2
S
F
F
F
x
C
F
F
F
x
F
x
SR
CF2
CF2CF2S
S
F
F
Ƚ
Ⱦ
ȿ
X = Br, Cl, SH, SCH3 (A);
R = H; X = Br (1), Cl (2); R = CH3, X = SH (3);
X
R =
F
F
, X = Br (7).
S
Схема 7.
X
X
:CF2
CF2=CF2
F
F
1, 2, 7
F
F
x
x
CF
CF2CF2CF2
2
ɀ
Ɂ
F
X
F
x
F
F
F
F
Xx
F
ɂ
X = Br, Cl.
2 по сравнению с ареном 3. Однако другой фактор,
пользу стерического эффекта в реакции тиола 3 с
обусловленный присутствием в радикале А в ка-
тетрафторэтиленом, а также, возможно, меньшей
честве заместителей X более акцепторных атомов
термической стабильности тиола 3. Стерический
брома и хлора (σI = 0.45 и 0.47; σR = -0.22 и -0.24
эффект тиола 3 может затруднять взаимодействие
[17]) по сравнению с группой SCH3 (σI = 0.13,
дифторкарбена со связью С-S с дальнейшим обра-
σR = -0.16 [18]), уменьшает вероятность взаимо-
зованием соединения 6 [6], по сравнению с реак-
действия этих более электрофильных радикалов
циями тиолов 1 и 2 с тетрафторэтиленом. Кроме
с тетрафторэтиленом, а также последующее об-
того, увеличение вероятности образования арена
разование и внутримолекулярную циклизацию
электрофильных радикалов Б, приводящую к
5 в реакции тиола 3 с тетрафторэтиленом может
соединению 5. Наблюдаемая в действительно-
быть связано с статистическим фактором из-за на-
сти противоположная картина свидетельствует в
личия в соединении 3 двух атомов серы.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1864
НИКУЛЬШИН и др.
Ранее при взаимодействии 4-метилсульфанил-
бавкой CDCl3. Спектры ЯМР 13C записаны на при-
тетрафторбензолтиола с тетрафторэтиленом при
боре Bruker DRX 500 (125.8 МГц) в CDCl3. ИК и
360-435°C в проточной системе была получена
УФ спектры записаны на приборах Bruker Vector
смесь, содержащая заметное количество перфто-
22 IR и Hewlett Packard 8453 UV соответственно.
риндана (~16%) наряду с перфтор-2,3-дигидро-
Молекулярные массы и элементный состав опре-
бензо[b]тиофеном (~38%) [5]. Образование перф-
делены масс-спектрометрически на приборе DFS
ториндана может свидетельствовать об отсутствии
с энергией ионизации 70 эВ. Для ГХ-МС исполь-
заметного стерического эффекта (ван-дер-ваальсо-
зовали хроматограф HP 5890 с масс-селективным
вый радиус атома фтор равен 1.47 Å [16]), который
детектором HP G1801A. Энергия ионизирующих
предполагается в случае соединения 3.
электронов - 70 эВ. Разделение веществ осущест-
Вероятно, радикалы бензильного типа Ж
вляли с помощью колонки HP-5 (5% бифенила и
(X = Br, Cl), образующиеся из соединений 1, 2 и
95% диметилсилоксана, 30 м × 0.25 мм × 0.25 мкм),
7, взаимодействуют с тетрафторэтиленом, образуя
газ-носитель - гелий, скорость потока 1 мл/мин,
радикалы З, которые затем претерпевают внутри-
температура колонки 50-280°C, источника ионов
молекулярную циклизацию с последующим эли-
173°С. ГХ-Анализ проводили на приборе HP 5890
минированием атомов галогена из радикальных
серии II c колонкой HP-5 (5% бифенила и 95% ди-
σ-комплексов И и образованием арена 6 (схема 7).
метилсилоксана, 30 м × 0.52 мм × 2.6 мкм) и детек-
Генерация радикалов Ж может быть объяснена бо-
тором по теплопроводности.
лее высокой реакционной способностью связи C-S
6-(Метилсульфанил)октафториндан-5-тиол
по сравнению с связями C-Br и C-Cl в тиолах 1 и
(3). К раствору 22.08 г (67.69 ммоль) индана 4 в
2 в реакциях с электрофильным дифторкарбеном,
100 мл изопропанола, охлажденному смесью воды
образующимся при пиролизе тетрафторэтилена. В
со льдом до 2°C, при перемешивании прибавляли в
случае соединения 7 генерирование из него ради-
течение 17 мин 35 мл раствора KSH в этиленглико-
кала Ж с участием дифторкарбена может оказать-
ле (~4.1 моль/л). При прибавлении раствора KSH
ся более сложным процессом по сравнению с тио-
температуру в реакторе поддерживали не выше
лами 1 и 2, поскольку в соединении 7 присутствует
6°С. Реакционную массу перемешивали 2.5 ч,
реакционноспособная связь S-S с низкой энергией
поддерживая температуру не выше 3°C, затем вы-
связи (47 ккал/моль [10]).
ливали в смесь 150 мл соляной кислоты и 250 г
Участие связи C-S по сравнению со связями
льда. Органический слой отделяли (19.62 г), суши-
C-Br и C-Cl в реакциях с дифторкарбеном согла-
ли CaCl2 и анализировали методом ЯМР 1Н, 19F и
суется с данными по сопиролизу бром-, хлорпен-
ГХ. Содержание соединения 3 по данным ГХ со-
тафторбензолов, а также пентафторбензолтиола
ставило 85.4%, выход 73%. Перегонкой в вакууме
с тетрафторэтиленом как источником дифторкар-
(~8 мм рт. ст.) из 18.35 г реакционной смеси полу-
бена в проточной системе при ~620°C. Оказалось,
чили 3.89 г фракции с т. кип. 102-106°C и содер-
что бром- и хлорпентафторбензолы практически
жанием соединения 3 92.1% (ГХ) и 7.89 г фракции
не реагируют с тетрафторэтиленом, тогда как пен-
с т. кип. 105-106°C и содержанием соединения
тафторбензолтиол в подобных условиях дает пер-
3 97.9% (ГХ). ИК спектр (пленка), ν, см-1: 2937,
фториндан с хорошим выходом. Этот результат
2494, 1626, 1583, 1450, 1327, 1303, 1247, 1200,
был объяснен внедрением дифторкарбена по связи
1147, 1094, 1067, 973, 954, 869, 813, 708, 672, 594,
C-S данного тиола с последующей генераций геп-
578, 551, 475, 445. Спектр ЯМР 1H, δ, м. д.: 2.54 д
тафторбензильного радикала [6, 19, 20].
(SCH3, J = 1.0 Гц) 4.84 с (SH). Спектр ЯМР 13C, δС,
м. д.: 17.7 т (CH3, 4JCF = 6.0 Гц), 112.7 т. квинтетов
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(2-CF2, 1JCF = 276.0, 2JCF = 26.0 Гц), 113.8 т. т. м
Спектры ЯМР 19F и 1H записаны на приборе
(1-CF2 + 3-CF2, 1JCF ~261.0, 2JCF ~26.0 Гц), ~116.0
Bruker AV-300 [282.4 (19F), 300 МГц (1H)] в CDCl3.
м, 119.4 м, 130.6 д (2JCF = 20.0 Гц), 137.2 д (2JCF =
Внутренние стандарты - С6F6, ГМДС. Спектр
17.0 Гц), 149.1 д. д (1JCF = 255.0, 4JCF = 3.0 Гц),
ЯМР 19F для соединения 5 записан в EtOH с до-
155.1 д. д (1JCF = 256.0, 4JCF = 3.0 Гц). Спектр ЯМР
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
ТЕРМИЧЕСКИЕ РЕАКЦИИ 6-БРОМ-, 6-ХЛОР- И 6-(МЕТИЛСУ
ЛЬФАНИЛ)...
1865
19F, δF, м. д.: 32.2 квинт (2-CF2, JFF ~5.0 Гц), 49.9 д.
(36.36 ммоль) брома в 20.45 г ледяной уксусной
т и 51.9 д. т (F4(7), JFF = 21.0, ~8.0 Гц), 54.0 уш. м и
кислоты. Полученную смесь оставляли на 3 сут
55.0 уш. м [1(3)-CF2]. УФ спектр (гексан), λmax, нм
до образования осадка. Раствор (с осадком) кон-
(ε×10-4, л·моль-1·см-1): 208 (0.847), 224 пл (0.661),
центрировали, затем промывали раствором 6.50 г
282 (0.741). Масс-спектр, m/z: 339.9620. Найдено,
Na2SO3 в 50 мл воды. Осадок отфильтровали и
%: С 35.66; H 1.24; F 44.87; S 18.96. C10H4F8S2.
сушили над CaCl2. Выход 8.10 г (81%), т. пл. 50-
Вычислено, %: C 35.30; H 1.18; F 44.67; S 18.85.
52°C. ИК спектр (KBr), ν, см-1: 1443, 1330, 1298,
М 339.9621.
1246, 1202, 1051, 1093, 1053, 951, 874, 808, 578,
544. Спектр ЯМР 13C, δC, м. д.: 112.3 т. квинте-
5-(Метилсульфанил)нонафториндан
(4). К
тов (2,2'-CF2, 1JCF = 277.0, 2JCF = 25.0 Гц), 113.2
27.51 г (86.88 ммоль) 5-нонафториндантиола в
т. т. м и 113.3 т. т. м [1,1’(3,3’)-CF2, 1JCF ~262.0,
550 мл ацетона при перемешивании при комнат-
2JCF ~25.0 Гц), 120.2 к (2JCF ~27.0 Гц), 122.7 кв. м
ной температуре добавляли 18.52 г (83.35 ммоль)
(2JCF ~24.0 Гц), 124.8 д (С6, 2JCF = 20.0 Гц), 134.1 д
K2CO3, затем 11.72 г (92.92 ммоль) диметилсуль-
(С5, 2JCF = 20.0 Гц), 151.9 д. д (1JCF = 262.0, 4JCF =
фата в 100 мл ацетона. Реакционную массу пере-
4.0 Гц), 155.1 д. д (1JCF = 262.0, 4JCF ~4.0 Гц).
мешивали при комнатной температуре в течение
Спектр ЯМР 19F, δF, м. д.: 32.0 квинтет (2-CF2, JFF
4 суток. По окончании реакции реакционную массу
~4.0 Гц), 53.8 уш. м и 53.9 уш. м [1(3)-CF2], 57.5
выливали в 2 л воды, продукт экстрагировали CCl4
д. т и 58.2 д. т (F4(7), JFF = 21.0, JFF ~8.0 Гц). УФ
(3×50 мл). Экстракт промывали 10%-ным раство-
спектр (гексан), λmax, нм (ε×10-4, л·моль-1·см-1):
ром Na2CO3. После удаления CCl4 получили 27.21 г
207 (5.072), 255 (1.391), 298 (0.776). Масс-спектр,
соединения 4 чистотой 93.5% (ГХ). После возгон-
m/z: 741.7562. Найдено, %: C 29.08; F 40.87; S 8.76;
ки в вакууме (~2 мм рт. ст.) при 100-110°C из 0.93 г
Br 21.20. C18Br2F16S2. Вычислено, %: C 29.05; F
получили 0.67 г соединения 4 с содержанием 98.7%
40.85; S 8.62; Br 21.48. M+ 741.7547.
(ГХ). ИК спектр (пленка), ν, см-1: 2943, 1635, 1606,
1486, 1458, 1381, 1310, 1250, 1201, 1152, 1091, 1023,
Пиролитические реакции полифтораренти-
983, 958, 911, 848, 755, 710, 666, 609, 583, 561, 484,
олов с тетрафторэтиленом. Процесс проводили в
449. Спектр ЯМР 1H, δ, м. д.: 2.63 т (CH3, J ~1.0 Гц).
реакторе, состоящем из кварцевой трубки (400 ×
Спектр ЯМР 13C, δС, м. д.: 16.9 т (CH3, 4JCF = 5.0 Гц),
20 мм), нагреваемой в электрической трубчатой
112.5 т. квинтетов (2-CF2, 1JCF = 276.0, 2JCF =
печи. Исходное соединение помещали в капель-
25.0 Гц), 113.6 т. т. м и 115.7 т. т. м [1(3)-CF2, 1JCF
ную воронку (соединения 1 и 7 расплавляли), при-
~261.0, 2JCF ~25.0 Гц), 115.6 м, 119.4 м, 125.2 д. д.
соединенную к кварцевой трубке реактора. Перед
т (С5, 2JCF 20.0, 2JCF = 19.0, 4JCF ~1.0 Гц), 143.4 д.
началом подачи систему предварительно продува-
д. д (С7, 1JCF = 263.0, 2JCF = 16.0, 3JCF = 4.0 Гц),
ли аргоном, затем тиол подавали одновременно с
153.4 д. д. д. т (С6, 1JCF = 258.0, 2JCF = 13.0, 3JCF =
током тетрафторэтилена (~15 л/ч). По окончании
5.0, 4JCF ~1.0 Гц), 153.8 д. т (С4, 1JCF = 258.0, 3JCF =
прибавления исходного соединения в реактор по-
4.0 Гц). Спектр ЯМР 19F, δF, м. д.: 20.8 д. д. т (F7,
дачу тетрафторэтилена прекращали. Продукты
JF7F6 = 22.0, JF7F4 = 19.0, JF7F ~7.0 Гц), 32.2 квинтет
реакции собирали в колбу, охлаждаемую ледяной
(2-CF2, JFF ~5.0 Гц), 44.3 д. д (F6, JF6F7 = 22.0, JF6F4
водой. Далее реакционную массу доводили до
~8.0 Гц), 51.2 д. к (F4, JF4F7 = 19.0, JFF ~ 8.0 Гц),
комнатной температуры и перегоняли с паром.
54.8 уш. м и 54.9 уш. м [1(3)-CF2]. УФ спектр (гек-
Полученный дистиллят отделяли, сушили CaCl2 и
анализировали методами ГХ-МС, ГХ и ЯМР 19F.
сан), λmax, нм (ε×10-4, л·моль-1·см-1): 207 (0.798),
224 пл (0.591),
281
(0.662). Масс-спектр, m/z:
При сопиролизе соединения
1
(3.98 г,
325.9826. Найдено, %: С 36.76; H 0.97; F 52.08; S
10.67 ммоль) и тетрафторэтилена (~145 ммоль) в
9.76. C10H3F9S. Вычислено, %: C 36.82; H 0.93; F
течение 13.0 мин при 610-625°C получили 3.68 г
52.42; S 9.83. М+ 325.9806.
смеси соединений 5 (60.7%) и 6 (7.0%). Выходы 53
и 6% соответственно.
Бис(6-бром-5-перфторинданил)дисульфан
(7).
10.04 г (26.91 ммоль) тиола 1 растворяли в
При сопиролизе соединения
1
(2.63 г,
50.16 г ледяной уксусной кислоты при комнатной
7.05 ммоль) и тетрафторэтилена (~70 ммоль) в те-
температуре, затем по каплям добавляли 5.81 г
чение 6.5 мин при 500-510°C получили 2.25 г сме-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1866
НИКУЛЬШИН и др.
си соединений 5 (57.5%) и 6 (6.2%). Выходы 47 и
л·моль-1·см-1): 216 (1.529), 222 (1.520), 248 (0.617),
6% соответственно.
254 (0.617), 298 (0.299), 308 (0.275). Масс-спектр,
m/z: 391.9523. Найдено, %: C 33.80; F 58.16; S 8.20.
При сопиролизе соединения
1
(2.50 г,
M+ 391.9525. C11F12S. Вычислено, %: C 33.69; F
6.70 ммоль) и тетрафторэтилена (~70 ммоль) в те-
58.13; S 8.18. M 391.9525.
чение 6.3 мин при 400-410°C получили 1.51 г сме-
си соединений 5 (69.3%) и 6 (4.4%). Выходы 40 и
Тетрадекафтор-1,2,3,5,6,7-гексагидро-s-
4% соответственно.
индацен (6). Спектр ЯМР 19F (CCl4), δF, м. д.: 31.3
квинтет (2,6-CF2, JFF ~4.0 Гц), 44.3 м (F4,8), 53.3
При сопиролизе соединения
2
(2.57 г,
уш. м (1,3,5,7-CF2). Масс-спектр, m/z: 409.9770
7.82 ммоль) и тетрафторэтилена (~55 ммоль) в те-
(вычислено для C12F14: 409.9771).
чение 5.0 мин при 400-430°C получили 1.61 г сме-
си соединений 5 (63.6%) и 6 (4.2%). Выходы 33 и
Рентгеноструктурный анализ выполня-
3% соответственно.
ли при 223 K на дифрактометре Bruker Kappa
APEX II (MoKα-излучение, графитовый моно-
При сопиролизе соединения
7
(2.29 г,
хроматор, CCD-детектор). Все расчеты выполне-
3.08 ммоль) и тетрафторэтилена (~80 ммоль) в те-
ны с помощью комплекса программ SHELXTL в
чение 7.1 мин при 405-420°C получили 1.08 г сме-
анизотропном приближении с геометрическими
си соединений 5 (67.8%) и 6 (3.1%). Выходы 30 и
ограничениями для разупорядоченных фрагмен-
3%.
тов. Кристаллографические данные и параметры
При сопиролизе соединения
3
(13.82 г,
рентгеноструктурного эксперимента для соедине-
40.62 ммоль) и тетрафторэтилена (~190 ммоль) в
ния 5: C11F12S, M = 392.17, ромбическая сингония,
течение 17.2 мин при 400-430°C получили 7.70 г
пространственная группа Cmca, a = 8.492(4) Å,
соединения 5 (47.5%). Выход 23%. По данным ГХ,
b = 9.744(4) Å, c = 15.103(6) Å, V = 1249.8(9) Å3,
в смеси отсутствовал арен 6. 7.40 г реакционной
Z = 4, dвыч = 2.084 г•см-3, μ = 0.409 мм-1, область
смеси перегнали в вакууме. Получили 2.43 г фрак-
сканирования 2θ < 52.1°, 7863 измеренных отра-
ции с т. кип 150-153°C (15 мм рт. ст.) с содержа-
жений, 653 независимых (Rint = 0.0441), 545 отра-
нием соединения 5 77.8%. 2.10 г Данной фракции
жений с I ≥ 2σ(I), 96 уточняемых параметров, R1
возогнали в статическом вакууме (60-65°C, 3-
[I ≥ 2σ(I)] = 0.0449, wR2 = 0.1257 и GOF = 1.166 (по
4 мм рт. ст.). Получили 1.31 г твердого продукта с
всем отражениям).
содержанием соединения 5 96.2%. Из 1.20 г данно-
Авторы выражают благодарность Химическому
го продукта перекристаллизацией из EtOH полу-
исследовательскому центру коллективного поль-
чили 0.63 г соединения 5 чистотой 98.4%.
зования Сибирского отделения РАН за проведение
Додекафтор-2H,3H,5H,6H,7H-индено[5,6-b]-
спектральных и аналитических измерений.
тиофен (5). Т. пл. 42-44°C. ИК спектр (KBr), ν, см-1:
1643, 1506, 1439, 1367, 1333, 1311, 1236, 1157,
КОНФЛИКТ ИНТЕРЕСОВ
1082, 1028, 955, 918, 874, 708, 580, 548. Спектр
Авторы заявляют об отсутствии конфликта
ЯМР 13C, δС, м. д.: 112.3 т. квинтетов (6-CF2, 1JCF =
интересов.
277.0, 2JCF = 25.0 Гц), 113.1 т. т. м и 113.3 т. т. м
[5(7)-CF2, 1JCF = 262.0, 2JCF = 26.0 Гц), 117.0 т. т.
СПИСОК ЛИТЕРАТУРЫ
д (3-CF2, 1JCF = 266.0, 2JCF = 26.0, 3JCF ~3.0 Гц),
1. Brooke G.M. // J. Fluor. Chem. 1997. Vol. 86. P. 1. doi
120.0 м, 122.0 м, 125.7 м, 128.5 т. т (2-CF2, 1JCF =
10.1016/S0022-1139(97)00006-7
266.0, 2JCF = 28.0 Гц), 132.1 уш. д (JCF = 29.0), 148.5
д. д (1JCF = 266.0, 4JCF = 9.0 Гц), 151.9 д (1JCF =
2. Платонов В.Е., Петрова Т.Д. В кн.: Химия аромати-
266.0 Гц). Спектр ЯМР 19F, δF, м. д.: 32.7 квин-
ческих, гетероциклических и природных соедине-
тет (6-CF2, JFF = 4.0 Гц), 41.9 д. т. т (F4, JF4F8 =
ний / Под ред. В.Н. Пармона. Новосибирск: Офсет,
23.0, JF4F = 10.0, JF4F ~7.0 Гц), 43.2 д. т (F8, JF8F4 =
2009. C. 277.
23.0, JF8F ~7.0 Гц), 51.2 уш. д (3-CF2, JF4F = 10.0 Гц),
3. Platonov V.E.,Bredikhin R.A., Maksimov A.M.,
54.2 уш. м и 55.6 уш. м [5(7)-CF2], 69.3 с (2-
Kireenkov V.V. // J. Fluor. Chem. 2010. Vol. 131. P. 13.
CF2). УФ спектр (гексан), λmax, нм (ε×10-4,
doi 10.1016/j.jfluchem.2009.09.011
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
ТЕРМИЧЕСКИЕ РЕАКЦИИ 6-БРОМ-, 6-ХЛОР- И 6-(МЕТИЛСУ
ЛЬФАНИЛ)...
1867
4. Платонов В.Е., Малюта Н.Г., Якобсон Г.Г. // ЖОрХ.
Chem. Rev. 2019. Vol. 88. N 5. P. 425. doi 10.1070/
1985. Т. 21. Вып. 2. С. 383.
RCR4871
5. Platonov V.E., Maksimov A.M., Maslovsky P.I. // J. Fluor.
9. Карпов В.М., Меженкова Т.В., Платонов В.Е. В кн.:
Chem. 1995. Vol. 75. N 1. P. 41. doi 10.1016/0022-
Химия ароматических, гетероциклических и при-
1139(95)03294-N
родных соединений / Под ред. В.Н. Пармона. Ново-
сибирск: Офсет, 2009. C. 247.
6. Никульшин П.В., Максимов А.М., Гатилов Ю.В.,
10. Luo Y.-R. Handbook of Bond Dissociation Energies in
Платонов В.Е. // ЖОХ. 2018. Т. 88. С. 1967; Nikul’-
Organic Compounds. Boca Raton; London; New York:
shin P.V., Maksimov A.M., Gatilov Yu.V., Platonov V.E. //
CRC Press LLC, 2003.
Russ. J. Gen. 2018. Vol. 88. P. 2486. doi 10.1134/
S107036321812006X
11. Nikul’shin P.V., Maksimov A.M., Platonov V.E. //
7. Malyuta N.G., Platonov V.E., Furin G.G., Yakobson G.G. //
ru/public/2016/3_2016/letters/rusletter2.html
Tetrahedron 1975. Vol. 31. N 9. P. 1201. doi 10.1016/
0040-4020(75)85057-5
12. Никульшин П.В., Максимов А.М., Платонов В.Е. //
ЖПХ. 2010. Т. 83. Вып. 7. С. 1148; Nikul’shin P.V.,
8. Политанская Л.В., Селиванова Г.А., Пантелее-
Maksimov A.M., Platonov V.E. // Russ. J. Appl.
ва Е.В., Третьяков Е.В., Платонов В.Е., Никуль-
Chem. 2010. Vol. 83. N 7. P. 1254. doi 10.1134/
шин П.В., Виноградов А.С., Зонов Я.В., Карпов В.М.,
S1070427210070165
Меженкова Т.В., Васильев A.В., Колдобский А.Б.,
13. Платонов В.Е., Максимов А.М., Дворникова К.В.,
Шилова О.С., Морозова С.М., Бургарт Я.В.,
Никульшин П.В. // ЖОрХ. 2005. Т. 41. С. 1681; Plato-
Щегольков Е.В., Салоутин В.И., Соколов В.Б.,
nov V.E., Maksimov A.M., Dvornikova K.V., Nikul’-
Аксиненко А.Ю., Ненайденко В.Г., Москалик М.Ю.,
shin P.V. // Russ. J. Org. Chem. 2005. Vol. 41. P. 1647.
Астахова В.В., Шаинян Б.А., Таболин А.А.,
doi 10.1007/s11178-006-0012-1
Иоффе С.Л., Музалевский B.М., Баленкова Е.С.,
Шастин А.В., Тютюнов А.А., Бойко В.Э., Игум-
14. Plusnin V.F., Ivanov Yu.V., Grivin V.P., Vorobjev D.Y.,
Larionov S.V., Maksimov A.M., Platonov V.E.,
нов С.М., Дильман А.Д., Адонин Н.Ю., Бардин В.В.,
Tkachenko N.V., Lemmftyinen H. // Chem. Phys. Chem.
Масоуд С.М., Воробьева Д.В., Осипов С.Н., Носо-
Lett. 2000. Vol. 325. P. 153. doi 10.1016/S0009-
ва Э.В., Липунова Г.Н., Чарушин В.Н., Прима Д.О.,
2614(00)00700-4
Макаров А.Г., Зибарев А.В., Трофимов Б.А.,
Собенина Л.Н., Беляева К.В., Сосновских В.Я.,
15. Матье Ж., Панико Р. Курс теоретических основ ор-
Обыденнов Д.Л., Усачев С.А. // Усп. хим. 2019.
ганической химии М.: Мир. 1975. С. 19; Mathieu J.,
Т. 88. № 5. С. 425; Politanskaya L.V., Selivano-
Panico R. Mecanismes Reactionnels en Chimie
va G.A., Panteleeva E.V., Tretyakov E.V., Platonov V.E.,
Organique. Paris: Hermann, 1972.
Nikul’shin P.V., Vinogradov A.S., Zonov Ya.V., Kar-
16. Hine J. Structural Effects on Equilibria in Organic
pov V.M., Mezhenkova T.V., Vasilyev A.V., Koldob-
Chemistry. New York: John Wiley & Sons, 1975.
skii A.B., Shilova O.S., Morozova S.M., Burgart Ya.V.,
17. Sheppard W.A., Sharts C.M. Organic Fluorine
Shchegolkov E.V., Saloutin V.I., Sokolov V.B., Aksinen-
Chemistry. New York: W.A.Benjamin, Inc., 1969.
ko A.Yu., Nenajdenko V.G., Moskalik M.Yu., Astakho-
18. Ягупольский Л.М. Ароматические и гетероцикличе-
va V.V., Shainyan B.A., Tabolin A.A., Ioffe S.L.,
ские соединения с фторсодержащими заместителя-
Muzalevskiy V.M., Balenkova E.S., Shastin A.V.,
ми. Киев: Наукова думка, 1988.
Tyutyunov A.A., Boiko V.E., Igumnov S.M., Dil-
19. Платонов В.Е. Дис. … докт. хим. наук. Новоси-
man A.D., Adonin N.Yu., Bardin V.V., Masoud S.M.,
бирск, 1979.
Vorobyeva D.V., Osipov S.N., Nosova E.V., Lipuno-
va G.N., Charushin V.N., Prima D.O., Makarov A.G., Ziba-
20. Платонов В.Е. В кн.: Реакционная способность
rev A.V., Trofimov B.A., Sobenina L.N., Belyaeva K.V.,
полифторароматических соединений / Под ред.
Sosnovskikh V.Y., Obydennov D.L., Usachev S.A. // Russ.
Г.Г. Якобсона. Новосибирск: Наука, 1983.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1868
НИКУЛЬШИН и др.
Thermal Reactions of 6-Bromo-, 6-Chloro-,
and 6-(Methylsulfanyl)octafluoroindane-5-thioles
with Tetrafluorethylene. Synthesis
of Dodecafluoro-2H,3H,5H,6H,7H-indeno[5,6-b]thiophene
P. V. Nikul’shin, A. M. Maksimov, Yu. V. Gatilov, and V. E. Platonov*
N.N. Vorozhtsov Novosibirsk Institute of Organic Chemistry, Siberian Branch of the Russian Academy of Sciences,
pr. Akademika Lavrentieva 9, Novosibirsk, 630090 Russia
*e-mail: platonov@nioch.nsc.ru
Received May 20, 2019; revised May 20, 2019; accepted May 25, 2019
Dodecafluoro-2H,3H,5H,6H,7H-indeno[5,6-b]thiophene and a small amount of tetradecafluoro-1,2,3,5,6,7-
hexahydro-s-indacene were synthesized by co-pyrolysis of 6-bromo-, 6-chlorooctafluorindane-5-thiols, as well as
bis(6-bromo-5-perfluoroindanyl)disulfane with tetrafluoroethylene in a flow system at 400-625°C. Dodecafluoro-
2H,3H,5H,6H,7H-indeno[5,6-b]thiophene formed in the reaction of 6-(methylsulfanyl)octafluoroindane-5-thiol
with tetrafluoroethylene at 420°C was isolated, and its structure was proved by the X-ray diffraction analysis
method. Schemes for the formation of the reaction products involving intermediate radicals are proposed.
Keywords: polyfluoroindanethiols, tetrafluoroethylene, co-pyrolysis, dodecafluoro-2H,3H,5H,6H,7H-inde-
no[5,6-b]thiophene
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019