ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 12, с. 1874-1884
УДК 547.1;547.233
СИНТЕЗ СИММЕТРИЧНЫХ
N-(ГЕТ)АРИЛ-С-ФОСФОНОАЦЕТАМИДИНОВ
© 2019 г. А. Г. Завьяловаa, Е. Б. Эрхитуеваb, Н. И. Свинцицкаяa, *, А. В. Догадинаa
a Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
*e-mail: nsvincickaya@mail.ru
b Санкт-Петербургский государственный университет, Санкт-Петербург, Россия
Поступило в Редакцию 6 августа 2019 г.
После доработки 6 августа 2019 г.
Принято к печати 10 августа 2019 г.
Взаимодействием диэтилхлорэтинфосфосфоната с рядом первичных ароматических и гетероаромати-
ческих аминов получены новые симметричные С-фосфонилированные ацетамидины.
Ключевые слова: симметричные фосфорсодержащие амидины, С-фосфонилированные амидины,
первичные ароматические амины
DOI: 10.1134/S0044460X19120114
Амидины привлекают внимание широкого кру-
тивностью
[16,
17]. Соединения, содержащие
га исследователей благодаря высокой реакцион-
N-ариламидиновый фрагмент, являются эффек-
ной способности, обусловленной наличием в их
тивными противовспалительными и анальгезиру-
структуре аминогруппы, сопряженной с кратной
ющими средствами [18-20]. Амидины, имеющие
связью С=N [1, 2]. Синтетический потенциал со-
арильные заместители у атома азота, являются со-
единений данного класса огромен. Амидины и их
единениями-предшественниками для синтеза био-
производные находят применение в качестве клю-
логически важных гетероциклов, таких как имида-
чевых интермедиатов в синтезе различных клас-
золы [21, 22], бензимидазолы [23], хиназолины и
сов органических соединений [3-5], в том числе
хиназолиноны [24-27], пиримидины [28] и др.
азотсодержащих гетероциклов [6], металлоциклов
Модификация структуры амидинов введением
и координационных соединений [7-10]. Данный
фосфонатной группы позволяет расширить их син-
структурный фрагмент входит в состав огромно-
тетический и биологический потенциал [29-33].
го числа природных соединений [3]. Благодаря
Фосфонаты и их производные находят широкое
уникальной структуре амидины являются высо-
применение в биохимии [34], органическом син-
коосновными соединениями и могут выступать в
тезе [35], медицинской [36-38] и агрохимии [39].
роли супероснований [11, 12]. Кроме того, амиди-
Амидины, содержащие фосфорильную группу,
ны проявляют широкий спектр биологической ак-
были впервые описаны в работах [40, 41]. К на-
тивности, вследствие чего представляют интерес
стоящему времени имеется всего несколько при-
с точки зрения перспективности их использования
меров синтеза С-фосфорилированых амидинов
для создания лекарственных средств [13-15].
[42-50]. Однако синтез симметричных фосфони-
Введение арильной или гетероарильной груп-
лированных амидинов представлен единичны-
пы к атому азота ослабляет основные свойства
ми примерами [40, 41, 49, 51]. Так, в работе [51]
амидинов и повышает липофильность, что, в
представлен метод синтеза N-алкилированных
свою очередь, открывает путь к созданию новых
симметричных амидинов путем взаимодействия
соединений с разнообразной биологической ак-
гем-дихлорвинилфосфоната с первичными амина-
1874
СИНТЕЗ СИММЕТРИЧНЫХ N-(ГЕТ)АРИЛ-С-ФОСФОНОАЦЕТАМИДИНОВ
1875
Схема 1.
O
NH2
(EtO)2P
O
R2
K2CO3, '
HN
(EtO)2P
Cl
+ 2
R1
R1
CCl
N
4
R2
R1
R2
1
ɚ-ɭ
ɚ-ɭ
ми. Альтернативным подходом к получению сим-
лее длительное время (до 40-49 ч). Так, при вза-
метричных фосфоноамидинов является реакция
имодействии хлорацетиленфосфоната 1 с м-толу-
фосфорилированных кетениминов с аминами [40].
идином 2а полная конверсия была достигнута за
40 ч, выход целевого амидина составил 79%, в то
В продолжение исследований в области химии
фосфорсодержащих амидинов [49, 50, 52, 53] нами
время как реакция с участием п-толуидина про-
текала за 10 ч с образованием соответствующего
осуществлен синтез ряда новых симметричных
амидина с выходом 86% [49]. Аналогичная ситу-
C-фосфоноацетамидинов на основе реакции диэ-
тил-2-хлорэтинфосфоната с первичными аромати-
ация наблюдается и в случае других мета-заме-
щенных анилинов 2в-и. Наибольший выход це-
ческими и гетероароматическими аминами. Ранее
левых симметричных амидинов (91-93%) был до-
нами была показана возможность получения сим-
стигнут при взаимодействии с 4-изопропил- (2б),
метричных N-арилфосфоноацетамидинов из хло-
4-хлор- (2к) и 4-трифторметоксианилином (2л).
рацетиленфосфонатов [49]. В данной работе нами
Как и ожидалось, время реакции в данном случае
был расширен круг вводимых в реакцию первич-
составило 10-15 ч.
ных ароматических аминов и исследовано влияние
различных заместителей в ароматическом кольце
При использовании 3-галогензамещенных арил-
на протекание реакции.
аминов наибольший выход (73%) был достигнут
в случае м-хлоранилина 2д. В отличие от пара-
Установлено, что реакции диэтил-2-хлорэти-
галогенанилинов [49] реакционная способность
нилфосфоната 1 [54] с первичными ароматически-
ариламинов, имеющих Hlg-заместитель в мета-
ми аминами 2а-с приводят к образованию соот-
положении, снижается в следующем порядке: Cl >
ветствующих N-арилфосфоноацетамидинов 3а-с
Br > F (см. таблицу).
с выходом 30-93% (схема 1, см. таблицу). Реакции
протекали в безводном четыреххлористом углеро-
Реакции ароматических аминов
2г, з, и,
де при 80°С в присутствии 1 экв. K2CO3 в качестве
имеющих акцепторные заместители (Ac, NO2,
акцептора выделяющегося хлороводорода в тече-
CF3), с диэтил-2-хлорэтинфосфонатом 1 проходят
ние 10-49 ч при соотношении реагентов 1:2 = 1:2.
в течение
45-49 ч, приводя к образованию
Следует отметить, что во избежание нежелатель-
соответствующих амидинов с удовлетворительным
ного образования амидов вследствие взаимодей-
выходом (59-63%).
ствия промежуточно образующихся инаминофос-
В случае дизамещенных ароматических аминов
фонатов даже со следовыми количествами влаги,
2м-с наилучшие результаты были достигнуты
реакции необходимо проводить в атмосфере ар-
при использовании
3,4-дихлоранилина
2н:
гона с использованием безводных растворителя и
время реакции составило 14 ч, выход целевого
аминов.
продукта - 80%. Для остальных использованных
Анализируя данные по аналогичным реакциям
дизамещенных анилинов полная конверсия
с участием первичных ароматических аминов с за-
достигалась за
46-48 ч, при этом выход
местителем в пара-положении [49], можно отме-
соответствующих амидинов не превышал
60%
тить, что в случае мета-замещенных ариламинов
(см. таблицу). Аналогичные результаты были
для достижения полной конверсии требуется бо-
получены и в случае 5-амино-2-метилизоиндол-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1876
ЗАВЬЯЛОВА и др.
Выходы, время реакции, данные спектроскопии ЯМР 31Р и масс-спектрометрии для симметричных фосфоноацета-
мидинов 3а-у
№
R1
R2
Время реакции, ч
Выход, %
Тпл, °C
m/z [M + H]+
δP, м. д.
3а
3-Me
H
40
79
76-78
375.1832
22.53
3б
4-i-Pr
H
10
91
101-103
453.2276
22.54
3в
3-OMe
H
44
55
-
407.1743
22.41
3г
3-Ac
H
49
62
92-94
431.1730
21.95
3д
3-Cl
H
45
71
85-87
415.0810
21.61
3е
3-Br
H
46
68
88-90
504.9735
21.63
3ж
3-F
H
48
53
-
383.1344
21.74
3з
3-NO2
H
49
59
109-111
437.1237
21.28
3и
3-CF3
H
45
63
75-77
483.1254
21.53
3к
4-Cl
H
10
93
104-106
415.0727
21.85
3л
4-OCF3
H
15
92
125-127
537.1013
21.71
3м
3-OMe
4-OMe
46
56
-
467.1959
22.95
3н
3-Cl
4-Cl
14
80
95-97
482.9975
21.35
3о
3-Cl
4-OMe
48
59
-
475.0906
22.16
3п
3-NO2
4-Me
46
55
106-108
465.1521
21.48
3р
2-Me
3-Cl
47
30
73-75
443.1057
22.66
3с
2-Cl
3-NO2
49
45
122-124
527.0265
21.62
O
3т
48
44
-
513.1527
21.02
1
N Me
N
2
O
1
O
3у
40
53
133-135
463.1612
22.59
N
2
O
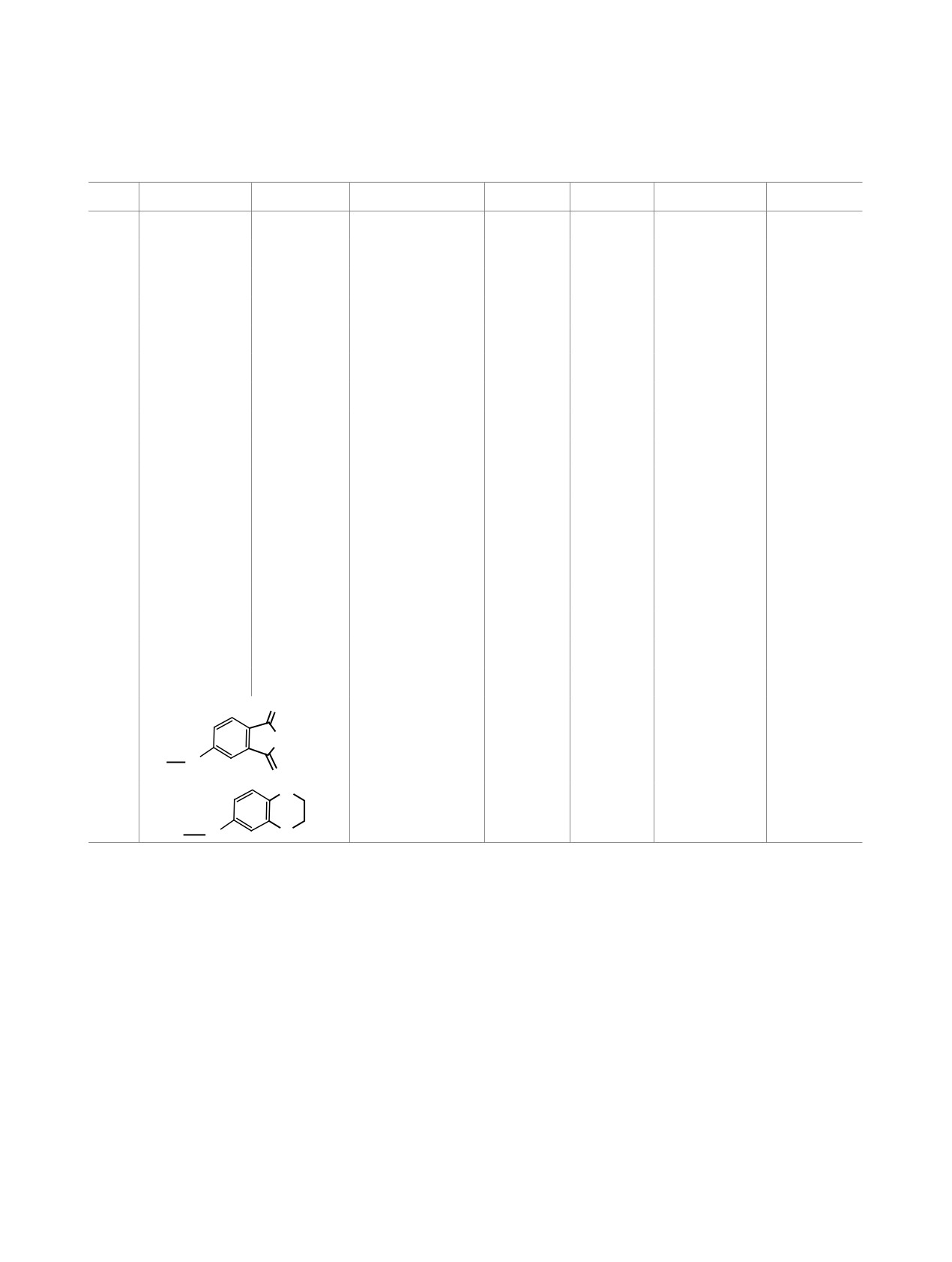
1,3-диона
2т и
2,3-дигидробензо[1,4]диоксин-
фосфора, проявляется дублетным сигналом с δC
6-амина 2у: выход целевых амидинов в данном
28.72-30.90 м. д., расщепленным от ядра фосфора, с
случае составил 44 и 53% соответственно.
константой спин-спинового взаимодействия 1JCP =
131.3-132.7 Гц, что типично для фосфонатов с
Строение и состав полученных симметричных
sp3-гибридизированным атомом углерода. Углерод
С-фосфонилированных ацетамидинов доказано с
помощью ИК и ЯМР 1Н, 13С, 31Р, 19F спектроскопии,
азометинового фрагмента резонирует в слабом
поле при 147.09-149.21 м. д. с константой спин-
а также масс-спектрометрии (см. таблицу). Так, в
спинового взаимодействия 2JCP = 6.6-7.3 Гц. Хими-
спектрах ЯМР 1Н фосфоноацетамидинов 3a-у
ческий сдвиг атома фосфора в ацетамидинах 3а-у
присутствует характерный дублетный сигнал
протонов метиленового фрагмента PCН2 в области
регистрируется в диапазоне δP 21.02-22.59 м. д.
2.95-3.05 м. д. с константой спин-спинового
В ИК спектрах соединений 3a-у присутствуют
взаимодействия 2JHP = 21.6-22.3 Гц. В спектрах
интенсивные полосы поглощения в области 1019-
ЯМР 13C атома углерода, связанный с атомом
1065 и 1227-1291 см-1, обусловленные валентными
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
СИНТЕЗ СИММЕТРИЧНЫХ N-(ГЕТ)АРИЛ-С-ФОСФОНОАЦЕТАМИДИНОВ
1877
колебаниями связей P-O-C и P=О соответственно.
Поглощение в области 3102-3371 (NH) и 1493-
1607 см-1 (С=N) обусловлено колебаниями связей
в амидиновом фрагменте.
Данные рентгеноструктурного анализа на
примере диэтил-(2-{[3-(трифторметил)фенил]-
амино}-2-{[3-(трифторметил)фенил]имино}этил)-
фосфоната 3и (см. рисунок) также однозначно
подтверждают строение полученных фосфоно-
ацетамидинов 3а-у.
Таким образом, взаимодействием 2-хлорэтин-
фосфоната с первичными ароматическими
аминами получен новый ряд симметричных N-
(гет)арил-C-фосфоноацетамидинов. Полученные
фосфорилированные амидины могут представлять
интерес как перспективные строительные блоки в
органическом синтезе и для получения веществ с
потенциально широким спектром биологической
активности.
Общий вид молекулы 3и в кристалле (CCDC 1832056).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Общая методика синтеза С-фосфоно-
Спектры ЯМР зарегистрированы на спектро-
ацетамидинов. К раствору 1 ммоль диэтил-2-
метрах Bruker Ascend 400 [400.13 (1H), 100.61
хлорэтенилфосфоната 1 [31] в 10 мл безводного
(13C), 161.98 (31P) и 376.50 МГц (19F)] в ДМСО-d6.
четыреххлористого углерода при интенсивном
Химические сдвиги фосфора приведены относи-
перемешивании при комнатной температуре
тельно внешнего стандарта - 85%-ной фосфорной
добавляли 2 ммоль соответствующего амина 2а-у.
кислоты. Для отнесения сигналов в спектрах ЯМР
Полученную смесь кипятили в течение 10-49 ч в
1H, 13C использовали методы двумерной гомо-
атмосфере аргона. Ход реакции контролировали
и гетероядерной спектроскопии ЯМР NOESY,
методом ЯМР 31Р. После окончания растворителя
HMQC, HSQC. ИК спектры записаны на спек-
смесь фильтровали, растворитель отгоняли.
трометре Shimadzu IRAffinity-1 в таблетках KBr.
Остаток перекристаллизовывали из гексана.
Масс-спектры высокого разрешения записаны
на масс-спектрометре Bruker MicrOTOF при ио-
Диэтил-{2-[(3-метилфенил)амино]-2-(3-ме-
низации вещества распылением в электрическом
тилфенилимино)этил}фосфонат
(3а). Выход
поле (ESI); температура ионизационной камеры -
79%, белые кристаллы, т. пл. 76-78°C. ИК спектр,
180°С, напряжение ионизации - 70 и 100 эВ).
ν, см-1: 1022 (P-O-C), 1232 (P=О), 3038 (СН3), 3291
Температуры плавления измерены на столи-
(NH). Спектр ЯМР 1H, δ, м. д.: 1.18 т (6Н, СН3,
ке Кофлера (VEB Wägetechnik Rapido, PHMK
3JНН = 7.0 Гц), 2.27 с [6Н, СН3(Ph)], 2.98 д (2Н, P-
81/2969).
СН2, 2JНР = 21.8 Гц), 3.93 д. к (4Н, PОСН2, 3JНН =
Ренгеноструктурный анализ выполнен на
7.0, 3JНР = 14.2 Гц), 6.60 д (1Н, СНпNH, 3JНН =
дифрактометре Agilent Technologies Xcalibur при
7.8 Гц), 6.64 с (1Н, СНоNH), 6.78 д (1Н, CHоN=, 3JHH =
100 K. Кристаллы соединения 3и моноклинные,
6.5 Гц), 6.79 д (1Н, СНпN=, 3JНН = 6.4 Гц), 7.15 т
C20H21F6N2O3P, пространственная группа P21/c,
(2Н, СНмNH, СНмN=, 3JНН = 7.7 Гц), 7.52 д (1Н,
параметры элементарной ячейки: a = 15.7826(8) Å,
СНоNH, 3JHH = 8.3 Гц), 7.54 с (1Н, СНоN=), 8.49 с
b = 10.7262(5) Å, c = 26.2490(12) Å, β = 97.252(5)°,
(1Н, NH). Спектр ЯМР 13С, δС, м. д.: 16.59 д (СН3,
V = 4408.1(4) Å3, Z = 8, dвыч = 1.454 г/см3, μ(MoKα) =
3JCP = 5.9 Гц), 21.50 (СН3NH), 21.76 (СН3N=), 28.88
0.199 мм-1, F(000) = 1984.0, R1 = 0.0504 (число от-
д (PСН2, 1JCP = 132.1 Гц), 62.24 д (PОСН2, 2JCP =
ражений 8156), wR2 = 0.1264 (10099).
6.6 Гц), 116.64 (СНоNH), 119.00 (СНоNH), 119.83
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1878
ЗАВЬЯЛОВА и др.
(СНпNH), 122.77 (СНоN=), 122.94 (СНоN=), 123.03
147.30 д (=С2, 2JCP = 6.9 Гц), 151.63 (CипсоNH),
(СНпN=), 128.74 (СНмN=), 128.97 (СНмNH), 137.95
159.91 (СмN=), 160.29 (СмNH). Спектр ЯМР 31Р: δР
(СмN=), 138.28 (СмNH), 141.19 (СипсоN=),
147.09
22.41 м. д. Масс-спектр, m/z: 407.1743 [M + H]+
д (=С2, 2JCP = 6.6 Гц), 150.32 (СипсоNH). Спектр
(вычислено для C20H27N2O5P: 407.1730 [M + H]+).
ЯМР 31Р: δР 22.53 м. д. Масс-спектр, m/z: 375.1832
Диэтил-(2-[3-(ацетилфенил)амино]-2-[3-
[M + H]+ (вычислено для C20H27N2O3P: 375.1821
(ацетилфенил)имино]этил)фосфонат
(3г).
[M + H]+)
Выход 62%, белые кристаллы, т. пл. 92-94°C. ИК
Диэтил-{2-[(4-изопропилфенил)амино]-
спектр, ν, см-1: 1029 (P-O-C), 1246 (P=О), 3355
2-[(4-изопропилфенил)имино]этил}фосфонат
(NH). Спектр ЯМР 1H, δ, м. д.: 1.15 т (6Н, СН3,
(3б). Выход 91%, красноватые кристаллы, т. пл.
3JНН = 7.0 Гц), 2.56 с (3Н, СН3NH), 2.58 c (3Н,
101-103°C. ИК спектр, ν, см-1: 1025 (P-O-C),
СН3N=), 3.00 д (2Н, PСН2, 2JНP = 21.7 Гц), 3.92 д. к
1260 (P=О), 1605 (C=N), 2959 (CH3), 3333 (NH).
(4Н, POСН2, 3JНН = 7.1, 3JНP = 14.5 Гц), 7.11 д (1Н,
Спектр ЯМР 1H, δ, м. д.: 1.16 т (6Н, СН3, 3JНН =
СНоN=, 3JНН = 7.8 Гц), 7.41-7.47 м (3H, CHмNH,N=,
7.0 Гц), 1.17 д (6Н, СН3, 3JНН = 6.5 Гц), 1.19 д (6Н,
CHпNН), 7.59 с (1Н, СНоN=), 7.60 д (1Н, СНоNH,
СН3, 3JНН = 5.4 Гц), 2.83 д. септ. (2H, CH, 3JНН =
3JHH = 7.4 Гц), 8.06 д (1Н, СНпN=, 3JНН = 7.9 Гц),
6.9 Гц), 2.97 д (2Н, PСН2, 2JНР = 21.6 Гц), 3.89 д.
8.29 с (1Н, СHоNH), 9.11 c (1Н, NH). Спектр ЯМР
к (4Н, PОСН2, 3JНН = 7.1, 3JНР = 14.3 Гц), 6.71 д
13С, δС, м. д.: 16.58 д (СН3, 3JCP = 5.9 Гц), 27.21
(2Н, СНоN=, 3JНН = 8.1 Гц), 7.13 д (4Н, СНп, 3JНН =
(СН3NH), 27.29 (СН3N=), 29.35 д (PСН2, 1JCP =
8.4 Гц), 7.61 д (2Н, CHоNH, 3JHH = 8.3 Гц), 8.53 с
132.1 Гц), 62.32 д (POСН2, 2JCP = 6.5 Гц), 118.60
(1Н, NH). Спектр ЯМР 13С, δС, м. д.: 16.61 д (СН3,
(СНоNH), 121.91 (СНпNH), 122.29 (СНоNH), 122.62
3JCP = 5.9 Гц), 24.51 (СН3NH), 24.58 (СН3N=), 28.72
(СHоN=), 124.07 (СHпN=), 126.98 (СНоN=), 129.39
д (P-СН2, 1JCP = 131.4 Гц), 33.27 (CH), 62.20 д
(СмN=), 129.53 (CHмNH), 131.62 (СмN=),
137.98
(PОСН2, 2JCP = 6.5 Гц), 119.55 (СНоNH), 121.89
(СмNH), 141.45 (СипсоN=), 148.13 д (=С2, 2JCP =
(СНоN=), 126.56 (СНмNH), 126.91 (СНмN=), 139.04
6.7 Гц), 150.43 (СипсоNH), 198.25 (С=ONH), 198.47
(СипсоN=), 142.09 (СпNH), 142.19 (СпN=), 147.15 д
(С=ON=). Спектр ЯМР 31Р: δР 21.95 м. д. Масс-
(=С2, 2JCP = 6.9 Гц), 148.16 (СипсоNH). Спектр ЯМР
спектр, m/z: 431.1730 [M + H]+ (вычислено для
31Р: δР 22.54 м. д. Масс-спектр, m/z: 453.2276 [M +
C22H27N2O5P: 431.1732 [M + H]+).
Na]+ (вычислено для C24H35N2O3P: 453.2278 [M +
Диэтил-{2-[(3-хлорфенил)амино]-2-[(3-хлор-
Na]+).
фенил)имино]этил}фосфонат (3д). Выход 71%,
Диэтил-{2-[(3-метоксифенил)амино]-2-
белые кристаллы, т. пл. 85-87°C. ИК спектр, ν,
[(3-метоксифенил)имино]этил}фосфонат
(3в).
см-1: 1022 (P-O-C), 1049 (C-Cl), 1227 (P=О),
Выход 55%, светло-желтое масло. ИК спектр, ν,
3126 (NH). Спектр ЯМР 1H, δ, м. д.: 1.17 т (6Н,
см-1: 1047 (P-O-C), 1251 (P=О), 1593 (C=N), 3332
СН3, 3JНН = 7.0 Гц), 2.98 д (2Н, PСН2, 2JНР =
(NH). Спектр ЯМР 1H, δ, м. д.: 1.19 т (6Н, СН3,
21.7 Гц), 3.93 д. к (4Н, ОСН2, 3JНН = 7.0, 3JНР =
3JНН = 7.0 Гц), 3.01 д (2H, PCH2, 2JНP = 21.7 Гц),
14.0 Гц), 6.79 д (1Н, СНпNH, 3JНН = 7.9 Гц), 6.92
3.72 с (3Н, OСН3), 3.74 с (3Н, OСН3), 3.94 д. к
с (1Н, СНоNH), 7.03 д (1Н, СНоN=, 3JНН = 7.6 Гц),
(4Н, PОСН2, 3JНН = 7.0, 3JНР = 14.9 Гц), 6.41 д
7.05 д (1H, CHпN=, 3JНН = 7.5 Гц), 7.30 т (1Н,
(1Н, СНоN=, 3JНН = 7.8 Гц), 6.44 с (1Н, СНоNH),
СНмNH, 3JHH = 8.0 Гц), 7.31 т (1Н, СНмN=, 3JНН =
6.56 д (2Н, CHпNH, CHоN=, 3JHH = 7.8 Гц), 7.18
8.0 Гц), 7.51 д (1Н, СНоNH, 3JНН = 8.2 Гц), 8.01 с
т (2Н, СНмNH, СНмN=, 3JНН = 8.0 Гц), 7.24 уш. д
(1Н, СНоN=), 9.08 с (1Н, NH). Спектр ЯМР 13С, δС,
(1Н, СНпN=, 3JHH = 7.4 Гц), 7.51 уш. с (1Н, СНоNH),
м. д.: 16.57 д (СН3, 3JCP = 6.6 Гц), 29.51 д (PСН2,
8.64 с (1Н, NH). Спектр ЯМР 13С, δС, м. д.: 16.56 д
1JCP = 131.3 Гц), 62.35 д (PОСН2, 2JCP = 6.6 Гц),
(СН3, 3JCP = 5.9 Гц), 29.11 д (PСН2, 1JCP = 131.7 Гц),
117.96 (СНоNH), 118.85 (СНоN=), 120.79 (СНпNH),
55.33 (OСН3), 62.29 д (PОСН2, 2JCP = 6.4 Гц),
122.01 (СНоN=), 122.13 (СНоNН), 122.38 (СНпN=),
105.61 (CHоNH), 107.36 (CHпNH), 107.55 (CHоNH),
130.59 (СНмN=), 130.74 (СНмNН), 133.32 (СмN=),
108.32 (СНоN=), 111.96 (СНоN=), 114.35 (СНоN=),
133.54 (СмNH), 142.40 (СипсоN=), 148.22 (=C2, 2JCP =
129.62 (СНмN=), 129.86 (СНмNH), 142.31 (СипсоN=),
6.6 Гц),
151.52 (СипсоNH). Спектр ЯМР 31Р: δР
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
СИНТЕЗ СИММЕТРИЧНЫХ N-(ГЕТ)АРИЛ-С-ФОСФОНОАЦЕТАМИДИНОВ
1879
21.61 м. д. Масс-спектр, m/z: 415.0810 [M + H]+
[M + H]+ (вычислено для C18H21F2N2O3P: 383.1331
(вычислено для C18H21Cl2N2O3P: 415.0822 [M + H]+).
[M + H]+).
Диэтил-{2-[(3-бромфенил)амино]-2-[(3-бром-
Диэтил-(2-[3-(нитрофенил)амино]-2-[3-
фенил)имино]этил}фосфонат (3е). Выход 68%,
(нитрофенил)имино]этил)фосфонат (3з). Выход
желтоватые кристаллы, т. пл. 88-90°C. ИК спектр,
59%, светло-желтые кристаллы, т. пл. 109-111°C.
ν, см-1: 1020 (P-O-C), 1050 (C-Br), 1227 (P=О),
ИК спектр, ν, см-1: 1019 (P-O-C), 1237 (P=О),
3121 (NH). Спектр ЯМР 1Н, δ, м. д.: 1.18 т (6Н,
1520 (NO2), 3122 (NH). Спектр ЯМР 1H, δ, м. д.:
СН3, 3JНН = 7.0 Гц), 2.98 д (2Н, PСН2, 2JНР =
1.15 т (6Н, СН3, 3JНН = 7.0 Гц), 3.05 д (2Н, PСН2,
21.7 Гц), 3.94 д. к (4Н, PОСН2, 3JHH = 7.2, 3JHP =
3JНР = 21.6 Гц), 3.93 д. к (4Н, P-ОСН2, 3JНН =
14.4 Гц), 6.83 д (1Н, СНоN=, 3JHH = 7.8 Гц), 7.07
7.0, 3JНР = 14.2 Гц), 7.32 д (1Н, СНоNН, 3JНН =
с (1Н, СНоNH), 7.16 д (1Н, СНпNH, 3JHH = 8.7 Гц),
7.9 Гц), 7.58 д. т (2Н, СНм, 3JНН = 8.2 Гц), 7.69 т (1Н,
7.18 д (1Н, СНпN=, 3JHH = 8.5 Гц), 7.23 т (1Н,
СНпNH, 4JНН = 2.1 Гц), 7.87 т (2Н, СНоN=, 3JHH =
СНмNH, 3JHH = 7.8 Гц), 7.25 т (1Н, СНмN=, 3JHH =
8.2 Гц), 8.06 д (1Н, СНпN=, 3JHH = 8.1 Гц), 8.81 с
8.1 Гц), 7.58 д (1Н, СНоNH, 3JHH = 8.1 Гц), 8.13 с
(1Н, СНоNН), 9.59 с (1Н, NH). Спектр ЯМР 13С, δС,
(1Н, СНоN=), 9.06 с (1Н, NH). Спектр ЯМР 13С, δС,
м. д.: 16.49 д (СН3, 3JCP = 5.9 Гц), 29.80 д (PСН2,
м. д.: 16.60 д (СН3, 3JСР = 5.8 Гц), 29.51 д (PСН2,
1JCP = 132.7 Гц), 62.44 д (PОСН2, 2JCP = 6.6 Гц),
1JCP = 132.7 Гц), 62.37 д (PОСН2, 1JCP = 6.6 Гц),
113.59 (СНоNH), 116.76 (СНпNH), 117.22 (СНоN=),
118.36 (СНоNH), 121.16 (СНоN=), 121.71 (СНоN=),
117.50 (СНоN=), 125.68 (СНпN=), 129.05 (СHоNН),
121.85 (СмN=), 122.10 (СмNH), 124.84 (CHоNH),
130.37 (СHмN=), 130.51 (СНмNH), 141.91 (СипсоN=),
125.04 (CHпNH), 125.27 (CHпN=), 130.90 (CHмN=),
148.40 (СмN=), 148.76 (СмNH), 149.21 д (=С2, 2JCP
131.04 (CHмNH), 142.54 (CипсоN=), 148.21 д (=C2,
6.6 Гц), 150.95 (СипсоNН). Спектр ЯМР 31Р: δР
2JCP = 7.3 Гц), 151.69 (СипсоNH). Спектр ЯМР 31Р:
21.28 м. д. Масс-спектр, m/z: 437.1237 [M + H]+
δР 21.63 м. д. Масс-спектр, m/z: 504.9735 [M + H]+
(вычислено для C18H21N4O7P: 437.1221 [M + H]+).
(вычислено для C18H21Br2N2O3P: 504.9709 [M + H]+).
Диэтил-(2-{[3-(трифторметил)фенил]ами-
Диэтил-{2-[(3-фторфенил)амино]-2-[(3-
но}-2-{[3-(трифторметил)фенил]имино}этил)-
фторфенил)имино]этил}фосфонат (3ж). Выход
фосфонат (3и). Выход 63%, белые кристаллы,
53%, оранжевое масло. ИК спектр, ν, см-1: 1026
т. пл. 75-77°C. ИК спектр, ν, см-1: 1050 (P-O-C),
(P-O-C), 1243 (P=О), 1601 (C-Cl). Спектр ЯМР
1235 (P=О), 3120 (NH). Спектр ЯМР 1H, δ, м. д.:
1H, δ, м. д.: 1.17 т (6Н, СН3, 3JНН = 7.0 Гц), 3.02
1.15 т (6Н, СН3, 3JНН = 7.1 Гц), 3.01 д (2Н, PСН2,
д (2Н, PСН2, 2JНР = 21.7 Гц), 3.93 д. к (4Н, ОСН2,
2JНР = 21.7 Гц), 3.92 д. к (4Н, PОСН2, 3JНН = 7.0,
3JНН = 7.1, 3JНР = 15.1 Гц), 6.68 д (1Н, СНоN=, 3JНF =
3JНР = 14.2 Гц), 7.13 д (1Н, СНоN=, 3JНН = 7.9 Гц),
12.2 Гц), 6.70 д (1Н, СНпNH, 3JНH = 8.0 Гц), 6.79 к
7.20 c (1Н, СНоN=), 7.33 д (1Н, СНпNH, 3JНН =
(2Н, СНоN=, CHп1N=, 3JНH = 7.9, 3JНF = 8.2 Гц), 7.30
7.8 Гц), 7.35 д (1Н, СНпN=, 3JHH = 7.9 Гц), 7.51 т (1Н,
к (2Н, СНмNH, CHмN=, 3JНН = 7.8 Гц), 7.37 д (1H,
СНмNН, 3JHH = 7.5 Гц), 7.53 т (1Н, СНмN=, 3JHH =
CHоNH, 3JНН = 8.1 Гц), 7.85 д (1Н, СНоNH, 3JHF =
7.6 Гц), 7.94 д (1Н, СНоNН, 3JНН = 8.1 Гц), 8.21 с (1Н,
12.2 Гц), 9.11 с (1Н, NH). Спектр ЯМР 13С, δС,
СНоNН), 9.29 с (1Н, NH). Спектр ЯМР 13С, δС, м. д.:
м. д.: 16.50 д (СН3, 3JCP = 6.1 Гц), 29.38 д (PСН2,
16.47 д (СН3, 3JCP = 5.8 Гц), 29.60 д (PСН2, 1JCP =
1JCP = 131.7 Гц), 62.33 д (PОСН2, 2JCP = 6.5 Гц),
132.7 Гц), 62.33 д (PОСН2, 2JCP = 5.8 Гц), 115.51
106.19 д (СНоNН, 2JCF = 26.9 Гц), 108.70 д (СНпNH,
к (СНоNH, 3JCF = 4.4 Гц), 118.72 к (СНоN=, 3JCF =
2JCF = 21.0 Гц), 109.07 д (СНоN=, 2JCF = 20.8 Гц),
4.4 Гц), 118.82 к (СНпNН, 3JCF = 3.7 Гц), 119.14 к
109.11 д (СНпN=, 2JCF = 22.2 Гц), 115.23 (СНоNH),
(СНпN=, 3JCF = 3.7 Гц), 123.17 (СНоNН), 124.68 к
118.18 (СНоN=), 130.38 д (СНмN=, 3JCF = 9.6 Гц),
(СF3NН, 1JCF = 272.1 Гц), 124.74 к (СF3N=, 1JCF =
130.57 д (СНмNН, 3JCF = 9.7 Гц), 142.73 д (СипсоN=,
272.1 Гц), 126.09 (СНоN=), 129.72 к (СмNH, 2JCF =
3JCF = 11.3 Гц), 148.03 д (=C2, 2JCP = 7.0 Гц), 151.99
31.0 Гц), 130.12 к (СмN=, 2JCF = 31.3 Гц), 130.18
д (СипсоNH, 3JCF = 9.9 Гц), 162.59 д (СмN=, 1JCF =
(СНмN=), 130.33 (СНмNH), 141.66 (СипсоN=), 148.62 д
240.1 Гц), 163.03 д (СмNH, 1JCF = 242.8 Гц). Спектр
(=С2, 2JCP = 6.6 Гц), 150.56 (СипсоNH). Спектр ЯМР
ЯМР 19F, δF, м. д.: -113.28, -112.35. Спектр ЯМР
19F, δF, м. д.: -61.30 (СF3), -61.09 (СF3). Спектр
31Р: δP 21.74 м. д. Масс-спектр, m/z:
383.1344
ЯМР 31Р: δР 21.53 м. д. Масс-спектр, m/z: 483.1254
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1880
ЗАВЬЯЛОВА и др.
[M + H]+ (вычислено для C20H21F6N2O3P: 483.1267
3.71 с (6Н, OСН3), 3.72 с (3Н, OСН3), 3.73 с (3Н,
[M + H]+).
OСН3), 3.95 д. к (4Н, POСН2, 3JНН = 7.5, 3JНP =
Диэтил-{2-[(4-хлорфенил)амино]-2-[(4-хлор-
14.9 Гц), 6.32 д (1Н, СНоN=, 3JНН = 6.6 Гц), 6.51 с
(1H, СНоN=), 6.84 д (1Н, СНмN=, 3JHH = 7.8 Гц), 6.85
фенил)имино]этил}фосфонат (3к). Выход 93%,
д (1Н, СНмNH, 3JHH = 8.0 Гц), 7.31 д (1Н, СНоNH,
белые кристаллы, т. пл. 104-106°C. ИК спектр, ν,
3JHH = 8.5 Гц), 7.41 с (1Н, СНоNH), 8.41 c (1Н, NH).
см-1: 1027 (P-O-C), 1209 (C-Cl), 1256 (P=О), 3328
Спектр ЯМР 13С, δС, м. д.: 16.60 д (СН3, 3JCP =
(NH). Спектр ЯМР 1H, δ, м. д.: 1.17 т (6Н, СН3, 3JНН =
7.1 Гц), 2.98 д (2Н, P-СН2, 2JНР = 21.7 Гц), 3.93 д. к
5.9 Гц), 28.80 д (PСН2, 1JCP = 131.8 Гц), 55.71
(OCH3), 55.79 (OCH3), 56.17 (OCH3), 56.25 (OCH3),
(4Н, PОСН2, 3JНН = 7.0, 3JНР = 14.2 Гц), 6.84 д (2Н,
62.31 д (POСН2, 2JCP = 6.4 Гц), 104.94 (СНоNH),
СНоN=, 3JНН = 8.5 Гц), 7.30 д (2Н, СНмNН, 3JНН =
107.03 (СНоN=), 111.44 (СНоNH), 112.29 (СипсоN=),
8.5 Гц), 7.32 д (2Н, СНмN=, 3JНН = 9.0 Гц), 7.75 д
112.55 (СHмN=), 112.96 (СHмNH), 113.05 (СHоN=),
(2Н, СНоNН, 3JHH = 8.8 Гц), 8.95 с (1Н, NH). Спектр
ЯМР 13С, δС, м. д.: 16.57 д (СН3, 3JCP = 5.9 Гц),
135.13 (СпNH), 144.28 (СипсоNH), 144.46 (СмN=),
147.41 д (=С2, 2JCP = 7.1 Гц), 148.84 (СмNH), 149.41
29.26 д (PСН2, 1JCP = 132.0 Гц), 62.33 д (PОСН2,
(СпN=). Спектр ЯМР 31Р: δР 22.95 м. д. Масс-
2JCP = 5.8 Гц), 121.02 (СНоNH), 123.84 (СНоN=),
спектр, m/z: 467.1959 [M + H]+ (вычислено для
125.86 (СпNH),
126.53 (СпN=),
128.79 (СНмN=),
C22H31N2O7P: 467.1942 [M + H]+).
128.97 (СНмNН), 140.01 (СипсоN=), 147.90 д (=С2,
2JCP = 6.6 Гц), 149.03 (СипсоNH). Спектр ЯМР 31Р:
Диэтил-{2-[(3,4-дихлорфенил)амино]-
δР 21.85 м. д. Масс-спектр, m/z: 415.0727 [M + H]+
2-[(3,4-дихлорфенил)имино]этил}фосфонат
(вычислено для C18H21Cl2N2O3P: 415.0740 [M +
(3н). Выход 80%, белые кристаллы, т. пл. 95-97°C.
H]+).
ИК спектр, ν, см-1: 1025 (P-O-C), 1051 (C-Cl),
1233 (P=О), 1582 (С=N), 3106 (NH). Спектр ЯМР
Диэтил-(2-{[4-(трифторметокси)фенил]-
1H, δ, м. д.: 1.17 т (6Н, СН3, 3JНН = 7.0 Гц), 2.99 д
амино}-2-{[4-(трифторметокси)фенил]имино}-
(2Н, PСН2, 2JНP = 21.7 Гц), 3.95 д. к (4Н, POСН2,
этил)фосфонат (3л). Выход 92%, белые кристаллы,
3JНН = 7.1, 3JНP = 14.2 Гц), 6.84 д. д (1Н, СНоNH,
т. пл. 125-127°C. ИК спектр, ν, см-1: 1024 (P-O-C),
3JНН = 8.5, 4JНН = 2.4 Гц), 7.14 д (1Н, СНоNН, 4JHH =
1291 (P=О), 1502 (C=N), 3150 (NH). Спектр ЯМР
2.4 Гц), 7.49-7.59 м (3Н, СНоN=, СНмNH, СНмN=),
1H, δ, м. д.: 1.15 т (6Н, СН3, 3JНН = 7.0 Гц), 3.01 д
8.16 д (1Н, СНоNH, 4JНН = 1.7 Гц), 9.30 c (1Н, NH).
(2Н, PСН2, 2JНР = 21.7 Гц), 3.90 д. к (4Н, PОСН2,
Спектр ЯМР 13С, δС, м. д.: 16.56 д (СН3, 3JCP = 5.9 Гц),
3JНН = 7.0, 3JНР = 14.2 Гц), 6.92 д (2H, CHоN=, 3JНН =
29.75 д (PСН2, 1JCP = 131.3 Гц), 62.42 д (POСН2,
8.7 Гц), 7.27 т (4Н, СНоNH, СНмNH, 3JНН = 8.9 Гц),
2JCP = 6.5 Гц), 119.71 (СНоNH), 120.59 (СНоNH),
7.84 д (2Н, СНмN=, 3JНН = 8.9 Гц), 9.08 с (1Н, NH).
122.64 (СНоN=), 123.88 (СипсоN=), 123.96 (СHоN=),
Спектр ЯМР 13С, δС, м. д.: 16.49 д (СН3, 3JCP =
124.63 (СпNH), 130.84 (СHмN=), 130.91 (СHмNH),
5.8 Гц), 29.26 д (PСН2, 1JCP = 131.6 Гц), 62.27 д
131.17 (СмN=), 131.38 (СмNH), 140.89 (СпN=), 148.73
(PОСН2, 2JCP = 6.4 Гц), 120.66 к (OСF3, 1JCF =
д (=С2, 2JCP = 6.9 Гц), 149.94 (СипсоNH). Спектр
255.3 Гц), 120.69 к (OCF3, 1JCF = 255.3 Гц), 120.70
ЯМР 31Р: δР 21.35 м. д. Масс-спектр, m/z: 482.9975
(СНмN=), 121.83 (СНмNН), 122.02 (СНоNH), 123.41
[M + H]+ (вычислено для C18H19Cl4N2O3P: 482.9960
(СНоN=), 140.28 (СипсоN=), 143.05 (СпNH), 143.80
[M + H]+).
(СипсоNH), 148.09 д (=С2, 2JCP = 7.1 Гц), 149.34
(СпN=). Спектр ЯМР 19F, δF, м. д.: -57.11. Спектр
Диэтил-(2-([4-(метокси-3-хлорфенил)ами-
ЯМР 31Р: δР 21.71 м. д. Масс-спектр, m/z: 537.1013
но]-2-([4-(метокси-3-хлорфенил)имино]этил)
[M
+ Na]+ (вычислено для C20H21F6N2O5P:
фосфонат (3о). Выход 59%, желтое масло. ИК
537.0984 [M + Na]+).
спектр, ν, см-1: 1022 (P-O-C), 1252 (P=О), 1493
(С=N), 3317 (NH). Спектр ЯМР 1H, δ, м. д.: 1.18 т
Диэтил-{2-[(3,4-диметоксифенил)амино]-
2-[(3,4-диметоксифенил)имино]этил}фосфонат
(6Н, СН3, 3JНН = 7.0 Гц), 2.96 д (2Н, PСН2, 2JНP =
21.6 Гц), 3.81 с (6Н, OСН3), 3.94 д. к (4Н, POСН2,
(3м). Выход 56%, оранжевое масло. ИК спектр, ν,
3JНН = 7.1, 3JНP = 14.7 Гц), 6.75 д. д (1Н, СНоN=,
см-1: 1026 (P-O-C), 1231 (P=О), 1511 (С=N), 3368
3JНН = 8.6, 4JНН = 1.9 Гц), 6.93 д (1Н, СНоN=,
(NH). Спектр ЯМР 1H, δ, м. д.: 1.18 т (6Н, СН3,
4JHH = 1.9 Гц), 7.04 д (1Н, СНмNH, 3JHH = 8.8 Гц), 7.07
3JНН = 7.0 Гц), 2.99 д (2Н, PСН2, 2JНP = 21.6 Гц),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
СИНТЕЗ СИММЕТРИЧНЫХ N-(ГЕТ)АРИЛ-С-ФОСФОНОАЦЕТАМИДИНОВ
1881
д (1Н, СНмN=, 3JНН = 9.2 Гц), 7.51 д. д (1Н, СHоNH,
5.4 Гц), 8.29 c (1Н, NH). Спектр ЯМР 13С, δС,
3JHH = 8.9, 4JНН = 1.8 Гц), 7.98 д (1H, CHоNH, 4JНН =
м. д.: 15.33 (СН3NH), 15.40 (СН3N=), 16.54 д (СН3,
1.8 Гц), 8.79 c (1Н, NH). Спектр ЯМР 13С, δС,
3JCP = 6.0 Гц), 28.41 д (PСН2, 1JCP = 130.7 Гц),
м. д.: 16.59 д (СН3, 3JCP = 5.9 Гц), 29.12 д (PСН2, 1JCP =
62.31 д (POСН2, 2JCP = 6.3 Гц), 120.16 (СНоNH),
131.9 Гц), 56.59 (OCH3), 62.33 д (POСН2, 2JCP =
122.93 (СНпNH), 123.86 (СНмNH), 125.34 (СHпN=),
6.5 Гц), 113.27 (СНмN=), 113.49 (СНмNH), 119.33
127.21 (СHоN=), 127.35 (СНмN=), 127.75 (СипсоN=),
(СНоNH), 120.73 (СмN=), 121.05 (СHоNH), 121.32
130.01 (СоNH),
134.09 (СмN=),
134.12 (СмNH),
(СмNH), 121.49 (СHоN=), 123.67 (СHоN=), 135.04
140.24 (СоN=), 148.68 д (=С2, 2JCP = 6.5 Гц), 150.63
(СипсоN=), 144.12 (СипсоNH), 148.29 д (=С2, 2JCP =
(СипсоNH). Спектр ЯМР 31Р: δР 22.66 м. д. Масс-
6.9 Гц), 149.97 (СпNH), 150.31 (СпN=). Спектр ЯМР
спектр, m/z: 443.1057 [M + H]+ (вычислено для
31Р: δР 22.16 м. д. Масс-спектр, m/z:
475.0906
C20H25Cl2N2O3P: 443.1053 [M + H]+).
[M + H]+ (вычислено для C20H25Cl2N2O5P: 475.0921
Диэтил-(2-([5-(нитро-2-хлорфенил)ами-
[M + H]+).
но]-2-([5-(нитро-2-хлорфенил)имино]этил)фос-
Диэтил-(2-([4-(метокси-3-хлорфенил)ами-
фонат (3с). Выход 45%, желтоватые кристаллы,
но]-2-([4-(метокси-3-хлорфенил)имино]этил)-
т. пл. 122-124°C. ИК спектр, ν, см-1: 1045 (P-O-C),
фосфонат (3п). Выход 55%, желтые кристаллы,
1278 (P=О), 1514 (NO2), 3337 (NH). Спектр ЯМР
т. пл. 106-108°C. ИК спектр, ν, см-1: 1053 (P-O-C),
1H, δ, м. д.: 1.20 т (6Н, СН3, 3JНН = 7.0 Гц), 3.27 д
1225 (P=О), 1603 (С=N), 3105 (NH). Спектр ЯМР
(2Н, PСН2, 2JНP = 22.0 Гц), 4.02 д. к (4Н, POСН2,
1H, δ, м. д.: 1.15 т (6Н, СН3, 3JНН = 7.0 Гц), 2.46 с
3JНН = 7.2, 3JНP = 14.6 Гц), 7.76 д (1Н, СНмN=, 3JНН =
(3Н, СН3), 2.47 c (3Н, СН3), 3.01 д (2Н, PСН2, 2JНP =
8.6 Гц), 7.80 д (1Н, СНмNН, 3JHH = 8.8 Гц), 7.88 д
21.7 Гц), 3.93 д. к (4Н, POСН2, 3JНН = 7.1, 3JНP =
(2Н, СНоNH, СНоN=, 3JHH = 8.5 Гц), 7.94 д. д (1Н,
14.2 Гц), 7.12 д. д (1Н, СНоN=, 3JНН = 8.0, 4JНН =
СНпN=, 3JHH = 8.8, 4JHH = 2.6 Гц), 8.99 с (1Н, NH),
2.1 Гц), 7.41 т (2Н, СНмNH, СНмN=, 3JHH = 8.5 Гц),
9.43 c (1Н, CHпNH). Спектр ЯМР 13С, δС, м. д.:
7.45 д (1Н, СНоN=, 4JHH = 2.0 Гц), 7.84 д. д (1Н,
16.51 д (СН3, 3JCP = 5.9 Гц), 29.39 д (PСН2, 1JCP =
СНоNH, 3JНН = 8.3, 4JНН = 1.9 Гц), 8.57 д (1Н, СHоNH,
132.5 Гц), 62.79 д (POСН2, 2JCP = 6.4 Гц), 117.70
4JНН = 1.9 Гц), 9.41 c (1Н, NH). Спектр ЯМР 13С,
(СНоNH), 118.03 (СНпNH), 119.08 (СНоN=), 119.34
δС, м. д.: 16.53 д (СН3, 3JCP = 5.9 Гц), 19.37 (СН3),
(СHпN=), 130.67 (СоNH), 130.87 (СНмN=), 130.93
19.62 (СН3), 29.62 д (PСН2, 1JCP = 131.0 Гц), 62.41
(СНмNH), 133.70 (СоN=), 137.18 (СипсоN=), 146.73
д (POСН2, 2JCP = 6.4 Гц), 114.62 (СНоNH), 117.59
(СмN=), 146.85 (СмNH), 147.18 (CипсоNH), 150.87 д
(СНоN=), 124.28 (СНоNH), 126.36 (СпNH), 126.45
(=С2, 2JCP = 6.9 Гц). Спектр ЯМР 31Р: δР 21.62 м. д.
(СпN=), 127.46 (СоNH), 133.31 (СHмNH),
133.44
Масс-спектр, m/z: 527.0265 [M + Na]+ (вычислено
(СHмN=), 139.76 (СипсоN=), 148.75 (СипсоNH), 148.96
для C18H19Cl2N4O7P: 527.0261 [M + Na]+).
(CмN=), 149.05 д (=С2, 2JCP = 6.2 Гц), 149.51 (СмNH).
Диэтил-[N,N’-бис(2-метил-1,3-диоксо-2,3-
Спектр ЯМР 31Р: δР 21.48 м. д. Масс-спектр, m/z:
дигидро-1H-изоиндол-5-ил)карбамимидоилме-
465.1521 [M + H]+ (вычислено для C20H25N4O7P:
тил]фосфонат (3т). Выход 44%, желтоватое мас-
465.1534 [M + H]+).
ло. ИК спектр, ν, см-1: 1020 (P-O-C), 1280 (P=О),
Диэтил-(2-([3-(хлор-2-метилфенил)амино]-2-
1583 (C=N), 3102 (NH). Спектр ЯМР 1H, δ, м. д.:
([3-(хлор-2-метилфенил)имино]этил)фосфонат
1.16 т (6Н, СН3, 3JНН = 7.0 Гц), 3.00 с (3Н, NСН3),
(3р). Выход 30%, желтоватые кристаллы, т. пл.
3.03 c (3Н, NСН3), 3.05 д (2Н, PСН2, 2JНP = 22.3 Гц),
73-75°C. ИК спектр, ν, см-1: 1025 (P-O-C), 1050
3.94 д. к (4Н, POСН2, 3JНН = 7.1, 3JНP = 14.2 Гц),
(C-Cl), 1236 (P=О), 1576 (C=N), 2978 (СН3), 3371
7.22 д. д (1Н, СНоNH, 3JНН = 7.9, 4JНН = 1.8 Гц),
(NH). Спектр ЯМР 1H, δ, м. д.: 1.18 т (6Н, СН3,
7.30 д (1Н, СНмNН, 4JHH = 1.7 Гц), 7.76 д (1Н,
3JНН = 7.0 Гц), 2.07 с (3Н, СН3NH), 2.37 c (3Н,
СНоNH, 3JHH = 7.5 Гц), 7.78 д (1Н, СНоN=, 3JНН =
СН3N=), 2.99 д (2Н, PСН2, 2JНP = 21.8 Гц), 3.95 д. к
7.6 Гц), 7.96 д. д (1Н, СHоN=, 3JHH = 8.2, 4JНН =
(4Н, POСН2, 3JНН = 7.1, 3JНP = 14.4 Гц), 6.66 д (1Н,
1.7 Гц), 8.31 д (1Н, CHмN=, 4JНН = 1.7 Гц), 9.77 с
СНоNH, 3JНН = 7.4 Гц), 7.02 д (1Н, СНпNН, 3JHH =
(1H, NH). Спектр ЯМР 13С, δС, м. д.: 16.54 д (СН3,
7.4 Гц), 7.09 т (1Н, СНмN=, 3JHH = 7.5 Гц), 7.21 уш.
3JCP = 5.9 Гц), 24.13 (NСН3), 30.09 д (PСН2, 1JCP =
с (2Н, СНоN=, СНпN=), 7.72 д (1Н, СHмNH, 3JHH =
131.3 Гц), 62.52 д (POСН2, 2JCP = 6.6 Гц), 113.13
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1882
ЗАВЬЯЛОВА и др.
(СНоNH), 116.57 (СНоN=), 124.33 (СНмNH), 124.39
СПИСОК ЛИТЕРАТУРЫ
(СНоNH), 125.08 (С1NH), 125.14 (СHмN=), 125.81
1. Shriner R.L., Neumann F.W. // Cem. Rev.1944. Vol. 35.
(С1N=),
127.10 (СHоN=),
133.75 (С2NH),
133.83
N 3. P. 351. doi 10.1021/cr60112a002
(С2N=), 146.02 (СипсоNH),
148.58 д (=С2, 2JCP =
2. The Chemistry of Amidines and Imidates / Ed. S. Patai.
7.3 Гц), 155.26 (СипсоN=), 168.15 (С=O), 168.36
London: Wiley, 1975-1991. Vol. 1, 2.
(С=O), 168.39 (С=O). Спектр ЯМР 31Р: δР 21.02 м. д.
Масс-спектр, m/z: 513.1527 [M + H]+ (вычислено
3. Aly A.A., Bräse S., Goma M.A.-M. // Arkivoc. 2018.
для C24H25N4O7P: 513.1534 [M + H]+).
Pt vi. P. 85. doi 10.24820/ark.5550190.p010.607
4. Quek J.Y., Davis T.P., Lowe A.B. // Chem. Soc. Rev. 2013.
Диэтил-{N,N-бис(2,3-дигидробензо[1,4]диок-
Vol. 42. P. 7326. doi 10.1039/C3CS60065C
син-6-ил)карбамимидоилметил}фосфонат (3у).
Выход 53%, белые игольчатые кристаллы, т. пл.
5. Dunn P.J. In: Comprehensive Organic Functional
133-135°C. ИК спектр, ν, см-1: 1023 (диоксан),
Group Transformations / Eds A.R. Katritzky, O. Meth-
Cohn, C.W. Rees. Amsterdam: Pergamon Press, 1995.
1065 (P-O-C), 1240 (P=О), 1607 (C=N), 3335 (NH).
Vol. 5. P. 741.
Спектр ЯМР 1H, δ, м. д.: 1.19 т (6Н, СН3, 3JНН =
7.0 Гц), 2.95 д (2Н, PСН2, 2JНP = 21.6 Гц), 3.93 д.
6. Лобанов П.С., Дарьин Д.В. // ХГС. 2013. № 4. С. 546;
к (4Н, POСН2, 3JНН = 7.1, 3JНP = 14.8 Гц), 4.18 т
Lobanov P.S., Dar’in D.V. // Chem. Heterocycl. Compd.
(4H, CH2, 3JHH = 6.0 Гц), 4.19 т (4H, CH2, 3JHH =
2013. Vol. 49. N 4. P. 507. doi 10.1007/s10593-013-
1277-2
5.2 Гц), 6.26 д (1Н, СНоNH, 3JНН = 8.1 Гц), 6.31 с
(1Н, СНоNН), 6.74 д (2Н, СНмNH,N=, 3JHH = 8.6 Гц),
7. Pombeiro A.J.L., Kukushkin V.Yu. In: Comprehensive
6.98 д (1Н, СНоN=, 3JНН = 7.9 Гц), 7.45 c (1Н,
Coordination Chemistry II / Eds J.A. McCleverty, T.J.
СHоN=), 8.41 уш. с (1H, NH). Спектр ЯМР 13С, δС,
Meyer. New York: Elsevier Science, 2003 P. 639. doi
м. д.: 16.60 д (СН3, 3JCP = 6.0 Гц), 28.80 д (PСН2,
10.1016/B0-08-043748-6/01248-2
1JCP = 132.9 Гц), 62.28 д (POСН2, 2JCP = 6.5 Гц),
8. Barker J., Kilner M. // Coord. Chem. Rev. 1994. Vol. 133.
64.34 (СН2), 64.63 (СН2), 102.89 (СипсоNH), 107.86
P. 219. doi 10.1016/0010-8545(94)80059-6
(СипсоN=), 108.64 (СНоN=), 110.54 (СНоNH), 112.75
9. Edelmann F.T. // Chem. Soc. Rev. 2009. Vol. 38.
(СHоN=), 114.95 (CHоNH), 116.95 (СHмN=), 117.29
P. 2253. doi 10.1039/B800100F
(СHмNH),
138.66 (С1N=),
138.96 (С2N=),
143.09
10. Edelmann F.T. // Adv. Organomet. Chem. 2008. Vol. 57.
(С1NH), 143.66 (С2NH), 147.53 д (=С2, 2JCP = 7.0 Гц).
P. 183. doi 10.1016/S0065-3055(08)00003-8
Спектр ЯМР 31Р: δР 22.59 м. д. Масс-спектр, m/z:
11. Nagasawa K. In: Superbases for Organic Synthesis /
463.1612 [M + H]+ (вычислено для C22H27N2O7P:
Ed. T. Ishikawa. Chichester: John Wiley & Sons Ltd,
463.1629 [M + H]+).
2009. P. 211.
ФОНДОВАЯ ПОДДЕРЖКА
12. Taylor J.E., Bull S.D., Williams J.M. // J. Chem. Soc.
Rev. 2012. Vol. 41. P. 2109. doi 10.1039/C2CS15288F
Работа выполнена при финансовой поддержке
13. Guile S.D., Alcaraz L., Birkinshaw T.N., Bowers K.C.,
Российского фонда фундаментальных исследова-
Ebden M.R., Furber M., Stocks M.J. // J. Med. Chem.
ний (грант № 19-03-00365) в рамках базовой части
2009. Vol. 52. P. 3123. doi 10.1021/jm801528x
государственного задания Министерства образо-
14. Greenhill J.V., Lue P. // Prog. Med. Chem. 1993. Vol. 30.
вания и науки РФ (№ 4.5554.2017/8.9) с исполь-
P. 203. doi 10.1016/S0079-6468(08)70378-3
зованием оборудования Инжиниригового центра
Санкт-Петербургского государственного техно-
15. Caron S., Wei L., Douville J., Ghosh A. // J. Org. Chem.
логического института и Центра коллективного
2010. Vol. 75. P. 945. doi 10.1021/jo902159z
пользования «Методы анализа состава вещества»
16. Kantin G., Krasavin M. // Curr. Org. Chem. 2016.
Санкт-Петербургского госуниверситета.
Vol. 20. P. 1370. doi 10.2174/1385272820666160205
003213
КОНФЛИКТ ИНТЕРЕСОВ
17. Ostrowska K., Kolasa A. // Science of Synthesis. 2005.
Авторы заявляют об отсутствии конфликта
Vol. 22. P. 379.
интересов.
18. Kort M.E., Drizin I., Gregg R.J., Scanio M.J.C., Shi L.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
СИНТЕЗ СИММЕТРИЧНЫХ N-(ГЕТ)АРИЛ-С-ФОСФОНОАЦЕТАМИДИНОВ
1883
Gross M.F., Atkinson R.N., Johnson M.S., Pacof-
33. Quin L.D. A Guide to Organophosphorus Chemistry.
sky G.J., Thomas J.B., Carroll W.A., Krambis M.J.,
New York: John Wiley & Sons, 2000.
Liu D., Shieh C.-C., Zhang X., Hernandez G., Miku-
34. George A., Veis A. // Chem. Rev. 2008. Vol. 108.
sa J.P., Zhong C., Joshi S., Honore P., Roeloffs R.,
P. 4670. doi 10.1021/cr0782729
Marsh K.C., Murray B.P., Liu J., Werness S., Falty-
35. Tang W., Zhang X. // Chem. Rev. 2003. Vol. 103.
nek C.R., Krafte D.S., Jarvis M.F., Chapman M.L.,
P. 3029. doi 10.1021/cr020049i
Marron B.E. // J. Med. Chem. 2008. Vol. 51. P. 407. doi
36. Chen X., Kopecky D.J., Mihalic J., Jeffries S., Min X.,
10.1016/j.bmc.2008.05.003
Heath J., Deignan J., Lai S., Fu Z., Guimaraes C.,
19. Renton P., Green B., Maddaford S., Rakhit S., An-
Shen S., Li S., Johnstone S., Thibault S., Xu H., Cardozo M.,
drews J.S. // ACS Med. Chem. Lett. 2012. Vol. 3. P. 227.
Shen W., Walker N., Kayser F., Wang Z. // J. Med. Chem.
doi 10.1021/ml200268w
2012. Vol. 55. P. 3837. doi 10.1021/jm300037x
20. Annedi S.C., Ramnauth J., Maddaford S.P., Renton P.,
37. Dang Q., Liu Y., Cashion, D.K., Kasibhatla S.R.,
Rakhit S., Mladenova G., Dove P., Silverman S.,
Jiang T., Taplin F., Jacintho J.D., Li H., Sun Z., Fan Y.,
Andrews J.S., Felice M.D., Porreca F. // J. Med. Chem.
DaRe J., Tian F., Li W., Gibson T., Lemus R., van
2011. Vol. 54. P. 7408. doi 10.1021/jm201063u
Poelje P.D., Potter S.C., Erion M.D. // J. Med. Chem.
21. Wiglenda T., Ott I., Kircher B., Schumacher P., Schus-
2011. Vol. 54. P. 153. doi 10.1021/jm101035x
ter D., Langer T., Gust R. // J. Med. Chem. 2005.
38. Alexandre F., Amador A., Bot S., Caillet C., Convard T.,
Vol. 48. P. 6516. doi 10.1021/jm050190u
Jakubik J., Musiu, C., Poddesu B., Vargiu L., Liuzzi M.,
22. Kuethe J.T., Childers K.G., Humphrey G.R., Journet M.,
Roland A., Seifer M., Standring D., Storer R., Dous-
Peng Z. // Org. Process Res. Dev. 2008. Vol. 12. P. 1201.
son C.B. // J. Med. Chem. 2011. Vol. 54. P. 392. doi
doi 10.1021/op800176e
10.1021/jm101142k
23. Brasche G., Buchwald S.L. // Angew. Chem. Int. Ed.
39. Zhang A., Sun J., Lin C., Hu X., Liu W. // J. Agric. Food
2008. Vol. 47. P. 1932. doi 10.1002/anie.200705420
Chem. 2014. Vol. 62. P. 1477. doi 10.1021/jf404959v
24. Ma B., Wang Y., Peng J., Zhu Q. // J. Org. Chem. 2011.
40. Motoyoshiya J., Teranishi A., Mikoshiba R., Yamamo-
Vol. 76. P. 6362. doi 10.1021/jo2007362
to I., Gotho H. // J. Org. Chem. 1980. Vol. 45. P. 5385.
25. Kumar V., Mohan C., Gupta M., Mahajan M.P. //
doi 10.1021/jo01314a041
Tetrahedron. 2005. Vol. 61. P. 3533. doi 10.1016/j.
41. Koeckritz A., Schnell M. // Phosphorus, Sulfur,
tet.2005.01.118
Silicon, Relat. Elem. 1992. Vol. 73. P. 185. doi
26. Wang Y., Wang H., Peng J., Zhu Q. // Org. Lett. 2011.
10.1080/10426509208034444
Vol. 13. P. 4604. doi 10.1021/ol201807n
42. Palacios F., Ochoa de Retana A.M., Pagalday J. // Eur.
27. McGowan M.A., McAvoy C.Z., Buchwald S.L. // Org.
J. Org. Chem. 2003. P. 913. 10.1002/ejoc.200390139
Lett. 2012. Vol. 14. P. 3800. doi 10.1021/ol301700y
43. Шишкин В.Е., Медников Е.В., Шевченко М.А.,
28. Volochnyuk D.M., Kovaleva S.A., Chernega A.N.,
Анищенко О.В., Попов Ю.В., Гурба Е.В., Чау Нят
Chubaruk N.G., Kostyuk A.N., Pinchuk A.M., Tolma-
Банг // ЖОХ. 2010. Т. 80. № 1. С. 64; Shishkin V.E.,
chev A.A., Schmutzler R. // Synthesis. 2006. N 10. P.
Mednikov E.V., Shevchenko M.A., Anishchenko O.V.,
1613. doi 10.1055/s-2006-926460
Popov Yu.V., Gurba E.V., Chau Nyat Bang // Russ. J.
29. Oshovsky G.V., Pinchuk A.M., Tolmachev A.A. //
Gen. Chem. 2010. Vol. 80. N 1. P. 60. doi 10.1134/
Mendeleev Commun. 1999. Vol. 9. P. 161. doi 10.1070/
S1070363210010093
MC1999v009n04ABEH001112
30. Пушечников Д.М., Волочнюк Д.М., Кротко Д.Г.,
44. Панарина А.Е., Александрова А.В., Догадина А.В., Ио-
Тылтин А.К., Толмачев А.А. // ХГС. 2001. № 5.
нин Б.И. // ЖОХ. 2005. Т. 75. № 1. С. 5; Panarina A.E.,
С. 708; Pushechnikov A.O., Volochnyuk D.M.,
Aleksandrova A.V., Dogadina A.V., Ionin B.I. // Russ.
Krotko D.G., Tyltin A.K., Tolmachev A.A. // Chem.
J. Gen. Chem. 2005. Vol. 75. N 1. P. 3. doi 10.1007/
Heterocycl. Compd. 2001. Vol. 37. N 5. P. 656. doi
s11176-005-0162-9
10.1023/A:1011633327895
45. Rossi E., Calabrese D., Parma F. // Tetrahedron. 1991.
31. Engel R. Handbook of Organophosphorus Chemistry.
Vol. 47. P. 5819. doi 10.1016/S0040-4020(01)86532-7
New York: M. Dekker, Inc. 1992.
46. Omrani R., Efrit M.L., Ben Akacha A. // Phosphorus,
32. Yudelevich V.I., Ionin B.I. Organophosphorus Drugs. St.
Sulfur, Silicon, Relat. Elem. 2015. Vol. 190. P. 2291.
Petersburg: Thesa, 1995.
doi 10.1080/10426507.2015.1071372
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1884
ЗАВЬЯЛОВА и др.
47. Шишкин В.Е., Медников Е.В., Попов Ю.В., Шевчен-
2019. Vol. 89. N 10. P. 2159. doi 10.1134/10.1134/
ко М.А., Анищенко О.В., Гурба Е.В. // ЖОХ. 2014.
S1070363219100281
Т. 84. № 6. P. 948; Shishkin V.E., Mednikov E.V., Po-
51. Синица А.Д., Криштал В.С., Кальченко В.И. // ЖОХ.
pov Yu.V., Shevchenko M.A., Anishchenko O.V.,
1980. Т. 50. С. 1288.
Gurba E.V. // Russ. J. Gen. Chem. 2014. Vol. 84. N 6.
52. Свинцицкая Н.И., Аймаков О.А., Догадина А.В.,
P. 1130. doi 10.1134/S1070363214060139
Ионин Б.И. // ЖОХ. 2009. Т. 79. № 7. С. 1104;
48. Александрова А.В., Догадина А.В., Ионин Б.И. //
Svintsitskaya N.I., Aimakov O.A., Dogadina A.V.,
ЖОХ. 2005. Т. 75. № 10. С. 1743; Aleksandrova A.V.,
Ionin B.I. // Russ. J. Gen. Chem. 2009. Vol. 79. N 7.
Dogadina A.V., Ionin B.I. // Russ. J. Gen. Chem. 2005.
P. 1461. doi 10.1134/S1070363209070093
Vol. 75. N 10. P. 1664. doi 10.1007/s11176-005-0484-7
53. Svintsitskaya N.I., Dogadina A.V. Trifonov R.E. //
49. Erkhitueva E.B., Panikorovskii T.L., Svintsitskaya N.I.,
Synlett. 2016. Vol. 27. P. 241. doi 10.1055/s-0035-
Dogadina A.V., Trifonov R.E. // Synlett. 2018. Vol. 29.
1560505
P. 933. doi 10.1055/s-0036-1591919
50. Алексеева К.Д., Свинцицкая Н.И., Догадина А.В. //
54. Krylov A.S., Petrosian A.A., Piterskaya J.L., Svintsits-
ЖОХ. 2019. Т. 89. № 10. С. 1626; Alekseeva K.D.,
kaya N.I., Dogadina A.V. // Beilstein J. Org. Chem.
Svintsitskaya N.I., Dogadina A.V. // Russ. J. Gen. Chem.
2019. Vol. 15. P. 1563. doi 10.3762/bjoc.15.159
Synthesis of Symmetrical
N-(Het)aryl-C-Phosphonoacetamidines
A. G. Zavyalovaa, E. B. Erkhituevab, N. I. Svintsitskayaa, *, and A.V. Dogadinaa
a St. Petersburg State Institute of Technology (Technical University), Moskovskii pr. 26, St. Petersburg, 190013 Russia
*e-mail: nsvincickaya@mail.ru
b St. Petersburg State University, St. Petersburg, Russia
Received August 6, 2019; revised August 6, 2019; accepted August 10, 2019
A series of new symmetrical C-phosphonylated acetamidines was obtained by the reaction of diethyl chloro-
ethynylphosphosphonate with a number of primary aromatic and heteroaromatic amines.
Keywords: symmetrical phosphorus-containing amidines, C-phosphonylated acetamidines, primary aromatic
amines
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019