ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 12, с. 1885-1894
УДК 547.796.1:541.118:541.49
НОВЫЙ ТЕТРАЗОЛЬНЫЙ ТРИПОДАЛЬНЫЙ ЛИГАНД
НА ТРИФЕНИЛФОСФИНОКСИДНОЙ ПЛАТФОРМЕ
© 2019 г. О. В. Быховская, А. Г. Матвеева*, М. П. Пасечник, А. В. Вологжанина,
С. В. Матвеев, И. Ю. Кудрявцев, Т. В. Баулина, В. К. Брель
Институт элементоорганических соединений имени А. Н. Несмеянова Российской академии наук,
ул. Вавилова 28, Москва, 119991 Россия
*e-mail: matveeva@ineos.ac.ru
Поступило в Редакцию 7 августа 2019 г.
После доработки 7 августа 2019 г.
Принято к печати 15 августа 2019 г.
Синтезирован новый тетразольный триподальный лиганд - трис[2-(тетразол-5-илметокси)фенил]фос-
финоксид. Его строение в кристалле и растворах установлено методами рентгеноструктурного анализа,
колебательной и мультиядерной (1H, 13C, 31P) ЯМР спектроскопии. Координационные свойства поли-
дентатного лиганда исследованы на примере комплексообразования с лантаном(III).
Ключевые слова: тетразольные триподальные лиганды, трис[2-(тетразол-5-илметокси)фенил]фосфи-
ноксид, комплексы La(III)
DOI: 10.1134/S0044460X19120126
Тетразольный фрагмент как функциональная
[1-4]. Тетразолатные лиганды успешно применя-
группа играет все более важную роль в коорди-
ются в координационных соединениях с d- и f-э-
национной и медицинской химии, а также в раз-
лементами для активации люминесценции с помо-
личных приложениях материаловедения, включая
щью эффекта антенны, что представляет интерес
координационные полимеры, люминесцентные
при создании светоизлучающих материалов [1-4].
устройства и спин-кроссоверы [1-5]. Так, напри-
Среди множества политопных тетразольных
мер, 5-замещенная-1H-тетразолатная группа часто
лигандов известно всего несколько примеров три-
используется в качестве устойчивой к метаболиз-
подальных лигандов с разнообразными каркасами,
му биоизостерической замены карбоксильной
содержащими тетразольные циклы в подвесках
группы в синтезах аналогов в лекарственной хи-
[1, 2]. Установлено, что эти соединения образуют
мии. Многие производные тетразола и их комплек-
прочные комплексы с катионами d- и f-элементов.
сы с металлами обладают выраженной биологиче-
Среди них найдены соединения, формирующие
ской активностью [6]. Поэтому изучение структур
координационные полимеры с разнообразными
тетразолов имеет отношение к нескольким аспек-
полезными свойствами [1]. Комплексы с Fe(II)
там как координационной, так и медицинской хи-
демонстрируют свойства спин-кроссоверов, а
мии из-за возрастающей важности лекарственных
комплексы с лантанидами известны как многообе-
препаратов на основе металлов. В последние годы
щающие контрастные реагенты для магниторезо-
в исследовании координационных соединений
нансной томографии и катализа [2, 7, 8].
тетразола был достигнут значительный прогресс
Продолжая наши исследования по созданию
благодаря возможности их применения в различ-
триподальных лигандов на платформе трифенил-
ных областях. Они используются при создании
фосфинокисида [9, 10], мы синтезировали новый
катализаторов, функциональных полимеров с за-
триподальный лиганд, содержащий в подвесках
данными свойствами, а также люминесцентных,
тетразольные фрагменты, и исследовали его коор-
электропроводящих и магнитных материалов
динационные свойства.
1885
1886
БЫХОВСКАЯ и др.
Схема 1.
N
N
N
N
N
N
N
NH
HN
N
O
O
O
O
O
O
Cl
NaN3, NH4
P
P
ȾɆɎȺ, 125oC
H
O
O
N
N
N N
N
H3L
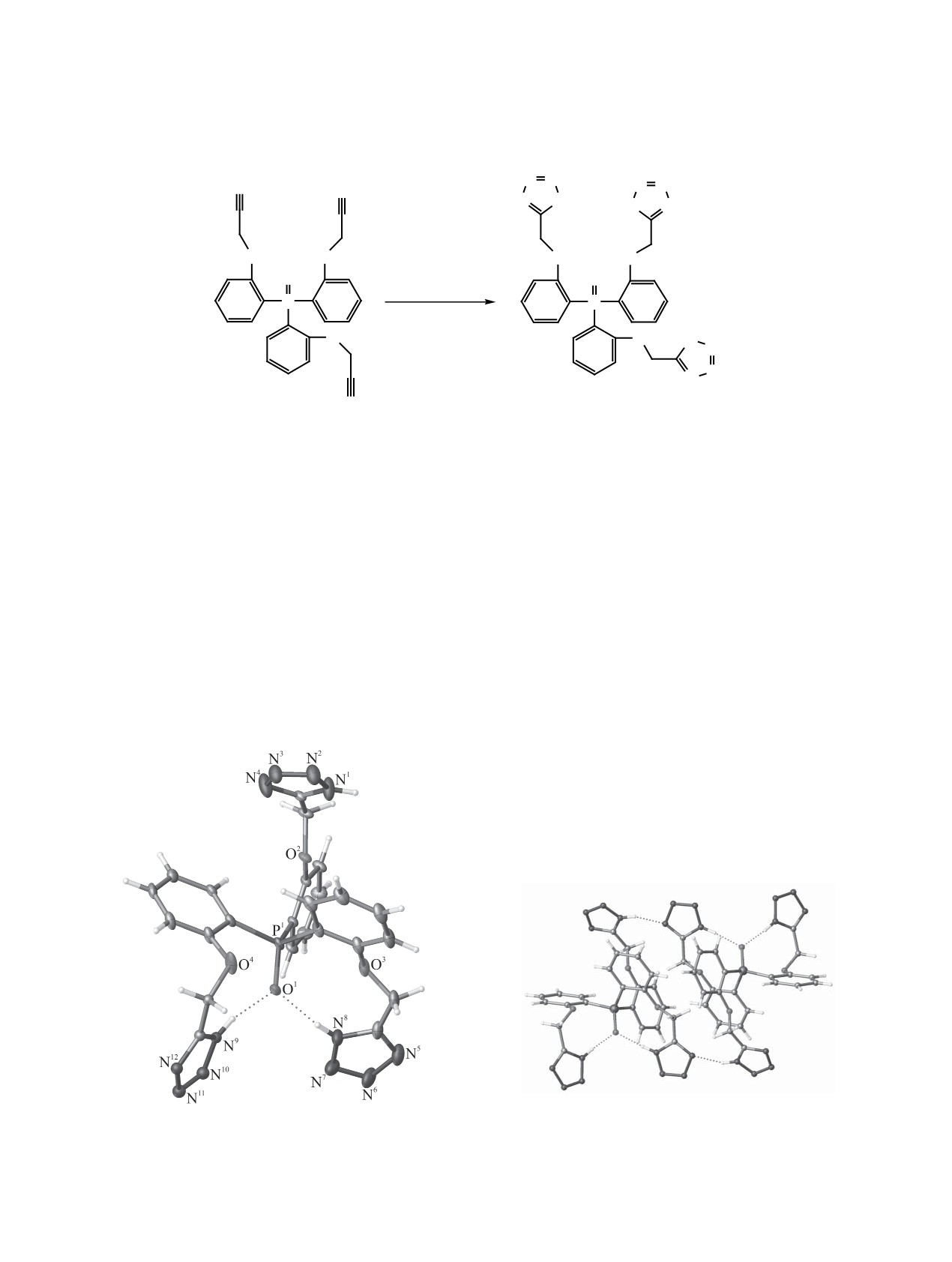
Тетразольный лиганд Н3L был синтезирован по
(рис. 1). Длины валентных связей обычные, углы
известной методике [11, 12] взаимодействием со-
стандартные. Конформация соединения опреде-
ответствующего цианпроизводного [13] с азидом
ляется наличием двух внутримолекулярных водо-
аммония, полученного, в свою очередь, in vitro из
родных связей. В данном соединении два из трех
азида натрия и хлорида аммония (схема 1).
гетероциклов образуют водородные связи N-H···О
[r(N···O) = 2.618(1)-2.763(2) Å, угол NHO = 164-
Лиганд Н3L выделен в виде белого мелкокри-
167°] с двумя неподеленными электронными па-
сталлического порошкообразного вещества, хо-
рами фосфорильной группы. В результате атомы
рошо растворимого в ДМФА и ДМСО и умерен-
кислорода О1, О3 и О4 оказываются по одну сто-
но растворимого в МеОН, EtOH и воде. Состав и
рону от плоскости, образованной тремя атомами
строение полученного соединения подтверждены
углерода, связанными с атомом Р1. Третий гетеро-
данными элементного анализа, ИК, КР и ЯМР (1Н,
цикл в образовании внутримолекулярных связей
13С и 31Р) спектроскопии.
не участвует, однако образует межмолекулярную
Молекулярное строение лиганда Н3L уста-
водородную связь N-H···N [r(N···N) = 2.845(1) Å,
новлено методом рентгеноструктурного анализа
угол NHN = 161°) с одним из атомов азота гете-
роцикла, что приводит к образованию водород-
но-связанных димеров (рис. 2). При этом атом
кислорода О2 и гетероцикл, благодаря возможно-
сти свободного вращения фенильных колец отно-
сительно связей Р-С, оказываются развернуты по
отношению к фосфорильной группе.
Рис. 2. Внутри- и межмолекулярные водородные связи
Рис. 1. Общий вид молекулы лиганда Н3L в кристалле.
в димере соединения Н3L (изображены пунктиром).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
НОВЫЙ ТЕТР
АЗОЛЬНЫЙ ТРИПОДАЛЬНЫЙ ЛИГАНД
1887
Таблица 1. Избранные данные ИК спектроскопии (см-1) для соединений H3L и 1 в твердом состоянии и растворах
Соединение
Образец
ν(P=O)
Колебания тетразольных колец
ν(NH), ν(ОH)
H3L
Кристаллический
1098
1561, 1211
~2700
Раствор в ДМСО-d6
1154
1562, 1221
~3300, ~2100
1
Твердый
1125
1575, 1414, 1221
~3250
Раствор в ДМСО-d6
1129
1571, 1408, 1223
~3400а
Раствор в CD3OD
-б
1571, 1560, 1416, 1221
~3350а
а Широкая интенсивная полоса воды в растворителе.
б Полоса свободной группы P=O отсутствует. Область поглощения координированной группы P=O закрыта поглощением CD3OD.
См. текст.
Образование конформации с согласованной
наблюдаются полосы при
1561 и
1211 см-1.
ориентацией трех тетразольных заместителей и
Валентные колебания ν(NH) проявляются в виде
фосфорильной группы для координации с катио-
широкой неразрешенной полосы с максимумом при
ном металла также легко может быть достигнуто
~2700 см-1, что характерно для NH групп, обра-
при свободном вращении фенильных колец.
зующих водородные связи [15]. По данным РСА,
атом кислорода фосфорильной группы образует
Исследование способа координации лиган-
бифуркатную внутримолекулярную водородную
да и строения его лантанового комплекса в твер-
связь с протонами двух тетразольных циклов, а
дом состоянии и растворах проводили методом
атом азота одного из связанных циклов - межмо-
ИК и ЯМР спектроскопии. Колебательные спек-
лекулярную водородную связь с протоном сво-
тры лиганда Н3L и его лантанового комплек-
бодного тетразольного цикла соседней молекулы.
са 1 были интерпретированы в соответствии с
В ИК спектре кристаллического образца полоса
расчетом частот и форм нормальных колебаний
ν(Р=О) наблюдается при 1098 см-1. Близкое значе-
5-замещенных тетразолов [14] и родственного
ние частоты ν(Р=О) фосфорильной группы имеют
триподального лиганда на трифенилфосфинок-
триол (HOCH2CH2CH2)3PO [16] и фосфиноксид
сидной платформе
(2-Bu2NC(O)CH2OC6H4)3PO
(2-HOC6H4)3P=O [17], образующие трифуркатную
[9]. Согласно анализу колебаний 5-метил-заме-
внутримолекулярную водородную связь.
щенного тетразола [14], в области 1580-1560 см-1
проявляются смешанные колебания ν(C=N) и
В спектре раствора лиганда в ДМСО-d6 полоса
ν(C=C); в области 1440-1410 см-1 проявляются эти
группы P=O, образующей бифуркатную Н-связь,
же колебания, смешанные с деформационными
отсутствует и появляется полоса при 1154 см-1,
колебаниями δ(CH). В области 1250-1260 см-1
которая может быть отнесена к колебанию фос-
регистрируются колебания ν(C-N) и ν(C-C), сме-
форильной группы, образующей одну водород-
шанные с колебаниями δ(NH); в области 1100-
ную связь, как, например, в фосфорилалканолах
1040 см-1 наблюдаются неплоские деформацион-
Ph2P(O)(CR2)nCH2CH(OH)Me (n = 0, 1; R = H, Me)
ные колебания связей NH. В этих же областях про-
[18]. Широкие полосы при ~3300 и ~2100 см-1 со-
являются колебания фенильных фрагментов (1500-
ответствуют колебаниям свободных и участвую-
1600 см-1) и смешанные колебания ν(C-O-C),
щих в образовании внутримолекулярной Н-связи
содержащие некоторый вклад ν(P=O)
(1260-
групп NH [15].
1230 см-1) [9]. Наложение полос существенно за-
ИК спектры раствора Н3L в CD3OD не реги-
трудняет анализ колебательных спектров.
стрировали из-за низкой растворимости лиганда
В спектре КР кристаллического образца Н3L
наряду с сильным поглощением растворителя..
колебания, характеризующие тетразольный цикл,
В спектре ЯМР 1Н раствора соединения Н3L в
не определяются, видимо, из-за наложения по-
ДМСО-d6 в области 7.25-7.60 м. д. присутствуют
лос других колебаний. В ИК спектре (табл. 1)
сигналы различной мультиплетности, принадле-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1888
БЫХОВСКАЯ и др.
Схема 2.
3
3
2
2
3
2
N
N
N NH
N N
4
4
+
4N NH
H+
N N
N
N
1
1
1
5
5
5
R
R
R
жащие фенильным протонам трифенилфосфинок-
Спектры ЯМР раствора лиганда Н3L в CD3OD
сидной платформы, и синглетный сигнал с хими-
(0.01 М.) в общих чертах близки к вышеописан-
ческим сдвигом 5.37 м. д., соответствующий ме-
ным (см. табл. 2). Повышенное значение величины
тиленовым протонам. Интенсивность сигналов со-
δP (32.0 м. д.) объясняется сольватацией P=O груп-
гласуется с предлагаемой структурой. Ожидаемый
пы за счет образования Н-связей.
сигнал протона N-H группы в спектре не прояв-
Благодаря присутствию трех 1H-тетразольных
ляется, что, впрочем, довольно частое явление для
фрагментов лиганд H3L является трехосновной
спектров тетразолов. Как известно, кислотность
кислотой, и его строение благоприятно для обра-
5-замещенных 1H-тетразолов, определяемая дис-
зования нейтральных комплексов с трехзарядны-
социацией протона N-H группы, близка к кислот-
ми катионами d- и f-элементов. Стратегия синтеза
ности карбоновых кислот, и в растворах существу-
нейтрального комплекса в данном случае опреде-
ет равновесие 1H- и 2H-таутомерных форм [19, 20]
лялась его ожидаемой растворимостью. В пред-
(схема 2). Это приводит к значительному ушире-
положении высокой растворимости комплекса в
нию сигнала протона N-H группы.
растворителях, способных сольватировать за счет
В спектре ЯМР 13С (табл. 2) наряду с сиг-
образования Н-связей, средой для проведения ре-
налами углеродных атомов фенильных колец
акции мы выбрали абсолютный этанол, для полу-
и сигналом углерода СН2О-группы в слабом
чения аниона лиганда использовали трет-бутилат
поле регистрируется сигнал (δC = 153.9 м. д.),
калия, а в качестве соли лантанида - LaCl3·7H2O
относящийся к атому углерода тетразоль-
(схема 3). Хлорид лантана выбран по двум причи-
ного цикла. В спектре ЯМР
31Р{1H} при
нам. Во-первых, образующийся в результате реак-
29.4 м.д. присутствует синглетный сигнал в обла-
ции KCl плохо растворим в абсолютном этаноле
сти, характерной для замещенных триарилфосфи-
(0.0064 м. [21]). Во-вторых, комплексы лантана в
ноксидов (табл. 2). Значение δP несколько выше
отличие от комплексов большинства лантанидов
ожидаемого, по-видимому, вследствие образова-
непарамагнитны, что позволяет при их исследова-
ния связи P=O···H-N, что согласуется с данными
нии успешно использовать спектроскопию ЯМР.
ИК спектроскопии. Отметим, что величины δP
Схема 3.
родственных триподальных лигандов на трифе-
LaCl3
нилфосфиноксидной платформе, в которых P=O
H3L + 3t-BuOK
LaL + KClp
EtOH
группа свободна, не превышают 24-25 м. д. [10].
Таблица 2. Избранные данные спектроскопии ЯМР для лиганда H3L и его комплекса 1 в растворах
Соединение
Растворитель
δP (W1/2)a, м. д.
δH(OCH2) , м. д.
δC(C2Ar)б, м. д.
δC(C5), м. д.
δC(OCH2), м. д.
H3L
ДМСО-d6
29.4
(0.02)
5.37
159.71
153.92
60.89
CD3OD
32.0
(0.02)
5.37
159.48
153.39
59.97
1
ДМСО-d6
28.7
(0.3)
4.99
157.60
161.13
63.39
CD3OD
32.4
(0.6)
5.1 (уш.)
157.37
160.00
61.64
a Полуширина сигнала, м. д.
б Атом С2 арильного кольца.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
НОВЫЙ ТЕТР
АЗОЛЬНЫЙ ТРИПОДАЛЬНЫЙ ЛИГАНД
1889
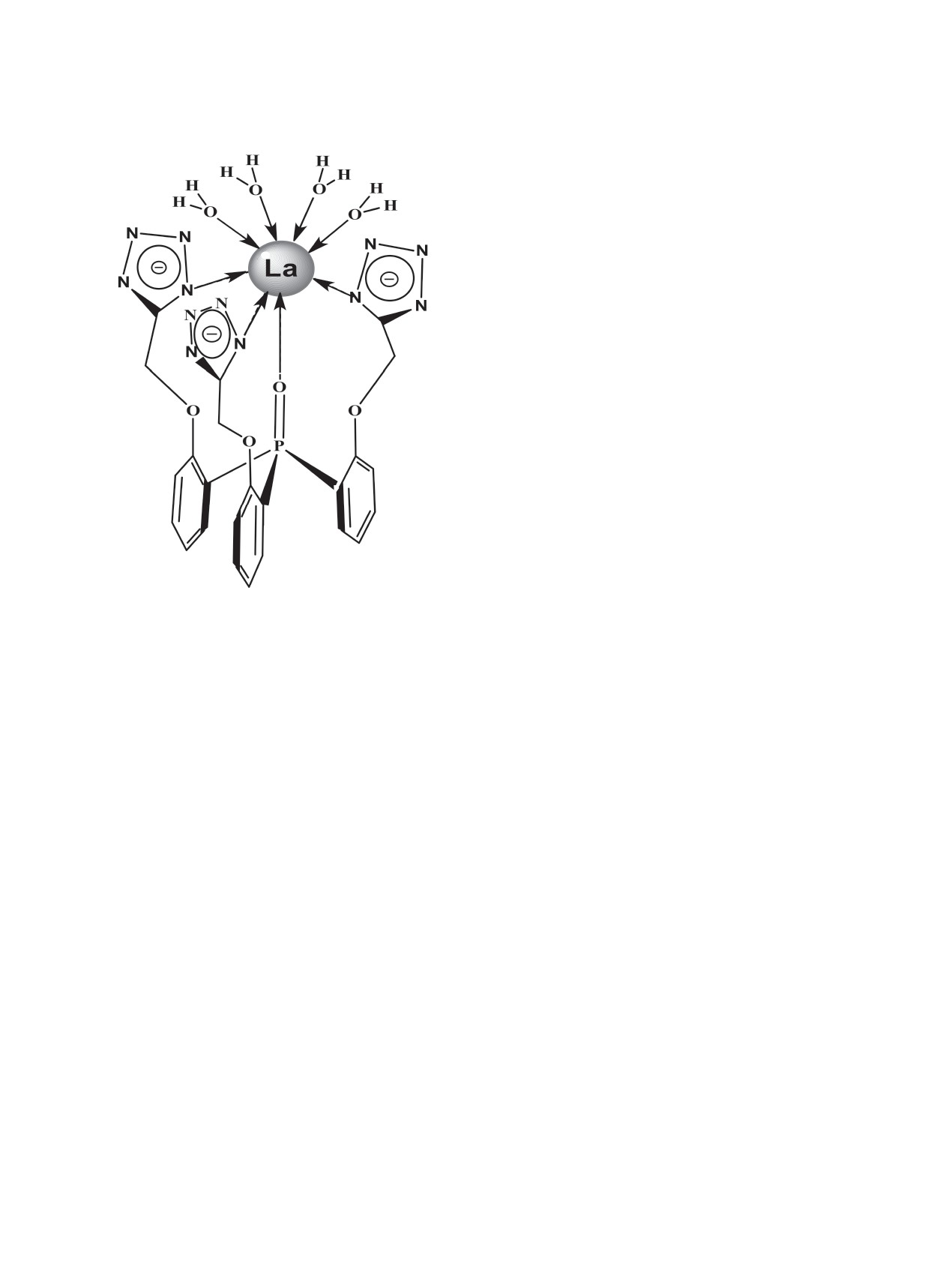
Комплекс LaL(H2O)4(EtOH) 1 был выделен в
ложить, что соединение 1 является нейтральным
виде белого порошкообразного вещества, хорошо
моноядерным комплексом
[LaL(H2O)4]·(EtOH).
растворимого в спиртах и ДМСО и практически
Тетразолатный анион L3- проявляет тетраден-
нерастворимого в ацетонитриле. Состав комплек-
татную координацию, благодаря образованию
са установлен на основании данных элементного
связей с тремя атомами азота N1 тетразолатных
анализа, ИК и ЯМР спектров.
фрагментов и атомом кислорода P=O группы.
Координационную сферу дополняют 4 молекулы
В ИК спектре твердого комплекса при 1125 см-1
воды. Координационное число лантана равно 8.
наблюдается полоса, которая может быть отнесена
Во второй координационной сфере присутствует
к колебанию ν(P=O) координированной фосфо-
молекула спирта. Очевидно, что не участвующие
рильной группы. Близкую частоту (1121-1125 см-1)
в координации атомы азота тетразолатных фраг-
имеют лантановые комплексы родственных три-
ментов и атомы водорода молекул воды будут об-
подальных лигандов (2-R2NC(O)CH2OC6H4)3P(O)
разовывать множество связей N···H-O с соседни-
(R = Me, Bu, cyclo-C6H11) [10]. Менее показательны
ми молекулами в твердом комплексе. В полярных
изменения полос тетразолатных циклов (табл. 1).
растворителях, способных сольватировать за счет
Однако важно отметить, что в спектре появляет-
Н-связей, комплекс будет хорошо растворим (ме-
ся полоса при 1414 см-1, которая отсутствовала в
танол, этанол, отчасти вода) и плохо растворим,
спектре лиганда. Вместе с тем аналогичная полоса
либо нерастворим, в апротонных диполярных
типична для других родственных тетразолатных
растворителях (ацетонитрил). Полярный высокоо-
комплексов (см. например, [22, 23]). В области ко-
сновный ДМСО, являющийся акцептором прото-
лебаний ν(OH) при 3250 см-1 имеется широкая по-
нов, также будет хорошо растворять комплекс.
лоса, которая может быть отнесена к колебаниям
воды [23], что согласуется с данными элементного
Строение комплекса 1 в растворах было ис-
анализа. Сложность спектра в области колебаний
следовано методами ИК и мультиядерной ЯМР
тетразолатных циклов и наложение полос не по-
спектроскопии. В качестве растворителей были
зволяют судить о том, сколько циклов координиро-
выбраны ДМСО-d6 и CD3OD, где хорошая рас-
ваны и каким именно атомом азота.
творимость комплекса позволяла использовать ИК
спектроскопию для установления координации
Известно, что в моноядерных комплексах 5-за-
P=O группы.
мещенный тетразолатный цикл чаще всего связан
с катионом металла через атом N1, либо атом N2
В ИК спектре раствора комплекса в ДМСО-d6
[1]. В кристаллах комплексов лантанидов с тет-
полоса ν(P=O) наблюдается при 1129 см-1, что со-
разолатными лигандами линейной структуры об-
ответствует, как и в спектре твердого комплекса,
наружены и другие типы координации [2]. Однако
координированной P=O группе (табл. 1). В спектре
по данным РСА, известные на сегодняшний день
метанольного раствора эта область закрыта погло-
кристаллические комплексы лантанидов с разно-
щением растворителя, но можно видеть, что по-
образными триподальными тетразолатными ли-
лоса свободной P=O группы отсутствует. Полосы
гандами являются моноядерными, в координации
цикла аналогичны полосам в спектре твердого
с металлом участвуют атомы N1 всех трех циклов,
комплекса (см. табл. 1). Часть координационной
а координационную сферу могут дополнять моле-
воды уходит в растворитель. Следовательно, мож-
кулы растворителя так, чтобы координационное
но полагать, что координация аниона L3- в раство-
ре и твердом комплексе одинакова.
число лантанида составляло 8 или 9 [2]. Во вто-
рой координационной сфере часто присутствуют
Данные ЯМР спектров для растворов лиганда
молекулы растворителя, а в кристалле наблюдает-
и комплекса приведены в табл. 2. При координа-
ся сеть Н-связей с участием некоординированных
ции P=O группы лиганда к катиону лантанида
атомов тетразолатных циклов [2-4]. Отметим, что
сигнал δP в спектре комплекса обычно сдвигается
N1-координация стерически предпочтительна для
в слабое поле. Например, в спектрах лантановых
аниона синтезированного триподального лиган-
комплексов родственных лигандов [2-R2NC(O)·
да L3-, как это видно из строения его молекулы
CH2OC6H4]3P(O), где R = Me, Bu, cyclo-C6H11,
(рис. 1). Суммируя вышесказанное, можно предпо-
сигнал атома фосфора регистрируется при 31.4-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1890
БЫХОВСКАЯ и др.
ет исключить из рассмотрения возможное изомер-
ное равновесие для наших экспериментальных ус-
ловий. Участие тетразолатного фрагмента в коор-
динации проявляется в спектрах ЯМР 13C сдвигом
сигналов C5 кольца (ΔδC ~ 7 м. д.) в типичную для
N1-тетразолатных комплексов область ~ 160 м. д.
Соответствующие сдвиги претерпевают сигналы
атомов углерода C2Ar и OCH2-групп (см. табл. 2).
Сигналы других ароматических атомов углерода
почти не меняются. Данные ИК и ЯМР спектров
растворов согласуются между собой.
Совокупность наших и литературных дан-
ных позволяет предположить, что в растворах
обоих растворителей комплекс 1 является ней-
тральным моноядерным и лиганд в нем прояв-
ляет тетрадентатную O,N1,N1,N1-координацию.
Координационная сфера катиона дополнена че-
тырьмя молекулами воды, координационное число
лантана - 8 (рис. 3).
Таким образом, нами синтезирован первый
тетразольный триподальный лиганд на трифе-
нилфосфиноксидной платформе и его нейтраль-
Рис. 3. Визуализация пространственного строения ком-
ный тетразолатный комплекс с катионом лантана.
плекса 1 в растворах согласно спектральным данным.
Методом РСА установлено молекулярное и кри-
32.0 м. д., а сигнал свободного лиганда - при
сталлическое строение лиганда. Строение обоих
соединений в растворах исследовано методами
24.0-24.8 м. д. [10]. Соответствующий сигнал
комплекса 1, свидетельствующий о координации
колебательной и ЯМР спектроскопии. Оба сое-
P=O группы, наблюдается при 28.7 и 32.4 м. д. в
динения растворимы в спиртах, ДМСО, незначи-
тельно в воде, что представляет интерес для воз-
ДМСО-d6 и CD3OD соответственно. Различия в
значениях δP соединений H3L и 1 практически нет
можного применения в биомедицине, катализе.
из-за образования внутри- и межмолекулярных
Синтезированный лиганд может служить основой
связей P=O···H-N и P=O···H-O в растворах сво-
для получения разнообразных комплексных сое-
бодного лиганда.
динений с d- и f-элементами.
Спектры ЯМР 1H малоинформативны. В спек-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
трах обоих растворов сигналы ароматических про-
тонов несколько уширены и сдвигаются незначи-
Органические растворители марки ХЧ обезво-
тельно. Сигнал протонов OCH2 групп сдвигается
живали и очищали по стандартным методикам
в сильное поле на ~0.3 м. д., по-видимому, отвечая
[28]. Дейтерированные растворители CD3OD и
на координацию тетразолатных циклов (табл. 2).
ДМСО-d6 (Acros) использовали без дополнитель-
ной очистки. Соли LaCl3·7H2O (Sigma-Aldrich),
Известно, что спектры ЯМР 13C комплексов
t-BuOK (Acros), азид натрия (Acros), NH4Cl (ХЧ)
тетразолатных лигандов часто демонстрируют
использовали без дополнительной очистки.
увеличение числа сигналов либо их значительное
уширение для каждого отдельного типа атомов,
ИК спектры получены на ИК Фурье-спектро-
что объясняется равновесием координационных
метре Bruker Tensor 37 для твердых образцов (KBr,
изомеров, где тетразолатный лиганд связан с ме-
суспензия в нуйоле) в диапазоне 4000-400 см-1,
таллом через N1 или N2 атом [24-27]. Сигналы в
для 0.03 M. растворов в ДМСО-d6 в диапазоне
спектрах ЯМР 13C комплекса 1 узкие, что позволя-
4000-900 см-1 [толщина кювет (CaF2) - 0.062 мм],
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
НОВЫЙ ТЕТР
АЗОЛЬНЫЙ ТРИПОДАЛЬНЫЙ ЛИГАНД
1891
для 0.1 М. растворов в CD3OD в диапазоне 4000-
подвижное масло
- закристаллизовывали с
900 см-1 [толщина кювет (CaF2) - 0.024 мм].
эфиром. Осадок перекристаллизовывали из МеОН
Спектры КР в области 3500-100 см-1 зарегистри-
и сушили в вакууме (1-2 мм рт. ст.) над P2O5
рованы на спектрометре Jobin-Yvon LabRAM
при 60°С. Кристаллы, пригодные для РСА, были
300, снабженном микроскопом и лазерным ССD-
получены перекристаллизацией из этанола. Выход
детектором. В качестве возбуждающей линии ис-
0.38 г (67%), т. пл. 248-250°С (разл.) (MeOH). ИК
пользована линия He-Ne-лазера с длиной волны
спектр, ν, см-1: 2700 ср, ш, 1592 о. с, 1578 с, 1561
632.8 нм и мощностью не более 2 мВт.
пл., 1477 о. с, 1444 о. с, 1388 ср, 1280 о. с, 1249
ср, 1236 ср, 1211 с, 1164 ср, 1142 с, 1116 ср, 1098
Спектры ЯМР 1Н, 13С{1Н} и 31P{1Н} растворов
пл, 1089 с, 1050 с, 1040 с, 1027 пл, 1009 ср, 925
синтезированных соединений в ДМСО-d6
сл, 853 сл, 802 пл, 764 с, 750 ср, 730 с, 720 с, 698
(0.03 М.) и CD3OD (0.01 и 0.1 М.) регистрировали
ср, 587 сл, 577 сл, 563 ср, 552 ср, 532 ср, 514 ср,
на приборе Bruker Avance 500. Рабочие частоты
487 ср, 450 сл, 429 сл. Спектр КР, ν, см-1: 3181 о.
1Н,
13С и
31P составляли
500.13,
125.77 и
сл, 3145 о. сл, 3095 пл, 3064 с, 2971 сл, 2943 о. сл,
242.97 МГц соответственно. В спектрах ЯМР 1Н и
2920 о. сл, 2893 о. сл, 2870 о. сл, 2586 о. сл, 1592
13С сигналы остаточных протонов и атомов углерода
с, 1573 ср, 1474 о. сл, 1445 о. сл, 1389 о. сл, 1339
растворителя использованы в качестве внутренних
сл, 1278 сл, 1248 ср, 1212 ср, 1165 ср, 1144 ср, 1099
стандартов, точность определения химических
ср, 1050 оч. с, 1014 сл, 855 сл, 799 сл, 700 сл, 663
сдвигов не менее 0.01 и 0.03 м. д. соответственно.
оч. с, 588 о. сл, 374 сл, 355 сл, 237 ср. Спектр ЯМР
Значения химических сдвигов в спектрах ЯМР
1Н (ДМСО-d6, 0.03 М.), δ, м. д. (J, Гц): 5.37 уш.
31P получены относительно внешнего стандарта
с (6Н, СН2О), 6.95 т (3Н, Н5, 3JHH = 6.8 Гц), 7.25
85%-ной H3PO4. Для отнесения сигналов в
д. д (3Н, Н6, 3JHH = 7.0, 3JPH = 14.6 Гц), 7.32 д. д
спектрах ЯМР 1Н и 13С применены двумерные
(3Н, Н3, 3JHH = 7.9, 4JPH = 5.6 Гц), 7.60 т (3Н, Н4,
гетероядерные (1Н-13С и 1H-15N) корреляционные
3JHH = 8.4 Гц). Спектр ЯМР 1Н (CD3OD, 0.01 М.),
методики из стандартной библиотеки программ
δ, м. д.: 5.37 с (6Н, СН2О), 6.99 т. д (3Н, Н5, 3JHH =
фирмы Bruker с использованием импульсных
7.5, 4JPH = 2.0 Гц), 7.25 д. д (3Н, Н3, 3JHH =
полевых градиентов gs-HSQC и gs-HMBC.
8.3, 4JPH = 5.8 Гц), 7.34 д. д. д (3Н, Н6, 3JHH =
Температуры плавления измерены укорочен-
9.0, 3JPH = 15.0, 4JHH = 1.5 Гц), 7.58 т (3Н, Н4, 3JHH =
ными термометрами Аншютца в специальном
7.8 Гц). Спектр ЯМР 13С (ДМСО-d6, 0.03 М.), δС,
блоке с использованием капилляров. Содержание
м. д.: 60.89 (СН2О), 114.50 д (С3, 3JPС = 6.1 Гц),
С, H, N определено на приборе Carlo Erba
119.48 д ( С1, 1JPС = 111.2 Гц), 122.35 д (С5, 3JPС =
1106, содержание P в соответствии с известной
12.5 Гц), 133.95 д (С6, 2JPС = 9.0 Гц), 134.90 (С4),
методикой [29].
153.92 (С=N), 159.71 д (С2, 2JPС = 1.8 Гц). Спектр
Трис(2-цианометоксифенил)фосфиноксид син-
ЯМР 13С (CD3OD, 0.01 М.), δС, м. д.: 59.97 (СН2О),
тезирован по известной методике [13].
113.00 д (С3, 3JPС = 7.5 Гц), 118.70 д ( С1, 1JPС =
Трис[2-(тетразол-5-ил-метокси)фенил]фос-
112.5 Гц), 121.92 д (С5, 3JPС = 12.5 Гц), 133.70 д (С6,
финоксид (Н3L). К раствору 0.45 г (0.001 моль)
2JPС = 8.8 Гц), 134.61 д (С4, 4JPС = 2.5 Гц), 153.39
трис(2-цианометоксифенил)фосфиноксида в 20 мл
(С=N), 159.48 д (С2, 2JPС = 2.5 Гц). Спектр ЯМР
ДМФА при комнатной температуре и интенсивном
31Р{1Н} (ДМСО-d6, 0.03 М.): δP 29.4 м. д. Спектр
перемешивании прибавляли 0.59 г (0.009 моль)
ЯМР 31Р{1Н} (CD3OD, 0.01 М.): δP 32.0 м. д. (W1/2 =
NaN3 и 0.48 г (0.009 моль) NH4Cl. Полученную
0.02 м. д.) Найдено, %: С 50.13; H 3.79; N 29.02;
суспензию выдерживали при температуре 125°С в
P 5.56. C24H21N12O4P. Вычислено, %: С 50.35; H
3.67; N 29.37; P 5.42.
течение 4 ч, охлаждали до комнатной температуры
и добавляли 30 мл воды. Полученный раствор
Комплекс [LaL(H2O)4)]EtOH (1). К раствору
подкисляли до рН 2 и экстрагировали СНСl3
0.0525 г (0.092 ммоль) лиганда Н3L и 0.0309 г
(3×15 мл). Органические фракции объеди-
(0.276 ммоль) t-BuOK в 6 мл абсолютного EtOH
няли, промывали водой
(3×15 мл) и сушили
по каплям при перемешивании прибавляли
Na2SO4. После удаления растворителя остаток -
раствор 0.0253 г (0.092 ммоль) LaCl3 7H2O в 2 мл
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1892
БЫХОВСКАЯ и др.
абсолютного EtOH, наблюдали образование
одного равновероятно разупорядоченного по двум
обильного белого осадка, выдерживали ~12 ч
позициям фрагмента CH2-CN4H. Атомы водорода
при комнатной температуре. Прозрачный раствор
найдены геометрически и уточнены в изотропном
декантировали (отделяли от осадка), проба
приближении в модели жесткого тела, с Uiso(H) =
на содержание хлорид-иона отрицательная.
1.2Ueq(Xi), где Ueq(X) - эквивалентные тепловые
Растворитель удаляли в вакууме, остаток сушили
параметры атомов, с которыми связан атом водо-
в вакууме (1-2 мм рт. ст.) над P2O5 3 ч при 70°С.
рода. Атомы азота, не участвующие в образовании
Выход 0.0538 г (70%), т. разл. > 350°С. Комплекс
водородных связей, испытывают заметное тепло-
хорошо растворим в ДМСО, метаноле, этаноле,
вое движение, поэтому тепловые параметры ато-
умеренно растворим в воде (0.25 г/100 г воды) и
мов N1, N2 и N4 были уточнены с помощью команд
практически нерастворим в MeCN. ИК спектр, ν,
ISOR и RIGU. Ячейка содержит молекулы раство-
см-1: 3250 с. ш, 1650 ср. ш, 1590 с, 1579 пл, 1575
рителя, вклад которых в интенсивности отраже-
ср, 1414 ср, 1282 с, 1248 пл, 1221 с, 1166 ср, 1142
ний был уточнен без координат атомов с помощью
с, 1125 пл, 1114 с, 1088 с, 1064 ср, 1045 с, 1009 с,
SQUEEZE/PLATON [34].
848 ср, 801 ср, 757 с, 730 ср, 720 ср, 703 ср, 589
Кристаллы соединения Н3L триклинные,
ср, 559 ср, 525 ср. Спектр ЯМР 1Н (ДМСО-d6,
C24H21N12O4P (Fw = 572.50 г/моль), простран-
0.03 М.), δ, м. д.: 4.99 уш. с (6Н, СН2О), 6.93 т
(3Н, Н5, 3JHH = 7.2 Гц), 7.32 д. д (3Н, Н6, 3JHH =
ственная группа P1¯; параметры элементарной
11.3, 3JPH = 21.4 Гц), 7.43-7.46 м (3Н, Н3), 7.51 т
ячейки при 120 K: a = 11.115(2) Å, b = 11.863(2) Å,
(3Н, Н4, 3JHH = 7.6 Гц). Спектр ЯМР 1Н (CD3OD,
c = 12.622(2) Å, α = 64.197(4)°, β = 88.391(4)°,
0.1 М.), δ, м. д.: 5.1 уш. с (6Н, СН2О), 6.8 уш. с
γ = 80.453(4)°, V = 1475.7(5) Å3, Z = 2, dвыч =
(3Н, Н5), 7.2 уш. с (6Н, Н6+ Н3), 7.5 уш. с (3Н, Н4).
1.288 г/см3, μ(MoKα) = 0.144 мм-1, измерено 20214
Спектр ЯМР 13С (ДМСО-d6, 0.03 М.), δС, м. д.:
отражений, из них 8860 независимых (Rint = 0.1012)
63.39 (СН2О), 114.80 д (С3, 3JPС = 6.2 Гц), 119.66 д
и 3601 наблюдаемых; R1(obs) = 0.0925, wR2(all) =
(С1, 1JPС = 111.2 Гц), 121.11 д (С5, 3JPС = 12.5 Гц),
0.2130, GOF = 1.063. Кристаллографические дан-
134.21 (С4), 134.29 д (С6, 2JPС = 10.0 Гц), 157.60
ные депонированы в Кембриджской базе струк-
(С2), 161.13 (С=N). Спектр ЯМР 13С (CD3OD,
турных данных (CCDC 1945599).
0.1 М.), δС, м. д.: 61.64 (СН2О), 112.91 (С3), 117.30
ФОНДОВАЯ ПОДДЕРЖКА
д (С1, 1JPС = 103.8 Гц), 121.45 д (С5, 3JPС = 13.8 Гц),
134.14 (С6), 134.52 (С4), 157.37 (С2), 160.00 (С=N).
Работа выполнена при поддержке Российского
Спектр ЯМР 31Р{1Н} (ДМСО-d6, 0.03 М.): δP
фонда фундаментальных исследований (грант
28.7 м. д. (W½ = 0.3 м. д.). Спектр ЯМР 31Р{1Н}
№ 17-03-00800). Рентгенодифракционные иссле-
(CD3OD, 0.1 М.): δP 32.4 м. д. (W½ = 0.6 м. д.).
дования, регистрация спектров ЯМР, ИК и КР
Найдено,
%: С
37.80; H
3.54; N
20.25.
проведены при поддержке Министерства науки и
C24H18N12LaO4P·4H2O· C2H5OH. Вычислено, %:
высшего образования Российской Федерации с ис-
С 37.78; H 3.90; N 20.34.
пользованием оборудования Центра исследования
Рентгеноструктурный анализ проведен на
строения молекул Института элементоорганиче-
дифрактометре Bruker APEX II, оснащенном двух-
ских соединений РАН.
координатным CCD детектором, с использовани-
ем излучения молибденового анода (λ = 0.71073 Å)
КОНФЛИКТ ИНТЕРЕСОВ
и графитового монохроматора. Поглощение
Авторы заявляют об отсутствии конфликта
учтено эмпирически по программе SADABS
интересов.
[30]. Структура решена с помощью программы
SHELXT [31], все неводородные атомы локали-
СПИСОК ЛИТЕРАТУРЫ
зованы в разностных синтезах электронной плот-
ности и уточнены по F2hkl с помощью комплексов
1. Aromí G., Barrios L.A., Roubeau O., Gamez P. // Coord.
программ SHELXL-14 [32] и OLEX2 [33] в ани-
Chem. Rev. 2011. Vol. 255. P. 485. doi 10.1016/j.
зотропном приближении за исключением атомов
ccr.2010.10.038
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
НОВЫЙ ТЕТР
АЗОЛЬНЫЙ ТРИПОДАЛЬНЫЙ ЛИГАНД
1893
2. Massi M., Stagni S., Ogden M.I. // Coord. Chem. Rev.
16. Durrell A.C., Gray H.B., Hazari N., Incarvito C.D., Liu J.,
2018. Vol. 375. P. 164. doi 10.1016/j.ccr.2017.11.017
Yan E.C.-Y. // Cryst. Growth Des. 2010. Vol. 10. N 4.
P. 1482. doi 10.1021/cg1001286
3. Гапоник П.Н., Войтехович С.В., Ивашкевич О.А. //
Усп. хим. 2006. Т. 75. № 6. С. 569; Gaponik P.N.,
17. Кудрявцев И.Ю., Баулина Т.В., Хрусталев В.Н., Пе-
Voitekhovich S.V., Ivashkevich O.A. // Russ. Chem.
тровский П.В., Пасечник М.П., Нифантьев Э.Е. //
Rev. 2006. Vol. 75. N 6. P. 507. doi 10.1070/
Докл. АН. 2013. Т. 448. № 6. С. 657. doi 10.7868/
RC2006v075n06ABEH003601
S0869565213060121; Kudryavtsev I.Yu., Baulina T.V.,
Khrustalev V.N., Petrovskii P.V., Pasechnik M.P.,
4. Popova E.A., Trifonov R.E., Ostrovskii V.A. // Arkivoc.
Nifant’ev E.E. // Doklady Chem. 2013. Vol. 448. N 2.
2012. P. 45. doi 10.3998/ark.5550190.0013.102
P. 55. doi 10.1134/S0012500813020092
5. Kusz J., Gütlich·P., Spiering H. // Top. Curr. Chem.
18. Pasechnik M.P., Matveeva A.G., Lyssenko K.A., Ay-
2004. Vol. 234. P. 129. doi 10.1007/b95415
sin R.R., Smol’yakov A.F., Zubavichus Y.V., Godovi-
6. Островский В.А., Трифонов Р.Е., Попова Е.А. // Изв.
kov I.A., Goryunov E.I. // J. Mol. Struct. 2019.
АН. Сер. хим. 2012. № 4. С. 765; Ostrovskii V.A.,
Vol. 1175. P. 874. doi 10.1016/j.molstruc.2018.08.009
Trifonov R.E., Popova E.A. // Russ. Chem. Bull. 2012.
19. Comprehensive Heterocyclic Chemistry II / Ed. R.C.
Vol. 61. N 4. P. 768. doi 10.1007/s11172-012-0108-4
Storr. Oxford: Pergamon Press, 1996. P. 621.
7. Boltjes A., Shrinidhi A., van de Kolk K., Herdtweck E.,
20. Колдобский Г.И., Островский В.А. // Усп. хим. 1994.
Dömling A. // Chem. Eur. J. 2016. Vol. 22. P. 7352. doi
Т. 63. Т 10. С. 847; Koldobskii G.I., Ostrovskii V.A. //
10.1002/chem.201600720
Russ. Chem. Rev. 1994. Vol. 63. N 10. P. 797. 10.1070/
8. Giraud M., Andreiadis E.S., Fisyuk A.S., Demadrille R.,
RC1994v063n10ABEH000119
Pécaut J., Imbert D., Mazzanti M. // Inorg. Chem. 2008.
Vol. 47. N 10. P. 3952. doi 10.1021/ic8005663
21. Li M., Constantinescu D., Wang L., Mohs A., Gmehling J. //
Ind. Eng. Chem. Res. 2010. Vol. 49. P. 4981. doi
9. Kudryavtsev I.Yu., Baulina T.V., Pasechnik M.P.,
10.1021/ie100027c
Matveev S.V., Matveeva A.G. // Phosphorus, Sulfur,
22. Mosalkova A.P., Voitekhovich S.V., Lyakhov A.S.,
Silicon, Relat. Elem. 2014. Vol. 189. N 7-8. P. 946. doi
10.1080/10426507.2014.904865
Ivashkevich L.S., Lach J., Kersting B., Gaponik P.N.,
Ivashkevich O.A. // Dalton Trans. 2013. Vol. 42. P. 2985.
10. Matveeva A.G., Kudryavtsev I.Yu., Pasechnik M.P.,
doi 10.1039/c2dt32512h
Vologzhanina AV., Baulina T.V., Vavina A.V.,
Sukat G.Ya., Matveev S.V., Godovikov I.A., Tura-
23. Mautner F.A., Gspan C., Gatterer K., Goher M.A.S.,
nov A.N., Karandashev V.K., Brel V.K. // Polyhedron.
Abu-Youssef M.A.M., Bucher E., Sitte W. // Polyhedron.
2004. Vol. 23.P. 1217. doi 10.1016/j.poly.2004.02.001
2018. Vol. 142. P. 71. doi 10.1016/j.poly.2017.12.025
24. Kreutzer P.H., Weis J.Ch., Bock H., Erbeund J.,
11. Finnegan W. G., Henry R. A., Lofquist R. // J. Am.
Chem. Soc. 1958. Vol. 80. N 15. P. 3908.
Beck W. // Chem. Ber. 1983. Vol. 116. P. 2691. doi
10.1002/cber.19831160724
12. Satzinger G. // Lieb. Ann. 1960. Vol. 638. P. 159.
25. Perfahl S., Bodtke A., Pracharova J., Kasparkova J.,
13. Кудрявцев И.Ю., Баулина Т.В., Пасечник М.П.,
Brabec V., Cuadrado J., Stürup S., Schulzke C.,
Айсин Р.Р., Матвеев С.В., Петровский П.В., Ни-
Bednarski P.J. // Inorg. Chim. Acta. 2017. Vol. 456.
фантьев Э.Е. // Изв. АН. Сер. хим. 2013. № 4.
P. 86. doi 10.1016/j.ica.2016.11.017
С. 1085; Kudryavtsev I.Yu., Baulina T.V., Pase-
26. Werrett M.V., Huff G.S., Muzzioli S., Fiorini V., Zacchini S.,
chnik M.P., Matveev S.V., Petrovskii P.V., Nifant’ev E.E. //
Skelton B.W., Maggiore A., Malicka J.M., Cocchi M.,
Russ. Chem. Bull. 2013. Vol. 62. N 4. P. 1086. doi
Gordon K.C., Stagni S., Massi M. // Dalton Trans. 2015.
10.1007/s11172-013-0146-6
Vol. 44 P. 8379. doi 10.1039/c4dt03228d
14. Матвеева Н.А., Сушко Н.И., Макаревич Н.И., Гапо-
27. Mukhopadhyay S., Lasri J., Charmier M.A.J., Guedes
ник П.Н., Ивашкевич О.А., Корень А.О.// Ж. прикл.
da Silva M.F.C., Pombeiro A.J.L. // Dalton Trans. 2007.
спектр. 1992. Т. 57. № 5-6. С. 442.
P. 5297. doi 10.1039/b709959b
15. Nakamoto K. Infrared and Raman Spectra of Inorganic
28. Armarego W.L.F., Chai C.L.L. Purification of laboratory
and Coordination Compounds. Hoboken: J. Wiley &
chemicals. New York: Elsevier, 2009. P. 743. doi
Sons, Inc., 2009. 408 p.
10.1134/S0044460X1809024X
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1894
БЫХОВСКАЯ и др.
29. Гельман Н.Е., Терентьева Е.А., Шанина Т.М., Кипа-
32. Sheldrick G.M. // Acta Crystallogr. (C). 2015. Vol. 71.
ренко Л.М. Методы количественного органического
N 1. P. 3. doi 10.1107/S2053229614024218
элементного микроанализа. М.: Химия, 1987. 296 с.
33. Dolomanov O. V., Bourhis L.J., Gildea R.J., Ho-
30. Sheldrick G.M., SADABS, Program for empirical X-ray
ward J.A.K., Puschman H. // J. Appl. Cryst. 2009.
absorption correction. Bruker-Nonius, 1990-2004.
Vol. 42. N 2. P. 339. doi 10.1107/S0021889808042726
31. Sheldrick G.M. // Acta Crystalogr. (A). 2015. Vol. 71.
34. Spek A.L. // Acta Crystallogr. (C). 2015. Vol. 71. N 1.
N 1. P. 3. doi 10.1107/S2053273314026370
P. 9. doi 10.1107/S2053229614024929
Triphenylphosphine Oxide
Based New Tetrazole Tripodal Ligand
O. V. Bykhovskaya, A. G. Matveeva*, M. P. Pasechnik, A. V. Vologzhanina,
S. V. Matveev, I. Yu. Kudryavtsev, T. V. Baulina, and V. K. Brel
Nesmeyanov Institute of Organoelement Compounds of the Russian Academy of Sciences,
ul. Vavilova 28, Moscow, 119991 Russia
*e-mail: matveeva@ineos.ac.ru
Received August 7, 2019; revised August 7, 2019; accepted August 15, 2019
A new tetrazole tripodal ligand, tris[2-tetrazol-5-ylmethoxy)phenyl]phosphine oxide, was obtained. Its structure
in crystal and solutions was established by X-ray crystallography, IR, Raman and multinuclear (1H, 13C, 31P)
NMR spectroscopy. Coordination properties of the polydentate ligand were studied by the example of com-
plexation with lanthanum(III).
Keywords: tetrazole tripodal ligands, tris[2-tetrazol-5-ylmethoxy)phenyl]phosphine oxide, La(III) complex
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019