ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 12, с. 1915-1924
УДК 543.054.2/.9;543.421/.422
СИНТЕЗ, ТРАНСПОРТНЫЕ И ИОНОФОРНЫЕ
СВОЙСТВА α,ω-ДИФОСФОРИЛИРОВАННЫХ
АЗАПОДАНДОВ: XII.1 МЕМБРАННЫЙ
ТРАНСПОРТ ОРГАНИЧЕСКИХ КИСЛОТ
ДИФОСФОРИЛИРОВАННЫМИ ДИАМИНАМИ И
ДИАЗАПОДАНДАМИ
© 2019 г. Н. В. Давлетшина*, И. Р. Насыров, А. Р. Хабибуллина, Р. Р. Давлетшин,
А. З. Гайнуллин, Р. А. Черкасов
Казанский федеральный университет, ул. Кремлевская 18, Казань, 420008 Россия
*e-mail: kurnosova.nataliya@yandex.ru
Поступило в Редакцию 24 мая 2019 г.
После доработки 24 мая 2019 г.
Принято к печати 30 мая 2019 г.
Изучены мембранно-транспортные свойства фосфорилированных диаминов по отношению к моно- и
полифункциональным карбоновым кислотам. Обсуждается строение переносимых Н-комплексов; в ряде
случаев обнаруживается зависимость эффективности трансмембранного переноса органических кислых
субстратов от строения мембранных переносчиков и их комплексов с последними. Оценена взаимосвязь
между величиной потока некоторых субстратов и смещением полос поглощения характеристичных
групп, а также изменением их интенсивности в ИК спектрах их комплексов с переносчиками по срав-
нению с соответствующими спектрами субстратов и переносчиков.
Ключевые слова: дифосфорилированные диамины, азаподанды, мембранная экстракция, амино-
фосфорильный переносчик
DOI: 10.1134/S0044460X19120163
Инновационные методы извлечения, сепара-
особое внимание привлекают ациклические ана-
ции и концентрирования субстратов природного и
логи краун-эфиров - поданды. К ним принад-
техногенного происхождения базируются, прежде
лежат и снабженные разнообразными по струк-
всего, на использовании технологий межфазного
туре и свойствам функциональными группами
жидкостного и мембранного транспорта, которые,
фосфорилированные поданды, проявившие себя
в свою очередь, требуют постоянного расширения
как эффективные комплексообразователи ионов
ассортимента переносчиков - комплексообразо-
металлов [2-4]. Относящиеся к этому структур-
вателей. К их числу относятся многочисленные
ному типу фосфорилированные диамины и диа-
органические производные азота и фосфора раз-
заподанды с концевыми азотсодержащими элек-
личной координации, содержащие также и раз-
тронодонорными группировками проявили себя
нообразные по структуре функциональные груп-
как эффективные комплексообразующие агенты
пы, способные связывать переносимые объекты.
по отношению к одно-, двух- и трехзарядным ио-
Среди широко используемых в экстракционных
нам металлов, а также к минеральным кислотам.
технологиях комплексообразующих реагентов
Поэтому они нашли применение в качестве жид-
костных и мембранных экстрагентов субстратов
1 Сообщение XI см. [1].
различной природы [5-7]. Ранее [8] нами были
1915
1916
ДАВЛЕТШИНА и др.
Схема 1.
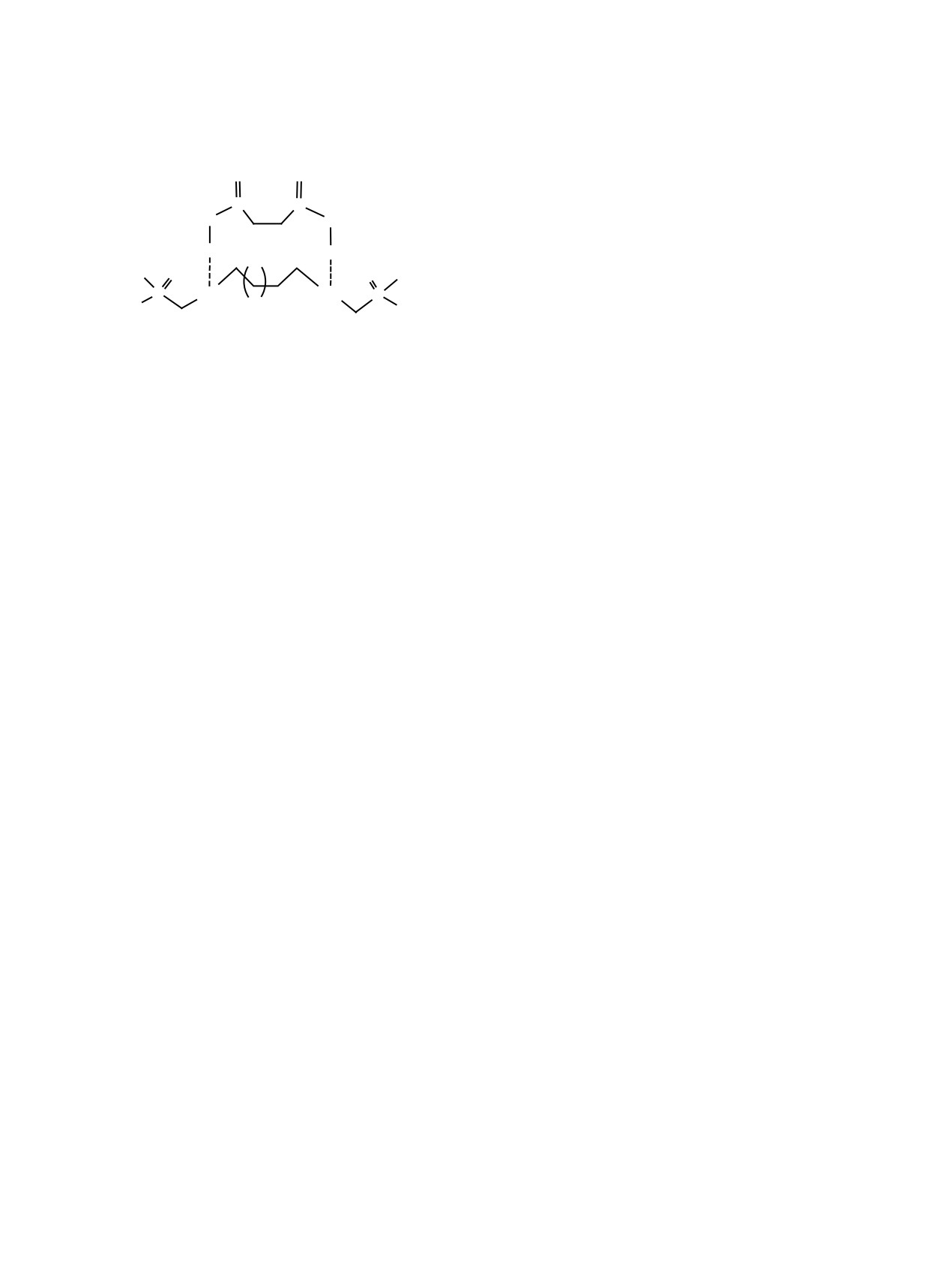
C8H17
O
O
C8H17
P
NH Z NH
P
C
8H17
C8H17
1 4
O
O
P
NH
O
O
NH
P
5
Z = (CH2)4 (1), (CH2)6 (2), CH2CH(CH3)(CH2)3 (3), (CH2)3O(CH2)2O(CH2)3 (4).
впервые изучены мембранно-транспортные свой-
фосфорильных фрагментов, содержащих элек-
ства некоторых фосфорилированных диазаподан-
тронодонорные атомы кислорода и азота. Ранее
дов по отношению к органическим субстратам -
было показано, что транспорт протонодонорных
моно- и полифункциональным карбоновым кислотам.
субстратов (органических кислот) происходит с
В настоящей работе приведены результаты ис-
образованием Н-комплексов между переносимым
следования мембранно-транспортных свойств по
субстратом и молекулой переносчика, содержащей
отношению к ряду полифункциональных карбо-
основные группы [7, 8]. Мы полагаем, что ввиду
новых кислот структурных аналогов α,ω-дифос-
высокой основности двух аминофосфорильных
форилированных азаподандов - α,ω-дифосфори-
фрагментов исследуемых переносчиков 1-5, мем-
лированных диаминов 1-3 и дифосфорилдиаза-
бранный перенос будет происходить по такому же
поданда 4, липофильных переносчиков, содержа-
механизму. Вместе с тем донорные атомы кисло-
щих октильные заместители у атомов фосфора и
рода полиэфирной цепочки в переносчиках 4 и 5
различающиеся природой линкера Z (схема 1). По
также могут принимать участие в образовании во-
нашему предположению, варьирование длины и
дородной связи с молекулой субстрата, что может
природы углеводородного линкера между атома-
внести свой дополнительный вклад в величины
ми азота позволит выявить некоторые взаимоза-
потоков переноса. При оценке взаимосвязи меж-
висимости между структурой переносчиков и их
ду структурой и транспортными свойствами пере-
способностью связывать разнообразные кислые
носчиков нужно иметь в виду, что эффективность
органические субстраты. Для сравнения мы так-
переноса зависит от скорости связывания перено-
же изучили мембранно-транспортные свойства
счика с субстратом, от прочности образующегося
по отношению к обсуждаемым субстратам ново-
комплекса и от скорости реэкстракции в принима-
го дифосфорилированного диазаподанда 5 с п-то-
ющую фазу. Принимая во внимание все вышеска-
лильными группами у атома фосфора, который,
занное, можно заметить, что какие-либо простые
являясь структурным аналогом дифосфорилдиа-
зависимости структура-свойство выявляются не-
минов 1-3, был синтезирован на основе реакции
часто. Последовательная замена структуры остова
Кабачника-Филдса [5, 6].
молекул экстракционных реагентов 1-5 позволяет,
Процесс трансмембранного переноса осущест-
на наш взгляд, сделать определенные суждения о
влялся с использованием жидких поддерживае-
влиянии строения аминофосфорильного перено-
мыех мембран, импрегнированных растворами
счика на величину потока субстрата. В качестве
переносчиков 1-5, молекулы которых, находясь
мембранного растворителя был использован ма-
в жидкой мембране, потенциально способны
лорастворимый в воде и нелетучий 1,2-дихлор-
взаимодействовать с переносимым субстратом
бензол. Результаты эксперимента представлены в
благодаря наличию в их структуре двух амино-
табл. 1.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
СИНТЕЗ, ТР
АНСПОРТНЫЕ И ИОНОФОРНЫЕ СВОЙСТВА... : XII.
1917
Таблица 1. Потоки трансмембранного переноса (Ji) карбоновых и гидроксикарбоновых кислот, индуцированного
переносчиками 1-5, и транспорта кислот в отсутствие переносчиков (J0)
Ji ×105, моль/(мин∙м2)
J0,
Кислота
logP
моль/(мин·м2)
1
2
3
4
5
Муравьиная
9.7×10-5
479.3±44.8
465.3±38.0
365.3±38.5
245.3±25.0
3.7±0.4
-0.54
Уксусная
1.6×10-4
273.7±18.6
325.7±20.8
255.3±19.0
263.0±25.9
10.7±1.1
-0.31
a
Пропионовая
1.9×10-3
479.7±14.1
567.0±16.3
528.0±60.3
471.3±40.5
0.26
н-Бутановая
1.1×10-2
a
0.79
Щавелевая
2.2×10-8
0.02±0.001
а
16.7±1.5
1.2±0.09
1.6±0.2
-1.08
d,l-Миндальная
7.6×10-3
159.3±6.3
120.7±11.7
77.0±6.6
81.3±2.9
22.2±1.5
0.53
Малоновая
2.5×10-8
124.3±12.5
8.3±0.3
253.7±1.4
158.7±20.7
145.0±13.1
-0.94
Янтарная
3.4×10-7
3200.0±14.3
2220.0±14.3
2206.7±87.2
182.0±7.6
35.4±2.7
-0.58
Глутаровая
3.0×10-7
171.7±1.4
216.0±4.3
180.0±23.7
241.3±2.9
2.5±0.1
-0.96
Виноградная
5.3×10-10
2.4±0.01
0.8±0.02
103.7±1.4
0.3±0.01
1.7·± 0.1
-1.08
a
a
d-Винная
1.3×10-9
0.14±0.005
105.3±14.6
0.08±0.0007
d,l-Яблочная
1.6×10-9
19.8±0.1
0.2±0.007
79.7±3.0
107.7±2.9
0.3±0.007
-1.26
Лимонная
2.3×10-9
11.4±0.8
3.3±0.09
71.7±0.7
71.1±0.4
0.1±0.006
-1.72
Аскорбиновая
2.3×10-7
1.13±0.06
1.1±0.05
266.7±3.8
184.0±16.3
0.5±0.02
-1.07
a Ji
≈ J0.
Благодаря своей растворимости в мембранной
Потоки холостых опытов в ряду моноосновных
фазе, органические субстраты способны перехо-
кислот значительно увеличиваются (от 9.7×10-5 до
дить через импрегнированные жидкие мембраны,
1.1×10-2) в порядке возрастания длины их углево-
содержащие только мембранный растворитель, в
дородной цепочки, что находится в соответствии
соответствии с технологией неиндуцированного
с ростом значений logР (увеличением липофиль-
пассивного транспорта. Для оценки вклада неин-
ности субстратов). Для н-бутановой кислоты зна-
дуцируемого переноса нами предварительно были
чения потоков для переносчиков 1-5 практически
определены потоки всех используемых субстратов
не меняются и близки к J0, что свидетельствует
через мембрану, пропитанную только мембран-
об определяющей роли неиндуцированного пас-
ным растворителем - 1,2-дихлорбензолом; их ве-
сивного транспорта. Данный эффект нами был
личины приведены в табл. 1. Эффективность не-
обнаружен и ранее в случае переноса н-бутановой
индуцируемого транспорта определяется в основ-
кислоты фосфорилированными диазаподандами
ном липофильностью субстратов, количественной
[8]. Значение потока холостого опыта для пропи-
характеристикой которой является значение logP -
оновой кислоты также имеет достаточно высокое
константа распределения вещества между водой и
значение, в то время как для муравьиной и уксус-
октан-1-олом [11, 12]. В наших экспериментах гра-
ной кислот значение J0 вносит небольшой вклад
фик зависимости logJ0 от logР представляет собой
в перенос субстрата. Сравнивая величины потока
линейную зависимость с коэффициентом корреля-
одноосновных кислот фосфорилированными ди-
ции R = 0.913, при этом обнаруживается тенден-
аминами 1-3 и фосфорилированным диазаподан-
ция увеличения потока с ростом липофильности
дом 4, можно видеть, что природа линкера Z не
субстратов.
вносит весомый вклад в перенос субстратов - ве-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1918
ДАВЛЕТШИНА и др.
Схема 2.
кислоты практически не зависят от длины линкера
O
O
Z переносчиков 1-3. Наиболее эффективным пере-
носчиком малоновой кислоты выступает дифосфо-
C
C
риламин 3, однако в данном случае нельзя делать
O
O
вывод о селективности переноса этого субстрата
H
H
ввиду близости значений его потока с таковым глу-
C8H17
O
O
C8H17
таровой кислоты. Крайне низкое значение потока
P
NH
n
NH
P
малоновой кислоты наблюдается для фосфорили-
C8H17
C8H17
рованного диамина 2, в котором атомы азота рас-
A
положены на большем расстоянии между собой по
сравнению с переносчиками 1 и 3. Возможно, что
личины потоков меняются незначительно. В то же
этот эффект связан с изменением структуры ком-
время замена донорных алкильных заместителей
плексов этого соединения, в которых может быть
у атомов фосфора на акцепторные п-толильные
иным соотношение лиганд-субстрат. Соединения
приводит к значительному снижению потоков мо-
4 и 5 переносят малоновую кислоту с практически
ноосновных субстатов ввиду снижения электрон-
одинаковой эффективностью. Небольшая разница
ной плотности на донорных атомах кислорода и
в величинах потока диаминных переносчиков 1-3
азота аминофосфорильных фрагментов молеку-
и азаподандов 4 и 5 при переносе простых незаме-
лы. Понижение величины потока оказывается на-
щенных дикарбоновых кислот свидетельствует о
столько сильным, что выравнивание величины J0
незначительной роли полиэфирных атомов кисло-
холостого опыта и Ji происходит уже при переносе
рода в образовании Н-комплексов. По-видимому,
пропионовой кислоты.
ввиду высокой основности атомов азота амино-
фосфорильных фрагментов молекул переносчи-
Из-за большего числа кислородных атомов в
ков, именно они вносят основной вклад в процесс
своем составе d,l-миндальная кислота по своим
комплексообразования.
липофильным свойствам немного уступает н-бу-
тановой, и для нее наблюдается большая величина
Нами была обнаружена высокая эффективность
потока в холостом опыте, 7.6×10–3 моль/(мин∙м2).
и селективность переноса янтарной кислоты фос-
Высокая роль неиндуцируемого транспорта вно-
форилированными диаминами и, в особенности -
сит более заметную погрешность в определение
переносчиком 1, что дает основание предполагать
потока этой кислоты, следовательно, трудно сде-
образование в мембранной фазе симметричного
лать какие-либо выводы о закономерностях ее пе-
комплекса А, в котором связывание субстрат-пе-
реноса в контексте взаимосвязи структура-свой-
реносчик происходит в соотношении 1:1 (схема 2).
ство. Однако и здесь для переносчика 5 проявляет-
При использовании фосфорилированных ди-
ся эффект акцепторной п-толильной группы - зна-
азаподандов какой-либо селективности по ян-
чение Ji в 4 раза ниже соответствующего значения
тарной кислоте не наблюдается; очевидно, при
для его ближайшего аналога 4.
значительной удаленности аминофосфорильных
Потоки двухосновных кислот (щавелевой, ма-
фрагментов друг от друга подобные комплексы не-
лоновой и глутаровой) оказываются ниже, чем для
стабильны, что приводит, возможно, к изменению
моноосновных, что может быть связано с нали-
их стехиометрии. Отметим проявление эффекта
чием в их молекулах двух карбоксильных групп,
электроноакцепторной п-толильной группы при
которые снижают липофильность молекулы суб-
транспорте янтарной кислоты, проявляющегося в
страта и затрудняют диффузию образуемых ими
низком значении величины ее потока.
комплексов в мембрану. Щавелевая кислота об-
Значительно менее эффективно по сравнению с
разует нерастворимые в 1,2-дихлорбензоле ком-
моно- и двухосновными кислотами переносчика-
плексы: было зафиксировано выпадение осадка на
ми 1, 2 и 5 переносятся субстраты, содержащие до-
мембране в ходе проведения экспериментов, что
полнительные гидрофильные гидрокси- и карбок-
нами отмечалось и ранее для аминофосфорильных
сигруппы - виноградная, d-винная, d,l-яблочная,
переносчиков [5, 8]. Потоки переноса глутаровой
лимонная и аскорбиновая кислоты. Возникновение
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
СИНТЕЗ, ТР
АНСПОРТНЫЕ И ИОНОФОРНЫЕ СВОЙСТВА... : XII.
1919
Таблица 2. Полосы поглощения характеристичных групп в ИК спектрах переносчиков 2-4 и комплексов пере-
носчик-субстрат
Комплекс переносчик-кислота
Кислота
2
3
4
δP=O
νC(О)ОН
νasCOO-
δP=O
ν
νasCOO-
δP=O
νC-O-C
νasCOO-
νC(О)ОН
C(О)ОН
Переносчик
1147
-
-
1154 ш
-
-
1140
1119
-
-
Уксусная
1147
1711
-
1150
1713
-
1138
1119
-
1713
Янтарная
1127
1711
-
1134
1715
1560
1121 ш
1560 ш
1714
d-Винная
1160 ш
1730
-
1154
1721 ш
1618 ш
1122 ш
1600 ш
1714
Виноградная
1147,
1700
1639
1154
1721 ш
1612 ш
1123 ш
1600
1714
1126
d,l-Яблочная
1147
1715
1592
1124
1719
1600
1137
1119
1580 ш
1717
Лимонная
1147
1714
1607
1146
1702
1644
1121
1576
1715
Аскорбиновая
1147
-
-
1147
-
-
1134
1113
-
-
Н-комплексов протонодонорных функциональных
группа d,l-яблочной кислоты образует дополни-
групп этих оксикислот с молекулами воды, оче-
тельную водородную связь с полиэфирным ато-
видно, создает дополнительное препятствие для
мом кислорода переносчика 4, что увеличивает
их транспорта из отдающей в мембранную фазу
прочность образуемого комплекса и облегчает
[8]. При переходе от d,l-яблочной к виноградной
его транспорт через мембрану. Введение же вто-
(d-винной) кислоте появление второй гидроксиль-
рой гидроксильной группы в молекулу виноград-
ной группы в молекуле негативно сказывается на
ной (d-винной) кислоты негативно сказывается
потоках их переноса и при использовании пере-
на величине потока, очевидно, ввиду образования
носчика 4, что подтверждает наше предположение
Н-комплекса с молекулой воды в отдающей фазе.
о роли дополнительных гидроксильных групп,
Для проверки наших предположений, мы про-
снижающих эффективность трансмембранного
вели жидкостную экстракцию переносчиков 2, 3
транспорта. Значительное падение потока при пе-
и 4 в системе 1,2-дихлорбензол-вода и регистри-
реходе от янтарной кислоты к гидроксикарбоновым
ровали ИК спектры органической фазы после
наблюдается и для переносчика 3, хотя оно и менее
экстракции. В табл. 2 представлены сдвиги ха-
выражено, чем для его структурных аналогов 1 и 2.
рактеристичных полос поглощения для перено-
Снижение величин потоков гидроксикислот
счиков 2-4 и их комплексов с кислотами [13, 14].
при переходе от содержащего липофильные ок-
Согласно данным ИК-спектрального исследова-
тильные заместители переносчика 4 к его аналогу
ния (табл. 2), уксусная кислота слабо экстрагиру-
с п-толильными группами 5 лишний раз свидетель-
ется в органическую фазу: наблюдается лишь сиг-
ствует о положительной роли электронодонорных
нал небольшой интенсивности в области 1714 см-1
алкильных групп у атома фосфора в образовании
(см. рисунок), характерный для димеров алифати-
переносимого комплекса, что было обсуждено
ческих кислот и принадлежащий С=О группе кис-
выше.
лоты. В целом же ИК спектр органической фазы
Интересно отметить, что различные по своей
практически идентичен таковому переносчика 4 в
природе переносчики 3 и 4 демонстрируют близ-
1,2-дихлорбензоле. Та же ситуация наблюдается и
кую эффективность переноса d,l-яблочной и вино-
для переносчиков 2 и 3: протофильные группы NH
градной кислот (d-винной), однако при переносе
и Р=О не участвуют во взаимодействии с уксусной
янтарной кислоты такого сходства не обнаружива-
кислотой, не наблюдается также и смещения поло-
ется. По нашему предположению, гидроксильная
сы поглощения С-О-С переносчика 4. Наличие же
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1920
ДАВЛЕТШИНА и др.
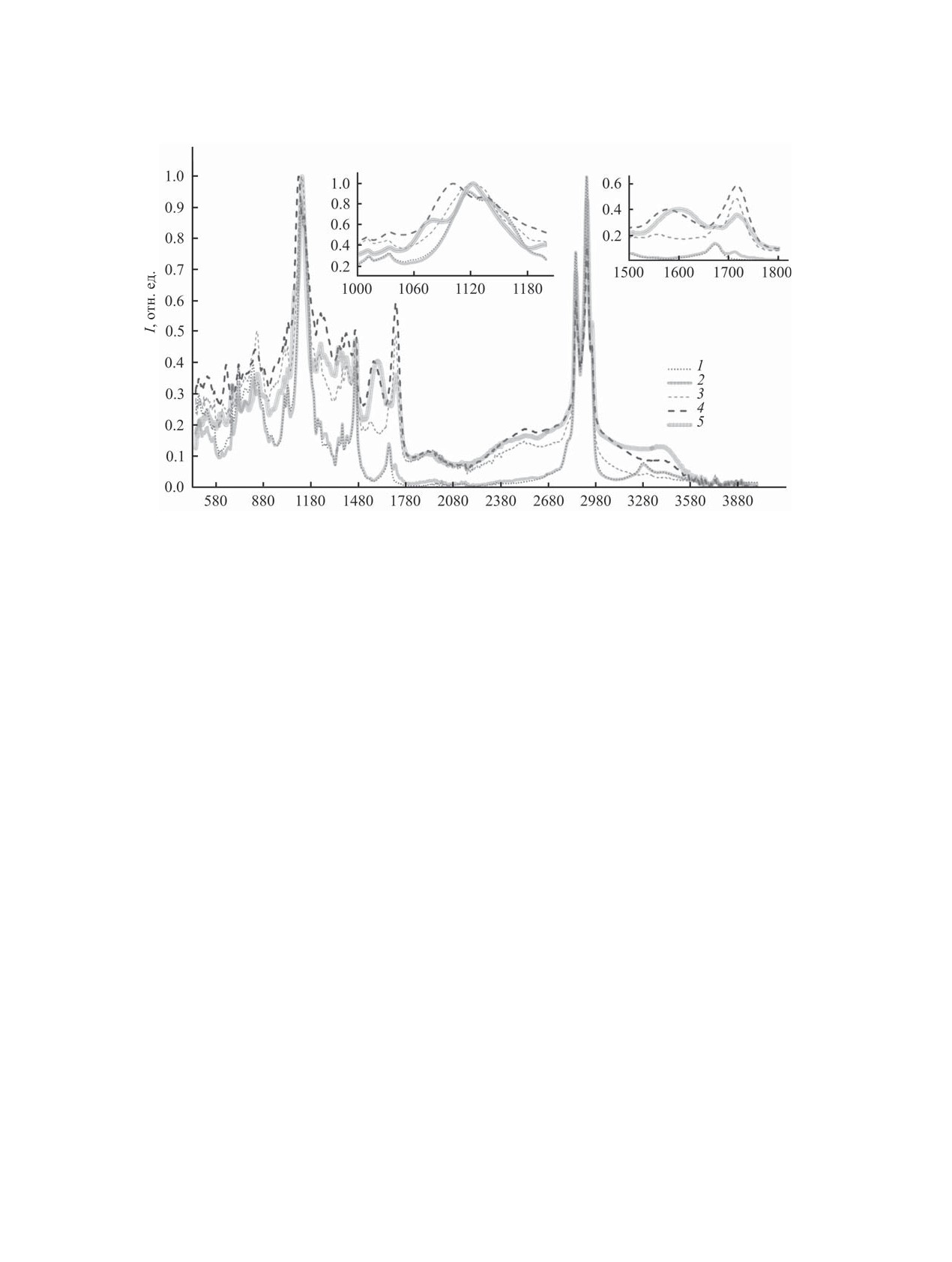
I ɨɬɧ ɟɞ
I ɨɬɧ ɟɞ
Ȟ ɫɦ-1
Ȟ ɫɦ-1
Ȟ ɫɦ-1
ИК спектры пробы органической фазы (1,2-дихлорбензол) после эктракции кислот переносчиком 4. 1 - переносчик 4,
2 - переносчик 4-уксусная кислота, 3 - переносчик 4-янтарная кислота, 4 - переносчик 4-яблочная кислота, 5 -
переносчик 4-винная кислота.
малоинтенсивных сигналов карбоксильной груп-
практически полном отрыве протона от молекулы
пы кислоты в спектрах при отсутствии смещения
кислоты и, следовательно, прочном водородном
характеристических полос групп NH и Р=О всех
связывании с переносчиком - протонировании
переносчиков и С-О-С-группы реагента 4 связано
последнего. Поглощение группы С=О в ИК спек-
с растворением субстратов в 1,2-дихлорбензоле.
трах янтарной и d,l-яблочной кислот находятся в
Таким образом, предположение о высоком вкладе
области 1680 см-1 и свидетельствует о наличии
неидуцируемого переноса в величину потока мо-
внутримолекулярных водородных связей в их мо-
ноосновных кислот подтверждается.
лекулах (частоты поглощения характеристичных
В ИК спектре комплекса диазаподанда 4 с ги-
групп самих кислот в таблице не представлены);
дроксикислотами (см. рисунок), в отличие от
в ИК спектрах комплексов этих кислот с перено-
экстракции уксусной кислоты, наблюдается сме-
счиками аналогичная полоса обнаруживается при
щение полосы группы Р=О и в некоторых случа-
1700-1730 см-1.
ях происходит ее слияние с полосой поглощения
Для эффективного транспорта кислот необ-
группы С-О-С, что свидетельствует об участии
ходимо, чтобы комплекс переносчик-субстрат
этих функций в связывании с гидроксикислотами.
разрушался на границе мембрана-принимаю-
В табл. 2 колебания карбоксильной группы
щий раствор, поэтому полный перенос протона
представлены в виде двух полос поглощения:
от кислоты к переносчику, имеющему основный
νC(О)ОН - поглощение свободной группы С=О
центр, будет негативно сказываться на величинах
(1700-1730 см-1), не связанной с переносчиком
потока субстратов. Наличие полосы поглощения
посредством водородной связи С=О∙∙∙Н-N, но не
νasСОО- в спектрах комплексов, свидетельствует
исключающей наличие водородного связывания
именно о такого рода кислотно-основном взаимо-
примыкающей к ней гидроксильной группы, и
действии субстрата с аминогруппой переносчика
νasСОО- - асимметричные колебания карбокси-
4, что и может являться причиной низкого значе-
лат-аниона (1560-1644 см-1). При этом наличие
ния величины потока кислых субстратов. Вместе
последней в спектре комплекса свидетельствует о
с тем появление в ИК спектре полосы поглощения
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
СИНТЕЗ, ТР
АНСПОРТНЫЕ И ИОНОФОРНЫЕ СВОЙСТВА... : XII.
1921
Схема 3.
HO
HO
HO
OH
O
O
O
O
OH
O
O HO
OH
OH
OH
OH
Ȼ
ȼ
Ƚ
νC(О)ОН может свидетельствовать о наличии водо-
фазы после проведения жидкостной экстракции
родного связывания между гидроксильной груп-
d-винной и виноградной кислот преносчиками 2-4
пой в составе карбоксильной и основными цен-
в 1,2-дихлорбензоле. Необходимо отметить, что
трами переносчика, но не о депротонировании
во всех случаях, кроме экстракции виноградной
кислоты и образовании карбоксилат-аниона. Нами
кислоты переносчиком 3, наблюдалось выпадение
также было отмечено изменение формы и ушире-
части образующихся комплексов в осадок. В этом
ние полос поглощения в области 3000-3500 см-1 в
случае смещение полос поглощения регистриро-
комплексах, однако отнести ее к колебаниям кон-
вали для растворов комплексов в 1,2-дихлорбен-
кретных связей и тем более обозначить величину
золе после удаления осадка. Образование нерас-
творимых в 1,2-дихлорбензоле комплексов иссле-
смещения полос их поглощения не представляет-
ся возможным, поскольку в этой области спектра
дуемых переносчиков с d-винной и виноградной
кислотами может являтся одной из причин низких
проявляются полосы NH-групп переносчиков и
значений их потока.
гидроксигрупп самих кислот; к тому же при этом
значительное уширение сигналов, вероятно, свя-
Комплекс виноградной кислоты с переносчи-
зано с образованием многочисленных водородных
ком 3, как уже отмечалось выше, растворяется в
связей.
органической фазе и не выпадает в осадок, однако
поток виноградной кислоты, переносимой этим
Таким образом, сопоставив данные ИК спек-
реагентом все же уступает по величине таковым
тров комплексов переносчика 4 с гидроксикис-
для двухосновных кислот, не содержащих гидрок-
лотами с изменением величин потоков соответ-
сильных групп в молекуле. Это лишний раз сви-
ствующих гидроксикислот в ряду Jянт > Jябл > Jвин
детельствует о наличии вклада в величину потока
можно отметить, что появление в спектре полосы
явления, упомянутого выше, которое можно обо-
поглощения νasСОО- свидетельствует об образова-
значить как эффект дополнительных гидроксиль-
нии прочного Н-комплекса между переносчиком
ных групп. Вследствие уменьшения концентрации
4 и кислотой, что приводит к снижению величи-
комплексов в 1,2-дихлорбензоле из-за выпадения
ны потока последней. Появление же в ИК спектре
в осадок некоторой их доли, в ИК спектрах этих
полосы поглощения νС(О)ОН, как уже обсуждалось
растворов отмечается низкая интенсивность по-
выше, свидетельствует о наличии водородного свя-
лос поглощения характеристичных групп, а так-
звания между гидроксилом карбоксильной группы
же появление шумовых линий. Несмотря на это,
и протоноакцепторными группами переносчика,
во многих спектрах вполне отчетливо прослежи-
что благоприятствует трансмембранному перено-
вается полоса поглощения карбоксилат-аниона
су. Следовательно, в зависимости от сооотноше-
(табл. 2). Можно отметить сходство ИК спектров
ния интенсивностей этих двух полос поглощения,
комплексов переносчик 3-d-винная и переносчик
отражающих характер связывания, поток кислот
3-виноградная кислоты, при этом величины пото-
будет варьироваться в ту или иную сторону.
ков переноса этих кислот обсуждаемым переносчи-
Как указывалось выше, и было отмечено нами
ком имеют одинаковое значение. Похожи и спектры
ранее при изучении транспортных свойств фосфо-
комплексов переносчиков 2 и 3 с d-винной кисло-
рилированных диазаподандов [10], d-винная кис-
той, что очевидно обусловлено сходством струк-
лота во всех случаях переносится хуже, чем вино-
туры реагентов. Как следует из данных табл. 2,
градная. Мы сравнили ИК спектры органической
в спектре переносимого комплекса переносчика
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1922
ДАВЛЕТШИНА и др.
2 с d-винной кислотой обнаруживается смещение
двух других обсуждаемых здесь кислых субстра-
полосы поглощения деформационных колебаний
тов, хоть, вероятно, и комплементарна таковой пе-
группы Р=О на 13 см-1. В то же время в спектре
реносчиков 3 и 4, однако наличие в их молекулах
комплекса переносчика 2 с виноградной кислотой
дополнительных гидроксильных групп, нивелиру-
проявляются две полосы поглощения. Одна из
ет эти структурные соответствия, предопределяя
них, наблюдаемая при 1147 см-1, характерна для
тем самым определенное снижение эффективно-
несвязанной Р=О-группы и идентичная таковой в
сти трансмембранного переноса.
спектре самого переносчика. Другая, находящаяся
Таким образом, осуществленное нами иссле-
при 1126 см-1, относится к группе Р=О, вступив-
дование мембранно-транспортных свойств нового
шей в водородное связывание с молекулой кислоты.
типа липофильных мембранных экстрагентов - ди-
Потоки переноса аскорбиновой кислоты экс-
фосфорилированных диаминов и диазаподандов
трагентами 1, 2 и 5 невелики, в то время как со-
по отношению к кислым органическим субстратам
позволило выявить хорошо прослеживаемую за-
единения 3 и 4 проявляют селективность по это-
му субстрату. Причина этого явления, возможно,
висимость величины потока переноса от структур-
ных особенностей переносчиков. Сопоставление
заключается в том, что согласно данным табл. 2
данных об эффективности трансмембранной экс-
в комплексе переносчик 2-аскорбиновая кислота
группа Р=О не участвует в связывании. Напротив,
тракции обсуждаемых субстратов с результатами
ИК-спектрального изучения участников мембран-
в спектрах комплексов с переносчиками 3 и 4 на-
ного процесса позволяет сделать обоснованные
блюдается смещение полос поглощения групп
прогностические выводы относительно выбора
Р=О и С-О-С.
комплементарных пар субстрат-переносчик и
Показателен тот факт, что для переносчиков
создает предпосылки для направленного синтеза
1-3 эффективность и селективность мембранного
новых экстрагентов субстратов различной струк-
транспорта наблюдается только для янтарной кис-
туры. В свою очередь, полученные в настоящей
лоты. По нашему предположению, это может быть
работе новые результаты вселяют надежду на рас-
обусловлено комплементарностью структур пере-
ширение ассортимента имеющихся и создание
носчиков и этого субстрата, приводящей к обра-
новых высокоэффективных и селективных экстра-
зованию комплеса переноса типа А. В этой связи
гентов, перспективных для создания инновацион-
обращает на себя внимание то обстоятельство, что
ных технологий извлечения, концентрирования и
транспорт некоторых гидроксикислот, в особенно-
разделения объектов природного и техногенного
сти аскорбиновой и лимонной, как и упомянутой
происхождения.
выше янтарной, переносчиками 3 и 4 характеризу-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ется довольно высокими значениями потоков пе-
реноса; такое явление для процессов экстракции
В работе использовали растворители марок
оксикислот моно- и дифосфорилированными ами-
ЧДА и ХЧ, которые при необходимости подвер-
нами ранее нами не наблюдалось.
гали очистке по стандартным методикам [15],
Одно из возможных объяснений этого феноме-
1,2-дихлорбензол и 1,10-диамино-4,7-диоксаоктан
на состоит в определенном структурном сходстве
(Acros Organics), п-толуолсульфокислоту (97.5%).
янтарной (Б), аскорбиновой (В) и лимонной (Г)
Спектры ЯМР 1Н, 13C{1H} и 31Р{1H} регистри-
кислотами (схема 3): все они характеризуются на-
ровали на приборе Bruker AVANCE 400 с рабо-
личием в них четырехуглеродного остова, соеди-
чей частотой 400, 100 и 160 МГц соответственно.
няющего терминальные гидроксильные группы,
Химические сдвиги определяли относительно
очевидно, связывающие субстрат с протонакцеп-
сигналов остаточных протонов дейтерирован-
торными центрами переносчиков.
ного ацетонитрила. ИК спектры регистрировали
Однако высокая эффективность и селектив-
на спектрометре Perkin Elmer UATR Two (4000-
450 см-1).
ность транспорта янтарной кислоты, безусловно,
обязана отсутствию упомянутого выше эффекта
Методы синтеза и спектральные данные перено-
дополнительных гидроксильных групп. Структура
счиков 1-3 описаны в работах [5, 6].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
СИНТЕЗ, ТР
АНСПОРТНЫЕ И ИОНОФОРНЫЕ СВОЙСТВА... : XII.
1923
Жидкостную экстракцию осуществляли сме-
ли кондуктометрическим датчиком. Величины по-
шением 150 мкл 0.1 М. раствора преносчика в
токов переноса через мембрану [Ji, моль/(м2·мин)]
1,2-дихлорбензоле с 150 мкл 0.2 М. раствора кис-
рассчитывали по начальным линейным участкам
лоты. После интенсивного встряхивания в течение
зависимости концентрации транспортируемо-
1 мин и расслоения фаз регистрировали ИК спек-
го вещества в принимающей фазе от времени по
тры органической фазы.
уравнению:
N,N'-Бис(ди-пара-толилфосфорилметил)-
Ji = cS∙1000∙Sм/t∙V,
1,10-диамино-4,7-диоксаоктан (5). Смесь 3.9 г
где cS - изменение концентрации вещества в рас-
параформа, 11.5 г 1,10-диамино-4,7-диоксаокта-
творе во времени t [(моль/л)/·мин], V - объем при-
на, 29.9 г ди(п-толил)фосфинистой кислоты, 1 г
нимающей фазы (8 мл), Sм - площадь мембраны
пара-толуолсульфокислоты и 60 мл толуола пере-
(4.75×104 м2). Концентрацию субстрата в прини-
мешивали при 60°С около 0.5 ч, затем кипятили
мающей фазе методом кондуктометрии. В каче-
3 ч. Добавляли 1 г карбоната калия, и смесь пе-
стве потока холостого эксперимента использовали
ремешивали несколько минут. Полученную смесь
значение, при котором мембрана пропитывалась
пропускали через прокаленный оксид алюминия,
чистым растворителем.
растворитель удаляли. К остатку добавляли 6 г
ФОНДОВАЯ ПОДДЕРЖКА
щавелевой кислоты в диэтиловом эфире. Осадок
отфильтровывали на фильтре Шотта и кипятили
Работа выполнена за счет средств субсидии,
в среде 1,4-диоксана 2 ч. Полученную соль обра-
выделенной Казанскому федеральному универси-
батывали водным раствором щелочи. Очищенный
тету для выполнения государственного задания в
продукт экстрагировали бензолом, который за-
сфере научной деятельности (№ 4.5888.2017/8.9).
тем удаляли. Выход 54% (23 г), густое масло. ИК
КОНФЛИКТ ИНТЕРЕСОВ
спектр, ν, см-1: 1116 (С-О-С), 1171 (P=O), 3352
Авторы заявляют об отсутствии конфликта ин-
(N-H). Спектр ЯМР 1Н, δ, м. д.: 1.63 квинтет [4H,
тересов
(NСН2СН2СН2O)2, 3JHH = 6.5 Гц], 2.26 с (2Н, NН2),
2.38 с (12Н, СН3), 2.70 т [4H, (NСН2СН2СН2O)2,
СПИСОК ЛИТЕРАТУРЫ
3JHH = 6.8 Гц], 3.36-3.45 м [4Н, (ОCH2СН2СН2N)2;
1. Гарифзянов А.Р., Давлетшина Н.В., Гайнеев А.М.,
4Н, (OСН2)2; 4Н, (PCH2N)2], 7.32 д. д (8Н, CH3CCH,
Гайнуллин А.З., Черкасов Р.А. // ЖОХ. 2018. Т. 88.
4JРH = 2.2, 3JHH = 8.0 Гц), 7.65 д. д (8Н, PCCH, 3JНH =
Вып. 9. С. 1506; Garifzyanov A.R., Davletshina N.V.,
8.1, 3JРH = 10.9 Гц). Спектр ЯМР 13С{H}, δC, м. д.:
Gayneev A.M., Gaynullin A.Z., Cherkasov R.A. // Russ.
21.17 (ССH3), 30.03 (NCH2CH2CH2O), 49.12 д
J. Gen. Chem. 2018. Vol. 88. N 9. P. 1850. doi 10.1134/
(NCH2CH2CH2O, 3JСР = 13.8 Гц), 49.60 д (NCH2P,
S1070363218090141
1JСР = 80.9 Гц), 69.63 (CH2OCH2CH2CH2), 70.41
2. Евреинов В.И., Баулин В.Е., Вострокнутова З.Н.,
(CH2OCH2CH2), 117.92 (CН3C), 128.70 д (CHCHСP,
Сафронова З.В., Крашакова И.Б., Сюндюкова В.Х.,
1JСР = 72.4 Гц) 129.80 д (CHCHCP, 3JСР = 11.7 Гц),
Цветков Е.Н. // Изв. АН. Сер. хим. 1991. № 9.
131.43 д (CНCP, 3JСР = 9.4 Гц), 142.81 д (CH3CCH,
С. 1992; Evreinov V.I., Baulin V.E., Vostroknutova Z.N.,
4JСР = 2.5 Гц). Спектр ЯМР 31P: δP 29.4 м. д.
Safronova Z.V., Krashakova I.B., Syundyukova V.Kh.,
Изучение мембранной экстракции проводили в
Tsvetkov E.N. // Bull. Russ. Acad. Sci. Div. Chem. Sci.
классической вертикальной ячейке с подвижным
1992. Vol. 40. N 9. P. 1759. doi 10.1007/BF00960399
цилиндром. Принимающий раствор находился во
3. Евреинов В.И., Баулин В.Е., Вострокнутова З.Н.,
внутреннем тефлоновом стакане, дном которого
Бондаренко Н.А., Сюндюкова В.Х., Цветков Е.Н. //
служила импрегнированная жидкая мембрана. В
Изв. АН. Сер. хим. 1989. № 9. С. 1990; Evreinov V.I.,
качестве матриц использовали мембраны на осно-
Baulin V.E., Vostroknutova Z.N., Bondarenko N.A.,
ве пористых тефлоновых фильтров на полиэфир-
Syundyukova V.Kh., Tsvetkov E.N. // Bull. Acad. Sci.
ной подложке Владипор МФФК-4 с размером пор
USSR. Div. Chem. Sci. 1990. Vol. 38. N 9. P. 1828. doi
0.65 мкм; растворитель мембранной фазы
-
10.1007/BF00957771
1.2-дихлорбензол (Acros Organics). Изменение кон-
4. Евреинов В.И., Баулин В.Е., Вострокнутова З.Н.,
центрации субстрата в принимающей фазе измеря-
Цветков Е.Н. // Изв. АН. Сер. хим. 1993. № 8.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1924
ДАВЛЕТШИНА и др.
С. 518; Evreinov V.I., Baulin V.E., Vostroknutova Z.N.,
sov R.A. // Russ. J. Gen. Chem. 2018. Vol. 88. N 7.
Tsvetkov E.N. // Russ. Chem. Bull. 1994. Vol. 42. N 3.
P. 1462. doi 10.1134/S1070363218070186
P. 472. doi 10.1007/BF00698434
9. Whitney D.C., Diamond R.M. // J. Phys. Chem. 1963.
5. Черкасов Р.А., Гарифзянов А.Р., Талан А.С., Давлет-
Vol. 67. N 2. P. 209. doi 10.1021/j100796a002
шин Р.Р., Курносова Н.В. // ЖОХ. 2009. Т. 79. Вып. 9.
10. Черкасов Р.А., Гарифзянов А.Р., Краснова Н.С.,
С. 1480; Cherkasov R.A., Garifzyanov A.R., Talan A.S.,
Черкасов А.Р., Талан А.С. // ЖОХ. 2006. Т. 76.
Davletshin R.R. // Russ. J. Gen. Chem. 2009. Vol. 79.
Вып. 10. С. 1603; Cherkasov R.A., Garifzyanov A.R.,
N 9. P. 1835. doi 10.1134/S1070363209090114
Krasnova N.S., Cherkasov A.R., Talan A.S. // Russ. J.
6. Гарифзянов А.Р., Черкасов Р.А., Давлетшин Р.Р.,
Gen. Chem. 2006. Vol. 76. N 10. P. 1537. doi 10.1134/
Давлетшина Н.В. // ЖОХ. 2012. Т. 82. Вып. 10.
S1070363206100057
С.1619; Garifzyanov A.R., Davletshin R.R., Davletshi-
11. Collander R. // Acta Chem. Scand. 1951. N 5. P. 774.
na N.V., Cherkasov R.A. Russ. J. Gen. Chem. 2012.
doi 10.3891/acta.chem.scand.05-0774
Vol. 82. N 10. P. 1646. doi 10.1134/S1070363212100039
12. Advanced Chemistry Development (ACD/Labs)
7. Гарифзянов А.Р., Давлетшин Р.Р., Давлетшина Н.В.,
Software V11.02. 2018.
Черкасов Р.А. // ЖОХ. 2013. Т. 83. Вып. 2. С. 343;
13. Беллами Л. Инфракрасные спектры сложных
Garifzyanov A.R., Davletshin R.R., Davletshina N.V.,
молекул М.: ИЛ, 1963. 590 с.
Cherkasov R.A. // Russ. J. Gen. Chem. 2013. Vol. 83.
14. Казицына Л.А., Куплетская Н.Б. Применение УФ-,
N 2. P. 398. doi 10.1134/S1070363213020278
8. Гарифзянов А.Р., Давлетшина Н.В., Ахмадулли-
ИК- и ЯМР-спектроскопии в органической химии.
на Л.И., Гайнуллин А.З., Черкасов Р.А. // ЖОХ. 2018.
М.: ВШ, 1971. 264 с.
Т. 88. Вып. 7. С. 1171; Garifzyanov A.R., Davletshi-
15. Карякин Ю.В., Ангелов И.И. Чистые химические
na N.V., Akhmadullina L.I., Gaynullin A.Z., Cherka-
вещества М.: Химия, 1974. 407 с.
Synthesis, Transport and Ionophoric Properties
of α,ω-Diphosphorylated Azapodands:
XII. Membrane Transport of Organic Acids
with Diphosphorylated Diamines and Diazapodands
N. V. Davletshina*, I. R. Nasyrov, A. R. Khabibullina, R. R. Davletshin,
A. Z. Gainullin, and R. A. Cherkasov
Kazan Federal University, ul. Kremlyovskaya 18, Kazan, 420008 Russia
*e-mail: kurnosova.nataliya@yandex.ru
Received May 24, 2019; revised May 24, 2019; accepted May 30, 2019
The membrane transport properties of phosphorylated diamines with respect to mono- and polyfunctional
carboxylic acids were studied. Structure of the transferred H-complexes was discussed; in some cases, the de-
pendence of the efficiency of transmembrane transfer of organic acid substrates on the structure of membrane
carriers and their complexes with the latter was found. The relationship between the flow of some substrates
and the shift of the absorption bands of characteristic groups, as well as the change in their intensity in the IR
spectra of their complexes with carriers compared with the corresponding spectra of substrates and carriers,
was estimated.
Keywords: diphosphorylated diamines, azapodands, membrane extraction, aminophosphoryl carrier
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019