ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 12, с. 1932-1937
УДК 549.752/.753:546.56:543.544-414
СОРБЦИЯ ИОНОВ МЕДИ(II) НАНОРАЗМЕРНЫМ
ФОСФАТОМ МАГНИЯ
© 2019 г. А. В. Баландина*, Е. В. Окина, О. В. Тарасова, Л. В. Начкина, С. Г. Кострюков,
В. М. Кяшкин, А. Д. Юдина, Ю. И. Люкшина, А. А. Ахматова, Е. О. Соловьева
Национальный исследовательский Мордовский государственный университет
имени Н. П. Огарева, ул. Большевистская 68, Саранск, 430005 Россия
*e-mail: iman081@gmail.com
Поступило в Редакцию 30 апреля 2019 г.
После доработки 27 июня 2019 г.
Принято к печати 1 июля 2019 г.
Разработан новый подход к получению наноразмерного сорбента на основе фосфата магния. Исследо-
ваны закономерности сорбции ионов меди(II) наноразмерным фосфатом магния из водных растворов.
Определены сорбционные характеристики, а также кинетика и механизм протекающих процессов. По-
казана высокая сорбционная способность наноразмерного сорбента по сравнению с существующими
сорбентами на основе фосфата магния.
Ключевые слова: наноразмерные сорбенты, фосфат магния, сорбция ионов меди(II), механизм сорбции
DOI: 10.1134/S0044460X19120187
Для извлечения ионов меди(II) из растворов
ции. Эффективность хемосорбционного поглоще-
сложного химического состава в настоящее вре-
ния зависит от ряда факторов, основным из кото-
мя предложено большое число разнообразных
рых является разность произведений растворимо-
природных и синтетических материалов: от мо-
сти исходного фосфата и сорбента, образуемого
дифицированных опилок до новейших синтетиче-
при хемосорбционном взаимодействии, т. е. полу-
ских ионитов, являющихся продуктами сложного
ченный продукт должен иметь меньшую раство-
органического синтеза [1-9]. Однако немногие
римость, чем исходный фосфат. Отличительной
из этих материалов обладают высокой емкостью,
особенностью фосфатов является достаточно ши-
селективностью, достаточной механической проч-
рокий интервал рН (от 1 до 12) соответствующих
ностью, химической и гидролитической устойчи-
растворов. В отличие от сульфидов фосфаты не
востью, имеют приемлемую стоимость, а также,
имеют запаха. Однако высокая кристалличность
в зависимости от решаемых задач, возможность
фосфатов и, как следствие, невысокая адсорб-
проведения процесса десорбции, либо обеспече-
ционная емкость существенно ограничивают их
ния надежной иммобилизации сорбированного
применение на практике. Таким образом, полу-
компонента. Известные сорбенты неорганическо-
чение сорбентов на основе фосфатов с высокими
го и органического характера не в полной мере
емкостными характеристиками является важной
отвечают этой совокупности требований, что
и актуальной задачей. В представленной работе
определяет актуальность разработки сорбентов
предложен оригинальный синтез наноразмерного
с улучшенными характеристиками сорбционных
фосфата магния с высокими сорбционными ха-
свойств. Перспективными сорбционными мате-
рактеристиками и исследованы его сорбционные
риалами для ионов тяжелых и цветных металлов
свойства по отношению к ионам меди(II) в водной
являются фосфаты двухвалентных металлов с низ-
среде.
кой растворимостью, которые при контакте с рас-
творами, содержащими ионы металлов, вступают
Наноразмерный сорбент на основе фосфа-
с последними в гетерогенные химические реак-
та магния получали непрерывным методом пу-
1932
СОРБЦИЯ ИОНОВ МЕДИ(II)
1933
I
2ș ɝɪɚɞ
2ș ɝɪɚɞ
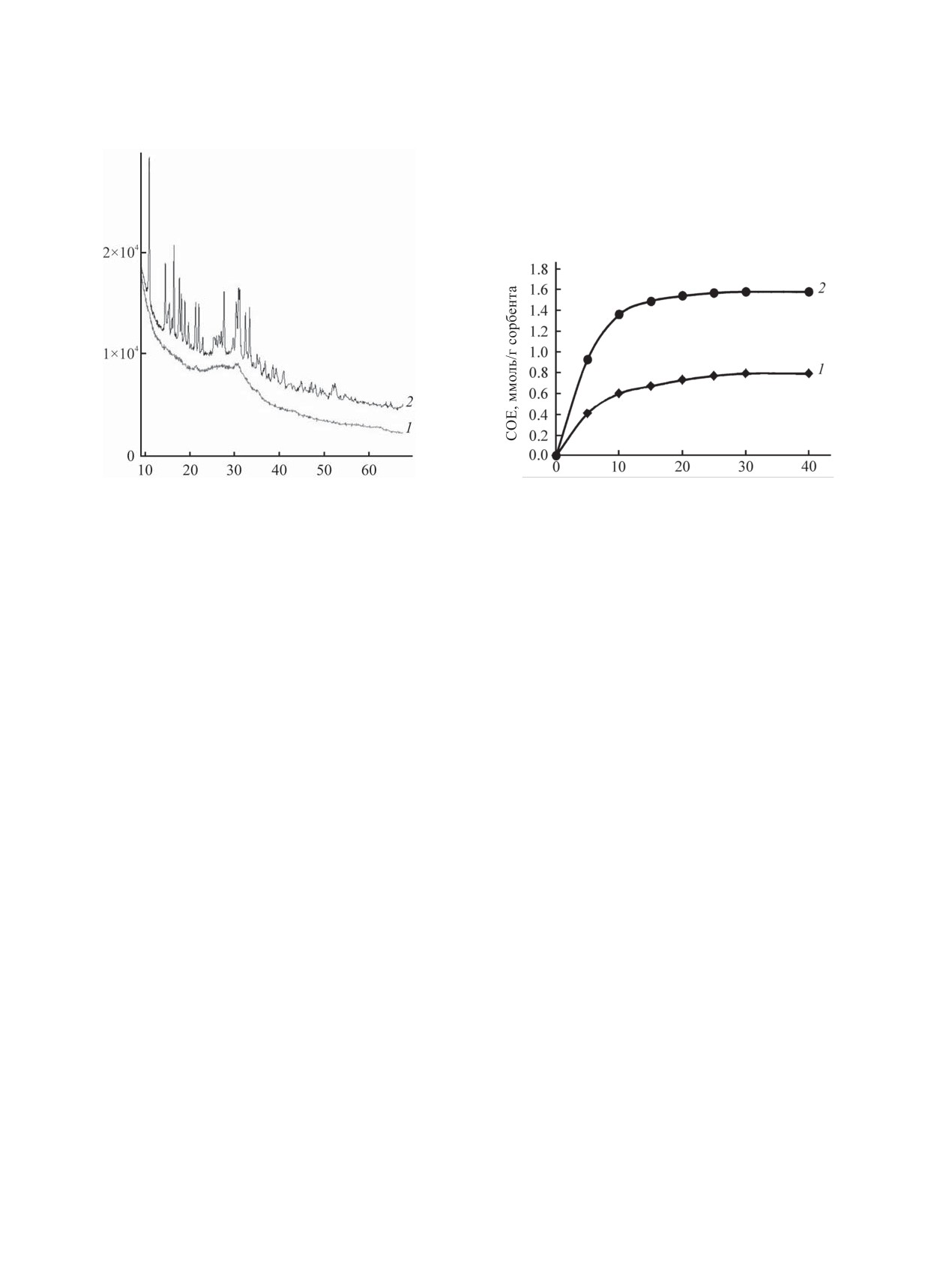
Рис. 1. Дифрактограммы криогранулированного образ-
Рис. 2. Кинетические кривые сорбции ионов меди(II)
ца фосфата магния до (1) и после сорбции (2) ионов
криогранулированным (1) и наноразмерным (2) образ-
меди(II).
цами фосфата магния.
тем осаждения получаемого фосфата магния при
детельствуют о том, что сорбция ионов меди(II)
добавлении 0.75 М. раствора хлорида магния к
образцом наноразмерного фосфата магния проте-
0.5 М. раствору ортофосфата натрия при рН = 8-9.
кает интенсивнее по сравнению с криогранулиро-
Полученный наноразмерный сорбент представлял
ванным фосфатом магния. У данных сорбентов за
15 мин достигается максимальная скорость ад-
собой аморфный порошок белого цвета. Размеры
сорбции, далее наклон кинетических кривых по-
частиц образующегося фосфата магния, опреде-
степенно выходит на плато, и система достигает
ленные методом динамического светорассеяния,
адсорбционного равновесия после 30 мин контак-
находятся в области 7-10 нм.
та фаз. Высокая скорость сорбции при использо-
На дифрактограмме наноразмерного фосфа-
вании наноразмерного фосфата магния обуслов-
та магния отсутствуют характеристические пики
лена более развитой поверхностью и большой
кристаллической фазы фосфата магния, что сви-
степенью ненасыщенности кислородных связей
детельствует о рентгеноаморфности структуры ис-
в анионе, что, в итоге, и приводит к увеличению
ходного образца (рис. 1). В данном случае проте-
сорбционной емкости. Сорбционная обменная
кание процесса сорбции не приводит к появлению
емкость криогранулированного фосфата магния
кристаллической фазы.
составляет
0.79±0.01, наноразмерного
-
1.58±
0.01 ммоль/г сорбента, что соответствует 100.0±
В отличие от наноразмерного криогранулиро-
0.1% извлечения меди(II) из раствора. Все даль-
ванный фосфат магния содержит небольшое коли-
нейшие экспериментальные исследования прово-
чество кристаллической фазы. Можно предполо-
дили при времени контакта твердой и жидкой фаз
жить наличие дифосфата магния Mg2P2O7 (рис. 1,
30 мин.
кривая 1). Сорбция ионов меди(II) криогранули-
Известно, что механизм сорбции ионов имеет
рованным образцом приводит к его кристаллиза-
сложный, многостадийный характер и рассмотре-
ции с образованием фосфатгидратов меди (рис. 1,
ние всех стадий процесса трудно осуществимо
кривая 2).
[10], поэтому чаще всего при его изучении широко
Экспериментальные данные по продолжитель-
используются модели, основанные на принципах
ности сорбции образцами криогранулированного
определения лимитирующей стадии сорбции [11].
и наноразмерного фосфата магния (рис. 2) сви-
Критерием определения стадии, лимитирующей
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1934
БАЛАНДИНА и др.
t ɦɢɧ
t
ɦɢɧ
Рис. 3. Определение лимитирующей стадии изучаемых
процессов сорбции ионов меди(II) криогранулиро-
Рис. 4. Процессы сорбции ионов меди(II) криогранули-
ванным (1) и наноразмерным (2) образцами фосфата
рованным (1) и наноразмерным (2) образцами фосфата
магния.
магния, лимитируемые внутренней диффузией.
скорость сорбции ионов, является соблюдение ли-
Для определения лимитирующей стадии изуча-
нейной зависимости ln(1 - F) от t для внешнедиф-
емых процессов были использованы обе модели.
фузионных и Гt от t1/2 - для внутридиффузионных
В случае криогранулированного образца фосфа-
процессов [11]. Для внешнедиффузионных про-
та магния (рис. 3, кривая 1) только на начальном
цессов, когда стадия, которая контролирует ско-
участке зависимости -ln(1 - F) от t наблюдается
рость всего процесса, является диффузия в непод-
прямолинейный характер функции -ln(1 - F) = f(t),
вижной пленке раствора вокруг зерна сорбента,
что соответствует протеканию процесса по внеш-
кинетическая кривая описывается уравнением (1).
недиффузионному механизму. В дальнейшем пря-
молинейность кинетической кривой нарушается,
ln(1 - F) = -y·t,
(1)
что свидетельствует о смене механизма сорбции на
где t - время, мин; y - некоторая постоянная для
внутридиффузионный механизм. Таким образом,
данных условий величина; F - степень достиже-
полученная закономерность показывает класси-
ния равновесия, рассчитываемая как F = at/ap, где
ческий смешанно-диффузионный механизм сорб-
аt - количество сорбированного вещества в момент
ции, т. е. диффузия сорбата из раствора к поверх-
времени t, ммоль/г; ар - количество сорбированно-
ности сорбента через пленку и диффузию сорбата
го вещества в состоянии равновесия, ммоль/г [10].
в зерне сорбента. Как показано на рис. 3, кривая 2,
Для процесса, в котором лимитирующей стади-
у наноразмерного образца фосфата магния прак-
ей является внутренняя диффузия, служит соблю-
тически во всем интервале сорбции наблюдается
дение прямoлинейной зависимости в координатах
прямолинейный характер функции -ln(1 - F) =
Гt-t1/2, кинетическая кривая описывается уравне-
f(t), свидетельствующий о внешнедиффузионном
нием (2).
механизме сорбции ионов меди(II) наноразмер-
Гt = Kdt1/2 + A,
(2)
ным фосфатом магния.
где Гt - количество меди(II) на единицу массы со-
Процессы, лимитирующиеся внутренней диф-
рбента, ммоль/г; Kd - константа скорости внутрен-
фузией, показаны на рис. 4. С помощью получен-
ней диффузии, ммоль·г-1·мин-0.5; t - время, мин;
ных зависимостей определены кинетические па-
А - величина, пропорциональная толщине пленки,
раметры (константы скорости внутренней диффу-
окружающей зерно сорбента (отрезок, отсекаемый
зии Kd), характеризующие внутреннюю диффузию
продолжением прямой зависимости Гt = f(t) на оси
ионов меди(II) образцами фосфата магния: вели-
ординат) [10].
чина Kd составляет 0.13 и 0.22 для наноразмерного
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
СОРБЦИЯ ИОНОВ МЕДИ(II)
1935
12.5 ммоль/л, а в случае криогранулированного -
13.3 ммоль/л. Хемосорбционное взаимодействие
можно представить уравнением химической реак-
ции:
Mg3(PO4)2·3H2O + 3Cu2+ → Cu3(PO4)2·3H2O + 3Mg2+,
которое согласуется с разностью произведений
растворимости фосфатов магния и меди(II) [реак-
ция (3)] [12].
ПР[Mg3(PO4)2] = 1.0×10-13; ПР[Cu3(PO4)2]
CCu(II)
ɦɦɨɥɶ ɥ
= 1.26×10-37.
(3).
Рис. 5. Изотермы сорбции ионов меди(II) криогранули-
На рис. 5 представлены изотермы сорбции для
рованным (1) и наноразмерным (2) образцами фосфата
криогранулированного и наноразмерного фосфа-
магния.
та магния. Полученные изотермы сорбции ионов
меди(II) криогранулированным и наноразмер-
и криогранулированного образцов соответствен-
ным образцами соответствуют изотермам модели
но. Константы скорости внутренней диффузии
Ленгмюра. Начальные прямолинейные участки
Kd, найденные по тангенсу угла наклона Гt-t1/2 к
кривых показывают, что адсорбция локализована
оси абсцисс, показывают, что скорость внутрен-
на отдельных адсорбционных центрах, каждый из
ней диффузии для криогранулированного образца
которых взаимодействует только с одной молеку-
фосфата магния больше, чем для наноразмерного.
лой адсорбата, образуя мономолекулярный слой.
С увеличением рН среды наблюдается рост
Участки на изотермах, соответствующие большим
сорбции ионов меди(II) данными образцами, каж-
концентрациям, отвечают поверхности сорбента
дый из которых достигает максимума в интервале
полностью насыщенной сорбатом. Средние участ-
рН = 5-6 и соответствует 100.0±0.1% извлече-
ки изотерм сорбции соответствуют промежуточ-
ния меди(II) из раствора. По мере увеличения рН
ным степеням заполнения поверхности сорбента.
среды до 6-9 полнота извлечения ионов меди(II)
О протекании ионообменного механизма сорб-
вновь уменьшается, что, очевидно, связано с об-
ции ионов меди(II) синтезированными сорбента-
разованием осадка Cu(OH)2 [11]. Дальнейшие ис-
ми подтверждают данные ИК спектроскопии. На
следования сорбции проводили при оптимальном
ИК спектрах образцов после сорбции наблюдают-
значении рН раствора, равном 5.5. Для корректи-
ся полосы поглощения в области 735 и 740 см-1,
ровки кислотности среды использовали фосфат-
относящиеся к антисимметричным валентным
ные буферные растворы с рН = 3 и рН = 8.
колебаниям связи Cu-O и свидетельствующие об
Сорбция меди(II) сопровождалась подщелачи-
ионообменном механизме сорбции ионов меди(II)
ванием раствора после сорбции, которое обуслов-
криогранулированным и наноразмерным фосфа-
лено выделением ионов магния из состава сорбен-
том магния.
та и хемосорбционным взаимодействием ионов
Таким образом, разработан подход к получе-
Cu2+ с фосфатом магния [8]. Для доказательства
нию высокоэффективного наноразмерного сор-
протекания хемосорбционного взаимодействия в
бента на основе фосфата магния. Сорбционная
фильтратах после сорбции определяли содержа-
способность полученного сорбента по отношению
ние Mg2+ титриметрическим и хроматографиче-
к ионам меди(II) превосходит на ≈ 40% криогра-
ским методами анализа. Количественные расчеты
нулированный фосфат магния. Подробно изуче-
показали неэквивалентное выделение в раствор
на кинетика сорбции, а также механизм сорбции.
ионов Mg2+ для образцов криогранулированного и
Установлено, что для наноразмерного сорбента ре-
наноразмерного сорбента по сравнению с сорбиро-
ализуется внешнедиффузионный, а для криограну-
ванными ионами меди (II): в случае наноразмерно-
лированного смешанный механизм: хемосорбция
го сорбента концентрация ионов Mg2+ составляла
и физическая сорбция за счет ван-дер-ваальсовых
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1936
БАЛАНДИНА и др.
сил. Таким образом, уменьшение размеров частиц
Содержание ионов магния измеряли на ионном
сорбента приводит к изменению механизмов сор-
анализаторе Shimadzu PIA-1000.
бции, это позволяет регулировать механизм сорб-
Сорбцию ионов меди(II) изучали в статиче-
ции путем варьирования размера частиц сорбента.
ском режиме по следующей методике: к 0.2 г со-
рбента прибавляли 20 мл раствора, содержащего
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
сорбируемый ион меди(II) (15.7 ммоль/л), име-
В качестве исходных реагентов для синтеза
ющего кислотность раствора ~5.5. Фазы переме-
фосфата магния использовали кристаллогидраты
шивали в течение 30 мин, затем разделяли филь-
фосфата натрия Na3PO4·12H2O и хлорида магния
трованием твердую и жидкую фазы и определя-
MgCl2·2H2O марки ХЧ.
ли содержание сорбируемого иона в растворе.
Экспериментальные результаты выражали в виде
ИК спектр наноразмерного сорбента до сорб-
величин статической обменной емкости сорбента
ции согласуется с литературными данными [13] и
(СОЕ, ммоль/г сорбента) и степени сорбции (L, %)
характеризуется наличием следующих полос по-
соответственно [уравнения (4), (5)].
глощения, см-1: 3425 [ν(H2O)], 1645 [δ(H2O)], 1062
и 573 [(РО4)3-].
(C0 - Cp)ÂV
,
(4)
COE =
m
Криогранулированный фосфат магния осажда-
(C0 - Cp)ÂV
ли путем одновременного совместного сливания
(5)
L =
× 100%,
C0
0.75 М. раствора хлорида магния и 0.5 М. раствора
ортофосфата натрия при непрерывном перемеши-
где СОЕ - статическая обменная емкость, ммоль/г
вании (рН = 8-9). После 2-часового созревания в
сорбента; с0 - исходная концентрация Cu2+ в рас-
маточном растворе гелеобразный осадок отфиль-
творе, ммоль/л; сp - равновесная концентрация
тровывали, промывали дистиллированной водой,
Cu2+ в растворе после сорбции, ммоль/л; V - объем
затем замораживали в морозильной камере при
анализируемого раствора, л; m - навеска сорбента, г.
-25°С в течение 1 сут. Криогранулированный сор-
Для изучения кинетики сорбции в серию колб
бент представлял собой после оттаивания и высу-
на 50 мл помещали 0.2 г сорбента, добавляли по
шивания на воздухе мелкокристаллическое веще-
20 мл раствора сульфата меди(II), колбы закрыва-
ство белого цвета, размером частиц 500-700 нм.
ли пробкой и встряхивали растворы в течение 5,
ИК спектр криогранулированного фосфата магния
10, 15. 20, 25, 30 и 40 мин при комнатной темпе-
до сорбции аналогичен наноразмерному.
ратуре. Содержание меди(II) в растворе состав-
Дифрактограммы порошковых образцов за-
ляло 7.87 ммоль/л для криогранулированного и
15.75 ммоль/л для наноразмерного образцов фос-
писывали на рентгеновском дифрактометре
фата магния. В каждой колбе определяли остаточ-
Empyrean PANalytical c медным излучением (λ =
1.5418 Å) при комнатной температуре. Для анализа
ную концентрацию ионов меди(II), рассчитывали
сорбционную емкость и степень извлечения по
дифрактограмм использовали базу данных PDF-2.
формулам (4) и (5).
Содержание ионов меди(II) в модельном растворе
(15.7 ммоль/л) определяли спектрофотометриче-
Изотермы сорбции получены с использованием
ским методом с диэтилдитиокарбаматом натрия на
переменных концентраций. Для этого брали наве-
сканирующем однолучевом спектрофотометре PE-
ски сорбентов массой 0.2 г, вводили 20 мл аликво-
5300V (λ = 430 нм, l = 3 см). Модельный раствор
ты раствора сульфата меди(II) концентрации
готовили из соли CuSO4·5H2O (ХЧ). Исследование
0.79-17.32 ммоль/л для криогранулированного и
влияния рН среды на характер сорбции ионов
0.79-23.62 ммоль/л для наноразмерного образцов.
меди(II) проводили при постоянной массе наве-
Кислотность растворов была постоянной и состав-
ски (0.2 г), объеме исходного раствора (20 мл),
ляла 5.5 ед. рН. Растворы перемешивали в течение
времени взаимодействия адсорбента и раствора
30 мин при комнатной температуре, затем филь-
30 мин. Кислотность растворов контролировали с
тровали. Массу сорбированного иона меди(II) на-
помощью рН-метра Hanna HI2211 pH/ORPMeter.
ходили как разницу между количеством введенной
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
СОРБЦИЯ ИОНОВ МЕДИ(II)
1937
в пробу меди(II) и количеством несорбированной
5. Barquilha C.E.R., Cossich E.S., Tavares C.R.G.,
меди(II) в фильтрате, затем рассчитывали стати-
Silva E.A. // J. Clean. Prod. 2017. Vol. 150. P. 58. doi
10.1016/j.jclepro.2017.02.199
ческую обменную емкость по формуле (4). По по-
лученным данным строили графическую зависи-
6. Bi X., Lau R.J., Yang K.-L. // Langmuir. 2007. Vol. 23.
мость в координатах: содержание меди(II) в фазе
P. 8079. doi 10.1021/la7008072
сорбента (ммоль/г) от равновесной концентрации
7. Calero M., Iáñez-Rodríguez I., Pérez, A., Martín-
меди(II) в растворе (ммоль/л).
Lara M.A., Blázquez G. // Bioresour. Technol. 2018.
Vol. 252. P. 100. doi 10.1016/j.biortech.2017.12.074
КОНФЛИКТ ИНТЕРЕСОВ
8. Choińska-Pulit A., Sobolczyk-Bednarek J., Łaba W. //
Ecotoxicol. Environ. Saf. 2018. Vol. 149. P. 275. doi
Авторы заявляют об отсутствии конфликта
10.1016/j.ecoenv.2017.12.008
интересов.
9. Bilal M., Shah J.A., Ashfaq T., Gardazi S.M.H.,
СПИСОК ЛИТЕРАТУРЫ
Tahir A.A., Pervez A., Haroon H., Mahmood Q. // J.
Hazard. Mater. 2013. Vol. 263. P. 322. doi 10.1016/j.
1. Krstić V., Urošević T., Pešovski B. // Chem. Eng. Sci.
jhazmat.2013.07.071
2018. Vol. 192. P. 273. doi 10.1016/j.ces.2018.07.022
10. Алосманов Р.М. // Сорбц. xромат. проц. 2010. Т. 10.
2. Acheampong M.A., Pakshirajan K., Annachhatre A.P.,
С. 427.
Lens P.N.L. // J. Ind. Eng. Chem. 2013. Vol. 19. P. 841.
11. Senthil Kumar P., Sathya Selva Bala V., Ramakrishnan K.,
doi 10.1016/j.jiec.2012.10.029
Vijayalakshmi P., Sivanesan S. // Russ. Chem. Bull.
3. Ahmady-Asbchin S., Andrès Y., Gérente C., Cloirec P.L. //
2010. Vol. 59. P. 1859. doi 10.1007/s11172-010-0325-7
Bioresour. Technol. 2008. Vol. 99. P. 6150. doi
12. Лурье Ю.Ю. Справочник по аналитической химии.
10.1016/j.biortech.2007.12.040
М.: НД «Альянс», 2007. 448 с.
4. Akkaya G., Güzel F. // Desalin. Water Treat. 2013.
13. Щегров Л.Н. Фосфаты двухвалентных металлов.
Vol. 51. P. 7311. doi 10.1080/19443994.2013.815685
Киев: Наукова думка, 1987. 216 c.
Sorption of Copper(II) Ions by Nanosized Magnesium
Phosphate
A. V. Balandina*, E. V. Okina, O. V. Tarasova, L. V. Nachkina, S. G. Kostryukov,
V. M. Kyashkin, A. D. Yudina, Yu. I. Lyukshin, A. A. Akhmatova, and E. O. Soloviev
N.P. Ogarev National Research Mordovian State University, ul. Bolshevistskaya 68, Saransk, 430005 Russia
*e-mail: iman081@gmail.com
Received April 30, 2019; revised June 27, 2019; accepted July 1, 2019
A new approach to the preparation of a nanosized sorbent based on magnesium phosphate was developed. The
patterns of sorption of copper(II) ions by nanosized magnesium phosphate from aqueous solutions were inves-
tigated. The sorption characteristics were determined, as well as the kinetics and mechanism of the ongoing
processes. The high sorption ability of a nanoscale sorbent is shown in comparison with existing sorbents based
on magnesium phosphate.
Keywords: nanosized sorbents, magnesium phosphate, sorption of copper(II) ions, sorption mechanism
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019