ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 12, с. 1965-1968
ПИСЬМА
В РЕДАКЦИЮ
УДК 547.379
СБОРКА ТИАЗОЛО[3,2-а]ПИРИДИНИЕВЫХ СОЛЕЙ
ПО РЕАКЦИИ 2-ПИРИДИНСУЛЬФЕНИЛГАЛОГЕНИДОВ
С ВИНИЛЭТИЛОВЫМ ЭФИРОМ
© 2019 г. В. А. Потаповa,*, Р. С. Ишигеевa, И. В. Шкурченкоa, b, С. В. Амосоваa
a Иркутский институт химии имени А. Е. Фаворского Сибирского отделения Российской академии наук,
ул. Фаворского 1, Иркутск, 664033 Россия
*e-mail: v_a_potapov@irioch.irk.ru
b Иркутский государственный университет, Иркутск, Россия
Поступило в Редакцию 23 августа 2019 г.
После доработки 23 августа 2019 г.
Принято к печати 26 августа 2019 г.
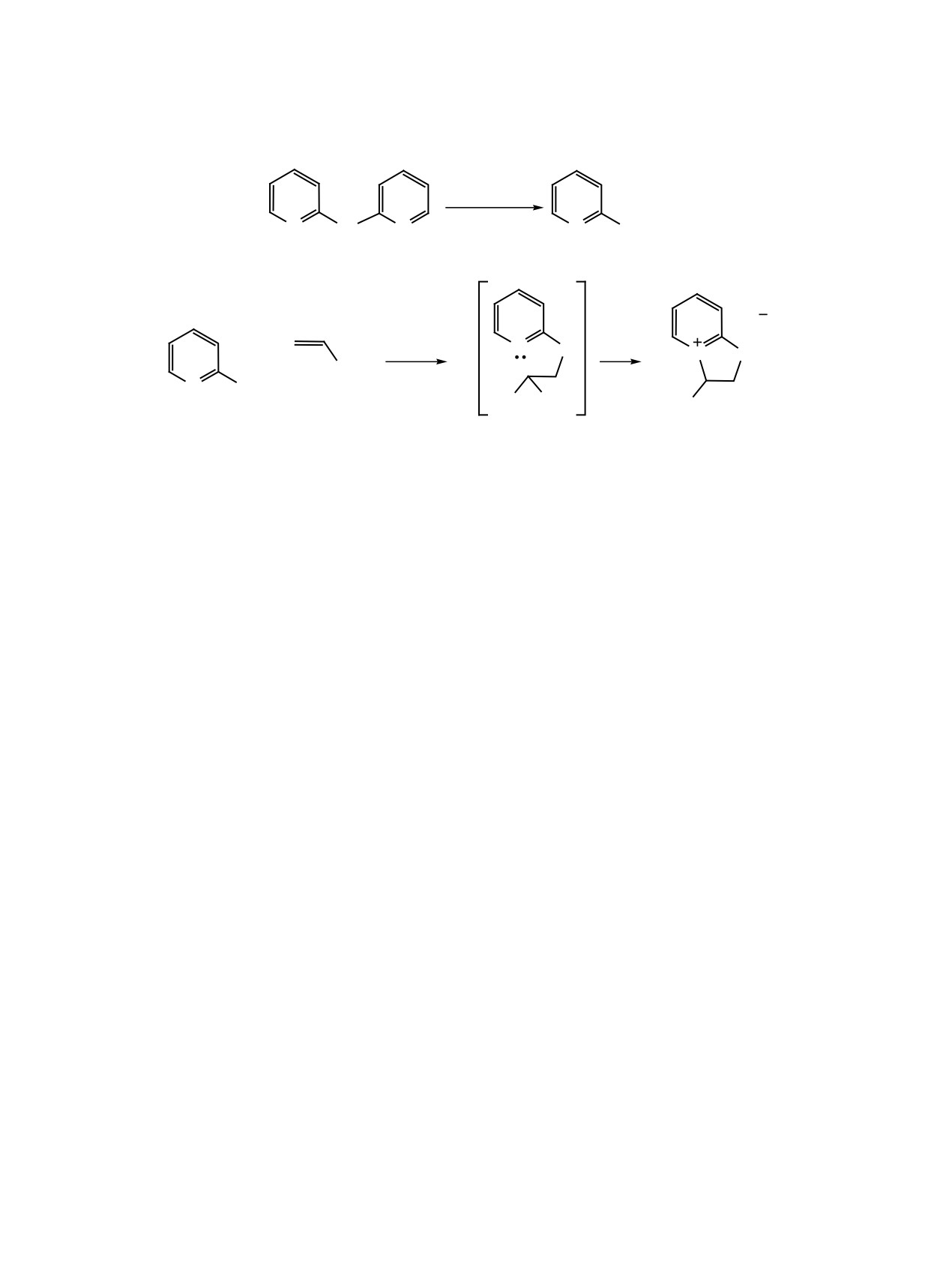
На основе реакции 2-пиридинсульфенилгалогенидов с винилэтиловым эфиром разработан региоселек-
тивный метод синтеза 3-этокси-2H,3H-[1,3]тиазоло[3,2-a]пиридин-4-ийгалогенидов.
Ключевые слова: винилэтиловый эфир, 2-пиридинсульфенилгалогениды, тиазоло[3,2-a]пиридин-4-
ийгалогениды
DOI: 10.1134/S0044460X19120230
Значительная часть известных медицинских
зуется в синтезе конденсированных соединений
препаратов содержит пиридиновое кольцо, в ряде
по реакции присоединения к двойной связи [11]. В
случаев - в сочетании с конденсированным серо-
этой работе нами описана реакция бромида 2 с ци-
содержащим циклом (цефалоридин, цефапирин,
клоалкенами, которая приводит к аннелированию
пироксикам и др.) [1, 2]. Производные пиридина
и образованию соответствующих трициклических
с серосодержащими функциональными группами
конденсированных соединений. В аналогичных
проявляют противоопухолевую, противовирус-
условиях реакция хлорида 1 с циклоалкенами
ную, противовоспалительную и анти-ВИЧ ак-
приводит к продуктам электрофильного присо-
тивность [3-6]. Синтез новых водорастворимых
единения,
1-(2-пиридинилсульфанил)-2-хлорци-
гетероциклических соединений, содержащих фар-
клоалканам [11]. Аннелирование этих продуктов
макофорные группы, и исследование их свойств
не наблюдается. Различие в поведении хлоридов
является актуальной задачей.
и бромидов объясняется более высокой реакци-
онной способностью промежуточных 1-(2-пири-
В последние годы нами разрабатываются под-
ходы к синтезу аннелированных халькогенорга-
динилсульфанил)-2-бромциклоалканов по сравне-
нию с аналогичными хлорпроизводными. В этих
нических гетероциклических соединений на ос-
соединениях внутримолекулярное нуклеофиль-
нове серо- и селенсодержащих электрофильных
ное замещение брома атомом азота пиридинового
реагентов (SCl2, SeHlg2,
2-PySHlg,
2-PySeHlg,
кольца протекает уже при комнатной температуре
Hlg = Cl, Br) [7-11]. Эффективным реагентом
для получения производных тиазоло[3,2-a]пи-
и приводит к трициклическим конденсированным
гетероциклам.
ридинов является 2-пиридинсульфенилхлорид 1
[11, 12]. Химические свойства 2-пиридинсульфе-
Реакции 2-пиридинсульфенилгалогенидов 1 и
нилбромида 2 изучены недостаточно, известна
2 с алкилвиниловыми эфирами не описаны в ли-
лишь одна работа, в которой этот реагент исполь-
тературе. С целью синтеза новых конденсирован-
1965
1966
ПОТАПОВ и др.
Схема 1.
SO2Cl2 (Br2)
CH2Cl2
N SS
N
N
SHlg
1, 2
Hlg
CH2Cl2
N S
N S
+
OEt
20qC
N SHlg
EtO Hlg
EtO
5, 6
3, 4
Hlg = Cl (1, 3, 5), Br (2, 4, 6).
ных соединений с потенциальной биологической
му углероду молекулы винилового эфира, что и
активностью нами изучены реакции с винилэтило-
происходит. Образование региоизомеров продук-
вым эфиром галогенидов 1 и 2. Последние получе-
тов 3 и 4 не наблюдается.
ны взаимодействием ди(2-пиридинил)дисульфида
Строение и состав соединений 3 и 4 подтверж-
с хлористым сульфурилом или бромом в хлори-
дены методами ЯМР 1H, 13C и данными элемент-
стом метилене (схема 1). Установлено, что реак-
ного анализа. В спектрах ЯМР 13C соединений 3
ция, проводимая при эквимольном соотношении
и 4 наблюдается слабопольный сигнал СН-группы
реагентов в хлористом метилене при комнатной
при ~99.3 м. д., который соответствует атому угле-
температуре, протекает региоселективно (схема 1).
рода, связанного одновременно с атомами кисло-
Реакция хлорида
1 с винилэтиловым эфиром
рода и четвертичного азота.
заканчивается в течение 5 ч, приводя к 3-эток-
Таким образом, на основе реакции 2-пиридин-
си-2H,3H-[1,3]тиазоло[3,2-a]пиридин-4-ийхлори-
сульфенилхлорида и 2-пиридинсульфенилброми-
ду 3 с количественным выходом. Выход бромисто-
да с винилэтиловым эфиром разработан региосе-
го аналога 4 составляет 75% при продолжительно-
лективный метод синтеза новых конденсирован-
сти процесса 48 ч.
ных водорастворимых 3-этокси-2H,3H-[1,3]тиазо-
Как следует из полученных данных, реакция с
ло[3,2-a]пиридин-4-ийгалогенидов с потенциаль-
хлоридом 1 протекает значительно быстрее, чем с
ной биологической активностью.
бромидом 2. Однако в отличие от реакции галоге-
3-Этокси-2Н,3Н-[1,3]тиазоло[3,2-a]пиридин-
нидов 1 и 2 с циклоалкенами [11] взаимодействие
4-ийхлорид (3). К раствору 0.175 г (0.79 ммоль)
винилэтилового эфира как с бромидом 2, так и с
ди(2-пиридинил)дисульфида в 10 мл CH2Cl2 до-
хлоридом 1 приводит к конденсированным про-
бавляли раствор 0.107 г (0.79 ммоль) сульфу-
дуктам. Вероятно, такое отличие связано с тем, что
рилхлорида в 10 мл CH2Cl2. Полученную смесь
внутримолекулярной циклизации с образованием
перемешивали 10 мин, затем добавляли раствор
аннелированных продуктов способствует наличие
винилэтилового эфира 0.115 г (1.59 ммоль) в
этоксигруппы в интермедиатах 5 и 6, которая со-
5 мл CH2Cl2 и перемешивали при комнатной тем-
действует вытеснению геминального атома гало-
пературе 5 ч. Растворитель удаляли, остаток су-
гена.
шили в вакууме. Выход 0.344 г (100%), бежевый
Региоселективность реакции определяется тем,
порошок, растворимый в воде, т. пл. 132-134°С
что в сульфенилгалогенидах группа RS электро-
(CHCl3). Спектр ЯМР 1H, δ, м. д.: 1.27 т (3Н, CH3,
фильна и должна присоединяться к терминально-
3J = 7.0 Гц), 3.82 д. д (1H, SCH2, 2J = 13.0, 3J =
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
СБОРКА ТИАЗОЛО[3,2-а]ПИРИДИНИЕВЫХ СОЛЕЙ
1967
2.6 Гц), 3.93 к (2H, OCH2, 3J = 7.0 Гц), 4.10 д. д
2. Лукевиц Е. // ХГС. 1995. № 6. С. 723; Lukevits E. //
(1H, SCH2, 2J = 13.0, 3J = 6.0 Гц), 6.64 д. д (1Н,
Chem. Heterocycl. Compd. 1995. Vol. 31. N 6. P. 639.
NCH, 3J = 6.0, 3J = 2.6 Гц), 7.72-7.76 м (1HPy),
doi 10.1007/BF01169065
8.02-8.04 м (1HPy), 8.34-8.38 м (1HPy), 8.85-8.87
3. Kedarnath G., Jain V.K. // Coord. Chem. Rev. 2013.
м (1HPy). Спектр ЯМР 13C, δС, м. д.: 14.19 (CH3),
Vol. 257. P. 1409. doi 10.1016/j.ccr.2013.01.003
34.85 (SCH2), 66.74 (OCH2), 99.33 (CHN+), 122.76
4. Zhang Y., Liu B., Wu X., Li R., Ning X., Liu Y., Liu Z., Ge Z.,
(Py), 123.92 (Py), 140.92 (Py), 146.08 (Py), 159.79
Li R., Yin Y. // Bioorg. Med. Chem. 2015. Vol. 23.
(NCS, Py). Найдено, %: С 49.92; Н 5.43; Cl 15.98;
P. 4815. doi 10.1016/j.bmc.2015.05.041
N 6.61; S 15.02. C9H12ClNOS. Вычислено, %: С
5. Yoon D.S., Wu S.C., Seethala R., Golla R., Nayeem A.,
49.65; Н 5.56; Cl 16.28; N 6.43; S 14.73.
Everlof J.G., Gordon D.A., Hamann L.G., Robl J.A. //
3-Этокси-2Н,3Н-[1,3]тиазоло[3,2-a]пиридин-
Bioorg. Med. Chem. Lett. 2014. Vol. 24. P. 5045. doi
4-ийбромид (4) получали аналогично из бромида
10.1016/j.bmcl.2014.09.012
2 и винилэтилового эфира, время реакции - 48 ч.
6. Pan B.C., Chen Z.H., Piras G., Dutschman G.E.,
Выход 75%, бежевый порошок, растворимый в
Rowe E.C., Cheng Y.C., Chu S.H. // J. Heterocycl. Chem.
воде, т. пл. 195-197°С (CHCl3). Спектр ЯМР 1H,
1994. Vol. 31. P. 177. doi 10.1002/jhet.5570310130
δ, м. д.: 1.27 т (3Н, CH3, 3J = 7.0 Гц), 3.83 д. д (1H,
7. Potapov V.A., Musalov M.V., Amosova S.V. // Tetra-
SCH2, 2J = 13.0, 3J = 2.6 Гц), 3.94 к (2H, OCH2, 3J =
hedron Lett. 2011. Vol. 52. P. 4606. doi10.1016/j.
7.0 Гц), 4.14 д. д (1H, SCH2, 2J = 13.0, 2J = 6.0 Гц),
tetlet.2011.06.071
6.68 д. д (1Н, NCH, 3J = 6.0, 3J = 2.6 Гц), 7.75-7.79
8. Мусалов М.В., Потапов В.А., Мусалова М.В., Амо-
м (1HPy), 8.05-8.07 м (1HPy), 8.36-8.40 м (1HPy),
сова С.В. // ЖОрХ. 2014. Т. 50. Вып. 11. С. 1712;
8.90-8.91 м (1HPy). Спектр ЯМР 13C, δС, м. д.: 14.50
Musalov M.V., Potapov V.A., Musalova M.V., Amoso-
(CH3), 35.20 (SCH2), 66.89 (OCH2), 99.30 (CHN+),
va S.V. // Russ. J. Org. Chem. 2014. Vol. 50. N 11. С.
122.95 (Py), 124.05 (Py), 141.09 (Py), 146.22 (Py),
1702. doi 10.1134/S107042801411030X
159.69 (NCS, Py). Найдено, %: С 41.52; Н 4.80; Br
9. Мусалов М.В., Потапов В.А., Амосова С.В. // Изв.
30.19; N 5.51; S 11.97. C9H12BrNOS. Вычислено,
АН. Сер. хим. 2011. Вып. 4. С. 751; Musalov M.V.,
%: С 41.23; Н 4.61; Br 30.48; N 5.34; S 12.23.
Potapov V.A., Amosova S.V. // Russ. Chem. Bull. 2011.
Спектры ЯМР сняты на приборе Bruker DPX-
Vol. 60. N 4. P. 767. doi 10.1007/s11172-011-0120-0
400 в D2O на рабочих частотах 400.13 (1Н) и 100.61
10. Мусалов М.В., Ишигеев Р.С., Удалова С.И., Мусало-
(13С), внешний стандарт - ГМДС.
ва М.В., Куркутов Е.О., Хабибулина А.Г., Алба-
Спектральные исследования проведены с ис-
нов А.И., Потапов В.А., Амосова С.В. // ЖОрХ.
пользованием материально-технической базы
2018. Т. 54. Вып. 7. С. 1031; Musalov M.V., Ishige-
Байкальского аналитического центра коллектив-
ev R.S., Udalova S.I., Musalova M.V., Kurkutov E.O.,
ного пользования СО РАН.
Khabibulina A.G., Albanov A.I., Potapov V.A., Amoso-
ФОНДОВАЯ ПОДДЕРЖКА
va S.V. // Russ. J. Org. Chem. 2018. Vol. 54. N 7. С.
1035. doi 10.1134/S1070428018070114
Работа выполнена при финансовой поддержке
11. Potapov V.A., Ishigeev R.S., Amosova S.V., Borodi-
Российского научного фонда (проект № 18-13-00372).
na T.N. // Tetrahedron Lett. 2019. Vol. 60. P. 475. doi
10.1016/j.tetlet.2019.01.001
КОНФЛИКТ ИНТЕРЕСОВ
12. Борисов А.В., Мацулевич Ж.В., Османов В.К., Бо-
Авторы заявляют об отсутствии конфликта
рисова Г.Н., Мамедова Г.З., Магаррамов А.М., Хру-
интересов.
сталев В.Н. // ХГС. 2012. № 7. C. 1180; Borisov A.V.,
Matsulevich Zh.V., Osmanov V.K., Borisova G.N.,
СПИСОК ЛИТЕРАТУРЫ
Mammadova G.Z., Maharramov A.M., Khrustalev V.N. //
1. Машковский М.Д. Лекарственные средства. М.: Но-
Chem. Heterocycl. Compd. 2012. Vol. 48. N 7. P. 1098.
вая волна, 2012. 1216 с.
doi 10.1007/s10593-012-1104-1
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019
1968
ПОТАПОВ и др.
Synthesis of Thiazolo[3,2-а]pyridinium Salts by Reaction
of 2-Pyridinesulfenyl Halides with Vinyl Ethyl Ether
V. A. Potapova, *, R. S. Ishigeeva, I. V. Shkurchenkoa, b, and S. V. Amosovaa
aA. E. Favorskii Irkutsk Institute of Chemistry of the Siberian Branch of the Russian Academy of Sciences,
ul. Favorskogo 1, Irkutsk, 664033 Russia
*e-mail: v_a_potapov@irioch.irk.ru
b Irkutsk State University, Irkutsk, Russia
Received August 23, 2019; revised August 23, 2019; accepted August 26, 2019
The regio- and stereoselective synthesis of 3-ethoxy-2H,3H-[1,3]thiazolo[3,2-a]pyridin-4-ium halides was
developed based on the reaction of 2-pyridinesulfenyl halides with vinyl ethyl ether.
Keywords: vinyl ethyl ether, 2-pyridinesulfenyl halides, thiazolo[3,2-a]pyridin-4-ium halides
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 12 2019