ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 2, с. 167-180
УДК 543.062
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ СИНТЕЗА
ПЕРОВСКИТА BaBiO3
© 2019 г. Н. В. Барковский*
Институт физики твердого тела Российской академии наук,
ул. Академика Осипьяна, 2, Черноголовка, 142432 Россия
*е-mail: barkov@issp.ac.ru
Поступило в Редакцию 9 августа 2018 г.
После доработки 28 сентября 2018 г.
Принято к печати 8 октября 2018 г.
Дано физико-химическое обоснование оптимальным условиям синтеза оксида BaBiO3, не содержащего
примесей кислорододефицитных фаз BaBiO3-x и BaСO3. Уменьшение времени контакта расплава с
тиглем позоляет получить образцы BaBiO3, минимально загрязненные материалом тигля. При
длительном отжиге на воздухе при 450°C обнаружено аномальное поведение BaBiO3, обусловленное
взаимодействием с CO2.
Ключевые слова: оксид BaBiO3, кислорододефицитные фазы, валентное состояние, рентгеновская
дифракция, химический анализ
DOI: 10.1134/S0044460X1902001X
BaBiO3 - первый перовскит, в структуре которого
Этот оксид ценен тем, что устойчив к поверхност-
упорядочены ионы одного и того же элемента,
ному окислению и разложению в отличие от извест-
висмута. Cогласно данным рентгеновской и
ных халькогенидных топологических изоляторов.
нейтронной дифракции [1], решетка перовскита
BaBiO3 - сегнетоэлектрик с температурой Кюри
BaBiO3 удвоена (Ba2Bi3+Bi5+O6) и содержит висмут
~320°C [5]. Благодаря окислительным свойствам,
в двух валентных состояниях - Bi3+ и Bi5+. Моно-
BaBiO3 нашел применение в органическом синтезе
клинный BaBiO3 (пространственная группа I2/m)
как катализатор селективного окислительного де-
существует при комнатной температуре и при
гидрирования углеводородов, в частности, пропена,
нагревании испытывает фазовые превращения в
а также окисления метана
[6].
Недавно
ромбоэдрическую фазу R¯m при
~130°С и из
обнаружены фотокаталитические свойства BaBiO3
R¯m→Fm¯m (кубическая фаза) - при ~480°С [2].
[7,
8]. Перовскит BaBiO3 может эффективно
Фазовые превращения не сопровождаются
разлагать органические вещества различных
изменением стехиометрии по атому кислорода,
классов (4-хлорфенол [8], газообразный ацеталь-
т. е. валентное состояние висмута остается неиз-
дегид и водный раствор метиленового синего [7])
менным в Ba2Bi3+Bi5+O6 от низких температур до
при облучении УФ или видимым светом с длиной
температур, при которых фиксируется кубическая
волны λ < 650 нм. BaBiO3 имеет самую узкую
фаза Fm¯m. Высокотемпературные модификации
ширину запрещенной зоны среди содержащих
BaBiO3 не удается закалить жидким азотом,
висмут оксидных фотокатализаторов. Кроме того,
поэтому их идентификация проведена in situ.
характеризуется подходящим потенциалом
BaBiO3
BaBiO3 считается полупроводником p-типа с
валентной зоны и зоны проводимости, а также
низкой концентрацией носителей заряда
[3].
большим временем жизни и высокой подвиж-
Оптическая ширина запрещенной зоны BaBiO3
ностью генерированных светом носителей зарядов [8].
составляет 2.05 эВ [4]. В последние годы интерес к
этому материалу возник вновь. BaBiO3 - первый
Методы синтеза моноклинного BaBiO3 можно
оксидный трехмерный топологический изолятор с
разделить на твердофазный, расплавный [9-11],
большой шириной запрещенной зоны, относя-
гидротермальный [2] и золь-гель синтез [7, 12, 13].
щийся к новому классу квантовых материалов [4].
Расплавный и гидротермальный методы исполь-
167
168
БАРКОВСКИЙ
зовали для выращивания кристаллов BaBiO3. По
ческие параметры (температура, время, атмосфера,
имеющимся на сегодняшний день литературным
скорость охлаждения) для получения максимально
данным, экспериментальные условия синтеза
чистого, однородного по составу BaBiO3, которые
BaBiO3 существенно различаются. Этот оксид
необходимо выяснить. Вместе с тем, из анализа
получали из различных соединений бария: BaO
литературы следует, что условия синтеза моно-
[14, 15], BaO2 [5, 16-18], BaСO3 [9, 10, 19, 20],
клинного BaBiO3 определяют объем его элемен-
Ba(OH)2·8H2O и BaO2 [2], Ba(NO3)2 [21-24]. В
тарной ячейки, который изменяется от 326.78 [8]
большинстве работ для синтеза использовали
до 331.09 Å3 [38].
оксид Bi2O3, за исключением методов, где
Применение наряду с традиционными струк-
источником висмута служил кристаллогидрат
турными методами рентгеновской и нейтронной
Bi(NO3)3·5H2O [2, 4, 6, 8, 25, 26].
дифракции метода элементного анализа в
Керамические образцы BaBiO3 синтезировали в
просвечивающем электронном микроскопе (ПЭМ)
широких интервалах температур (650 [7], 720-770
[39,
40] показало, что синтезированный в
[15, 27, 28], 780 [5], 800 [2, 6, 16], 825 [29], 850 [8],
различных условиях BaBiO3 (керамика или рас-
900
[20],
1000°С
[30]) и времени отжига от
плав) из различных соединений бария может
нескольких (2 [5], 5 [7], 8 ч [31]) до десятков (10
содержать примеси BaСO3, BaAl2O4, не детекти-
[22, 30], 12 [29], 15 [12], 24 [26], 72 ч [32]) и даже
руемые методом рентгеновской дифракции.
сотен часов (120 [33], 240 [34], 480 ч [28]). При
Причины их образования и влияние их на фазовый
минимальной температуре (650°С) отжигали соеди-
состав синтезируемых образцов не выявлены.
нение, полученное золь-гель методом с использо-
Основные технологические параметры синтеза
ванием лимонной и этилендиаминтетрауксусной
оксидов Ba-Bi-O
[41], строгое соблюдение
кислот в аммиачном растворе [7]. Синтезы BaBiO3
которых обеспечивает получение однофазного
проводили как в одну стадию [5, 10, 30], так и в
соединения, - это температура, время отжига и
несколько стадий [24, 34] с промежуточной гомо-
атмосфера. Температуру синтеза определяет не
генизаций путем измельчения и прессования на
только область термической устойчивости синтези-
воздухе [31, 32] или в атмосфере кислорода [26, 32].
руемого оксида, но также природа и физико-
Расплавные образцы BaBiO3 получали при 1050
химические свойства исходных реагентов.
[22, 35], 1060 [10], 1080 [36], 1100 [11, 24], 1125
Температура и время отжига должны быть опти-
[32], 1200°С [9], т. е. с существенным перегревом
мальными и обеспечивать, с одной стороны,
расплава. Для синтеза из расплава важен выбор
полное взаимодействие исходных реагентов, с
материала тигля. Использовали тигли из Al2O3
другой стороны, - необходимое для конкретной
[10, 11, 26], Pt [1, 9, 37], Au [2]. О взаимодействии
фазы количество кислорода, который вносится с
расплава при синтезе BaBiO3 с Al2O3, Pt и Au не
реагентами или из атмосферы синтеза.
сообщалось. Кристаллы выращивали гидротермаль-
Наилучшее исходное соединение бария для
ным методом
[2] (состав шихты Ba:Bi
=
1:1,
синтеза BaBiO3 - Ba(NO3)2, которое можно легко
300 МПа, 700°С, 8 ч), спонтанной кристаллизацией
получить в виде весовой формы. Реактив
на сетке из Pt [33] и методом зонной плавки [11].
пероксида BaO2, несмотря на высокую скорость
Время контакта расплава с тиглем составляло 6-
взаимодействия с Bi2O3 [42], содержит примеси
12 ч (Pt) [9], ~50 ч (Al2O3) [11]. При медленном
BaCO3, Ba(OH)2·8H2O, H2O и, следовательно, не
охлаждении расплава от 1100 до 900°С в течение
может использоваться в качестве весовой формы
100 ч выращены монокристаллы BaBiO3 размером
из-за непостоянного состава. Другие соединения
5×5×1 мм
[11] хорошего качества с осью c,
бария не нашли широкого применения в синтезе
перпендикулярной поверхности роста.
BaBiO3, в частности, BaO из-за своей гигро-
Столь широкий спектр экспериментальных
скопичности, высокой реакционной способности
условий не позволяет прийти к однозначному
по отношению к CO2 и H2O воздуха и низкой
выводу об оптимальных условиях синтеза одно-
скорости взаимодействия с Bi2O3
[43]. BaСO3
фазного BaBiO3. Описанные в литературе условия
[9-10, 34] обладает достаточно высокой терми-
получения подобраны эмпирически без физико-
ческой устойчивостью (только при температуре
химического обоснования. Из литературных
выше 1000°С диссоциирует на BaO и CO2). Относи-
данных не очевидны оптимальные технологи-
тельно невысокая скорость взаимодействия BaСO3
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ СИНТЕЗА ПЕРОВСКИТА
169
Таблица
1. Результаты химических тестов по обнаружению O2- и Bi(V) в образце BaO2:0.5Bi2O3 (мол.),
последовательно отожженном при 300-600°C на воздухе или в атмосфере аргона (0.5 ч при каждой температуре)
Температура отжига, °С
Реагент
300
400
500
600
Основание Арнольда
Без изменений
Синий
Сине-черный
Метиловый красный в HCl
Малиновый
Мгновенное обесцвечивание
Ti(IV) в H2SO4
Желтый
Светло-желтый
Без изменений
Mn(CH3COO)2 в HNO3
Выделение газа
Без изменений
Слабо-розовый
Красно-фиолетовый
с Bi2O3 при синтезе BaBiO3 требует длительного
или в атмосфере аргона. При тестировании
отжига с многочисленными гомогенизациями
образца, отожженного при
600°С, усиливается
[20,
28,
38]. На начальном этапе синтез с
интенсивность окраски продуктов окисления
-
использованием термически устойчивого BaСO3
основания Арнольда и перманганат-иона
- в
необходимо проводить при температурах 800-900°С,
реакции с Mn(CH3COO)2 в HNO3, что свидетель-
превышающих температуры синтеза с исполь-
ствует об увеличении концентрации образую-
зованием BaO2 или Ba(NO3)2.
щегося Bi(V) при 600°С. Интенсивное окисление Bi(III)
при этой температуре сопровождается появлением
Исследование процессов фазообразования в системе
темно-коричневой окраски образца. Тест с солью
Ba-Bi-O [41] показало, что формирование оксидов
Ti(IV) показывает, что BaO2 разлагается при
гомологических рядов BamBim+nOy-Bam+nBimOy (m = 1,
температуре выше 400°С. Поскольку все тесты
2, ...; n = 0, 1, 2, ...) происходит, как правило, с
проводили с использованием реагентов в кислых
участием окислителя, способного окислить Bi(III)
средах, когда высока вероятность окислительно-
до Bi(V). Таким окислителем является как
восстановительной реакции (3) между дипероксид-
атмосферный кислород, так и кислород,
ионом и Bi(V), то, по всей вероятности, качест-
образующийся при термическом разложении
венно обнаруживается избыток либо Bi(V), либо
пероксида и нитрата бария (1), (2).
O2-, не вступив-ший в реакцию (3).
4BaO2 + 2Bi2O3 → 4BaBiO3 + O2↑,
(1)
O2-+ Bi(V) → Bi(III)+ O2↑.
(3)
4Ba(NO3)2 + 2Bi2O3 → 4BaBiO3 + 8NO2↑ + O2↑.
(2)
При использовании BaСO3 продукт разложения
(CO2) не обладает окислительными свойствами,
Как отмечалось в ранних работах по синтезу
следовательно, при отжиге смесей BaСO3 с Bi2O3
оксидов Ba-Bi-O состава 1:1, 2:3 и 1:2 [42, 44], по
на воздухе окислителем Bi(III) является только
данным термогравиметрических исследований,
атмосферный кислород.
взаимодействие BaO2 и Bi2O3 начинается при 360-
540°С. Химические тесты позволяют оценить
Таким образом, кислород при формировании
температуру,
при которой
заканчивается
оксида BaBiO3 окисляет Bi(III) в Bi(V). В отсут-
разложение BaO2 и образуется Bi(V). Образец BaO2-
ствие кислорода (атмосфера аргона) моноклинный
0.5Bi2O3 в виде спрессованной таблетки отжигали
BaBiO3 не образуется [41]. При использовании
последовательно по 0.5 ч при 300, 400, 500 и 600°С
BaO2 [5, 16-18] и Ba(NO3)2 [23, 24] [реакции (1) и
на воздухе или в атмосфере аргона. Независимо от
(2)] источником кислорода являются сами
состава атмосферы отжига при 400°С таблетка
исходные реагенты бария, поэтому скорость их
приобретала серый цвет, переходящий при
взаимодействия с Bi2O3 выше, чем в реакции с
повышении температуры в темно-серый (500°С),
BaCO3. Взаимодействие Bi2O3 с BaO в отсутствие
затем в темно-коричневый (600°С). С закаленными
кислорода происходит в течение очень длитель-
образцами проводили тесты на наличие O2- и
ного времени. Казалось бы близкие по природе
Bi(V) (табл.
1)
[45]. Результаты тестов не
реакции между Bi2O3 и BaO или BaCO3 нельзя
противоречат данным гравиметрического и
рассматривать как аналоги, поскольку
«фазо-
термогравиметрического анализов, полученным в
образование, валентное состояние висмута,
работе
[42]. Bi(V) надежно обнаруживается в
направление массопереноса и природа лимити-
образцах, отожженных при 500 и 600°С на воздухе
рующей стадии в них различны» [43]. Так как
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
170
БАРКОВСКИЙ
образование BaBiO3 по реакции
(2)
∆m/mтеор =
3×103
‒20.23% еще не достигается. Поэтому дальнейший
отжиг (24-72 ч) проводили после измельчения и
3
2×10
прессования таблетки. Через 48 ч потеря массы
∆m/m = -20.18% приближается к теоретической, а к
(а)
1×103
72 ч - практически совпадает с ней в пределах
ошибки гравиметричесого анализа.
0
Кинетическая кривая -∆m/m = f(τ) не имеет на
начальном этапе индукционного периода, типич-
8×104
ного для аналогичных кривых, описывающих
(б)
классические твердофазные реакции [46]. Излом
4×104
кривой на этапе отжига в течение ~1-2 ч, вероятно,
свидетельствует об образовании промежуточных
0
продуктов термического разложения Ba(NO3)2 -
Ba(NO2)2 и BaO2-x, в дальнейшем вступающих во
взаимодействие с Bi2O3. Скорость взаимодействия
1×104
исходных веществ на начальном этапе выше, о чем
(в)
свидельствует больший тангенс угла наклона
5×103
кривой -∆m/m = f(τ).
Рентгенограмма полученного соединения соот-
0
ветствует моноклинному BaBiO3 (рис.
1а) с
параметрами a = 6.183, b = 6.136, c = 8.666 Å, β =
2θ, град
90.18°, V
= 328.78 Å3. По данным химического
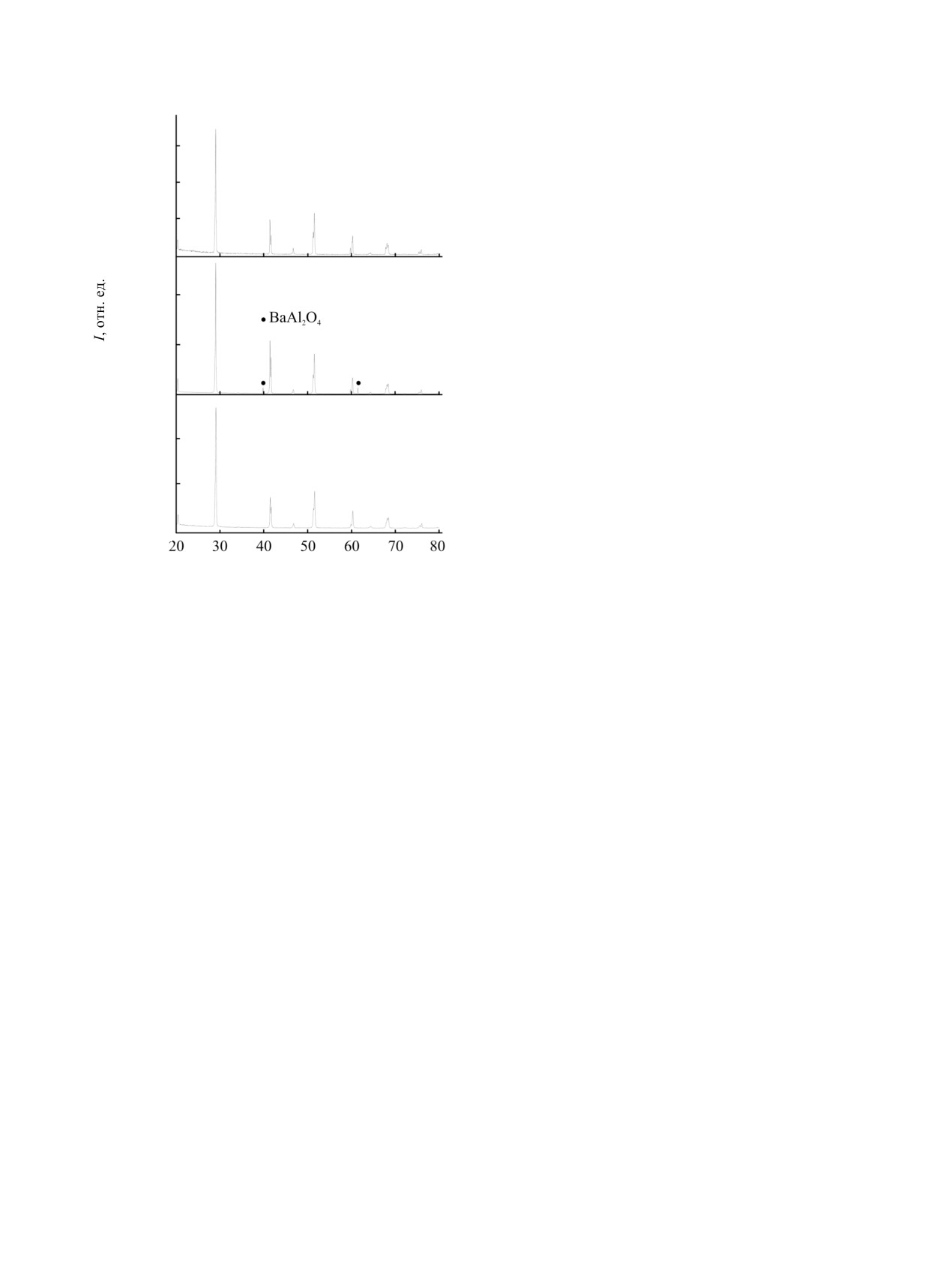
Рис.
1. Рентгенограммы образцов моноклинного
анализа, его состав отвечает формуле BaBiO3.00(1)
оксида BaBiO3, синтезированных керамическим (а) и
[средняя степень окисления висмута ¯i 4.00(1)], и
расплавным (б, в) методом в алундовом (б) и
платиновом (а, в) тиглях.
все частицы имеют картины электронной дифрак-
ции, соответствующие BaBiO3 [40].
При синтезе BaBiO3 исходные вещества не
поток диффузии направлен в сторону BaCO3 (или
только должны полностью прореагировать, но и
BaO), то взаимодействие Bi2O3 с BaCO3, как бы
полученный оксид необходимо окислить до
неожиданным это не показалось, протекает с
значения кислородного индекса
3.00. Для
большей скоростью и при более низкой
увеличения скорости взаимодействия исходных
температуре, нежели в системе Bi2O3-BaO, из-за
веществ увеличивают температуру отжига, но
разрыхления синтезируемого продукта газо-
повышение температуры способствует обеднению
образным CO2 и облегчения диффузии Bi2O3.
полученного вещества кислородом за счет
Условия синтеза моноклинного BaBiO3, не
образования кислорододефицитной фазы BaBiO3-x.
содержащего примеси кислорододефицитных фаз
В этом случае необходимо «доокисление», которое
BaBiO3-x [40], вытекают из анализа схемы фазовых
обычно проводят в режиме медленного (со
состояний системы Ba-Bi-O в области 45-55 мол%
скоростью 1.7 [36], 2 [10, 11], 6 град/ч [32)]) охлаж-
BiO1.5 [39]. Согласно данным ДТА и ТГА, потеря
дения образца в кислородсодержащей атмосфере
кислорода оксидом BaBiO3 начинается при тем-
[19, 47, 48] или дополнительный отжиг в кислороде
пературе выше
620°С, поэтому для синтеза
[9,
29,
30] или на воздухе
[24]. Выбранная
выбрана оптимальная температура 600°С.
температура
(600°С) синтеза керамического
образца BaBiO3 оптимальна, поскольку исходные
Для определения времени, необходимого для
реагенты полностью вступают во взаимодейстие, а
завершения синтеза BaBiO3, методом гравимет-
образующиеся окислители (NO2 и O2) обеспе-
рического анализа проведены кинетические исследо-
чивают кислородную стехиометрию оксида.
вания взаимодействия Ba(NO3)2 с Bi2O3 на воздухе.
Через ~14 ч отжига устанавливается квазиравно-
Согласно схеме фазовых состояний системы
весие: кривая -∆m/m = f(τ) выходит на плато, но
Ba-Bi-O и данным ДТА [39], окисление BaBiO3-x
при этом теоретическая потеря массы в расчете на
до BaBiO3 заканчивается при 500-600°С. Тем не
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ СИНТЕЗА ПЕРОВСКИТА
171
4×103
1
2×103
(а)
2
0
t, ч
1×103
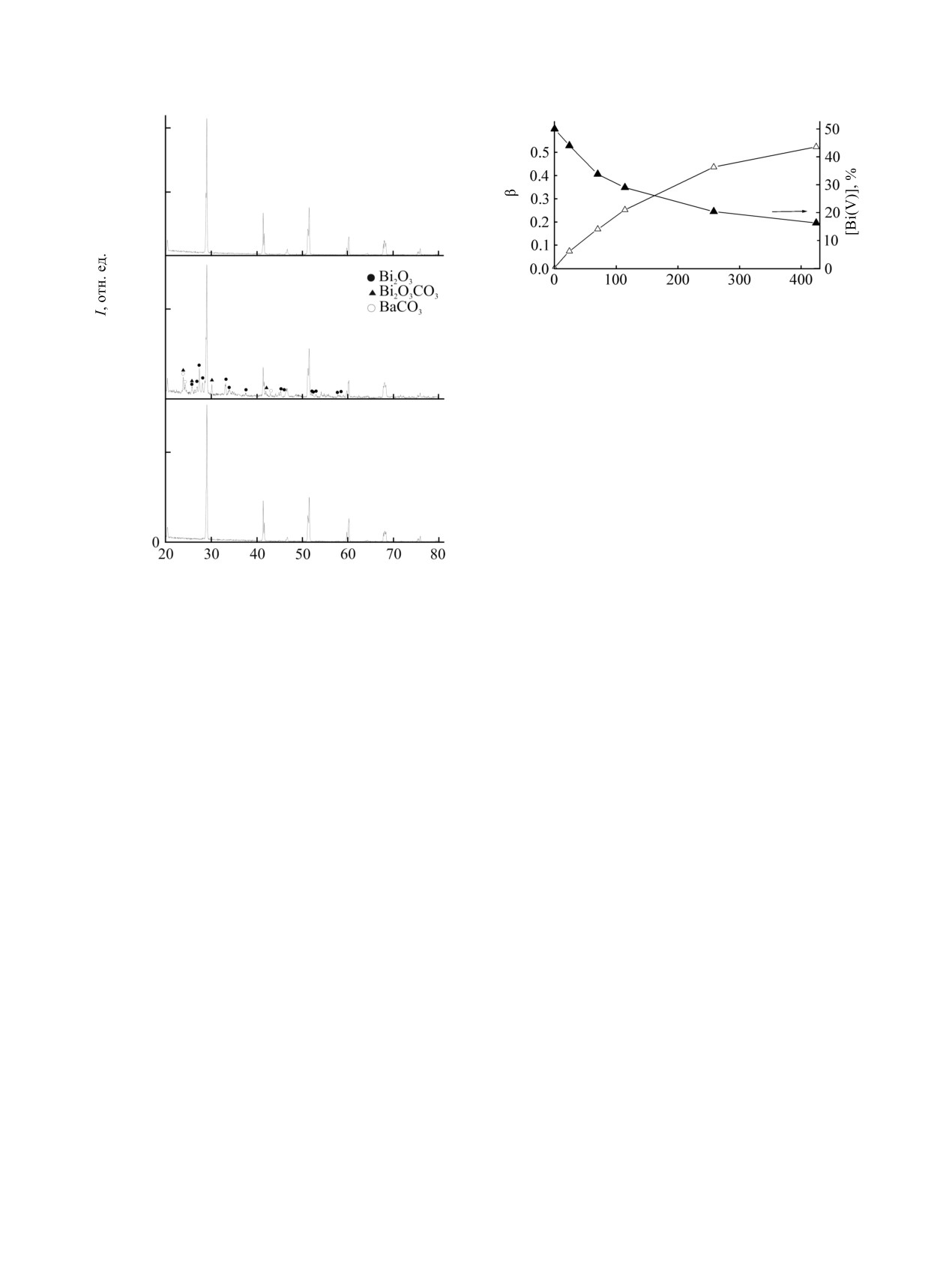
Рис. 3. Изменение степени превращения β (1) и доли
(б)
Bi(V) (2) в образце оксида BaBiO3 при отжиге на
воздухе (450°С).
вокруг основных рефлексов перовскитовой ячейки,
0
аналогичные наблюдаемым при облучении BaBiO3
в колонне ПЭМ [40]. Отжиг при 200°С не приводит
(в)
к заметным изменениям картины рентгеновской
2×103
дифракции (рис.
2а), параметров элементарной
ячейки (a = 6.182, b = 6.138, c = 8.668 Å, β = 90.15°,
V = 328.91 Å3) и содержания кислорода (химический
анализ).
При
450°С образец ведет себя аномально:
2θ, град
коричневый цвет изменяется на зеленый. На
Рис. 2. Рентгенограммы образцов моноклинного оксида
картине рентгеновской дифракции (рис. 2б) наряду
, отожженных на воздухе при 200 (1, 567 ч),
BaBiO3
с основными рефлексами моноклинного BaBiO3
45 (2, 424 ч) и 600°С (3, 335 ч). Неотмеченные рефлексы
(~49 мас%, параметры ячейки a = 6.184, b = 6.140,
принадлежат моноклинному BaBiO3.
c = 8.671 Å, β = 90.16°, V = 329.23 Å3) присут-
ствуют примесные, отнесенные к Bi2O3 (~12 мас%),
менее, следуя эмпирически подобранным условиям
BaCO3 (~37 мас%) и Bi2O2CO3 (следы). BaCO3 и
синтеза BaBiO3, охлаждение образцов проводят до
оксид Bi2O3 обнаружены также при электронно-
20°С (за исключением работы [48], где ограни-
микроскопическом исследовании. Увеличение
чились температурой 600°С).
времени отжига при 450°С ведет к увеличению
В охлажденном до
20°С образце BaBiO3
массы образца, не связанным с его окислением,
обнаружены [39] частицы с неперовскитоподобной
доля ионов Bi5+ в образце уменьшается (рис. 3,
структурой, включающие Ba при отсутствии Bi,
кривая 2). Степень превращения (рис. 3, кривая 1),
которые были идентифицированы как BaCO3. Для
рассчитанная как отношение n/Nисх (n и Nисх -
выявления условий образования примеси послед-
количество BaBiO3, прореагировавшее к моменту
него в BaBiO3 было проведено дополнительное
времени τ, и исходное) к 424 ч отжига, достигает
исследование. С этой целью образцы моно-
величины 0.52.
клинного BaBiO3 в виде таблетки длительно
Отжиг моноклинного BaBiO3 при 450°С в атмо-
отжигали на воздухе в изотермических условиях в
сфере аргона или кислорода (р
= 101 кПа)
интервале 130-600°С. При отжиге контролировали
практически не приводит к изменению массы
изменение массы образца (гравиметрическим
образца, содержания кислорода и параметров моно-
анализом), фазовый состав (рентгенофазовым
клинной ячейки. Следовательно, аномальное
анализом, электронной дифракцией в ПЭМ) и
поведение связано со взаимодействием BaBiO3 с
проводили химический анализ на содержание
CO2 воздуха, которое может быть объяснено
Bi(V) в закаленном образце. При минимальной
протеканием реакции (4). Bi2O3 реагирует с CO2 с
температуре отжига (130°С) в течение 619 ч не
образованием оксида-карбоната висмута(III) (5).
происходит изменения массы образца, равно как и
картины рентгеновской дифракции BaBiO3. На
2BaBiO3 (тв) + 2СO2 (г) ↔ 2BaСO3 (тв)
картинах электронной дифракции появляются тяжи
+ Bi2O3 (тв) + 0.5O2 (г),
(4)
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
172
БАРКОВСКИЙ
Bi2O3(тв.) + СO2 (г.) ↔ Bi2O2CO3.
(5)
охлаждении расплава или керамических образцов
до 20°С этот интервал проходят часто с низкой
Реакции (4) и (5) обратимы. Для реакции (4)
скоростью (от 1.7 [36] до 2 град/ч [10, 11]), что и
Kp = р(O2)0.5/р(CO2)2, тепловой эффект реакции, с
приводит к образованию частиц BaCO3 в продукте
учетом данных [49], составляет ΔrH°(298 K) =
отжига. С уменьшением скорости охлаждения
‒334.8 кДж/моль, а при других температурах не
увеличивается время контакта образца с СO2 в
может быть рассчитан из-за отсутствия необхо-
критическом температурном интервале. Расплав-
димых термодинамических функций BaBiO3(тв.).
ленные образцы из-за своей компактности и
По всей вероятности, прямая реакция
(4)
высокой плотности включают, по всей
экзотермична, тогда, согласно принципу
Ле
вероятности, меньшее количество примесных фаз
Шателье, при повышении температуры равновесие
(Bi2O3 и BaCO3), чем керамические.
сместится влево, в сторону эндотермической реакции.
Обнаруженное в настоящей работе взаимо-
Для проверки этой гипотезы зеленую таблетку,
действие BaBiO3 с СO2 воздуха не является
полученную при длительной термообработке
неожиданным: оксид бария-висмута(III,V) как соль
BaBiO3 при 450°С, отожгли при 600°С, при этом ее
несуществующей слабой
«висмутовой» кислоты
масса уменьшилась, и таблетка стала коричневой,
должна вытесняться более сильной угольной
т. е. приобрела цвет исходного моноклинного
кислотой и реагировать с ее ангидридом, однако
BaBiO3. Рентгенографическим методом примеси
этот факт ранее не был отмечен. Для избежания
Bi2O3 и BaCO3 не обнаружены (рис. 2в). Отжиг
загрязнения BaBiO3 примесью BaCO3 необходимо:
BaBiO3 при 600°С не сопровождается значитель-
охлаждение образцов проводить на воздухе или в
ным изменением параметров моноклинной ячейки
кислороде, очищенных от CO2; охлаждение
(a = 6.183, b = 6.139, c = 8.668 Å, β = 90.16°, V =
образцов в атмосфере, содержащей CO2 (воздух),
329.01 Å3).
необходимо заканчивать при
550-600°С, когда
Поскольку величина Kp реакции (4) зависит от
интенсивное взаимодействие BaBiO3 с CO2 еще не
парциального давления кислорода, то увеличение
началось, а кислорододефицитные фазы уже
значения р(O2) смещает равновесие в направлении
окислились до BaBiO3.
образования BaBiO3. Реакция с участием кислорода
Примесь BaCO3 в образцах BaBiO3 или BaBiO3-x,
воздуха гетерогенная, следовательно, на ее
не обнаруживаемая методом РФА, занижает значения
скорость будет влиять скорость диффузии кисло-
кислородного индекса y при гравиметрических
рода в таблетку, а также плотность как самой
определениях. В процессе изотермических отжигов
таблетки, так и приповерхностного слоя, порис-
таких образцов при температуре выше
600°С,
тость, размер частиц и т. д.
примесный BaCO3 образует CO2 (а не O2), что и
По результатам кинетического исследования
занижает значения y. Определить количество
взаимодействия смеси BaCO3-0.5Bi2O3 (мольное
BaCO3 на пределе или ниже предела чувствитель-
соотношение) на воздухе при 600°С, отжиг смеси
ности РФА можно методом дифференциальной
сопровождается уменьшением ее массы и
сканирующей калориметрии, который с этой целью
увеличением доли ионов Bi5+ в образце от 7 (24 ч)
широко используется при анализе оксидов,
до 43% (262 ч). Как и предполагалось, скорость
содержащих элемент с переменной валентностью,
реакции существенно ниже, чем в смесях BaO2-
в частности BaCuO2+δ
[50] (чувствительность
Bi2O3 и Ba(NO3)2-Bi2O3 такого же состава. Даже
метода термогравиметрии- дифференциальной
при измельчении и прессовании образца только
сканирующей калориметрии при обнаружении
через
300 ч отжига изменение массы
-∆m/m
BaCO3 оценена в 0.5 мас%). Однако в рассматри-
приближается к теоретически рассчитанному
ваемой системе это сделать проблематично, так как
значению. Средняя степень окисления висмута (¯i
эндоэффект фазового превращения α→β-BaCO3
3.86) к этому времени не достигает значения 4.00,
при 810°С накладывается на сложные эффекты
характерного для BaBiO3.
фазовых превращений кислорододефицитных фаз
BaBiO3-x [39].
Ваимодействие BaBiO3 с СO2 (4) нельзя игнори-
ровать при получении этой фазы на воздухе.
При выращивании монокристаллов BaBiO3
Максимальной скорости реакция 4 достигает при
используют расплавные методы, когда непременно,
400-450°С. Как показал анализ литературы, при
за исключением зонной плавки, возникает
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ СИНТЕЗА ПЕРОВСКИТА
173
проблема взаимодействия расплава с материалом
Таблица 2. Средняя степень окисление висмута ¯ в
тигля. Степень коррозии тигля определяется темпе-
образцах
1-9 оксида бария-висмута (Ba:Bi
=
1:1),
ратурой и временем контакта расплава. Из
полученных медленным охлаждением расплава от 1050°С
до температуры T и закаленных в жидком азоте
расплава Ba-Bi 1:1, медленно охлажденного на
воздухе со скоростью 2 град/ч от 1050 до 20°С,
№
Т, °С
¯
формируется BaBiO3, на рентгенограмме которого
1
1050а
3.12
обнаруживается примесь BaAl2O4 в количестве
2
1020
3.02
~6 мас% в нижней части тигля и <6 мас% - в
3
1010
3.10
верхней (рис. 2б). Химический анализ показал, что
4
1000
3.16
верхняя часть расплава более обогащена
5
950
3.28
кислородом (¯i 3.98), чем его объем (¯i 3.92).
Значения параметров элементарной ячейки BaBiO3
6
900
3.52
из верхней части тигля (a = 6.183, b = 6.138, c =
7
850
3.72
8.668 Å, β = 90.14°, V = 328.96 Å3) и из всего его
8
800
3.78
объема (a = 6.183, b = 6.139, c = 8.672 Å, β = 90.13°,
9
750
3.94
V = 329.17 Å3) близки между собой. Образование
a Образец закален на воздухе.
примесных фаз смещает брутто-состав образца на
~0.8-1 мол% BiO1.5 в сторону обогащения
висмутом. Для уменьшения времени контакта
превращениях оксидов, проходя области кристал-
расплава с тиглем образец после гомогенизации
лизации богатых барием фаз гомологического ряда
при 1050°С (0.5 ч) быстро (420 град/ч) охлаждали
Bam+nBimOy (m = 1, 2, ...; n = 0, 1, 2, 3,
) [41] с
до
940°С (ниже солидуса), затем продолжали
соотношением Ba:Bi = 17:9, 9:5, 3:2, 4:3, 5:4 и
охлаждение со скоростью 3 град/ч до 550°С. Такая
кислорододефицитных фаз Ba2nBin++1Bin
+–1O6n-1 (n =
процедура привела к отсутствию BaAl2O4 на
1,
2, ...)
[40]: BaBiO2.55, BaBiO2.75, BaBiO2.83,
рентгенограмме полученного соединения. Качество
BaBiO2.88, при окислении которых и образуется
полученного BaBiO3 не зависит от состава и
моноклинный BaBiO3.
свойств исходного реагента (пероксид или нитрат
При выращивании кристаллов из расплава
бария).
невозможно получить строго стехиометричный по
Замена алундового тигля на платиновый,
кислороду оксид BaBiO3 без стадии окисления. Окис-
который использовали в работах [1, 9, 24, 32, 37], с
ление кислорододефицитных фаз Ba2nBin++1Bin
+–1O6n-1
применением технологии быстрого охлаждения в
(n = 1, 2, ...) происходит при медленном охлаж-
области ликвидус-солидус позволяет получить
дении на воздухе уже закристаллизованного
BaBiO3, на 1 моль которого приходится 9.42×
расплава преимущественно ниже линии солидуса.
10-3 моля Pt. Методом РФА (рис. 2в) в полученном
Окисление расплава начинается с поверхности, на
образце платинаты не обнаружены. Параметры
которой появляются первые кристаллы оксидов, в
моноклинной ячейки BaBiO3 составляют a = 6.177,
последующем претерпевающих фазовые превра-
b = 6.133, c = 8.661 Å, β = 90.13°, V = 328.10 Å3.
щения в моноклинный BaBiO3. При дальнейшем
Таким образом, лишены смысла как длительное
охлаждении происходит прорастание кристаллов в
выдерживание расплава (более 100 ч [11]), так и
глубь объема, сопровождаемое поглощением
существенный его перегрев (до 1110 [11, 24], 1125
кислорода и окислением Bi(III), так, что буля
[32], 1200°С [9], в последнем случае на ~150°С), что
становится монолитной бронзовой и однородной в
ведет только к загрязнению образца материалом
объеме. При охлаждении обедненного кислородом
тигля.
расплава от 1050°С (¯i 3.12) (табл. 2) визуально
наблюдается изменение его цвета от темно-
Моноклинная фаза BaBiO3 при p(O2) = 21 кПа
красного (1050°С), к черному (1020°С) и темно-
не имеет собственного поля кристаллизации [39]. В
коричневому
(1000°С) в объеме и бронзовому
атмосфере аргона [p(O2) = 1 кПа] фаза катионного
сверху.
состава Ba-Bi 1:1 не существует, так как образцы
такого состава в широком интервале температур
В табл. 2 приведены значения средней степени
(20-1010°С) двухфазны и образованы оксидами
окисления висмута ¯i в образцах оксида бария-
Ba-Bi
5:4 и
6:7. BaBiO3 формируется при
висмута (Ba:Bi = 1:1), полученных медленным (2-
последовательных жидко- и твердофазных
3 град/ч) охлаждением выдержанного в алундовом
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
174
БАРКОВСКИЙ
тигле в течение 0.5 ч расплава при 1050°С до
На основании многочисленных данных хими-
температур 750-1020°С. Низкие значения средней
ческого анализа образцов BaBiO3, полученных
степени окисления висмута ¯i в образцах 2 и 3,
разными способами и проанализированных
закаленных в жидком азоте от 1020 и 1010°С (3.02
методами РФА и электронной дифракции в ПЭМ
и 3.10 соответственно), свидетельствуют только о
[39,
40], можно высказать предположения
начальном этапе окисления Bi(III)→Bi(V) кисло-
относительно области гомогенности по кислороду
родом воздуха, что сопровождается образованием
в BaBiO3. Занижение значения y
<
3.00, как
одной из наиболее дефицитной по кислороду фазы
правило, свидетельствует о присутствии в образце
BaBiO2.55
[40]. По этой причине процедура
примеси кислорододефицитной фазы или же о
медленного охлаждения образцов в области
смещении состава образца в сторону обогащения
ликвидус-солидус не оправдана. Эта стадия важна
висмутом по причине взаимодействия либо с
для кристаллизации фазы Ba-Bi (1:1), но скорость
материалом тигля (в случае расплава), либо с CO2
роста кристаллов достаточна высока. Длительный
воздуха (в случае и расплава, и керамики). Такие
контакт расплава с тиглем при медленном охлаж-
образцы, охлажденные до комнатной температуры,
дении способствует загрязнению получаемого
по составу оказываются в двухфазной области
вещества.
фазовой диаграммы BaO-BiO1.5(BiO2.5), образован-
ной оксидами с соотношением Ва:Вi = 1:1-4:13
Для окисления кислорододефицитной фазы
[39, 41]. Содержание кислорода в этих образцах
BaBiO3-x оптимальны более низкие субсолидусные
будет занижено в связи с тем, что оксид
температуры (до
500-600°С). В отличие от
Ba4Bi13O23.5 содержит только Bi(III). Расчет
расплавных, керамические образцы насыщаются
показывает, что смещение состава образца на
кислородом и при больших скоростях охлаждения
1 мол% BiO1.5 в сторону обогащения висмутом
(до 200 град/ч [29, 31]).
приводит к занижению средней степени окисления
Как показывают данные табл. 2, с понижением
висмута до значения ¯i 3.94. При таком значении
температуры в закаленных образцах в результате
¯i доля примесной фазы Ba4Bi13O23.5 составляет
окисления Bi(III) увеличивается доля Bi(V). При
~4 мас%, что находится на уровне чувстви-
закалке на воздухе (образец
1) получается
тельности метода РФА. В связи с наложением
завышенное значение ¯i в связи с окислением
основных рефлексов оксидов BaBiO3 и Ba4Bi13O23.5
образца кислородом воздуха при закалке.
идентификация последнего методом рентгеновской
дифракции затруднена [39]. Частицы этой фазы
В соответствии со схемой фазовых состояний
были идентифицированы по характерной картине
системы BaO-BiO1.5(BiO2.5), построенной при р(O2) =
электронной дифракции в ПЭМ [41], на которой
21 кПа методом ДТА [39], образцы 1 и 2 (табл. 2)
наблюдали сверхструктурные отражения с
закалены из области ликвидус-солидус, а образцы
вектором q
=
1/4
<100>. Катионный состав
3-9 - из субсолидусной области. В образцах 1 и 2
примесной фазы определен методом элементного
кристаллизуются фазы с соотношениями Ba:Bi =
анализа с применением ПЭМ.
4:3 и 5:4 [41]. Первые кристаллы фазы Ba-Bi (1:1)
появляются при 1015°C [39]. При 1010°С в образце
Синтезируемый из BaO2 продукт [5, 16-18] из-
3
формируется кислорододефицитная фаза
за дефицита бария также будет дефицитен и по
BaBiO2.55 в результате взаимодействия оксида с
содержанию кислорода, поскольку в нем на уровне
соотношением Ba-Bi 5:4 и обогащенного висмутом
ниже предела чувствительности РФА может
расплава. При дальнейшем охлаждении ниже
присутствовать примесь оксида Ba4Bi13O23.5. Таким
линии солидуса фаза BaBiO2.55 окисляется до
образом, смещение брутто-состава образца в
BaBiO2.75 (образец 5), BaBiO2.83, BaBiO2.88 (образец
сторону обогащения его висмутом приводит к
6) и, наконец, BaBiO3 (образцы
7-9). Таким
занижению кислородного индекса, что может
образом, кислород играет ключевую роль в
косвенно служить критерием однофазности
процессе формирования моноклинного BaBiO3 из
BaBiO3.
расплава.
В соответствии с изложенным, данные работ, в
Все полученные образцы (табл. 2) тестировали
которых предполагается переменное содержание
на наличие Bi(V) и O2- по аналогии с образцами,
кислорода в моноклинном BaBiOy, составляющее
описанными в табл. 1. Во всех образцах обнаружен
2.95-3.00 [23], 2.96 [15], 2.97 [35], 2.98(1) [22], 2.97-
Bi(V) при отсутствии пероксидного кислорода O2-.
3.00
[26,
51],
недостаточно убедительны.
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ СИНТЕЗА ПЕРОВСКИТА
175
Вероятнее всего, область гомогенности по
Большинство приведенных в литературе данных
кислороду в BaBiO3 либо отсутствует, либо не
об объемах элементарной ячейки BaBiO3 попадают
превышает ошибку стандартного иодометричес-
в интервал
327.6-329.8 Å3, в который укла-
кого определения y (±0.01).
дываются значения объемов, рассчитанные как для
расплавных, так и керамических образцов BaBiO3
Сообщается о катионной области гомогенности
Аномально высокое значение V
=
331.09 Å3
BaBiO3 (49.6-62.1 мол% BiO1.5 [52], что не под-
получено для образца, находившегося более 100 ч
тверждается исследованиями фазовых равновесий
в расплаве в процессе медленного
(2 град/ч)
в системе Ba-Bi-O [41] с участием BaBiO3. По всей
охлаждения от 1100 до 900°С и далее до комнатной
вероятности, ошибочный вывод авторов работы
температуры в режиме отключенной печи [11].
[52] основывается на данных метода рентгеновской
Существенную разницу в параметрах ячейки
дифракции и на исследованиях образцов,
BaBiO3 образца, полученного керамическим
полученных из нестехиометрических расплавов,
способом примерно в идентичных условиях,
обогащенных преимущественно висмутом. Как
можно объяснить только погрешностями мате-
показано в работе [39], такие образцы как минимум
матической обработки и, возможно, наличием
двухфазны и состоят из BaBiO3 или
примесных кислорододефицитных фаз, если
кислорододефицитных фаз Ba2nBin++1Bin
+–1O6n-1 (n =
образцы были хорошо закалены. Окончательно не
1, 2, ...) [40] (если закалены от высоких темпе-
выяснено, почему для BaBiO3, синтезированного
ратур) и оксидов Bam+nBimOy и BamBim+nOy [41],
при 850°С за 24 [8] и 120 ч [38], рассчитанные
катионный состав которых зависит от температуры
объемы элементарных ячеек существенно
закалки. Поскольку доля последних мала в
различаются и соответственно имеют минимальное
областях существования фазы BaBiO3 и их
(326.78 Å3) и максимальное (331.09 Å3) значения из
основные рефлексы накладываются на рефлексы
имеющихся в литературе, совпадающие с
доминирующего оксида, идентификация при-
величинами для расплавного образца [11].
месных фаз становится затруднительной без
применения методов элементного анализа и
Высокая величина объема ячейки (330.43 Å3)
электронной дифракции в ПЭМ. В заявленной
характеризует образец BaBiO3, синтезированный
области гомогенности BaBiO3
(49.6-62.1 мол%
золь-гель методом при 650°С за 5 ч [7]. Рефлексы
BiO1.5) [52] в интервале температур 860-1040°С
рентгеновской дифракции моноклинного BaBiO3
кристаллизуются изоструктурные фазы BamBim+nOy
практически не расщеплены. Образец синтези-
(Ba:Bi = 5:4) и Bam+nBimOy (Ba:Bi = 7:8, 6:7, 9:11,
рован из смеси нитратов с избытком висмута, что
4:5,
7:9,
3:4,
5:7,
2:3,
5:8,
3:5). В этом
свидетельствует о возможной примеси оксида
температурном интервале с оксидами BamBim+nOy-
Ba4Bi13O23.5. Как показано выше, обогащение
Bam+nBimOy сосуществуют кислорододефицитные
образца висмутом смещает его по составу в
фазы BaBiO2.55, BaBiO2.75, BaBiO2.83, BaBiO2.88 [40].
двухфазную область, образованную при
650°С
Со стороны, обогащенной барием
(49.6 мол%
оксидами с соотношеним Ba:Bi = 1:(1-4):13. О
BiO1.5), примесные фазы - оксиды с соотношением
присутствии примесной фазы свидетельствует
Ba:Bi = 5:4, 19:6, 25:8 и 3:1.
красный цвет образца. Применение золь-гель
технологии привело к образованию мелко-
Параметры моноклинной ячейки BaBiO3,
доменной смеси фаз, из картины рентгеновской
полученные в настоящей работе для широкого
дифракции которой параметры ячейки BaBiO3
интервала температур, хорошо согласуются с
рассчитаны с точностью только до второго знака.
литературными данными, для которых наблю-
Аналогичным образом вычислены параметры
дается значительный разброс, обусловленный, в
ячейки образца BaBiO3, полученного термолизом
первую очередь, условиями синтеза образцов.
нитратов при 850°С в одну стадию [8].
Детальный анализ литературных данных затруднен
в связи с недостаточной характеристикой синтези-
В образцах BaBiO3, полученных плавлением в
рованных образцов, в частности, для многих
атмосфере кислорода в платиновом тигле
[22],
образцов отсутствуют данные элементного анализа.
обнаружена аномально низкая разница расстояний
Последние особенно важны для образцов BaBiO3,
Bi3+-O и Bi5+-O, равная 2.201(3) - 2.187(3) = 0.014 Å
синтезированных из расплава и прошедших
[22]. В таких образцах катионы Bi3+ и Bi5+
длительный контакт с тиглем.
считаются разупорядоченными почти на
100%.
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
176
БАРКОВСКИЙ
Образцы BaBiO3, аномально ведущие себя при
25 град/ч), характеризуются заниженными значе-
дифракции нейронов, не достаточно полно
ниями объемов элементарных ячеек
(327.98 и
охарактеризованы по химическому составу и
327.72 Å3 соответственно) [32]. Объем ячейки
содержанию кислорода. Очевидно, что в образцах
моноклинного BaBiO3, полученного при медленном
имеется кислородный дефицит, и средняя степень
(2 град/ч) охлаждении расплава в алундовом тигле
окисления отличается от оптимального значения (¯i
от 1100°С, имеет максимальное значение 331.09 Å3
4.00). К разупорядочению Bi3+ и Bi5+ может
[11].
привести незначительное нарушение кислородной
Существующая в течение более 30 лет проблема
стехиометрии BaBiO3-x (x < 0.05), которую можно
с возможным вхождением платины в ячейку
не зафиксировать методом дифракции нейтронов
BaBiO3 может быть решена при детальном
[53]. Упорядочение катионов наблюдается в
исследовании фазообразования и построении
кислорододефицитных фазах Ba2nBin++1Bin
+–1O6n-1
фазовой диаграммы системы Ba-Bi-Pt-O. Тройные
(n
=
1,
2, ...) и при большей кислородной
соединения в этой системе не идентифицированы и
дефицитности [40]. По всей вероятности, платина
не получены. Возможно, что это будут катионно-
переходит в расплав и образует твердый раствор.
упорядоченные фазы, также образующие гомо-
Один из таких твердых растворов с замещением
логические ряды.
бария платиной [радиусы Ba2+, Pt2+ и Pt4+ равны
1.37(5), 0.97(2) и 0.70(5) Å соответственно] может
Таким образом, используя данные настоящей
+
иметь
состав
(Ba1
–zPt
z
-xPt4+)Bi1+–yBi5+O2.5+x+y.
работы и более ранних исследований
[39-41],
Поскольку на картинах рентгеновской (рис. 1в) и
можно дать физико-химическое обоснование про-
нейтронной дифракции образцов BaBiO3, получен-
цессам, происходящим при синтезе BaBiO3 в
ных плавлением в Pt тигле, отсутствуют примес-
эмпирически подобранных условиях, описанных в
ные линии, можно предположить, что такой
литературе. При попытке вырастить кристаллы
твердый раствор изоструктурен BaBiO3. Появление
BaBiO3 из обогащенного висмутом (Ba:Bi = 1:2)
Pt4+ в загрязненном продукте может существенно
расплава при 900°С в соответствии со схемой фазовых
изменить соотношение Bi5+-Bi3+ в образце без
соотношений [14] в системе BaO-BiO1.5 (BiO2.5),
изменения (или с незначительным изменением)
представленной в работе [41], будут получены
кислородного индекса.
кристаллы с соотношением катионов Ba:Bi = 2:3.
Охлаждение такого расплава до комнатной
Присутствие платины в образцах, полученных
температуры приводит к образованию двух фаз -
по технологии [22], обнаружено при исследовании
BaBiO3 и Ba4Bi13O23.5.
спектров рентгеновского поглощения
[54].
Ряд синтезов BaBiO3 [5, 7, 36] проведен из
Вероятно, Pt может замещать висмут в BaBiO3
нестехиометрических составов. Исходная шихта
[радиусы Bi3+ и Bi5+ равны 1.02(7) и 0.75(5) Å], и
была обогащена барием до концентрации 48.8 мол%
незначительная доля Pt может сильно ослабить
BiO1.5 [5]. В таком образце при 780°С образуется
волну зарядовой плотности
[53]. Кроме того,
смесь BaBiO3 и фазы Ba21Bi8O41-δ [41], обогащен-
вхождение в решетку BaBiO3 ионов Pt2+ и Pt4+,
ной барием и Bi(V). Отжиг образца BaBiO3-x при
имеющих значительно меньшие ионные радиусы,
730°С с целью его «доокисления» [23, 24] не
чем у катионов бария и висмута, должно приводить
приводит к получению стехиометричного по
к уменьшению объема элементарной ячейки.
кислороду состава, так как при этой температуре
Примечательно, что BaBiO3, синтезированный в
BaBiO3 теряет кислород [39].
платиновом тигле (рис.
1в), характеризуется
минимальным объемом ячейки (V = 328.10 Å3) из
Термической нестабильностью BaBiO3 можно
всех, рассчитанных в настоящей работе. Образец
объяснить результаты работы [55], авторы которой
BaBiO3, синтезированный твердофазным синтезом
синтезировали оксид при
700-900°С
(36 ч) и
в платиновом тигле (рис. 1а) и не претерпевающий
исследовали ряд свойств, в том числе фотолю-
стадии плавления, характеризуется значительно
минесценцию полученных образцов. Рентгено-
большим объемом ячейки (V = 328.78 Å3). Образцы
графически все три образца были однофазны, но
BaBiO3, прошедшие длительную (6 ч) выдержку
свойства их определялись температурой отжига. В
сильно перегретого расплава при 1125°C в Pt тигле
работе не приведены данные химического анализа
на воздухе и в атмосфере кислорода с
по определению средней степени окисления
последующим медленным охлаждением
(6 и
висмута ¯i, которые показали бы кислородную
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ СИНТЕЗА ПЕРОВСКИТА
177
дефицитность образца, отожженного при 900°С.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образующиеся при термолизе BaBiO3 кислородо-
дефицитные фазы BaBiO2.88 (800°С) и BaBiO2.75
Оксид BaBiO3 синтезировали отжигом стехио-
(900°С) могут быть обнаружены методом
метрической смеси нитрата Ba(NO3)2 (ХЧ) и оксида
электронной дифракции с применением ПЭМ, а
Bi2O3 (ОСЧ 13-3) при 600°С в течение 72 ч с
рентгенографически они детектируются при
измельчением и прессованием через 24 ч.
увеличении времени термообработки до 48-96 ч
В отдельных экспериментах использовали
[39]. Создается впечатление, что максимальную
BaCO3 (ХЧ) и пероксид BaO2
(95.5%, Acros
интенсивность
фотолюминесценции должен
Organics). Соединения Ba(NO3)2 и BaCO3 доводили до
проявить стехиометрический оксид BaBiO3,
постоянной массы при 200 и 600°С соответственно.
поскольку увеличение температуры отжига и, как
BaO2 дополнительно не обрабатывали. Bi2O3
следствие, потеря образцом кислорода приводит к
отжигали
24 ч при
600°C, что гарантировало
уменьшению интенсивности. Присутствие в
отсутствие в нем примесей воды и оксокар-
образцах кислорододефицитных фаз BaBiO3-x
бонатных фаз.
увеличивает величину фотоэлектрического напря-
жения на поверхности, что показывают соответ-
Для иследования кинетики взаимодействия
ствующие спектры.
исходных веществ, а также поведения BaBiO3 в
процессе длительных отжигов на воздухе
В последние годы разрабатываются нетра-
использовали гравиметрический анализ. Таблетку
диционные методы синтеза сложных оксидов, в
из смеси исходных компонентов или из пред-
частности предпринята попытка получения BaBiO3
варительно синтезированного оксида, помещенную
в доведенный до постоянной массы алундовый или
KOH-KNO3-Ba(NO3)2-Bi2O3 в мольном соотноше-
Pt тигель, отжигали в изотермических условиях.
нии
0.267:0.495:0.0765:0.0322 (Ba:Bi
=
1.19)
Тигель с анализируемым веществом через опре-
синтезировано «новое слабокристаллическое соеди-
деленные интервалы времени отжига закаливали,
нение», названное поливисмутатом бария на том
охлаждали в эксикаторе над KOH, взвешивали и
основании, что, по данным элементного анализа
рассчитывали изменение массы ∆m/m, где m -
частиц, его состав был переменным (Ba:Bi = 0.63-
исходная масса таблетки (мг). Из полученных
1.66). Полученный прекурсор при дальнейшей
данных строили кинетические кривые -∆m/m = f(τ).
химической обработке дает BaBiO3 с примесью
В отдельных случаях отжиги проводили в аргоне и
Bi2O3. На представленной картине рентгеновской
кислороде высокой чистоты в проточном
дифракции всего два рефлекса соотнесены с BaBiO3,
кварцевом реакторе.
по которым трудно судить об истинном фазовом
Методом иодометрического титрования во всех
составе образца. Доля основного вещества, судя по
исследуемых образцах определена средняя степень
интенсивностям, не превышает 77 мас%. По всей
окисления висмута ¯i. Относительная ошибка в
вероятности, основная фаза представляет собой
определении ¯i не превышала
±0.01. Образцы
мелкодоменную смесь оксидов гомологических
растворяли в смеси равных объемов 1 М. растворов
рядов Bam+nBimOy и BamBim+nOy
[41], о чем
KI и HCl в токе аргона высокой чистоты.
косвенно свидетельствуют широкие рефлексы на
Стандартизацию титранта
(0.02 М. раствор
картинах рентгеновской дифракции. Сам же оксид
Na2S2O3) проводили по K2Cr2O7 по методу титро-
BaBiO3 в присутствии KOH легко допируется
вания заместителя. Стандартом служила дважды
калием с образованием ромбической фазы
перекристаллизованная соль K2Cr2O7, доведенная
Ba0.96K0.04BiO3
[57]. Исследование процессов
до постоянной массы при 150°С. Индикатор -
фазаобразования в системе KOH-BaO2[Ba(OH)2]-
крахмал. Все реактивы имели квалификацию ХЧ.
Bi2O3 [58] показало, что получить однофазный
материал с узкими рефлексами на картине
Для проведения аналитических тестов исполь-
рентгеновской дифракции практически невозможно.
зовали насыщенный раствор основания Арнольда в
Многочисленные оксиды, существующие в этих
2 М. CH3COOH,
0.3 мМ. раствор метилового
системах, изостуктурны, характеризуются близкими
красного в 1 М. HCl, 0.01 М. раствор Mn(CH3COO)2
значениями параметров элементарных ячеек и
в
4 М. HNO3. Cульфат титана(IV) получали
склонны к образованию мелкодоменных смесей.
длительным кипячением TiO2 в концентрирован-
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
178
БАРКОВСКИЙ
ной H2SO4 на песчаной бане. Все реактивы имели
12. Licheron M., Gervais F., Coutures J., Choisnet J. //
Solid State Commun. 1990. Vol. 75. N 9. P. 759. doi
квалификацию ХЧ.
Картины рентгеновской дифракции снимали
13. Lobo R.P.S.M., Gervais F. // Solid State Commun.
при комнатной температуре на установке Siemens
D-500 с излучением CuKα1 и монохроматором.
Расчет параметров ячеек с погрешностью ±0.002 Å
14. Arpe R., Müller-Buschbaum Hk. // Z. anorg. allg. Chem.
осуществляли методом профильного анализа.
1977. Bd
434. N
1.
S.
73. Doi
Автор выражает глубокую признательность
15. Kambe S., Shime I., Ohshima S., Okuyama K., Sakamoto K. //
Л.А. Клинковой (Институт физики твердого тела
Solid State Ionics. 1998. Vol .108. N 1-4. P. 307. doi
РАН), принявшей участие в постановке ряда
экспериментов и в обсуждении полученных
16. Uemura Y.J., Sternlieb B.J., Cox D.E., Brewer J.H.,
результатов, В.И. Николайчику (Институт физики
Kadono R., Kempton J.R., Kiefl R.F., Kreitzman S.R.,
твердого тела РАН) за выполнение электронно-
Luke G.M., Mulhern P., Riseman T., Williams D.L.,
микроскопических исследований и О.Ф. Шахлевич
Kossler W.J., Yu X.H., Stronach C.E., Subramanian M.A.,
(Институт физики твердого тела РАН) за
Gopalakrishnan J., Sleight A.W.
// Nature.
1988.
выполнение расчетов параметров ячеек.
Vol. 335. P. 151. doi 10.1038/335151a0
17. Imai Y., Kato M., Koike Y., Sleight A.W. // Physica C.
КОНФЛИКТ ИНТЕРЕСОВ
Автор заявляет об отсутствии конфликта
18. Shizuya M., Fujimura S., Imai H., Ji X., Uwe H. //
интересов.
Physica (C). 2001. Vol. 357-360. Pt 1. P. 169. doi
СПИСОК ЛИТЕРАТУРЫ
19. Ghosh A. // Solid State Commun. 1999. Vol. 112. N 1.
1. Cox D.E., Sleight A.W. // Solid State Commun. 1976.
2. Cox D.E., Sleight A.W. // Acta Crystallogr. (B). 1979.
21. Takahashi Т., Esaka Т., Iwahara H. // J. Solid State
3. Lobo R.P.S.M., Gervais F. // Phys. Rev. (B).
1995.
Vol. 52. N 18. P. 13294. doi 10.1103/PhysRevB.52.13294
22. Chaillout C., Remeika J.P., Santoro A., Marezio M. //
4. Yan B., Jansen M., Felser C. // Nature Phys. 2013. Vol. 9.
Solid State Commun. 1985. Vol. 56. N 10. P. 829. doi
P. 709. doi 10.1038/NPHYS2762
5. Фесенко Е.Г., Шуваева Е.Т., Гольцов Ю.И.
//
23. Saito Y., Maruyama T., Yamanaka A. // Thermochim.
Кристаллография. 1972. Т. 17. № 1. С. 419.
6. Dissanayake D., Kharas K.C.C., Lunsford J.H., Ro-
synek M.P. // J. Catalysis. 1993. Vol. 139. N 2. P. 652.
7. Tang J., Zou Z., Ye J. // J. Phys. Chem. C. 2007. Vol. 111.
N 34. P. 12779. doi 10.1021/jp073344l
25. Бравина С.Л., Габович А.М., Морозовский Н.В.,
8. Lakshminarasimhan N., Park Y., Choi W. // Chem.
Моисеев Д.П., Уварова С.К. // Неорг. матер. 1990.
Phys. Lett. 2008. Vol. 452. N 4-6. P. 264. doi 10.1016/
Т. 29. № 1. С. 285
j.cplett.2007.12.050
26. Beyrlein R.A., Jacobson A.J., Yacullo L.N. // Mat. Res.
9. Богатко В.В., Веневцев Ю.Н. // Изв. АН СССР. Сер.
физ. 1983. Т. 47. № 4. С. 637.
10. Солдатов А.Г., Ширяев С.В., Барило С.Н., Вашук В.В. //
27. Kusuhara H., Yamanaka A., Sakuma H., Hashizume H. //
Japan J. Appl. Phys. 1989. Vol. 28. N 4. P.678. doi
10.1143/JJAP.28.678
Chem. 2000. Vol. 55. N 8. P. 791. doi 10.1007/
28. Kennedy B.J., Howard C.J., Knight K.S., Zhang Z.,
Zhou Q. // Acta Crystallogr. (B). 2006. Vol. B62.
11. Grumann M., Balakrishnan G., Tomy C.V., Mc Paul D.K. //
Physica (C). 1994. Vol. 226. N 3-4. P. 288. doi
29. Kumar N., Golledge S.L., Cann D.P.
Dielectrics. 2016. Vol. 6. N 4. 1650032. doi 10.1142/
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ СИНТЕЗА ПЕРОВСКИТА
179
S2010135X16500326
1996. Т. 41. № 11. С. 1822.
30. Von Sholder R., Ganter K.-W. // Z. anorg. allg. Chem.
44. Клинкова Л.А., Филатова М.В., Барковский Н.В.,
1963. Bd
19. H.
5-6. S.
375. doi
Батова Д.Е., Кушнир В.И. // ЖНХ. 1991. Т.36. №. 3.
С. 553; Klinkova L.A., Filatova M.V., Barkovskii N.V.
31. Adhikary G., Singh N., Radhamany B. // Mater. Res.
Batova D.E., Kushnir V.I. // Russ. J. Inorg. Chem. 1991.
Express.
2015. Vol.
2. N
12. P.
126001. doi
Vol. 36. N 3. P. 309.
10.1088/2053-1591/2/12/126001
45. Барковский Н.В. // ЖАХ. 2015. Т. 70. № 11. С. 1171;
Barkovskii N.V. // J. Anal. Chem. 2015. Vol. 70. N 11.
32. Chaillout C., Santora A., Remeika J.P., Cooper A.S.,
Espinosa G.P. // Solid State Commun. 1988. Vol. 65.
P. 1346. doi 10.1134/ S1061934815090048
46. Третьяков Ю.Д. Твердофазные реакции. М.: Химия,
33. Шевчук А.В., Скориков В.М., Каргин Ю.Ф., Констан-
1978. 360 с.
тинов В.В. // ЖНХ. 1985. Т. 30. № 6. С. 1519.
47. Itoh M., Sawada T., Liang R., Kawaji H., Nakamura T. //
34. Thornton G., Jacobson A.J. // Acta Crystallogr. (B).
J. Solid State Chem. 1990. Vol. 87. N 1. P. 245. doi
35. Chaillout C., Remeika J.P., Santoro A., Marezio M. //
48. Nagata Y., Mishiro A., Uchida Т., Ohtsuka M., Samata H. //
Solid State Commun. 1985. Vol. 56. N 10. P. 833. doi
J. Phys. Chem. Solids. 1999. Vol. 60. P. 1933. doi
49. Тифлова Л.А., Монаенкова А.С., Попова А.А., Барков-
36. Savosta M.M., Doroshev V.D., Borodin V.A.,
Pashhkevich Yu.G., Kamenev V.I., Tarasenko T.N.,
Englich J., Kohout J., Soldatov A.G., Barilo S.N.,
Shiryaev S.V. // Phys. Rev. (B). 2001. Vol. 63. 184106.
doi 10.1103/PhysRevB.63.184106
50. Монаенкова А.С., Попова А.А., Зайцева Н.В.,
37. Abbattista F., Vallino M., Delmasro A., Mazza D.,
Мудрецова С.Н., Майорова А.Ф., Сколис Ю.Я. //
ЖФХ. 1994. Т. 68. № 12. С. 2132.
51. Hashimoto T., Kobayashi T., Tanaka H., Hirasawa R.,
38. Zhou Q., Kennedy B. // Solid State Commun. 2004.
Hirai H., Tagawa H. // Solid State Ionics.
1998.
39. Klinkova L.A., Nikolaichik V.I., Barkovskii N.V.,
52. Шевчук А.В. Дис. … канд. хим. наук. М., 1987. 164 с.
Fedotov V.K. // J. Solid State Chem. 1999. Vol. 146.
53. Sleight A. // Physica (C). 2015. Vol. 514. P. 152. doi
P. 439. doi 10.1006/ jssc.1999.8390
40. Клинкова Л.А., Николайчик В.И., Барковский Н.В.,
54. Boyce J.B., Bridges F.G., Claeson T., Geballe T.H.,
Федотов В.К. // ЖНХ. 1997. Т. 42. № 6. С. 905;
Remeika J.M. // Phys. Rev. (В). 1990. Vol. 41. N 10.
Klinkova L.A., Nikolaichik V.I., Barkovskii N.V.,
P. 6306. doi 10.1103/PhysRevB.41.6306
Fedotov V.K. // Russ. J. Inorg. Chem. 1997. Vol. 42.
55. Men B., Zhang J., Diao C., Li X., Liu X., Zheng H. // J.
N 6. P. 810.
41. Клинкова Л.А., Николайчик В.И., Барковский Н.В.,
Федотов В.К. // ЖНХ. 1999. Т. 44. №. 12. С. 2081;
Klinkova L.A., Nikolaichik V.I., Barkovskii N.V.,
Fedotov V.K. // Russ. J. Inorg. Chem. 1999. Vol. 44.
С. 98.
N 12. P. 1974.
57. Schneemeyer L.F., Thomas J.K., Siegrist Т., Batlogg В.,
42. Клинкова Л.А., Филатова М.В., Барковский Н.В.,
Rupp L.W., Opila R.L., Cava R.J., Murphy D.W. //
Батова Д.Е. // ЖНХ. 1991. Т. 36. № 3. С. 547;
Nature. 1988. Vol. 335. P. 421. doi 10.1038/335421a0.
Klinkova L.A., Filatova M.V., Barkovskii N.V. Bato-
58. Клинкова Л.А., Николайчик В.И., Барковский Н.В.,
va D.E. // Russ. J. Inorg. Chem. 1991. Vol. 36. N 3.
Федотов В.К. // ЖНХ. 2001. Т. 46. № 10. С. 1601;
P. 305.
Klinkova L.A., Barkovskii N.V., Fedotov V.K.,
43. Белкова Т.Б., Нейман А.Я., Костиков Ю.П. // ЖНХ.
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
180
БАРКОВСКИЙ
Physico-Chemical Bases of BaBiO3 Perovskite Synthesis
N. V. Barkovskii*
Institute of Solid State Physics, Russian Academy of Sciences, ul. Akademika Osipyana 2, Chernogolovka, 142432 Russia
*e-mail: barkov@issp.ac.ru
Received August 9, 2018; revised September 28, 2018; accepted October 8, 2018
The physicо-chemical bases of optimal conditions for synthesis of BaBiO3 oxide, not containing impurities of
BaСO3 and BaBiO3-x oxygen-deficient phases, are given. The technique of obtaining BaBiO3 samples, minimum
polluted by a crucible material, from a melt, is developed. The technique comes down to the reduction of time of
the melt contact with a crucible. An abnormal behavior of BaBiO3 in the course of long-time annealing in the air
at 450°C is revealed, caused by the interaction with CO2.
Keywords: BaBiO3 oxide, oxygen-deficient phases, valence state, X-ray diffraction patterns, chemical analysis
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019