ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 2, с. 181-186
УДК 541.8:546.214
РАСТВОРИМОСТЬ ОЗОНА В ОРГАНИЧЕСКИХ
РАСТВОРИТЕЛЯХ
© 2019 г. Н. М. Панич, Б. Г. Ершов*
Институт физической химии и электрохимии имени А. Н. Фрумкина Российской академии наук,
Ленинский пр. 31/4, Москва, 119071 Россия
*e-mail: ershov@ipc.rssi.ru
Поступило в Редакцию 12 июля 2018 г.
После доработки 12 июля 2018 г.
Принято к печати 16 июля 2018 г.
Показана возможность применения спектрофотометрического метода для оценки растворимости озона в
высококонцентрированных растворах при измерении его поглощения в оптической зоне Шаппюи
непосредственно в жидкой фазе. Определена растворимость озона в органических растворителях
различной природы, рассчитана его предельная растворимость. Обнаружена зависимость коэффициента
молярного поглощения длинноволновой полосы озона от природы растворителя.
Ключевые слова: растворимость, озон, закон Генри, органические растворители, спектры поглощения,
коэффициент молярного поглощения
DOI: 10.1134/S0044460X19020021
Данные о растворимости озона в жидкостях,
хлорной) [9], а также проведено концентрирование
помимо научного интереса, связанного с особен-
озона в CCl4 [10]. В обеих работах была зафикси-
ностями состояния химически активного газа в
рована малоинтенсивная полоса поглощения озона
жидкой фазе, имеют важное практическое
в оптической области, известной как зона Шаппюи
значение, обусловленное широким использованием
(450-740 нм). В отличие от хорошо известной полосы
его в качестве эффективного дезинфектора, а также
поглощения при 258 нм (ε = 2900 л∙моль-1·см-1
мощного окисляющего реагента в химических
[11]) в зоне Хартли-Хаггинса (180-350 нм), полоса
технологиях [1-4]. Растворимость озона в воде и в
в зоне Шаппюи характеризуется низким коэф-
водных растворах солей и кислот изучена
фициентом молярного поглощения озона
4.5-
достаточно подробно
[5,
6], тогда как в
5.0 л∙моль-1·см-1 [9, 12] и 8.0 л∙моль-1·см-1 [10]. Эти
органических жидкостях его растворимость
данные могут быть успешно применены для
изучена существенно в меньшей степени. Это
спектрофотометрического определения растворен-
вызвано трудностями проведения исследований,
ного озона. Прямое определение озона в растворе
вызванными низкой устойчивостью озона в
позволяет исключить трудности химического
растворителях, ограниченным выбором средств
анализа, связанные с отбором аликвот растворов и
анализа, осложнениями, вызванными нарушением
определением концентрации озона в его реакциях с
равновесия между фазами при измерениях, и
реагентами. Особенно важно, что оптический
другими факторами
[7]. В индивидуальных
метод позволяет определять высокие концентрации
органических соединениях растворимость озона
озона в органических средах, не нарушая распре-
существенно выше, чем в водных растворах [5-8].
деления газа между фазами.
Тем не менее, количественные показатели
Нами определена предельная растворимость
растворимости достаточно неопределенны, и в
озона при низких температурах в органических
ряде случаев не в полной мере охарактеризованы
соединениях, имеющих низкую температуру
условия, при которых они были получены.
замерзания и различную диэлектрическую прони-
Недавно нами была изучена растворимость
цаемость (углеводороды, спирты и другие
озона при низких температурах в концентриро-
жидкости). Использованные вещества - токсичные
ванных неорганических кислотах (серной и
загрязнители атмосферы, где на них при низких
181
182
ПАНИЧ, ЕРШОВ
при низкой температуре для снижения скорости
(a)
его разложения.
Спектры оптического поглощения озона в
(б)
органических соединениях. Электронный спектр
озона характеризуются двумя полосами поглощения,
резко различающимися по своей интенсивности.
Это интенсивная полоса в УФ области Хартли-
Хаггинса (180-350 нм) и малоинтенсивная полоса в
видимой области Шаппюи (450-740 нм). На рис. 1
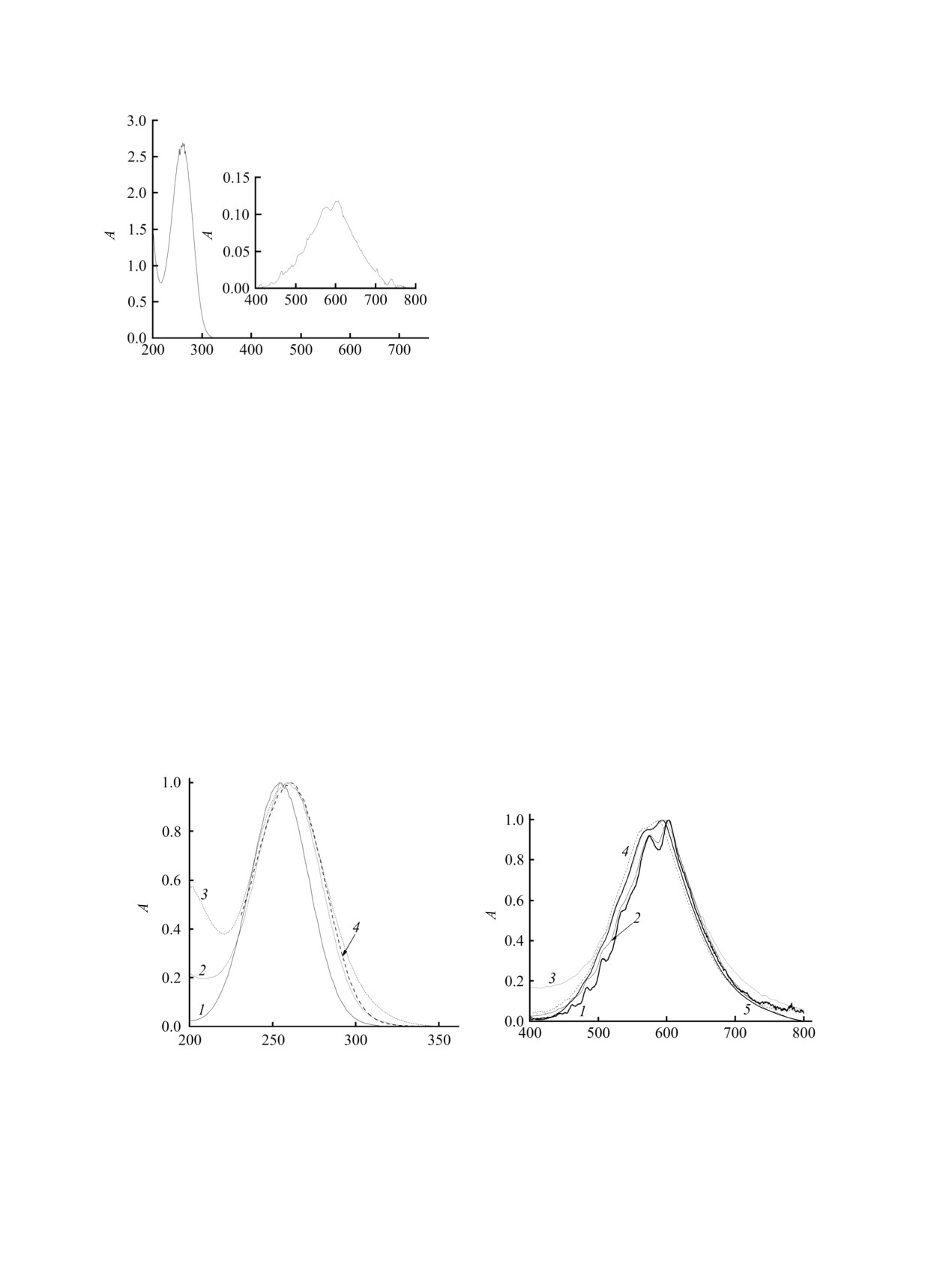
показано поглощение раствора озона в гексане.
λ, нм
Интенсивность поглощения в УФ области
примерно в 350 раз больше интенсивности полосы
λ, нм
в видимой области.
Рис. 1. Спектр поглощения озона в гексане при 201 K
На рис. 2а, показаны спектры поглощения озона
на стадии насыщения. Концентрация О3
в озоно-
в органических растворителях в УФ области в
кислородной смеси16.4 мг/л. Толщина оптической
относительных единицах. Они сопоставлены со
ячейки - 0.2 (а) и 3 см (б).
спектрами поглощения озона в
5 М. растворе
H2SO4 и в газовой фазе. Спектры поглощения в
температурах оказывает разрушающее влияние
жидкостях практически совпадают. Максимум
озон. Кроме того, исследуемые соединения широко
наблюдаемой полосы поглощения находится при
используются при проведении реакций в качестве
258 нм. Полосы поглощения озона в водной и в
органической среды для окисления растворенных
органических средах сдвинуты в красную область
веществ озоном [13-15]. Некоторые из реакций
относительно полосы поглощения озона в газовой
проводят, например, в двухфазном режиме
фазе. Таким образом, различная диэлектрическая
(известном как метод загрузки озона) [15]. Данные
проницаемость жидкостей (см. таблицу) не оказала
по растворимости газов необходимы при проекти-
существенного влияния на форму и максимум
ровании и проведении раздичных техноло-
полосы поглощения озона в области Хартли-
гических процессов
[16]. Предлагаемый нами
Хаггинса.
оригинальный метод определения растворимости
озона основывается на определении концентрации
Высокие концентрации растворенного озона в
озона непосредственно в изучаемом растворителе
органических растворителях приводят к появлению
по его поглощению в оптической зоне Шаппюи
синей окраски раствора и увеличению интенсив-
(a)
(б)
λ, нм
λ, нм
Рис. 2. (a) Нормированные спектры поглощения растворов озона (УФ область) в озоно-кислородной смеси (1, 20°С, λmax =
255 нм), 5 М. водного раствора Н2SО4 (2, -50°C), метаноле (3, -72°С), гептане (4, -72°С) и (б) нормированные спектры
поглощения растворов озона при различной длине волне (λmax, нм): 1 - озоно-кислородная смесь (603), 2 - гексан (601), 3 -
хлороформ (597), 4 - 5 M. водный раствор H2SO4 (588), 5 - метанол (592).
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
РАСТВОРИМОСТЬ ОЗОНА В ОРГАНИЧЕСКИХ РАСТВОРИТЕЛЯХ
183
Растворимость озона в различных растворителях
[О3], г/л (при
ε, л·моль-1·см-1
Растворитель
ε (при 20°С)
Т, K
α
p = 760 мм рт. ст.)
(приλmax 450-740 нм)
ССl4 [11]
273
4.4
9.4
8.0
ССl4 [11]
2.23
245
7.0
15.0
8.0
ССl4 [11]
298
2.6
5.6
8.0
ССl4
293
2.9
6.3
8.1
ССl4
263
5.1
10.5
8.2
Хлороформ
4.8
213
17.7
37.9
7.8
243
6.7
14.3
7.8
Гексан
2.0
201
14.2
30.4
7.9
Гептан
1.9
201
13.4
28.7
8.0
Изооктан
201
15.0
32.1
8.2
Метанол
33.1
201
14.3
≥30.6
5.3
Ацетон
20.7
201
26.5-22.5
≥56.8-48.2
4.5-5.3
Вода
80.4
H2SO4 (конц.)
101
18 M. H2SO4 [10]
223
1.5
3.2
5 М. H2SO4 [10]
203
1.47
3.2
4.5
5 М. HСlO4 [10]
223
1.3
2.8
4.5
ности полосы поглощения в области Шаппюи. На
случае можно избежать многих трудностей,
рис. 2б приведены спектры поглощения озона в
связанных с химическим анализом неустойчивого
органических жидкостях, а также в водном
соединения, каким является озон. Однако прямое
растворе и в газовой фазе. В растворах предельных
измерение растворимости озона по поглощению в
углеводородов (гексане, гептане, изооктане) и CCl4
УФ области ограничивается его высоким
сохраняется колебательная структура, характерная
коэффициентом молярного поглощения (ε
=
для озона в газообразном состоянии, хотя она
2900 л∙моль-1·см-1 [11]). Предельная измеряемая
выражена несколько слабее. Положения полос
концентрация озона даже при использовании
тонкой структуры практически совпадают. В
тонких оптических кювет (0.1 см) составляет всего
конденсированных средах наблюдается сдвиг
~3×10-3 моль/л. Однако растворимость озона в
максимума полосы в коротковолновую область
органических средах может достигать
0.1-
относительно поглощения газообразного озона: для
1.0 моль/л. Переход в видимую область поглощения
предельных углеводородов ~1-2 нм, для полярных
озона - в область Шаппюи - позволяет применить
сред (метанол, хлороформ, ацетон, водный
спектрофотометрический метод для измерения
раствор) ~6-15 нм.
больших концентраций озона, что объясняется
низким значением коэффициента молярного
Положение полос поглощения озона и их
поглощения озона в этой области (рис. 1).
интенсивность не зависят от температуры как в
области Хартли-Хаггинса, так и в области
Основываясь на данных предшествующих работ
Шаппюи.
[9, 10], мы предположили, что озон в органических
Оптимальный способ измерения растворимости
растворителях в ультрафиолетовой области
озона в жидкостях
- спектрофотометрический
сохраняет спектральные характеристики, свой-
метод измерения его поглощения. На основе закона
ственные его растворам в ССl4 и воде.
Ламберта-Бера с учетом установленного значения
Коэффициент молярного поглощения озона для
коэффициента молярного поглощения можно
многих органических жидкостей в области
измерять концентрацию озона в растворе. В этом
Шаппюи определяли путем сопоставления с
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
184
ПАНИЧ, ЕРШОВ
характеристиками поглощения в УФ области.
хлороформа скорость растворения существенно
Интенсивная полоса поглощения озона при длине
больше скорости его разложения. Время
волны 258 нм принята в качестве базовой для всех
полураспада озона при температуре эксперимента
исследованных органических соединений с
(K) составляло 2.6 (298), 3.2 (201), 4.0 (201), 2.9
одинаковым для всех молярным коэффициентом
(201), 5.1 ч (223) соответственно. Устойчивость
поглощения и использована для оценки кон-
озона в кислородсодержащих растворителях
центрации озона в них. В качестве базовой
значительно ниже. Время полупревращения в
величины коэффициента был взят коэффициент
ацетоне и метаноле (201 K) равно 0.5 и 0.3 ч
молярного поглощения, рассчитанный нами для
соответственно.
Органические растворители,
раствора озона в CCl4 с использованием в качестве
используемые в
данной работе, при взаимо-
индикаторов KI и индиго [10] и равный 2900±
действии с озоном образуют продукты окисления
150 л∙моль-1·см-1. В диапазоне концентраций озона
(альдегиды, кислоты и др.), поглощающие свет в
в ССl4 от 8×10-4 до 3×10-3 моль/л коэффициент ε =
оптической области поглощения озона (УФ
2900±150 л∙моль-1·см-1. Это значение хорошо
диапазон).
согласуется
с
коэффициентом молярного
При низких температурах скорость разложения
поглощения в воде, и по данным обзорных статей
озона заметно снижается. Поэтому измерения
[12, 17], разные авторы, действительно, оценивают
проводили при низких температурах, в ряде
его в диапазоне 2600-3300 л∙моль-1·см-1.
случаев практически при температуре сухого льда.
Далее при сопоставлении полосы поглощения
Изучена зависимость концентрации озона в
озона в УФ области (с максимумом при длине
растворителях, определенная по поглощению в
волны
258 нм и известным коэффициентом
области Шаппюи, от концентрации О3 в озоно-
молярного поглощения
2900 л∙моль-1·см-1) с
кислородной смеси. Линейный характер зави-
полосой поглощения в видимой области (с
симости подтверждает, что растворимость озона
максимумом в видимой области) определяли ее
подчиняется закону Генри в широком интервале
коэффициент молярного поглощения. Рассчитан-
температур и диапазоне концентраций О3 в озоно-
ные таким образом коэффициенты молярного
кислородной смеси.
поглощения озона в видимой области приведены в
таблице. Для различных жидкостей они находятся
Коэффициент растворимости α определяли как
в диапазоне 4.5-8.5 л∙моль-1·см-1, что позволяет
безразмерную величину (1).
применять оптический метод для измерения
α = [O3]ж/[O3]ОКС.
(1)
растворимости озона в органических жидкостях
вплоть до концентраций 0.1-1.0 моль/л.
Здесь [O3]ж и [O3]ОКС - концентрации озона в
жидкости и в озоно-кислородной смеси,
Ранее мы определили коэффициент молярного
соответственно (см. таблицу). Изменение концен-
поглощения озона в видимой области в CCl4
трации озона в озоно-кислородной смеси при
аналитическим способом с применением иода и
различных температурах проведения эксперимента
индиго [10]. Он оказался почти в ~2 раза выше
учитывали по уравнению (2).
измеренной величины в водных растворах [9, 12].
[O3](Т, K) = [O3]298×298/T, K.
(2)
Среднее значение ελmax = 8.0 (±10%) л∙моль-1·см-1
для ССl4 и углеводородов, имеющих близкие к
Рассчитана предельная растворимость озона в
ССl4 величины диэлектрической проницаемости, и
заданных условиях. Заметим, что явной тенденции
5.3
(±10%) л∙моль-1·см-1 для метанола. Согла-
в изменении предельной растворимости от числа
сованность результатов данной работы и ранее
углеродных атомов или от структуры растворителя
проведенных измерений [10] позволяет сделать
при одной и той же температуре не наблюдается.
вывод о правомерности предложенной методики
Теплота растворения озона определена по
определения коэффициента молярного поглощения.
тангенсу угла наклона зависимости в координатах
Растворимость озона в жидких органических
уравнения Аррениуса lna от 1/T. Она составила 9.3
соединениях. Насыщение растворителей озоном
(гексан), 10.5 (изооктан), 11.2 (ССl4), 13.2 (хлоро-
происходило достаточно быстро (обычно за 8-
форм) кДж/моль. Полученные величины по
12 мин). Для предельных углеводородов (гексана,
порядку величины близки к теплотам растворения
гептана, изооктана), четыреххлористого углерода и
других трехатомных газов. Так, теплота раство-
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
РАСТВОРИМОСТЬ ОЗОНА В ОРГАНИЧЕСКИХ РАСТВОРИТЕЛЯХ
185
рения СО2 в толуоле, метилэтилкетоне, этил-
величина в пределах ошибки эксперимента близка
ацетате в зависимости от его мольной доли в
к величине ε601, определенной аналитическими
растворе находится в пределах 13.5-16.5 кДж/моль
методами для раствора озона в CCl4 при 25°С, т. е.
[18], а теплота растворения озона в ССl4, декане,
величина параметра ε258/ε601
~330-360 для
гексане оценена равной ~8 кДж/моль [8].
растворов озона в ССl4, гексане, гептане, изооктане
хлороформе и ~550 - в метаноле, тогда как для
Определение коэффициента молярного погло-
водных растворов - 640.
щения полосы поглощения в длинноволновой
области спектра позволило измерить концен-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
трацию озона по длинноволновому поглощению
озона в растворах. Из данных таблицы видно, что
В работе использовали реактивы марки ХЧ
значения ε изменяются с изменением природы
(гексан, хлороформ), ОСЧ (ацетон, метанол),
среды. Значение ελmax для метанола близко к
эталон (гептан, изооктан) (Химмед). Хлороформ,
величине, полученной для озона в водных
стабилизированный этанолом, перед использо-
растворах кислот, и значительно выше коэф-
ванием промывали водой с последующей осушкой.
фициента молярного поглощения газообразного
озона (ε602 = 1.4 л∙моль-1·см-1) [19]. Действительно,
Для проведения экспериментов в низко-
в конденсированной среде межмолекулярное
температурном интервале была специально
взаимодействие молекул газа и молекул
разработана ячейка
- криостат с окнами из
растворителя оказывает заметное влияние на
оптического кварцевого стекла, соединенными
оптические характеристики растворенного газа по
параллельно друг другу дьюаровским спаем
сравнению с его состоянием в газообразной среде.
одновременно с кварцевой трубкой, служащей для
В жидкостях появляются дополнительные типы
загрузки исследуемого вещества, и внешней
поляризации, и локальное поле, действующее на
оболочкой собственно криостата. Сконструирован-
атом озона в конденсированной среде, не равно
ный реактор позволял проводить контроль
внешнему полю. Мы полагаем, что существует
температур в объеме сосуда Дьюара и в объеме
определенное влияние диэлектрической постоян-
оптической ячейки. Длина оптического пути
ной среды на указанный параметр полосы в
составила 3.0 см. Конструкция реактора позволяла
низкочастотной области спектра. Рискнем предпо-
использовать кюветы с меньшей длиной пути.
ложить величину предельной растворимости озона
Озон получали при пропускании особо чистого
в ацетоне. Спектр поглощения ацетона в УФ
кислорода через капиллярную разрядную камеру.
области покрывает зону поглощения озона и не
Концентрация озона в озоно-кислородной смеси
представлялось возможным оценить α только на
достигала 150 мг/л. Кроме того, для получения
основании спектров. В то же время на основании
озоно-кислородной смеси с заданной концентра-
поглощения в области Шаппюи можно оценить
цией озона в диапазоне от 10 до 100 мг/л исполь-
величину предельной растворимости, если
зовали автоматическую установку YOTA-60-01.
принять, что значение ε в максимуме полосы
Состав озоно-кислородной смеси на входе в
близко к величине ε метанола или воды и может
реактор контролировали с помощью анализатора
составлять ~4.5-5.3 л∙моль-1·см-1 (см. таблицу).
Медозон.
Таким образом, применение метода спектро-
Температуру в криостате поддерживали с
скопии позволило определить растворимость озона
точностью
±0.5°С. Для создания низких тем-
в органических растворителях разной природы при
ператур наиболее удобными оказались смеси на
низких температурах на основании измерения
основе спирта и сухого льда. Эксперимент
поглощения озона в жидкой фазе в области 450-
начинали после установления стационарного тем-
740 нм и рассчитать предельную растворимость
пературного состояния (обычно в течение 30 мин).
озона в них при 760 мм рт. ст. чистого (100%) О3.
Обнаружена зависимость коэффициента молярного
Растворы озона в растворителях получали при
поглощения длинноволновой полосы озона от
барботировании озоно-кислородной смеси со
природы растворителя. Коэффициент молярного
скоростью 2 мл/с и периодическим определением
поглощения в максимуме полосы поглощения в
количества озона в растворе по его спектру
видимой области для углеводородов оказался
поглощения до прекращения нарастания полосы
равным
8.0
(±10%) л∙моль-1·см-1. Полученная
поглощения. Измерения проводили без нарушения
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
186
ПАНИЧ, ЕРШОВ
равновесия по распределению газа в жидкости и в
9. Ершов Б.Г., Панич Н.М. // Докл. АH. 2015. Т. 465.
№ 2. С. 190; Ershov B.G., Panich N.M. // Doklady.
свободном объеме.
Phys. Chem. 2015. Vol. 465. Pt 1. P. 279. doi 10.1134/
Оптические спектры регистрировали на спектро-
S0012501615110068
фотометре Cary 50.
10. Панич Н.М., Ершов Б.Г. // ЖОХ. 2018. Т. 88. Вып. 6.
С. 889; Panich N.M., Ershov B.G. // Russ. J. Gen.
ФОНДОВАЯ ПОДДЕРЖКА
Chem. 2018. Vol. 88. N 6. P. 1071. doi 10.1134/
Работа выполнена при финансовой поддержке
S1070363218060038
Российского фонда фундаментальных исследо-
11. Bader H., Hoigne J. // Ozone Sci. Eng. 1982. Vol. 4.
ваний (проект № 16-03-00336).
КОНФЛИКТ ИНТЕРЕСОВ
12. Hart E.J., Sehested К., Holoman J. // Anal. Chem. 1983.
Vol. 55. N 1. P. 46. doi 10.1021/ac00252a015
Авторы заявляют об отсутствии конфликта
13. Раковский С.К., Аначков М., Заиков Г.Е., Стоянов О.В.,
интересов.
Софина С.Ю. // Вестн. Казанск. технол. унив. 2013.
СПИСОК ЛИТЕРАТУРЫ
T. 16. № 4. С. 11.
1.
Драгинский В.Л., Алексеева Л.П., Самойлович В.Г.
14. Бородин А.А., Разумовский С.Д.
// Кинетика и
Озонирование в процессах очистки воды. М.: ДеЛи
катализ. 2009. Т.
50.
№ 3. С. 406; Borodin A.A.,
принт, 2007. 400 с.
Razumovskii S.D.
// Kinetics and Catalysis.
2009.
2.
Böhme A. // Ozone Sci. Eng. 1999. Vol. 21. N 2. P. 163.
Vol. 50. N 3. P. 385. doi 10.1134/S0023158409030070
doi 10.1080/01919519908547250
15. Shiyin L., Yiping Zh., Xiaorong L., Guoxiang W.,
3.
Rice R. G. // Ozone Sci. Eng. 1999. Vol. 21. N 2. P. 99.
Lixiao N.
// Bull. Env. Contamin. Toxicol.
2011.
doi 10.1080/01919519908547244
Vol. 87. N 3. Р. 297. doi 10.1007/s00128-011-0352-6
4.
Le Paulouë J., Langlais B. // Ozone Sci. Eng. 1999.
16. Голованов И.Б., Женодарова С.М. // ЖOX. 2005.
Vol. 21. N 2. P. 153. doi 10.1080/01919519908547249
Т. 75. Вып 11. C. 1879; Golovanov I.B., Zhenodaro-
5.
Александров Ю.А., Тарунин Б.И., Переплетчиков М.Л. //
va S.M. // Russ. J. Gen. Chem. 2005. Vol. 75. N 11.
ЖФХ. 1983. Т. 57. № 10. С. 2385.
P. 1795. doi 10.1007/s11176-005-0512-7
6.
Biń A.K. // Ozone Sci. Eng. 2006. Vol. 28. N 2. P. 67.
17. Ershov B.G., Gordeev A.V., Seliverstov A.F. // Ozone
doi 10.1080/01919510600558635
Sci. Eng.
2017. Vol.
39. N
2. P.
69. doi
7.
Разумовский С.Д., Заиков Г.Е. Озон и его реакции с
10.1080/01919512.2016.1262239
органическими соединениями (кинетика и меха-
18. Матвиенко В.Г., Нифантова Л.С. // Научные труды
низм). М.: Наука, 1974. 322 с.
ДонНТУ. Сер. Хим. хим. технол. 2008. Вып. 134
8.
Разумовский С.Д., Заиков Г.Е. // Изв. АН СССР. Сер.
(10). С. 32.
хим. 1971. № 47. С. 686; Razumovskii S.D, Zaikov G.E. //
Bull. Acad. Sci. USSR. Div. Chem. Sci. 1971. Vol. 20.
19. Лунин В.В., Попович М.П., Ткаченко С.Н. Физи-
N 4. P. 616. doi 10.1007/BF00853885
ческая химия озона. М.: МГУ, 1998. 480 с.
Solubility of Ozone in Organic Solvents
N. M. Panich and B. G. Ershov*
A. N. Frumkin Institute of Physical Chemistry and Electrochemistry of the Russian Academy of Sciences,
Leninskii pr. 31/4, Moscow, 119071 Russia
*e-mail: ershov@ipc.rssi.ru
Received July 12, 2018; revised July 12, 2018; accepted July 16, 2018
The possibility of applying the spectrophotometric method to evaluate the solubility of ozone in highly
concentrated solutions when measuring its absorption in the Chappuis optical zone directly in the liquid phase
was shown. The solubility of ozone in organic solvents of various nature was determined, its limiting solubility
was calculated. The dependence of the molar absorption coefficient of the long-wavelength ozone band on the
solvent nature was found.
Keywords: solubility, ozone, Henry’s law, organic solvents, absorption spectra, molar absorption coefficient
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019