ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 2, с. 187-190
УДК 541.128:546.171:5547.235
ИССЛЕДОВАНИЕ КИНЕТИКИ И МЕХАНИЗМА
ГЕТЕРОГЕННО-КАТАЛИТИЧЕСКОГО ГИДРАЗИНОЛИЗА
ОЛЕИНОВОЙ КИСЛОТЫ
© 2019 г. С. А. Джумадуллаева*, А. Б. Баешов
Международный казахско-турецкий университет имени Х.А. Ясави,
пр. Б. Саттарханова 29, Туркестан, 161200 Казахстан
*e-mail: sveta.jumadullayeva@ayu.edu.kz
Поступило в Редакцию 7 июня 2018 г.
После доработки 7 июня 2018 г.
Принято к печати 15 июня 2018 г.
Впервые изучены кинетика и механизм реакции гидразинолиза олеиновой кислоты в присутствии
высокоосновного анионита АВ-17-8. Установлен первый порядок реакции по олеиновой кислоте и
гидразингидрату. Найдены значения энергии и энтропии активации процесса. На основе кинетического и
ИК-спектроскопического методов предложен вероятный механизм реакции с участием фиксированного
катиона смолы.
Ключевые слова: гидразинолиз, олеиновая кислота, анионит, гидразиды
DOI: 10.1134/S0044460X19020033
В настоящее время все большее внимание
процессов являются невысокий выход гидразидов
исследователей привлекают гидразиды ненасыщен-
(70-75%), низкая селективность процесса, труд-
ных карбоновых кислот и их производные
ность выделения целевого продукта из катали-
(кетогидразоны, тиосемикарбазиды, оксадиазолы,
затов, а также необходимость выращивания микро-
триазолы), которые являются физиологически
организмов.
активными веществами широкого спектра
Применение полимерных ионитных катализа-
действия, а также применяются для производства
торов в процессе гидразинолиза карбоновых
полимеров, стабилизаторов и красок [1, 2]. Так
кислот является перспективным методом синтеза
например, гидразиды олеиновой, линолевой,
гидразидов ненасыщенных карбоновых кислот.
линоленовой кислот используются в качестве
Использование ионитов позволяет проводить
антибактериальных, противогрибковых, антигель-
процесс в более мягких условиях, предотвращает
минтных средств, фунгицидов, хелатообразующих
нежелательные реакции, обеспечивает значитель-
агентов, а также ингибиторов коррозии металлов
ное повышение выхода целевых продуктов.
[3, 4].
Однако механизм реакции гидразинолиза до сих
В связи с этим большое внимание уделено
пор не изучен [5].
изучению методов их синтеза, особенно реакции
гидразинолиза ненасыщенных кислот и их
В настоящей работе на примере реакции
сложных эфиров. В работе [4] синтез гидразидов
олеиновой кислоты с водным гидразином на
олеиновой, линолевой и линоленовой кислот
анионите АВ-17-8 впервые изучен механизм
осуществлен из соответствующих метиловых
гидразинолиза ненасыщенных карбоновых кислот
эфиров в атмосфере азота в течение 3-4 ч в среде
в присутствии ионитов с привлечением кинети-
абсолютного спирта. Другим способом получения
ческого и ИК-спектроскопического методов. Нами
этих соединений является ферментативный гидра-
установлено, что в присутствии анионита АВ-17-8
зинолиз метиловых эфиров кислот с исполь-
в ОН-форме олеиновая кислота достаточно легко
зованием фермента липазы в водно-спиртовой
реагирует с гидразингидратом с образованием
среде при температуре 40°С [3]. Недостатками этих
олеингидразида (схема
1).
При массовом
187
188
ДЖУМАДУЛЛАЕВА, БАЕШОВ
Схема 1.
H H
H H
N2H4, KT
+ H2O
CH3(CH2)7 (CH2)7COOH
CH3(CH2)7 (CH2)7CONHNH2
соотношении олеиновая кислота:гидразингидрат:
олеиновой кислоте и гидразингидрату можно
катионит:Н2О = 1:0.72:2:32 при температуре 90°С и
предположить, что реакция протекает через образо-
продолжительности реакции
2
ч выход
вание поверхностных циклических переходных
олеингидразида составил 85%.
комплексов. Аналогичные кинетические дока-
зательства в пользу образования циклических
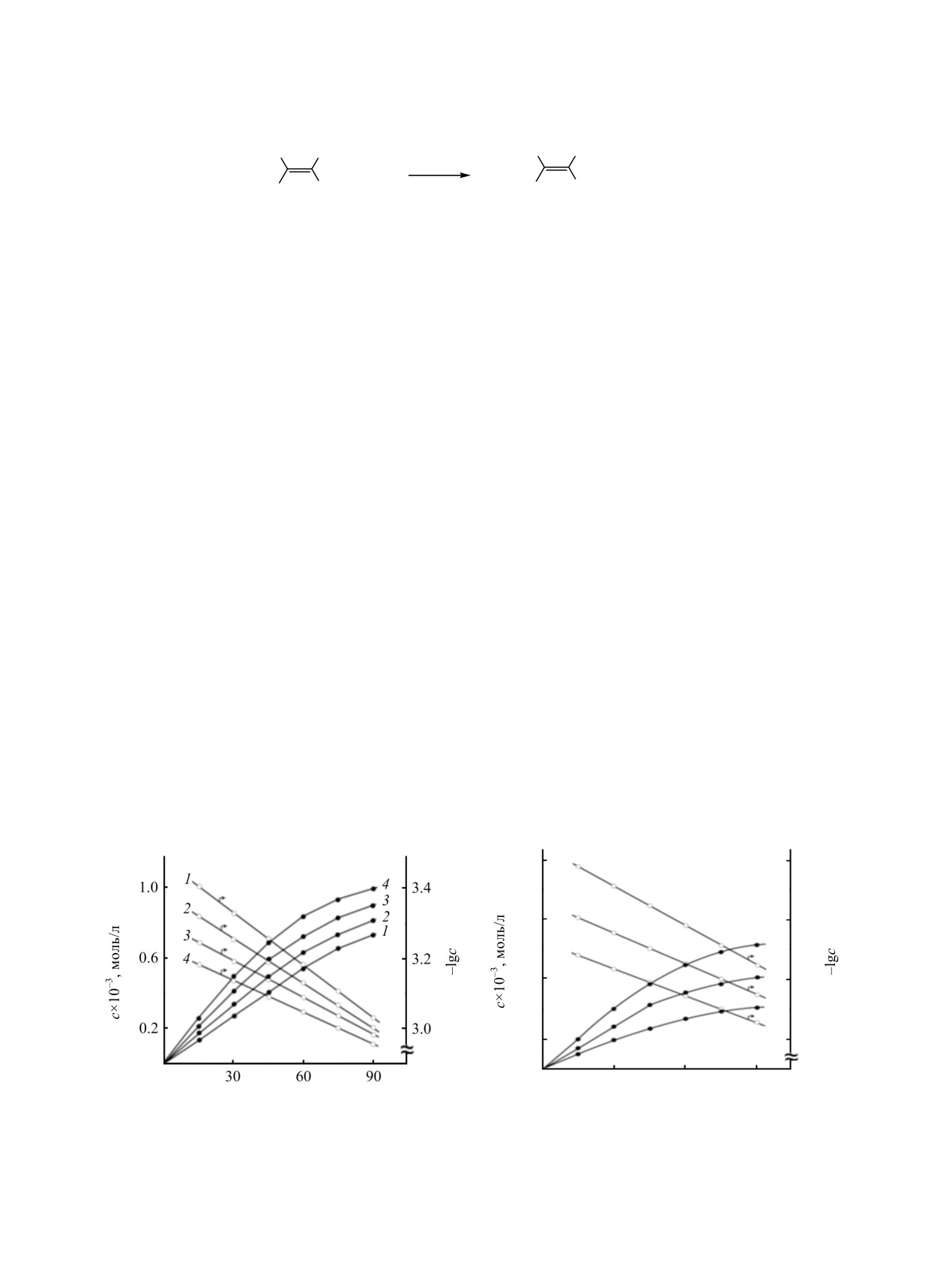
На рисунке приведена зависимость концентра-
комплексов на поверхности раздела фаз установ-
ции олеингидразида от времени при различных
лены при изучении реакции алкилирования
температурах. Константы скорости реакции при 60,
различных кетонов пренилхлоридом в присутствии
70, 80 и 90°С равны 2.8×10-3, 3.3×10-3, 4.0×10-3,
катализаторов - четвертичных алкиламмониевых
4.7×10-3 л/(моль∙мин) соответственно. Энергия
солей [7], при оксихлорировании углеводородов в
активации, найденная из аррениусовской зави-
присутствии силикагеля
[8], при гидратации
симости, составляет
77.86 кДж/моль. Энтропия
изоникотинонитрила на анионите АВ-17-8 в ОН-
активации, рассчитанная по методу, описанному в
форме [9].
работе [6], равна -146.6 Дж/(моль∙K).
Приведенные кинетические данные согласуются
Изменение начальной концентрации олеиновой
с результатами ИК-спектроскопических исследо-
кислоты в изученных пределах не влияет на
ваний. На основании литературных данных [10, 11]
константу скорости, которая при с0 = 0.41, 0.62, и
можно предположить, что реакция гидразинолиза
0.84 моль/л составила
3.8×10-3 л/(моль∙мин).
олеиновой кислоты в присутствии ионообменной
Линейный характер зависимости lgc-t свидетель-
смолы АВ-17-8 (ОН) осуществляется по
ствует о том, что реакция имеет первый порядок по
гетерогенно-каталитическому механизму, где за
субстрату
- олеиновой кислоте (см. рисунок).
протекание процесса отвечают полимерно-
Аналогично установлен первый порядок реакции
связанные четвертичные ионы аммония и гидрокси-
по второму компоненту - гидразингидрату. Для
ионы -N+(CH3)3OH-. В ИК спектре реакционной
начальной концентрации гидразингидрата c0 = 0.83,
массы при взаимодействии олеиновой кислоты с
1.04 и 1.25 моль/л при c0 = 2.86 моль/л значение
анионитом АВ-17-8 (ОН) отсутствуют очень
констант скорости составило 4.0×10-3 л/(моль∙мин).
интенсивная полоса валентного колебания группы
Исходя из кинетических параметров, низкого
C=O при 1710 см-1 и полоса поглощения при
значения энергии активации, высокой отрица-
940 см-1, относящаяся к неплоскостному деформа-
тельной энтропии активации, первого порядка по
ционному колебанию ОН-группы. На фоне
(а)
(б)
1.4
1
3.6
2
1.0
3.4
3
3
2
0.6
3.2
1
0.2
3.0
30
60
90
t, мин
t, мин
Кинетика гидразинолиза олеиновой кислоты на анионите АВ-17-8 (а) при с0 = 0.62 М., с0 = 1.25 М., [Кт] = 2 г/г олеиновой
кислоты и температуре 60 (1), 70 (2), 80 (3), 90°С (4); (б) при 90°С, с0 = 2.4 М. и с0 = 0.41 (1), 0.62 (2), 0.84 М. (3).
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
ИССЛЕДОВАНИЕ КИНЕТИКИ И МЕХАНИЗМА
189
Схема 2.
O
CH3(CH2)7CH=CH(CH2)7C
+ N+(CH3)3OH. H2O
OH
~
O
CH3(CH2)7CH=CH(CH
N+(CH3)3 + 2H2O
2)7C
O
~
собственных полос анионита появляются интен-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
сивные полосы при
1370 и
1620 см-1,
Анализ олеингидразида осуществляли фото-
соответствующие симметричным и антисиммет-
колориметрическим методом на приборе Флюорат-
ричным валентным колебаниям карбоксилатной
02-5М (Люмэкс, Россия)
[12]. Методика ИК-
группы COO-
[11],
которые становятся
спектроскопических исследований приведена в
противоионами фиксированного катиона смолы.
работе [13]. ИК спектры записывали на спектро-
Следовательно, взаимодействие олеиновой
метре Impact-410 (Melles Griot, США) в области
кислоты с активными центрами анионита можно
400-4000 см-1.
представить схемой 2.
Методика эксперимента. Опыты проводили в
Согласно работе [5], можно предположить, что
статической системе в термостатированном
комплекс карбоксилат-аниона с катализатором
стеклянном реакторе объемом 250 мл, снабженном
распадается под действием гидразина из обьема с
механической мешалкой, термометром и обратным
образованием целевого гидразида и регенерацией
холодильником. Реакционную смесь, состоящую из
активного центра (схема 3).
1 г
(0.0034 моль) олеиновой кислоты,
0.72 г
Следовательно, можно полагать, что в условиях
(0.0144 моль) гидразингидрата, 32 г (1.778 моль)
гетерогенного катализа процесс, по-видимому,
воды и 2 г воздушно-сухого ионита нагревали при
осуществляется с образованием промежуточного
перемешивании на водяной бане
2 ч при
циклического
переходного
состояния
на
температуре 60-90°С. После внесения реагентов
поверхности анионита АВ-17-8 (OH), который
фиксировали время, из реакционной смеси
быстро превращается в продукты реакции.
отбирали пробы и анализировали. По окончании
реакции водную фракцию отделяли и упаривали
Таким образом, впервые изучены кинетика и
досуха. Сухой остаток перекристаллизовывали из
механизм гидразинолиза олеиновой кислоты в
этанола. Получили гидразид олеиновой кислоты с
присутствии гетерогенного катализатора анионита
т. пл. 38-39°С. ИК спектр (KBr), ν, см-1:
1699
АВ-17-8 (OH). Установлен второй порядок реакции
(C=O), 1637 (CH=CH), 3289, 3326, 3451 (N-H),
по субстратам. В интервале температур 60-90°С
2848, 2915, 2957 (C-H ), 1100 (C-N), 980 (N-N).
определены значения энергии и энтропии
Найдено, %: С 72.94; Н 12.18; N 9.48. C18H36N2O.
активации процесса. На основании кинетических и
Вычислено, %: C 72.97; H 12.16; N 9.46.
ИК-спектроскопических исследований предложен
вероятный механизм реакции через образование
Предварительно была изучена зависимость
поверхностных циклических комплексов.
скорости реакции от интенсивности пере-
Схема 3.
O
O
CH3(CH2)7CH=CH(CH2)7C
N+(CH3)3 + NH2NH2
CH3(CH2)7CH=CH(CH2)7C
N+(CH3)3
O
~
O
~
H2NHN
H
O
CH3(CH2)7CH=CH(CH2)7C
+ N+(CH3)3OH
NHNH2
~
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
190
ДЖУМАДУЛЛАЕВА, БАЕШОВ
мешивания реакционной смеси и от размера зерна
2010. Vol. 12. P. 2012. doi 10.1039/C0GC00372G
анионита. Было установлено, что при скорости
5. Джумадуллаева С.А., Баешов А.Б. // Кинетика и
перемешивания 700 об/мин и размерах зерна 0.1-
катализ. 2017. Т. 58. С. 26; Dzhumadullaeva S.A.,
0.2 мм отсутствует внутренняя и внешняя
Baeshov A.B. // Kinetics and Catalysis. 2017. Vol. 58.
дуффузия, т. е. реакция протекает в кинетической
N 1. P. 24. doi 10.1134/S0023158417010025
области. За скоростью реакции следили по накоп-
6. Яцимирский К.Б. Кинетические методы анализа. М.:
лению гидразида олеиновой кислоты. Наблюда-
Химия, 1967. 200 с.
емые константы скорости (k) вычисляли по
7. Юфит С.С., Есикова А.И., Данилова О.И. // Докл.
кинетическому уравнению второго порядка.
АН СССР. 1987. Т.295. № 3. С. 621.
8. Чалабиев Ч.А., Ахвердиев И.Р., Салахов М.С.,
КОНФЛИКТ ИНТЕРЕСОВ
Колесников И.М. // Кинетика и катализ. 1989. Т. 30.
№ 2. С. 345.
Авторы заявляют об отсутствии конфликта
9. Джумакаев К.Х., Джумадуллаева С.А., Май И.И.,
интересов
Махметов Е.Х., Мулдахметов З.М. // Докл. АН
СССР. 1991. Т. 317. № 6. С. 1405.
СПИСОК ЛИТЕРАТУРЫ
10. Джумакаев К.Х., Аяпбергенов К.А., Май И.И.,
Джумадуллаева С.А. // Кинетика и катализ. 1989.
Т. 30 . № 2. С. 488.
Sci. 2009. Vol. 71. N 2. P. 144. doi 10.4103/0250-
11. Джумакаев К.Х., Май И.И., Джумадуллаева С.А.,
Койкаранова М.С. // ЖФХ. 1990. Т. 64. № 9. С. 2811.
2. Yousef E.A., Zaki M.E., Megahed M.G. // Heterocycl.
Commun.
2003. N
9.
P.
293. doi
10.1515/
12. Коренман И.М. Фотометрический анализ. Методы
HC.2003.9.3.293
определения органических соединений. М.: Химия,
3. Kinhikat G.M., Rao B.G., Rao C.V.N. // Anstrichmittel.
1975. 360 с.
1970. Vol. 72. N 3. P. 165.
13. Литтл Л. Инфракрасные спектры молекул. М.:
4. Chrissie A.C., James A.K., Neil P.J.P. // Green Chem.
Мир, 1969. 514 с.
Study of Kinetics and Mechanism of Heterogenous Catalytic
Hydrazinolysis of Oleic Acid
S. A. Dzhumadullaeva* and A. B. Baeshov
Kh. A. Yassawi International Kazakh-Turkish University, pr. B. Sattarkhanova 29, Turkestan, 161200 Kazakhstan
* e-mail: sveta.jumadullayeva@ayu.edu.kz
Received June 7, 2018; revised June 7, 2018; accepted June 15, 2018
Kinetics and mechanism of the hydrazinolysis of oleic acid in the presence of a highly basic anion exchanger
AV-17-8 were studied for the first time. The first reaction order was found. The values of activation energy and
entropy of the process were found. A plausible reaction mechanism involving a fixed resin cation was proposed
based on the kinetics and IR spectroscopy data.
Keywords: hydrazinolysis, oleic acid, exchange resin anion, hydrazides
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019