ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 2, с. 191-196
УДК 547.5:542.921.6:541.127
КИНЕТИКА ТЕРМИЧЕСКОГО РАЗЛОЖЕНИЯ
3,7-ДИНИТРО-1,3,5,7-ТЕТРААЗАБИЦИКЛО[3.3.1]НОНАНА
© 2019 г. Л. А. Кругляковаa, *, Р. С. Степановa, Ю. В. Кекинb, К. В. Пехотинa
a Сибирский государственный университет науки и технологий имени академика М. Ф. Решетнева,
пр. Газеты Красноярский рабочий 31, Красноярск, 660037 Россия
*e-mail: lakruglyakova@sibsau.ru
Поступило в Редакцию 19 июля 2018 г.
После доработки 19 июля 2018 г.
Принято к печати 26 июля 2018 г.
Изучена кинетика термораспада 3,7-динитро-1,3,5,7-тетраазабицикло[3.3.1]нонана в твердой фазе и в
растворе. Установлены механизм и кинетические закономерности распада. Определены активационные
параметры лимитирующей стадии.
Ключевые слова: динитротетраазабицикло[3.3.1]нонан, циклические нитрамины, октоген, термораспад,
активационные параметры
DOI: 10.1134/S0044460X19020045
3,7-Динитро-1,3,5,7-тетраазабицикло[3.3.1]нонан
сокращению индукционного периода, однако
является промежуточным продуктом нитролиза
практического влияния на скорость разложения в
уротропина до 1,3,5,7-тетранитро-1,3,5,7-тетрааза-
индукционном периоде не оказывает. Таким
циклооктана (октоген), и в значительной степени
образом, реакция разложения динитротетра-
выход динитротетраазабицикло[3.3.1]нонан опре-
азабицикло[3.3.1]нонана протекает только в
деляет выход октогена [1]. Заметим, что если
конденсированной фазе, а плавное увеличение
исследования кинетики и механизма термораспада
скорости распада на стадии ускорения связано с
вторичных нитраминов насчитывают уже более 70
автокаталитическим взаимодействием продуктов
лет
[2], то термораспад
3,7-динитротетрааза-
распада, в частности диоксида азота, с исходным
бицикло[3.3.1]нонана изучен фрагментарно [3] и не
веществом. На начальную скорость и величину
позволяет судить о структурно-кинетических законо-
периода индукции не влияет изменение размера
мерностях, механизме реакции его разложения и
кристаллов в пределах 0.01-0.2 мм (рис. 2). Это
безопасности применения. В этой связи в
свидетельствует также о том, что топохимические
настоящей работе изучена кинетика термораспада
эффекты практически не влияют на ускорение
3,7-динитротетраазабицикло[3.3.1]нонана в разных
распада динитротетраазабицикло[3.3.1]нонана. В
агрегатных состояниях - твердой фазе и растворах
случае октогена (β-форма)
3, когда конечный
в дибутилфталате и динитробензоле.
объем газообразных продуктов распада больше,
происходит еще и выделение внутрикристал-
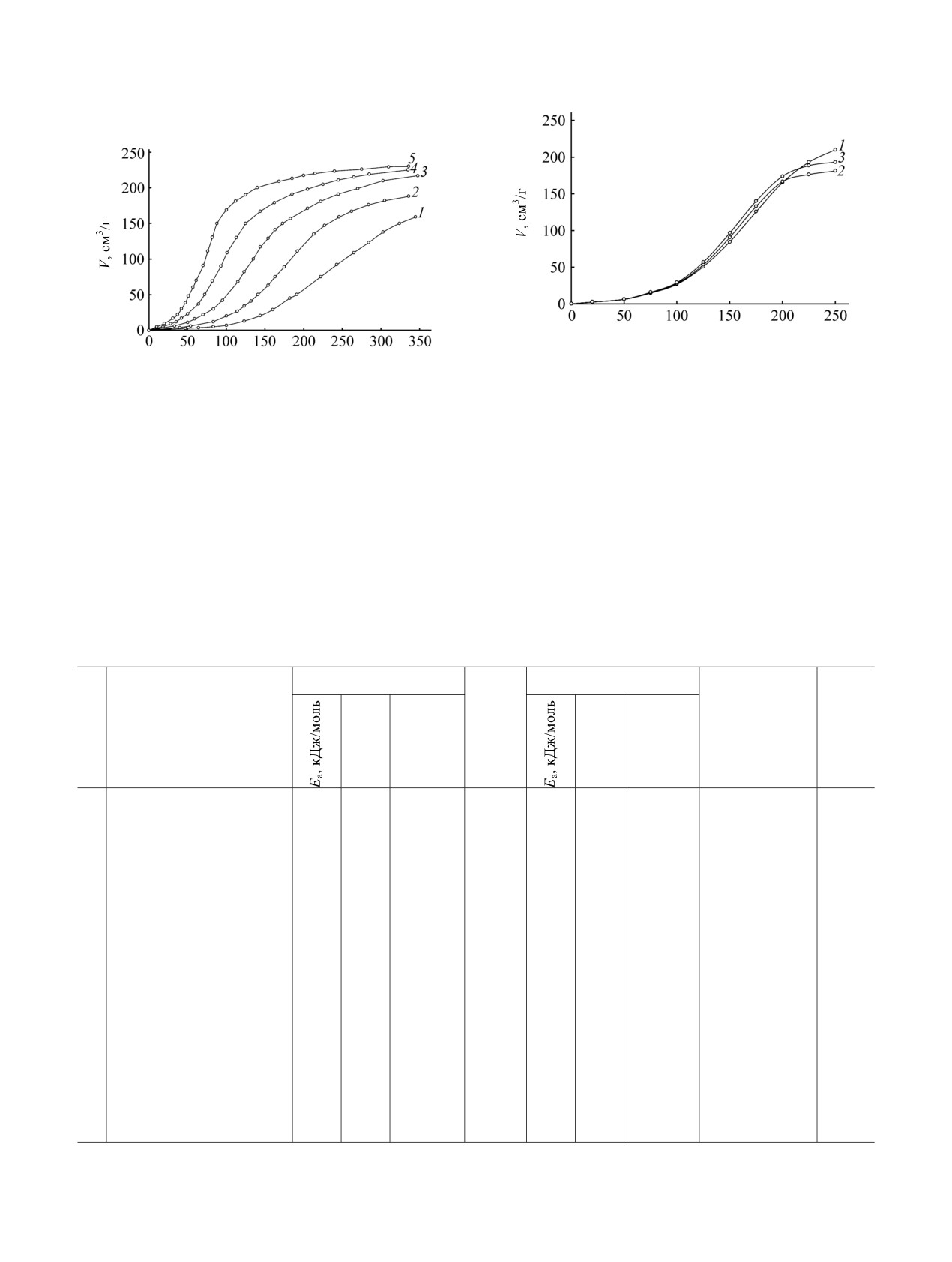
Термораспад
3,7-динитротетраазабицикло-
лического растворителя, захваченного динитро-
[3.3.1]нонана в твердом агрегатном состоянии
тетраазабицикло[3.3.1]нонаном при кристаллизации
протекает с усклрением и описывается S-образными
(рис. 2) [4].
кинетическими кривыми (рис.
1). Изменение
отношения величины поверхности реакционного
Кинетические кривые термораспада
3,7-
сосуда к его объему (S/V) не влияет на скорость и
динитротетраазабицикло[3.3.1]нонана в
2 мас%-
закон распада, что свидетельствует об отсутствии
ных растворах дибутилфталата и динитробензола,
гетерогенной реакции на стенках реакционного
отличающихся диэлектрической постоянной (ε =
сосуда и цепных процессов. В то же время
6.4 и 20.6 соответственно), имеют слабо выражен-
увеличение отношения массы вещества к объему
ную S-образность, характерную для вторичных
сосуда (m/V) в
20 раз хотя и приводит к
нитраминов. Скорость термораспада в растворах
191
192
КРУГЛЯКОВА и др.
τ, мин
Рис. 2. Влияние размеров кристаллов на термическое
τ, мин
разложение образцов динитротетраазабицикло[3.3.1]
нонана при 160ºС, m/V = 4.2·10-4 г/см3. 1 - измель-
Рис. 1. Кинетика термораспада 3,7-динитротетраазаби-
ченный (свежеприготовленный) образец, 2 - измель-
цикло[3.3.1]нонана. 1 - 140, 2 - 150, 3 - 160, 4 - 170,
ченный (выдержанный) образец; 3 - неизмельченный
5 - 180°C.
образец.
дибутилфталата и динитробензола выше, чем в
нитрамина, подобно тому, как это наблюдается в
твердом состоянии (табл. 1) и в целом выше, чем у
ароматических нитросоединениях. Однако, если
других циклических нитраминов, представленных
обратиться к соединению
1 (табл.
1), то
для сравнения в табл. 1.
проявляется совершенно другая картина: скорость
разложения не увеличивается при прочих равных
На первый взгляд, можно предполагать, что
условиях, а, наоборот, сильно уменьшается по
накопление нитраминных групп в цикле должно
сравнению с
3,7-динитротетраазабицикло[3.3.1]-
способствовать увеличению скорости распада
нонаном. Это уменьшение скорости для
Таблица 1. Кинетические параметры термораспада циклических нитраминов
Твердая фаза
Раствор
№
Вещество
Ссылка
Растворитель
Ссылка
k180°×105,
k180°×105,
lgA
lgA
c-1
c-1
1
Октоген
158.6
11.20
0.082
[5]
187.9
15.00
0.22
Динитробензол
[5]
2
Октоген (δ-форма)
158.9
11.30
0.095
[6]
3
Октоген (β-форма)
150.6
10. 80
0.280
[7]
280.3
25.00
0.048
[8]
4
Октоген (α-форма)
171.5
12.60
0.067
[9]
159.0
10.80
0.029
[6]
5
N,N-Динитропиперазин
155.6
12.00
0.12
Нитробензол
[11]
6
Гексоген
165.3
11.70
0.043
[5]
166.1
14.30
1.42
Динитробензол
[5]
167.4
11.30
0.010
[6]
167.5
14.62
2.04
Дибутилфталат
[10]
217.6
19.10
0.103
[5]
7
Пентоген
155.9
13.60
4.23
Динитробензол
[11]
8
Бициклооктан
210.2
18.00
0.058
[12]
170.0
13.77
14.79
Динитробензол
[12]
165.0
14.96
8.65
Дибутилфталат
[12]
9
Динитротетраазабицикло-
172.9
15.64
5.08
151.6
13.71
17.06
Дибутилфталат
[3.3.1]нонан
150.6
13.62
18.10
Динитробензол
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
КИНЕТИКА ТЕРМИЧЕСКОГО РАЗЛОЖЕНИЯ
193
Таблица 2. Состав неконденсирующихся газообразных продуктов, образующихся при термическом разложении 3,7-
динитротетраазабицикло[3.3.1]нонана в твердом состоянии
Состав продуктов распада, мол%
Температура, °C
Степень превращения, %
N
2
N2O
CO
CO2
160
10
0.98
96.19
0.90
1.93
160
20
0.69
96.47
0.83
2.01
160
50
0.64
95.57
1.09
2.69
160
75
0.66
93.94
1.29
4.11
160
100
0.64
91.87
2.39
5.10
150
10
0.68
96.32
0.83
2.18
150
20
0.46
96.55
0.76
2.23
170
100
0.95
88.22
2.87
7.94
соединения 1 в твердой фазе составляет примерно
укорочены. Расстояния между атомами кислорода
62 раза. В то же время, восьмичленный
и соседними атомами углерода метиленовых групп
циклический нитрамин октоген, который может
составляют 2.62-2.69 Å [13], что меньше суммы
существовать в кристаллической фазе в виде
ван-дер-ваальсовых радиусов атомов углерода и
полиморфных модификаций, отличающихся
кислорода
(3.16 Å). Кроме того, в структуре
конформацией цикла (соединения 1-4), является
кристаллов динитротетраазабицикло[3.3.1]нонана
наиболее стабильным. Константы скорости распада
имеется несколько коротких межмолекулярных
изменяются примерно на порядок в зависимости от
контактов С···О
(3.2-3.3 Å). В целом можно
конформации цикла. Как видно из табл.
1,
констатировать, что структура бицикло[3.3.1]-
наиболее термически стабильной является плотно
нонана значительно более жесткая, чем
упакованная β-форма октогена, которая имеет
циклооктана, и конверсия цикла значительно
конформацию скрученного кольца, где одна пара
затруднена. Отметим, что в соответствии с конфор-
соседних нитрогрупп расположена по одну
мационными расчетами, структуры типа кресло-
сторону от средней плоскости кольца, а другая - по
ванна и ванна-ванна существенно менее выгодны,
другую сторону. Структура аналога октогена - 3,7-
а небольшие барьеры их образования делают такие
динитротетраазабицикло[3.3.1]нонана
- в
конформации практически неустойчивыми.
кристалле подобна модификации октогена, при
Суммируя вышеизложенное, можно понять низкую
этом N-нитраминные группы в молекуле
термостабильность
3,7-динитротетраазабицикло
практически плоские [13, 14].
[3.3.1]нонана, константа скорости термораспада
которого в ~18 раз больше, чем у β-конформера
Теоретически возможны три конформации
октогена.
молекулы динитротетраазабицикло[3.3.1]нонана:
кресло-кресло (А), кресло-ванна (Б) и ванна-ванна
ГЖХ-Анализ неконденсирующихся газо-
(В), отличающиеся характером угловых
образных продуктов термораспада динитротетра-
деформаций и невалентными взаимодействиями
(схема 1). В кристалле реализуется конформация
Схема 1.
кресло-кресло А, в которой нитраминные группы
имеют пирамидальное строение (γ
=
26°-24°,
O2N
N
отклонение аминного азота от плоскости его
O2N
окружения), а углы CNC в циклах составляют 113°-
N
N
118°, т. е. примерно такие же, как в α-форме
N NO2
N
N
N
гексогена, промежуточного продукта в синтезе
NO2
N
октогена, и меньше, чем в молекуле октогена (121°-
N N
N N NO2
O2N
125°). В молекуле динитротетраазабицикло[3.3.1]-
нонана многие внутримолекулярные контакты
А
Б
В
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
194
КРУГЛЯКОВА и др.
Схема 2.
N
N
N
O2N
N
N
NO2
O2N
N N
NO2
O2N
N
N
+
NO2
(1)
N
N
N
N
O2N
N
N
2CH2=N
+
CH2=N NO2 + CH2=N CH2
(2)
N
(3)
CH2=N NO2
CH2O + N2O
(4)
CH2=N CH2+ NO2
CH2=N + CH2O + NO
N
N
(5)
O2N
N
N
+
NO
O2N
N
N
NO
N
N
N
O2N
N
N
NO
(6)
CH2=N+CH2=N NO + CH2=NCH2NNO2
N
CH2=N NO
CH2=N+ CH2O + N2
(7)
(8)
CH2=NCH2NNO
CH2=N +CH2O + N2O
2
CH2=N + CH2=NNO2
(9)
CH2=NCH2NNO
2
(10)
CH2=N NO2
CH2=N + NO
2
CH2O + NO2
NO
+
CO2
+
CO
+
H2O
(11)
азабицикло[3.3.1]нонана показал, что основным из
58,
46,
44,
42,
30,
28), свидетельствующие о
них является закись азота, а азот образуется в
деструкции цикла в ходе разложения.
количествах в 100-200 раз меньших (табл. 2), в то
Принимая во внимание вышесказанное, а также
время как при термическом разложении гексогена
симбатное изменение активационных параметров
и октогена закись азота и азот выделяются в
распада
3,7-динитротетраазабицикло[3.3.1]нонана
сопоставимых количествах [15].
в растворе, можно по аналогии с гексогеном и
Согласно данным хромато-масс-спектро-
октогеном предположить гомолитический
метрического анализа динитротетраазабицикло-
механизм термораспада, лимитирующей стадией
[3.3.1]нонана и конденсированных продуктов
которого является разрыв связи N-NO2 в одном из
термораспада при конверсии
5 и
30%,
циклов молекулы. При таком механизме реакции
интенсивность пика молекулярного иона в масс-
переходное состояние должно быть более
спектре исходного динитротетраазабицикло[3.3.1]-
упорядоченным, чем исходное, а энергия
нонана низка
(1.81%). Основными являются
активации
- меньше энергии наиболее слабой
осколочные ионы с m/z 128 (100%) и 142 (64%). В
связи N-NO2 (1.375 Å) [15].
конденсированных продуктах термораспада
интенсивность этих пиков изменяется с
Энтропия активации термораспада динитро-
увеличением степени конверсии, и появляются
тетраазабицикло[3.3.1]нонана в растворе при 180°С
новые пики осколочных и перегруппировочных
составляет всего 5.75 Дж/(моль·град) (дибутил-
ионов (m/z 202, 172, 144, 130, 114, 112, 88, 74, 72,
фталат) и
4.02 Дж/(моль·град) (динитробензол).
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
КИНЕТИКА ТЕРМИЧЕСКОГО РАЗЛОЖЕНИЯ
195
Можно предположить, что переходное состояние
СПИСОК ЛИТЕРАТУРЫ
близко к исходному из-за более жесткой структуры
и наличия коротких контактов С···О в молекуле
1. Орлова Е.Ю., Орлова Н.А., Жилин В.Ф., Збарский В.Л.,
Шутов Г.М., Витковская Л.И.
//
Октоген
-
динитротетраазабицикло[3.3.1]нонана с плоской
термостойкое взрывчатое вещество. М.: Недра,
конфигурацией нитраминной группы.
1975. 126 с.
Механизм термораспада
3,7-динитротетра-
2. Шу Ю., Корсунский Б.Л., Назин Г.М. // Усп. хим.
2004. Т.
73.
№ 3. С. 320; Shu Yu., Nazin G.M.,
азабицикло[3.3.1]нонана представлен на схеме 2. В
Korsounskii B.L. // Russ. Chem. Rev. 2004. Vol. 73.
рамках предложенного механизма (1)-(11) хорошо
P. 293. doi 10.1070/RC2004v073n03ABEH000802
объясняется образование газообразных и
3. Zeman S., Dimun M. // Propel. Expl. Pyrotechn. 1990.
конденсированных продуктов термораспада
Vol. 15. P. 217.
динитротетраазабицикло[3.3.1]нонана, а также
4. Збарский В.Л., Максимов Ю.Я., Орлова Е.Ю. // Тр.
пониженные активационные параметры уравнения
МХТИ. Теория взрывчатых веществ. М.: ВШ, 1967.
Аррениуса в растворе по сравнению с гексогеном и
Вып. 53. С. 84.
октогеном (табл. 1).
5. Максимов Ю.Я. // Тр. МХТИ. Теория взрывчатых
веществ. М.: ВШ, 1967. Вып. 53. С. 73.
Таким образом, установлены кинетические
6. Буров Ю.М., Манелис Г.Б., Назин Г.М.
// Хим.
закономерности, активационные параметры и
физика. 1985. Т. 4. № 7. С. 956.
механизм термораспада
3,7-динитротетраазаби-
7. Клименко Г.К. Горение и взрыв. М.: Наука, 1977.
цикло[3.3.1]нонана в твердом состоянии и
С. 785.
растворах. Показано, что причиной ускорения
8. Беляева М.С., Клименко Г.К., Бабайцева Л.Т.,
распада является автокатализ продуктами реакции.
Столяров П.Н. // Химическая физика процессов
Выявлено влияние строения молекулы
3,7-ди-
горения и взрыва. Кинетика химических реакций.
нитротетраазабицикло[3.3.1]нонана на скорость и
Черноголовка, 1977. С. 47.
механизм термического разложения
9. Буров Ю.М., Назин Г.М. // Хим. физика. 1984. Т. 3.
№ 8. С. 1126.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
10. Степанов Р.С., Круглякова Л.А., Астахов А.М. //
ЖОХ. 2007. Т. 77. Вып. 7. С. 1211; Stepanov R.S.,
3,7-Динитротетраазабицикло[3.3.1]нонан син-
Kruglyakova L.A., Аstaсhov А.М. // Russ. J. Gen. Chem.
тезировали из динитрата уротропина и уксусного
2007. Vol.
77. N
7. P.
1293. doi
10.1134/
ангидрида, очищали перекристаллизацией из
S1070363207070237
ацетона, т. пл. 207°С (205-206°С [1]).
11. Ситонина Г.В., Корсунский Б.Л., Пятаков И.Ф.,
Швайко В.Г., Абдрахманов И.Ш., Дубовицкий Ф.И. //
Кинетику термораспада изучали манометри-
Изв. АН СССР. Сер. хим. 1979. № 2. С. 311; Sitoni-
ческим методом с применением стеклянного
na G.V., Korsunskii B.L., Pyatakov N.F., Shvaiko V.G.,
Abdrakhmanov I.S., Dubovitskii F.I. // Bull. Acad. Sci.
манометра типа Бурдона при остаточном давлении
USSR. Div. Chem. Sci. doi 10.1007/BF00925868
воздуха в реакционном пространстве 10-2-10-1 мм
12. Степанов Р.С., Круглякова Л.А., Астахов А.М. //
рт. ст.
[16]. Анализ газообразных продуктов
ЖОХ. 2006. Т. 76. Вып. 12. С. 2063; Stepanov R.S.,
разложения проводили на хроматографе ЛХМ-80 с
Kruglyakova L.A., Аstaсhov А.М. // Russ. J. Gen. Chem.
использованием колонки с полисорбом 1. Состав
2006. Vol.
76. N
12. P.
1293. doi
10.1134/
конденсированных продуктов распада анализи-
S1070363206120292
ровали на хромато-масс-спектрометре Shimadzu
13. Choi C.S., Bulusu S. // Acta Crystallogr. (B).
1974.
LCMS-2020 (растворитель - ацетонитрил, 70 эВ).
Vol. 30. N 6. P. 1576. doi 10.1107/S0567740874005292
Константы скорости термораспада вычисляли по
14. Целинский И.В., Шугалей И.В., Щербинин М.Б.
начальным скоростям разложения. Ошибка в
Физическая химия нитросоединений. Л.: ЛТИ им.
определении константы скорости не превышала 6-
Ленсовета, 1985. 186 с.
8%, а энергии активации - 3-4 кДж/моль.
15. Дубовицкий Ф.И., Корсунский Б.Л. // Усп. хим. 1981.
Т.
50.
№ 10. С. 1828; Dubovitskii F.I., Korsun-
КОНФЛИКТ ИНТЕРЕСОВ
skii B.L. // Russ. Chem. Rev. 1981. Vol. 50. N 10.
P. 958. doi 10.1070/RC1981v050n10ABEH002721
Авторы заявляют об отсутствии конфликта
16. Круглякова Л.А., Степанов Р.С. // Изв. вузов. Сер.
интересов.
хим. и хим. технол. 2008. Т. 51. Вып. 10. С. 31.
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
196
КРУГЛЯКОВА и др.
Kinetics of Thermal Decomposition
of 3,7-Dinitro-1,3,5,7-tetraazabicyclo[3.3.1]nonane
L. A. Kruglyakovaa*, R. S. Stepanova, Yu. V. Kekinb, and K. V. Pekhotina
a Academician M. F. Reshetnev Siberian State University of Science and Technology,
pr. Gazety Krasnoyarskii Rabochii 31, Krasnoyarsk, 660037 Russia
*e-mail: lakruglyakova@sibsau.ru
b Siberian Law Institute of the Ministry of Internal Affairs of Russia, Krasnoyarsk, Russia
Received July 19, 2018; revised July 19, 2018; accepted July 26, 2018
The thermal decomposition kinetics of 3,7-dinitro-1,3,5,7-tetraazabicyclo3.3.1. nonane in the solid phase and in
solution was studied. The decomposition mechanism and kinetic regularities were established. The activation
parameters of the limiting stage were determined.
Keywords: dinitrotetraazabicyclo[3.3.1]nonane, cyclic nitramines, octogen, thermal decomposition, activation
parameters
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019