ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 2, с. 197-201
УДК 547.841:541.63
СТРОЕНИЕ И КОНФОРМАЦИОННЫЙ АНАЛИЗ
5,5-БИС(БРОММЕТИЛ)-2-МЕТИЛ-2-ФЕНИЛ-1,3-ДИОКСАНА
© 2019 г. Ш. Ю. Хажиевa, М. А. Хусаиновa, Р. А. Халиковb, Т. В. Тюмкинаc,
Е. С. Мещеряковаc, Л. М. Халиловc, В. В. Кузнецовa,d, *
a Уфимский государственный нефтяной технический университет, Уфа, Россия
b Башкирский государственный медицинский университет, Уфа, Россия
c Институт нефтехимии и катализа Российской академии наук, Уфа, Россия
d Уфимский государственный авиационный технический университет,
ул. К. Маркса 12, Уфа, 450008 Россия
*e-mail: kuzmaggy@mail.ru
Поступило в Редакцию 26 июля 2018 г.
После доработки 26 июля 2018 г.
Принято к печати 2 августа 2018 г.
С помощью методов ЯМР 1Н, 13С и рентгеноструктурного анализа исследовано строение 5,5-бис-
(бромметил)-2-метил-2-фенил-1,3-диоксана. Компьютерным моделированием в приближении DFT
метода PBE/3ξ выявлены маршрут интерконверсии кольца, а также оптимальная конформация
фенильной группы, отвечающая результатам рентгеноструктурного анализа.
Ключевые слова:
1,3-диоксан,
5,5-бис(галогенметил)-1,3-диоксаны, конформеры, компьютерное
моделирование
DOI: 10.1134/S0044460X19020057
Замещенные 1,3-диоксаны интересны как особен-
поведение кеталей данного ряда до настоящего
ностями строения, так и использованием в качестве
времени остается малоисследованным. В этой
реагентов для тонкого органического синтеза [1-4].
связи настоящая работа посвящена изучению
В частности, 5,5-бис(галогенметил)-1,3-диоксаны
строения и конформационных превращений 5,5-
относительно легко превращаются в моно- и
бис(бромметил)-2-метил-2-фенил-1,3-диоксана с
дииодпроизводные; при этом процесс протекает
помощью ЯМР
1H,
13С, рентгеноструктурного
стереоселективно и идет преимущественно по
анализа (РСА) и DFT-метода PBE/3ζ в рамках
экваториальному хлорметильному заместителю [5].
программного обеспечения ПРИРОДА [9].
Неописанный ранее 5,5-бис(бромметил)-2-метил-
Конформационное поведение формалей 5,5-бис-
2-фенил-1,3-диоксан синтезирован конденсацией
(галогенметил)-1,3-диоксанов при комнатной
2,2-бис(бромметил)-1,3-пропандиола с ацетофеноном
температуре характеризуется быстрой в шкале
(схема 1).
времени ЯМР интерконверсией цикла
[6].
Молекулы
2-замещенных аналогов, напротив,
Результаты исследования полученного кеталя
существуют преимущественно в конформации
методом РСА приведены в табл. 1 и 2. Структура
кресла с экваториальной ориентацией заместителя
молекулы 5,5-бис(бромметил)-2-метил-2-фенил-1,3-
у атома С2 (Ке) [7, 8]. Однако конформационное
диоксана отвечает конформации кресло с аксиаль-
Схема 1.
BrH
C
OH
C6H5
BrH2C
O
C6H5
2
H+
+
C=O
H
2O
BrH2C
OH
H3C
BrH2C
O
CH3
197
198
ХАЖИЕВ и др.
Таблица 1. Кристаллографические данные и детали рентгеноструктурного эксперимента
Параметр
Значение
Параметр
Значение
Формула
C13Н16О2Br2
Z
4
М
364.06
ρвыч, мг/мм3
1.693
Т, K
293(2)
μ, мм-1
5.665
Кристаллическая система
Моноклинная
F(000)
720.0
Пространственная группа
P21/с
Интервал измерения индексов
-9 ≤ h ≤ 7
-26 ≤ k ≤ 20
-14 ≤ l ≤ 13
a, Å
6.9219(4)
Число отражений использованных при уточнении/
2777/145
число уточняемых параметров
b, Å
19.0319(11)
GOOF
1.090
c, Å
11.2114(8)
Окончательные значения факторов расходимости
R1 = 0.0861
для отражений с I ≥ 2σ(I)
wR2 = 0.1492
β, град
104.780(6)
Окончательные значения факторов расходимости
R1 = 0.1634
для всех отражений
wR2 = 0.1815
V, Å3
1428.09(16)
Остаточная электронная плотность, e/Å-3
0.47/-1.01
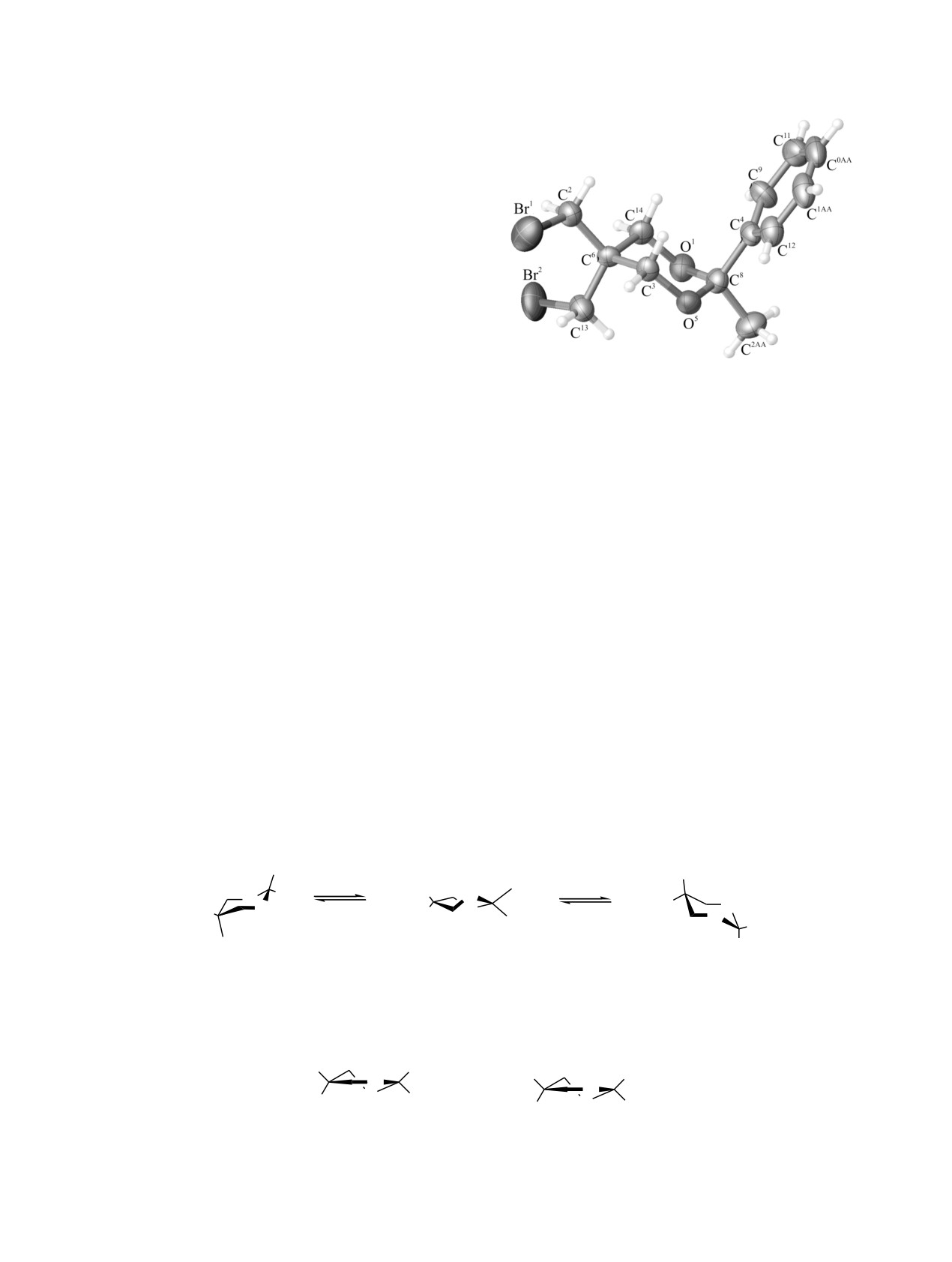
ной фенильной группой (Ка, см. рисунок). При
мого кеталя более гофрирован по сравнению с 5,5-
этом плоскости ароматического кольца и
бис(бромметил)-2-фенил-1,3-диоксаном, для которого
фрагмента О1-O5-С3-C14 почти ортогональны. Для
величина α1 равна
120.1°
[3]. Бромметильные
гетероатомной части гетероциклического кольца
заместители, в соответствии с ранее выполнен-
значения длин связей С-О
(1.416-1.430 Å) и
ными квантовохимическими расчетами
[7],
валентных углов (110°-113°) отвечают обычным
находятся в гош-положении относительно друг
величинам. Межплоскостные углы между фраг-
друга (см. рисунок), поскольку эта конфигурация
ментами 1,3-диоксанового кольца СОО и СООС
отвечает минимуму энергии.
(α1), а также СООС и ССС (α2) составляют 129.2(5)°
и 130.7(5)° соответственно. Следует подчеркнуть,
Спектры ЯМР
1Н и 13С свидетельствуют о
что гетероатомный фрагмент молекулы исследуе-
конформационной однородности молекул 5,5-бис-
Таблица 2. Избранные длины связей, а также валентные углы в молекуле 5,5-бис(бромметил)-2-метил-2-фенил-1,3-
диоксана
d, Å
φ, град
Связь
Валентный угол
расчет
эксперимент
расчет
эксперимент
О1-С8
1.434
1.416(8)
C14O1C8
113.6
113.8(4)
О1-С14
1.432
1.423(7)
С3О5С8
113.8
114.0(5)
О5-С8
1.435
1.430(7)
О1С8О5
110.5
110.1(5)
О5-С3
1.431
1.426(7)
О1С14С6
111.3
110.2(5)
С8-С4
1.538
1.530(8)
О5С3С6
112.1
110.6(4)
С6-С2
1.525
1.521(8)
С3С6С14
105.4
110.0(5)
С6-С13
1.529
1.532(8)
С6С2Br1
114.1
113.6(4)
С2-Br1
1.989
1.955(6)
С6С13Br2
114.1
113.9(5)
С8-С2АА
1.525
1.507(8)
С2С6С13
113.1
113.0(5)
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
СТРОЕНИЕ И КОНФОРМАЦИОННЫЙ АНАЛИЗ
199
(бромметил)-2-метил-2-фенил-1,3-диоксана в раст-
воре. Отнесение сигналов в спектрах ЯМР 1Н и 13С
выполнено по данным 1D и 2D спектроскопии с
использованием методик DEPT135, NOESY,
COSYHH и HSQC. Метиленовые протоны при
магнитно эквивалентных углеродных атомах С4 и
С6 гетероциклического кольца являются диа-
стереотопными (Δδ = 0.26 м. д.) и проявляются в
спектре ЯМР 1Н в виде дублетов с константой 2J =
10.7 Гц. Метиленовые протоны бромметильных
заместителей при атоме С5 кольца магнитно
неэквивалентны (Δδ = 0.90 м. д.); при этом на
основании NOESY эксперимента установлено, что
Кристаллическое строение молекулы 5,5-бис(бромметил)-
протоны аксиальной СН2Br-группы резонируют в
2-метил-2-фенил-1,3-диоксана.
более слабом поле.
Полученные результаты подтверждаются данными
ческого кольца (нумерация атомов дана согласно
конформационного анализа 5,5-бис(бромметил)-2-
рисунку). Моделирование ее внутреннего вращения
метил-2-фенил-1,3-диоксана в рамках прибли-
в ходе сканирования торсионного угла С2ААС8С4С12
жения PBE/3ζ. На поверхности потенциальной
(φ) приводит к появлению на ППЭ переходного
энергии (ППЭ) этого соединения выявлены три
состояния, в котором фенильный заместитель
минимума (конформеры Ке, Ка и 2,5-Т), а также два
ориентирован вдоль биссектральной плоскости
переходных состояния: ПС-1 и ПС-2 (схема 2). Все
гетероциклического кольца; потенциальный барьер
расчеты проведены для гош-ориентации брометиль-
такого вращения (ΔG298) составляет 11.1 ккал/моль.
ных заместителей у атома С5 гетероциклического
Ближайшим к форме Ка локальным минимумом
кольца.
является конформер 2,5-Т, а наименее стабильный
Главный минимум на ППЭ отвечает форме Ка
отвечает форме Ке. Переходные состояния - кон-
(табл. 3). Расчетные значения длин связей, а также
формации полукресло - отличаются на 1.2 ккал/моль
валентных и торсионных углов близки к данным
(ΔG
298);
при этом максимальная высота
рентгеноструктурного эксперимента (табл.
2).
потенциального барьера (9.2 ккал/моль) хорошо
Фенильная группа, как и в случае молекулы в
согласуется с данными эксперимента для 2-метил-2-
кристалле (см. рисунок), ориентирована орто-
фенил-1,3-диоксана [1]. Следует также отметить
гонально плоскости О1-O5-С3-C14 гетероцикли-
отсутствие на ППЭ промежуточного минимума
Схема 2.
Минимумы
C6H5
BrH2C
ПС-1
C6H5
ПС-2
BrH2C
CH3
O
O
BrH2C
O
BrH2C
O
O
BrH2C
O
CH3
C6H5
CH2Br
CH3
Кa
2,5-T
Ке
Переходные состояния
BrH2C
C6H5
BrH2C
CH3
O
O
O
CH
BrH2C
3
O
C6H5
BrH2C
ПС-1
ПС-2
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
200
ХАЖИЕВ и др.
Таблица 3. Энергетические параметры конформационных превращений молекул 5,5-бис(бромметил)-2-метил-2-фенил-
1,3-диоксана согласно данным расчета PBE/3ζ
ΔЕ°0, ккал/моль
ΔH°298, ккал/моль
ΔG°298, ккал/моль
ΔS°298, кал/(моль∙K)
Конформер
-Е0а, Хартри
(ΔЕ0)
(ΔH298)
(ΔG298)
(ΔS298)
Ка
5802.274495
0
0
0
0
Ке
5802.269567
3.1
3.2
2.6
1.9
2,5-Т
5802.270376
2.6
2.6
2.1
1.7
ПС-1
5802.261527
(8.1)
(7.9)
(8.0)
(-0.4)
ПС-2
5802.258974
(9.7)
(9.5)
(9.2)
(1.2)
Вращение 2-Ph (Ка)
5802.262507
(10.1)
(9.5)
(11.1)
(-5.5)
а С учетом ZPE.
1,4-твист, характерного для равновесия молекул
структуру исследовали методом PBE/3ζ (ПРИРОДА
незамещенного, а также 2-, 4-, 5-, 2,5- и 4,4-
[9]). Моделирование конформационных превра-
замещенных 1,3-диоксанов [4].
щений фенильной группы в конформере Ка 5,5-бис-
(бромметил)-2-метил-2-фенил-1,3-диоксана
осу-
Таким образом, данные рентгеноструктурного
ществляли путем оптимизации геометрии в ходе
анализа, ЯМР и компьютерного моделирования
изменения торсионного угла С2ААС8С4С12 от 0° до
однозначно подтверждают конформационную
180°; моделирование интерконверсии цикла
однородность молекул 5,5-бис(бромметил)-2-метил-
проводили путем сканирования внутрицикли-
2-фенил-1,3-диоксана, пребывающих в конформа-
ческого торсионного угла СССО от -60° до 60°.
ции кресло с аксиальной фенильной группой.
Значения потенциальных барьеров находили с
помощью процедуры поиска переходных
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
состояний в рамках программного обеспечения
ПРИРОДА. Принадлежность стационарных точек
Cпектры ЯМР получены на спектрометре Bruker
ППЭ к переходному состоянию подтверждалась
Avance 400 с рабочей частотой 400.13 (1H) и 100.62
наличием одной мнимой частоты в соответ-
(13С) в растворах CDCl3, использованного и в
ствующем гессиане, а к минимуму - отсутствием
качестве внутреннего стандарта. Рентгено-
мнимых частот.
структурный анализ выполнен на автоматическом
четырехкружном дифрактометре XCalibur Eos
5,5-Бис(бромметил)-2-метил-2-фенил-1,3-ди-
(графитовый монохроматор, MoKα-излучение, λ =
оксан получен по стандартной методике
[12]
0.71073 Å, ω-сканирование, 2θmax = 62°). Сбор и
кипячением эквимольной смеси (0.01 моль) 2,2-бис-
обработка данных проведены с помощью
(бромметил)-1,3-пропандиола с ацетофеноном в
программы CrysAlisPro Oxford Diffraction Ltd.,
бензоле в присутствии
0.1 г п-толуолсульфо-
версия
1.171.36.20. Структуры расшифрованы
кислоты. Выход
73%, т. пл. 96-97°С (гексан-
прямым методом и уточнены полноматричным
этанол, 1:1). Спектр ЯМР 1Н, δ, м. д.: 1.58 c (3Н,
методом наименьших квадратов в анизотропном
CH3), 3.12 c (2Н, СН2Breq), 3.63 д (2Н, НА, J =
приближении для неводородных атомов. Атомы
10.7 Гц), 3.89 д (2Н, НВ, J = 10.7 Гц), 4.02 c (2Н,
водорода локализованы в разностном синтезе
СН2Braх), 7.29-7.44 м (5Н, С6Н5). Спектр ЯМР 13C,
Фурье и уточнены изотропно. Расчеты выполняли
δС, м. д.: 31.5 (C2), 36.1 (C13), 37.5 (C6), 66.1 (C3,14),
по программе SHELX97
[10].
Структура
101.4 (C8), 126.5 (Сп), 128.2 (См), 129.0 (Со), 139.4
депонирована в Кембриджском банке структурных
(Сипсо). Найдено, %: С 42.79; Н 4.33; Br 44.01.
данных (CCDC 1849061).
С13Н16Br2O2. Вычислено, %: С 42.85; Н 4.39; Br
43.95.
Первоначальную оптимизацию геометрии кон-
формера Ка 5,5-бис(бромметил)-2-метил-2-фенил-
Структурные исследования проведены в Центре
1,3-диоксана проводили методом АМ1 с помощью
коллективного пользования
«Агидель» при
программы HyperChem
8.0
[11]. Полученную
Институте нефтехимии и катализа РАН.
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
СТРОЕНИЕ И КОНФОРМАЦИОННЫЙ АНАЛИЗ
201
ФОНДОВАЯ ПОДДЕРЖКА
5. Курмаева Е.С., Чалова О.Б., Чистоедова Г.И.,
Лапука Л.Ф., Киладзе Т.К., Кантор Е.А.,
Работа выполнена при финансовой поддержке
Рахманкулов Д.Л. // ЖОрХ. 1985. Т. 21. Вып. 1. С. 131.
Министерства образования и науки РФ (проект
6. Бочкор С.А., Лапука Л.Ф., Курмаева Е.С., Чалова О.Б.,
Злотский С.С., Рахманкулов Д.Л. // ХГС. 1987. № 5.
№ 16.1969.2017/4.6).
С. 607; Bochkor S.A., Lapuka L.F., Kurmaeva E.S.,
Chalova O.B., Zlotskii S.S., Rakhmankulov D.L.
//
КОНФЛИКТ ИНТЕРЕСОВ
Chem. Heterocycl. Compd. 1987. Vol. 23. N 5. P. 500.
doi 10.1007/BF00476374
Авторы заявляют об отсутствии конфликта
7. Хажиев Ш.Ю., Хусаинов М.А., Кантор Е.А.
//
интересов.
ЖОрХ. 2011. Т. 47. Вып. 3. С. 454; Khazhiev Sh. Yu.,
Khusainov M. A., Kantor E. A. // Russ. J. Org. Chem.
СПИСОК ЛИТЕРАТУРЫ
2011. Vol.
47. N
3.
P.
450. doi
10.1134/
S1070428011030225
1. Внутреннее вращение молекул / Под ред. В.Дж.
8. Хажиев Ш.Ю., Хусаинов М.А. // ЖОрХ. 2017. Т. 53.
Орвилл-Томаса. М.: Мир, 1977. С. 355.
Вып. 5. С. 707; Khazhiev Sh.Yu., Khusainov M.A. //
2. Кузнецов В.В. // Изв. АН. Сер. хим.
2005.
№ 7.
Russ. J. Org. Chem. 2017. Vol. 53. N 5. P. 717. doi
С. 1499; Kuznetsov V.V. // Russ. Chem. Bull. Int. Ed.
10.1134/S1070428017050116
2005. Vol. 54. N 7. P. 1543. doi 10.1007/s11172-006-
9. Лайков Д.Н., Устынюк Ю.А. // Изв. АН. Сер. хим.
0001-0
2005. № 3. С.804; Laikov D.N., Ustynyuk Yu.A. // Russ.
3. Хажиев Ш.Ю., Хусаинов М.А., Халиков Р.А.,
Chem. Bull. 2005. Vol. 54. N 3. P. 820. doi 10.1007/
Тюмкина Т.В., Мещерякова Е.С., Халилов Л.М.
s11172-005-0329-x
Кузнецов В.В. // ЖОХ. 2018. Т. 18. Вып. 3. С. 369;
10. Sheldrick G.M. // Acta Crystallogr. (A). 2008. Vol. 64.
Khazhiev Sh.Yu., Khusainov M.A., Khalikov R.A.,
N 1. P. 112. doi 10.1107/S0108767307043930
Tyumkina T.V., Meshcheryakova E.S., Khalilov L.M.,
Kuznetsov V.V. // Russ. J. Gen. Chem. 2018. Vol. 88.
N 3. P. 397. doi 10.1134/S1070363218030040
12. Рахманкулов Д.Л., Сыркин А.М., Караханов Р.А.,
4. Кузнецов В.В. // ЖОрХ. 2014. Т.50. Вып. 9. С. 1247;
Кантор Е.А., Злотский С.С., Имашев У.Б. Физико-
Kuznetsov V.V. // Russ. J. Org. Chem. 2014. Vol. 50.
химические свойства
1,3-диоксанов. М.: Химия,
N 9. P. 1227. doi 10.1134/S1070428014090012
1980. 237 с.
Structure and Conformational Analysis
of 5,5-Bis(bromomethyl)-2-methyl-2-phenyl-1,3-dioxane
Sh. Yu. Khazhieva, M. A. Khusainova, R. A. Khalikovb, T. V. Tyumkinac,
E. S. Meshcheryakovac, L. M. Khalilovc, and V. V. Kuznetsova,d*
a Ufa State Petroleum Technological University, Ufa, Russia
b Bashkirian State Medical University, Ufa, Russia
c Institute of Petrochemistry and Catalysis, Russian Academy of Sciences, Ufa, Russia
d Ufa State Aviation Technical University, ul. K. Marksa 12, Ufa, 450008 Russia
*e-mail: kuzmaggy@mail.ru
Received July 26, 2018; revised July 26, 2018; accepted August 2, 2018
The structure of 5,5-bis(bromomethyl)-2-methyl-2-phenyl-1,3-dioxane was studied using 1H, 13C NMR and
X-ray diffraction analysis methods. Computer simulation in the DFT approximation of PBE/3ξ method revealed
the route of the ring interconversion, as well as the optimal conformation of the phenyl group, corresponding to
the results of X-ray diffraction data.
Keywords: 1,3-dioxane, 5,5-bis(halomethyl)-1,3-dioxanes, conformers, computer simulation
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019