ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 2, с. 202-210
УДК 547.49;547.87;542.97
КАТАЛИТИЧЕСКОЕ АМИНОМЕТИЛИРОВАНИЕ
АМИНОБЕНЗАМИДОВ
БИС(N,N-ДИМЕТИЛАМИНО)МЕТАНОМ
И КАРБАМИДАМИ
© 2019 г. Р. Р. Хайруллина*, Т. В. Тюмкина, А. Р. Гениятова,
Ф. К. Муллагильдина, А. Г. Ибрагимов
Институт нефтехимии и катализа Российской академии наук, пр. Октября 141, Уфа, 450075 Россия
*е-mail: ink@anrb.ru
Поступило в Редакцию 12 июля 2018 г.
После доработки 12 июля 2018 г.
Принято к печати 16 июля 2018 г.
Разработан эффективный метод синтеза ациклических производных анилина с карбамидными
фрагментами взаимодействием карбамидов с орто-, мета- и пара-аминобензамидами и бис(N,N-
диметиламино)метаном в присутствии NiCl2·6H2O и SmCl3·6H2O в качестве катализаторов.
Ключевые слова: аминометилирование, аминобензамиды, бис(N,N-диметиламино)метан, карбамиды
DOI: 10.1134/S0044460X19020069
Реакция аминометилирования амидов кислот
аминогруппе [11, 12], а также с целью разработки
формальдегидом и NH-кислотами до настоящего
эффективного метода синтеза перспективных для
времени
является
классическим
методом
практического применения N-замещенных произ-
получения аминометилированных амидов кислот
водных анилина с карбамидными фрагментами мы
[1-10]. Нами было показано, что каталитическое
изучили аминометилирование орто-, мета- и пара-
аминометилирование первичных алкиламинов [11]
аминобензамидов с помощью бис(N,N-диметил-
или гидразидов арилкарбоновых кислот
[12] с
амино)метана и карбамидов (мочевина, биурет,
помощью бис(N,N-диметиламино)метана и (тио)-
семикарбазида гидрохлорид), а также N,N′-бис-
мочевины или N,N'-бис[(диметиламино)метил]-
(диметиламинометил)мочевины, N,N'-бис[(диметил-
(тио)карбамидов является удобным методом
амино)метил]аллофанамида и N-({[(диметиламино)-
синтеза азотсодержащих гетероциклов с карба-
метил][(2-метиленгидразино)карбонил]амино}метил)-
мидными фрагментами в мягких условиях.
N,N-диметиламина с участием катализаторов на
основе переходных и редкоземельных металлов.
Азотсодержащие гетероциклы с карбамидными
фрагментами обладают антивирусной, антибакте-
На примере реакции аминометилирования орто-
риальной активностью [13], являются перспектив-
аминобензамида бис(N,N-диметиламино)метаном и
ными синтонами при получении алкалоидов с
мочевиной установили, что из числа испытанных
противоопухолевыми свойствами [14, 15], находят
катализаторов на основе d- и f-элементов наиболее
применение в качестве пестицидов
[16] и
эффективным является NiCl2·6H2O
(67%, см.
биопротекторов топлив [17]. Аминобензамиды и их
таблицу). При соотношении реагентов орто-
производные перспективны в качестве активаторов
аминобензамид:бис(N,N-диметиламино)метан:
фермента глюкокиназы [18, 19], люминесцентных
мочевина: NiCl2·6H2O = 10:20:10:2 в EtOH при 70°С
маркеров в биологических системах
[20],
реакция проходит в течение 12 ч с образованием
проявляют противоопухолевую
[21-23] и анти-
2-({[({[(диметиламино)метил]амино}карбонил)-
бактериальную активность [24].
амино]метил}амино)бензамида 1 (схема 1).
В продолжение исследования реакции каталит-
Аминометилирование мета- и пара-амино-
ического аминометилирования по первичной
бензамидов мочевиной и бис(N,N-диметиламино)-
202
КАТАЛИТИЧЕСКОЕ АМИНОМЕТИЛИРОВАНИЕ АМИНОБЕНЗАМИДОВ
203
Влияние природы растворителя и катализатора на выход соединений 1 и 2а
Выход 1
Выход 1 (2),
Катализатор
Растворитель
Катализатор
Растворитель
(2), %
%
NiCl2·6H2O
EtOH
67 (5)
Sm(NO3)3·6H2O
EtOH
15 (5)
–‹‹-
EtOH-CHCl3
59 (8)
ZnCl2·2H2O
-‹‹-
5 (5)
–‹‹-
CHCl3
32 (5)
Cs2CO3
-‹‹-
5 (5)
Ni(NO3)2·6H2O
EtOH
54 (4)
CuCl2·2H2O
-‹‹-
5 (-)
SmCl3·6H2O
-‹‹-
24 (5)
FeCl3·6H2O
-‹‹-
- (-)
а Условия реакции: аминобензамид:бис(N,N-диметиламино)метан:карбамид:катализатор = 10:20:10:2, 70°С, EtOH, 12 ч.
метаном при соотношении реагентов амино-
Наряду с мочевиной в реакцию каталитического
бензамид:бис(N,N-диметиламино)метан:мочевина:
аминометилирования аминобензамидов бис(N,N-ди-
NiCl2·6H2O = 10:20:10:2 в EtOH при 70°С в течение
метиламино)метаном были вовлечены биурет и
24 ч приводит к аминометилированным по амино-
гидрохлорид семикарбазида. В оптимальных
группе продуктам 3 (64%) и 5 (70%,схема 2).
условиях
[аминобензамид:бис(N,N-диметиламино)
метан:биурет:SmCl3·6H2O = 10:20:10:2, 70°С, EtOH,
Минорными продуктами реакции амино-
12 ч] аминометилирование орто-, мета- и пара-
метилирования аминобензамидов являются 2(3,4)-
аминобензамидов с помощью биурета проходит, как
амино-N-[(диметиламино)метил]бензамиды 2, 4 и 6
и в случае с мочевиной, по аминогруппе с
с выходами не более 10%, образование которых,
образованием ациклических производных аминобенз-
вероятно, связано с формированием в условиях
амидов 7 (43%), 8 (40%) и 9 (51%, схема 3). При
реакции комплексов аминобензамида с NiCl2·6H2O
использовании в реакции NiCl2·6H2O в качестве
[25] или SmCl3·6H2O, которые аминометилируются
катализатора выход соединений 7-9 составляет 11,
бис(N,N-диметиламино)метаном
по амидной
10 и 15% соответственно. Выход 2(3,4)-амино-N-
группе (схема
2). В отсутствие катализатора
[(диметиламино)метил]бензамидов
2,
4 и
6 не
реакция не проходит.
превышает 20%.
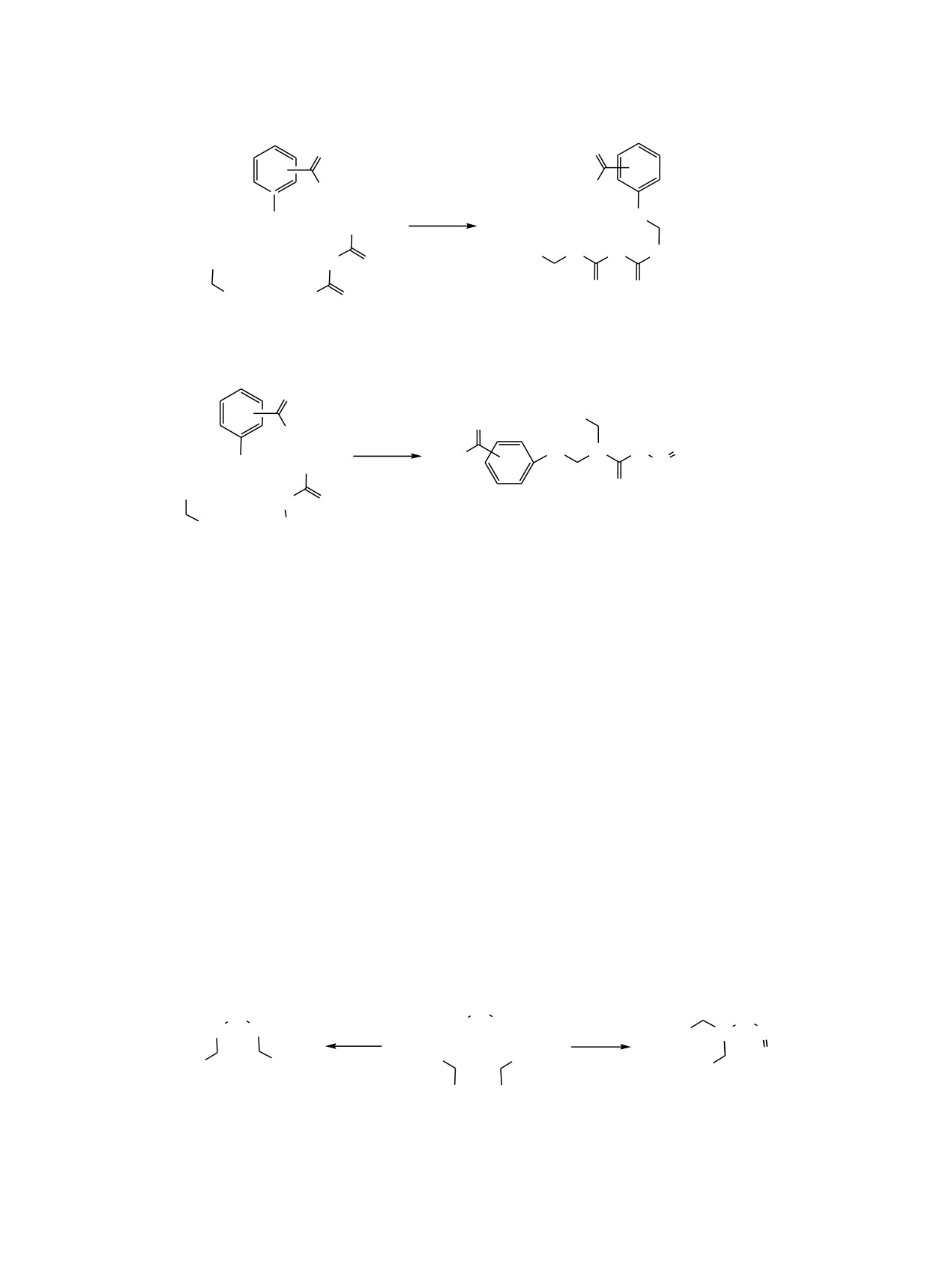
Схема 1.
O
O
NH2
H2N
NH2
[Ni]
O
HN
NH2
Me2NH
+
NMe2
H2N
H
HN
Me2N
N NH
+
NMe2
NMe2
H2N O
O
1, 3, 5
2, 4, 6
ortho (1, 2), meta (3, 4), para (5, 6).
Схема 2.
NH2
H2N
H2
O
NMe2
NMe2
Cl
N
O
Ni
Me2NH
NiCl2 6H2O.
HN
Cl
N
O
NMe2
H
2
NH2
2, 4, 6
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
204
ХАЙРУЛЛИНА и др.
Схема 3.
O
O
NH2
H2N
[Sm]
NH2
HN
NH
+
2, 4, 6
2
Me2NH
H
H
Me
2
N N
N
NH
NMe
+
2
HN O
O
O
NMe
2
H2N O
7-9
ortho (7), meta (8), para (9).
Схема 4.
O
Me2N
O
NH2
[Ni]
H
H
+
2, 4, 6
N N
N
CH2
H2N
H2N
N
NH2
Me2NH
NMe2
O
+
HN O
10, 11
NMe
NH2
HCl
2
meta (10), para (11).
Аминометилирование гидрохлорида семи-
диметиламино)метаном и карбамидами проходит
карбазида с помощью бис(N,N-диметиламино)метана
через стадию формирования промежуточных
с участием SmCl3·6H2O в качестве катализатора в
аминометилированных производных карбамидов,
аналогичных условиях
[аминобензамид:бис(N,N-
которые затем вступают в реакцию с амино-
диметиламино)метан:гидрохлорид семикарбазида:
бензамидами с образованием целевых продуктов.
SmCl3·6H2O
=
10:30:10:2,
70°С, EtOH,
24 ч]
Для проверки данного предположения реакцией
приводит к образованию 3- и 4-[({[(диметиламино)-
аминометилирования карбамидов бис(N,N-ди-
метил][(2-метиленгидразино)карбонил]амино}-
метиламино)метаном синтезировали N,N′-бис(ди-
метил)амино]бензамидов 10 и 11 с выходами 58 и
метиламинометил)мочевину
12,
N,N'-бис[(ди-
36% соответственно; орто-аминобензамид не
метиламино)метил]аллофанамид 13 и N-({[(диметил-
удалось вовлечь в реакцию аминометилирования
амино)метил][(2-метиленгидразино)карбонил]амино}-
(схема 4). При аминометилировании в присутствии
метил)-N,N-диметиламин
14
[карбамид:бис(N,N-
NiCl2·6H2O выход продуктов 10 и 11 составил 40 и
диметиламино)метан:SmCl3·6H2O = 10:10:0.5, 80°С,
29% соответственно. В этих условиях выход амино-
EtOH, 8 ч] (схема 5) [11].
метилированных по амидной группе продуктов 2, 4
Предварительно полученный N,N'-бис(диметил-
и 6 не превышает 30%, в отсутствие катализатора
аминометил)карбамид 12 вступает в реакцию с
реакция аминометилирования не проходит.
орто-, мета- и пара-аминобензамидами [амино-
Можно предположить [11,
12], что реакция
бензамид:12:NiCl2·6H2O
=
10:10:2,
70°С, EtOH,
аминометилирования аминобензамидов бис(N,N-
24 ч] с образованием продуктов 1, 3 и 5 с выходами
Схема 5.
X
X
X
H2N
NH2
HN
NH
[kat]
[kat]
Me2N
N
N
+
Me2N
NMe2
CH
2
Me2NH
Me2NH
Me2N
NMe2
Me2N
12, 13
14
NMe2 NMe2
X = C=O (12), O=CNHC=O (13), C(O)NH (14).
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
Схема 6.
O
O
H2N
H2N
O
12 или 13, [Ni]
14, [Ni]
HN
HN
Me2NH
Me2NH
NH2
H
Me
2N
N
NH
N
N
NMe2
X
NH
2
H2C
X
1, 3, 5, 9
10, 11
X = C=O (1, 3, 5), O=CNHC=O (79), C(O)NH (11).
30, 31 и 38% соответственно. Аналогично проходит
7-9. В спектрах ЯМР 1Н аминометилированных
реакция аминобензамидов с N,N'-бис[(диметил-
продуктов 10 и 11 дублеты в области δН 6.0-7.0 м. д.
амино)метил]аллофанамидом (аминобензамид:13:
с 2J = 12.0 Гц свидетельствуют о наличии в
NiCl2·6H2O
=
10:10:2,
70°С, EtOH,
24 ч) с
молекуле терминальной двойной связи. Подобную
образованием соединений 7 (14%), 8 (20%) и 9
спектральную спиновую систему мы наблюдали в
(22%, схема
6). N-({[(Диметиламино)метил][(2-
случае N-({[(диметиламино)метил][(2-метилен-
метиленгидразино)карбонил]амино}метил)-N,N-ди-
гидразино)карбонил]амино}метил)-N,N-диметил-
метиламин 14 в реакции с мета- и пара-амино-
амина
14. Согласно данным HMBC, протоны
бензамидами в аналогичных условиях
[амино-
двойной связи изолированы, а метиленовые
бензамид:14:NiCl2·6H2O = 10:10:2, 70°С, EtOH, 24 ч]
протоны при δН ~4.2 и
4.5 м. д. фрагментов
приводит к образованию соединений 10 (15%) и 11
Me2NCH2N и HNCH2N взаимодействуют с атомом
(11%); орто-аминобензамид не вступал в реакцию.
углерода ароматического кольца HCC(NH2)C и
атомом углерода карбонильной группы мочевины.
Структура соединений
1,
3,
5,
7-14 под-
тверждена данными ЯМР
(1D,
2D), ИК
В ИК спектрах соединений 3, 5, 7, 9-11 имеются
спектроскопии и масс-спектрометрии. Так, в
уширенные полосы поглощения в области 1694-
спектрах ЯМР
13С и 1Н аминометилированных
1689 см-1, соответствующие валентным колеба-
продуктов 1, 3 и 5 характеристичными являются
ниям карбонильных групп (полоса «амид I») и 1567-
сигналы при δС ~61 м. д. (δH ~3.9-4.3 м. д.) и δС
1515 см-1 (полоса
«амид II»), обусловленные
~48 м. д. (δH ~4.5 м. д.), которые, согласно данным
деформационными колебаниями C-N группы.
HSQC, относятся к фрагментам Me2NCH2NH и
HNCH2NH соответственно. Надежным подтвер-
Полученные результаты позволяют пред-
ждением указанного отнесения сигналов являются
положить [7,
26,
27] что в условиях реакции
данные гетероядерного корреляционного экспери-
первоначально происходит аминометилирование
мента HMBC. Слабопольный сигнал при δH ~4.5 м. д.
карбамидов бис(N,N-диметиламино)метаном с
взаимодействует с атомом углерода аромати-
формированием соответствующих аминометили-
ческого кольца HCC(NH2)C и карбонильной
рованных карбамидов
12-14
[11,
12], которые
группой мочевины, тогда как более сильнопольный
координируются с ионом центрального атома
сигнал при δH ~3.9-4.3 м. д. коррелирует как с
катализатора, что способствует смещению элек-
карбонильной группой мочевины, так и с
тронной плотности от атома азота к иону металла и
метильными углеродами группы Me2N. Анализ
образованию карбокатионов. Последующее нуклео-
спектров COSY показал, что атомы водорода
фильное присоединение аминогруппы амино-
метиленовой группы при δH
~4.5 м. д.
бензамидов к карбокатиону приводит к
взаимодействуют с вицинальными NH-протонами
формированию соответствующих связей C-N и
(δH ~6.3-7.6 м. д.), а метиленовые протоны при δH
образованию ациклических молекул 1, 3, 5, 7-11
~3.9-4.3 м. д. коррелируют с атомом водорода NH
(схема 7).
(~7.8-8.3 м. д.), что свидетельствует об его
Таким образом, реакция аминометилирования
относительно большей кислотности.
орто-, мета- и пара-аминобензамидов с помощью
Полученные результаты были использованы
бис(N,N-диметиламино)метана и карбамидов или
при идентификации продуктов реакции с биуретом
N-аминометилированных карбамидов с участием
206
ХАЙРУЛЛИНА и др.
Схема 7.
X
R1
NH2
+
kat
Me
Me
N N
R2 X
X
1
Me Me
HN N R
1
+
Me
R
N N
O
Me
R2
kat
NH2
1214
O NH2
X
H
+
NH2
R1
N CH2
N
kat
O
R2
Me2NH
Me ..
H
N kat
NH
2
Me
R1 = N(H)CH2NMe2, R2 = H, (а); R1 = N(H)C(O)N(H)CH2NMe2, R2 = H (б); R1 =
N(H)N=CH2, R2 = CH2NMe2 (в).
NiCl2·6H2O и SmCl3·6H2O в качестве катализаторов
б. Смесь 1 ммоль N,N'-бис(диметиламинометил)-
может быть с успехом использована для получения
мочевины, (N,N'-бис[(диметиламино)метил]алло-
ациклических производных анилина с карба-
фанамида, N-({[(диметиламино)метил][(2-метилен-
мидными фрагментами.
гидразино)карбонил]амино}метил)-N,N-диметил-
амина) в 5 мл этилового спирта и 0.2 ммоль
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
катализатора NiCl2·6H2O или SmCl3·6H2O
перемешивали 5 мин, затем добавляли 1 ммоль
Одномерные
(1Н,
13С), гомо- (COSY) и
аминобензамида в
5 мл этилового спирта и
гетероядерные (HSQC, HMBC) эксперименты ЯМР
перемешивали полученную смесь 24 ч при 80°С.
проводили на спектрометре Bruker Avance
400
Из реакционной массы методом колоночной
[100.62 (13С) и 400.13 МГц (1Н)], растворитель -
хроматографии на SiO2 выделяли целевые
ДМСО-d6. Масс-спектры получали на приборе
продукты.
MALDI TOF/TOF AUTOFLEX III Bruker. ИК
2-({[({[(Диметиламино)метил]амино}карбо-
спектры снимали на спектрометре Bruker Vertex 70 v
нил)амино]метил}амино)бензамид
(1).
Выход
в суспензии в вазелиновом масле. Температуры
0.18 г (67%, метод а), 0.08 г (30%, метод б), смоло-
плавления определяли на приборе РНМК 80/2617.
образное вещество кремового цвета. ИК спектр, ν,
Контроль за ходом реакции осуществляли методом
см-1: 3401-3334, 2965, 2781, 1667, 1615, 1556, 1468,
ТСХ на пластинах Sorbfil (ПТСХ-АФ-В),
1395, 1263, 1159, 1022, 756, 630. Спектр ЯМР 1Н, δ,
проявление парами иода. Для колоночной
м. д.: 2.54 уш. с (6Н, NСH3), 4.25 уш. с (2Н,
хроматографии использовали силикагель КСК (100-
MeNСH2NH), 4.52 т (2Н, HNСH2NH, 3J = 5.5 Гц),
200 мкм).
6.45 т (1Н, HCAr, 3J = 7.6 Гц), 6.65 д (1Н, HCAr, 3J =
8.0 Гц), 7.07 т (1Н, HCAr, 3J = 7.5 Гц), 7.49 д (1Н,
Синтез соединений 1-11 (общая методика). а.
HCAr, 3J = 8.0 Гц); 6.71 уш. с, 7.40 уш. с и 8.34 уш.
Смесь 1 ммоль карбамида в 5 мл этилового спирта,
с (3Н, NH). Спектр ЯМР 13С, δС, м. д.: 40.50 (NСH3),
2.5
ммоль бис(N,N-диметиламино)метана и
48.33 (HNСH2NH), 61.71 (HNСH2NMe), 114.10 (Ph),
0.2
ммоль катализатора NiCl2·6H2O или
114.99 (Ph), 116.89 (Ph), 129.12 (Ph), 132.25 (Ph),
SmCl3·6H2O перемешивали 5 мин, затем добавляли
148.64 (Ph), 159.28 (С=O), 172.08 [С(O)NH2]. Масс-
1 ммоль аминобензамида, растворенного в 5 мл
спектр, m/z (Iотн, %): 266.176 [М + H]+, 288.154 [М +
этилового спирта. Повышали температуру до 80°С
Na]+, 304.130 [М + K]+.
и перемешивали реакционную смесь в течение
12 ч. Из реакционной массы с помощью
2-Амино-N-[(диметиламино)метил]бензамид
колоночной хроматографии на SiO2 выделяли
(2). Выход
0.06 г
(30%, метод а), аморфный
целевые продукты.
порошок кремового цвета, т. пл. 40-46°С. ИК
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
спектр, ν, см-1: 3438, 2923-2854, 1654, 1607, 1585,
62.11 (HNСH2NMe), 113.00 (Ph), 121.80 (Ph), 129.35
1461, 1305, 1281, 1152, 1035, 722. Спектр ЯМР 1Н,
(Ph), 150.50 (Ph), 159.13 (С=O), 168.80 [С(O)NH2].
δ, м. д.: 2.25 уш. с (6Н, NСH3), 4.06 уш. с (2Н,
Масс-спектр, m/z (Iотн, %):
266.063
[М + H]+,
MeNСH2NH), 6.40 уш. с (2Н, NH2), 6.54 т (1Н,
287.250 [М + Na - H]+.
HCAr, 3J = 7.4 Гц), 6.86 д (1Н, HCAr, 3J = 8.3 Гц),
4-Амино-N-[(диметиламино)метил]бензамид
7.21 т (1Н, HCAr, 3J = 8.3 Гц), 7.56 д (1Н, HCAr, 3J =
(6). Выход
0.03 г
(18%, метод а), аморфный
7.4 Гц), 8.23 уш. с (1Н, NH). Спектр ЯМР 13С, δС, м.
порошок кремового цвета, т. пл. 85-90°С. ИК
д.: 41.77 (NСH3), 61.07 (HNСH2NMe), 112.25 (Ph),
спектр, ν, см-1: 3400, 2923-2854, 1657, 1606, 1584,
115.10 (Ph), 115.31 (Ph), 129.49 (Ph), 132.76 (Ph),
1462, 1304, 1283, 1153, 1031, 722. Спектр ЯМР 1Н,
150.36 (Ph),
170.18
[С(O)NH2]. Масс-спектр, m/z
δ, м. д.: 2.21 уш. с (6Н, NСH3), 4.05 уш. с (2Н,
(Iотн, %): 232.110 [М + K]+.
MeNСH2NH), 6.54 д (2Н, HCAr, 3J = 8.6 Гц), 7.59 д
3-({[({[(Диметиламино)метил]амино}карбо-
(2Н, HCAr, 3J = 8.6 Гц), 8.57 уш. с (1Н, NH). Спектр
нил)амино]метил}амино)бензамид
(3).
Выход
ЯМР
13С, δС, м. д.:
42.93 (NСH3),
61.50
0.17 г (64%, метод а), 0.09 г (31%, метод б), амор-
(HNСH2NMe), 112.15 (Ph), 121.02 (Ph), 129.38 (Ph),
фный порошок кремового цвета, т. пл. 65-70°С. ИК
152.28 (Ph),
167.69
[С(O)NH2]. Масс-спектр, m/z
спектр, ν, см-1: 3402, 2923-2854, 2724, 1654 ш,
(Iотн, %): 194.281 [М + H]+.
1607, 1581, 1460, 1377, 1168, 1152, 1030, 973, 722.
2-[(8-Метил-3,5-диоксо-2,4,6,8-тетраазанон-1-
Спектр ЯМР 1Н, δ, м. д.: 2.19 уш. с (6Н, NСH3), 4.04
ил)амино]бензамид (7). Выход 0.13 г (43%, метод
уш. с
(2Н, MeNСH2NH),
4.46 уш. с
(2Н,
а),
0.04 г
(14%, метод б), бесцветное смоло-
HNСH2NH), 5.64 уш. с (2Н, NH2), 6.82, 7.07-7.16 м
образное вещество. ИК спектр, ν, см-1: 3327, 2946,
(4Н, HCAr); 6.28 уш. с, 6.70 уш. с и 8.50 уш. с (3Н,
2867-2782, 1694 ш, 1640 ш, 1567-1519, 1455, 1384,
NH). Спектр ЯМР 13С, δС, м. д.: 41.46 (NСH3), 48.78
1260, 1162, 1032, 752, 632. Спектр ЯМР 1Н, δ, м. д.:
(HNСH2NH),
62.27 (HNСH2NMe),
111.82 (Ph),
2.18 уш. с (6Н, NСH3), 3.98 д (2Н, MeNСH2NH, 3J =
115.97 (Ph), 116.99 (Ph), 129.15 (Ph), 135.54 (Ph),
6.1 Гц), 4.66 уш. с (2Н, HNСH2NH); 6.52 м, 6.69 м,
147.69 (Ph), 159.02 (С=O), 169.13 [С(O)NH2]. Масс-
7.14 м и 7.53 м (4Н, HCAr); 7.95 уш. с, 8.02 уш. с,
спектр, m/z (Iотн, %): 266.074 [М + H]+, 288.061 [М +
8.13 уш. с и 8.56 уш. с (4Н, NH). Спектр ЯМР 13С,
Na]+, 304.007 [М + K]+.
δС, м. д.: 41.77 (NСH3), 48.00 (HNСH2NH), 61.73
(HNСH2NMe), 114.10 (Ph), 115.05 (Ph), 116.84 (Ph),
3-Амино-N-[(диметиламино)метил]бензамид
128.70 (Ph), 132.40 (Ph), 148.40 (Ph), 155.47 (С=O),
(4). Выход 0.03 г (16%, метод а), аморфный порошок
155.94 (С=O), 171.79 [С(O)NH2]. Масс-спектр, m/z
кремового цвета, т. пл. 86-89°С. ИК спектр, ν, см-1:
(Iотн, %): 307.328 [М + H]+.
3332, 2925-2854, 1651, 1606, 1584, 1455, 1304,
1280, 1154, 1030, 722. Спектр ЯМР 1Н, δ, м. д.: 2.20
3-[(8-Метил-3,5-диоксо-2,4,6,8-тетраазанон-1-
уш. с (6Н, NСH3), 3.86 уш. с (2Н, MeNСH2NH), 6.98-
ил)амино]бензамид (8). Выход 0.12 г (40%, метод
7.15 м (4Н, HCAr), 6.60 уш. с (1Н, NH). Спектр ЯМР
а), 0.06 г (20%, метод б), смолообразное вещество
13С, δС, м. д.: 42.47 (NСH3), 61.58 (HNСH2NMe),
кремового цвета. ИК спектр, ν, см-1: 3337, 2948,
113.36 (Ph), 113.55 (Ph), 115.16 (Ph), 129.02 (Ph),
2854-2782, 1689 ш, 1652 ш, 1539, 1464, 1383, 1255,
136.84 (Ph), 149.11 (Ph), 168.24 [С(O)NH2]. Масс-
1139, 1032, 753, 692. Спектр ЯМР 1Н, δ, м. д.: 2.14
спектр, m/z (Iотн, %): 232.097 [М + K]+.
уш. с (6Н, NСH3), 3.95 уш. с (2Н, MeNСH2NH), 4.55
уш. с (2Н, NСH2NH); 6.84-6.85 м, 7.06-7.10 м и
4-({[({[(Диметиламино)метил]амино}карбо-
7.11-7.17 м (4Н, HCAr); 6.57 уш. с, 6.64 уш. с, 7.95 и
нил)амино]метил}амино)бензамид
(5).
Выход
8.85 уш. с (4Н, NH), 8.73 уш. с (2Н, NH2). Спектр
0.19 г (70%, метод а), 0.10 г (38%, метод б),
ЯМР 13С, δС, м. д.: 41.86 (NСH3), 52.40 (HNСH2NH),
аморфный порошок кремового цвета, т. пл. 124-
61.84 (HNСH2NMe), 111.62 (Ph), 115.73 (Ph), 116.07
126°С. ИК спектр, ν, см-1: 3438-3353, 2921, 2870-
(Ph), 129.15 (Ph), 135.82 (Ph), 147.91 (Ph), 155.48
2730, 1666 ш, 1614 ш, 1555, 1454, 1351, 1215, 1142,
(С=O),
155.93 (С=O),
169.00
[С(O)NH2]. Масс-
1039, 757, 668. Спектр ЯМР 1Н, δ, м. д.: 2.27 уш. с
спектр, m/z (Iотн, %): 307.353 [М + H]+.
(6Н, NСH3), 3.94 уш. с (2Н, MeNСH2NH), 4.45 т
(2Н, HNСH2NH, 3J = 6.0 Гц), 5.67 уш. с (2Н, NH2),
4-[(8-Метил-3,5-диоксо-2,4,6,8-тетраазанон-1-
6.68 д (2Н, HCAr, 3J = 8.6 Гц), 7.66 д (2Н, HCAr, 3J =
ил)амино]бензамид (9). Выход 0.16 г (51%, метод
8.6 Гц), 6.86 уш. с и 6.94 уш. с (3Н, NH). Спектр
а), 0.07 г (22%, метод б), аморфный порошок
ЯМР 13С, δС, м. д.: 41.90 (NСH3), 48.48 (HNСH2NH),
кремового цвета, т. пл. >350°С. ИК спектр, ν, см-1:
208
ХАЙРУЛЛИНА и др.
3306, 2923, 2854, 1694 ш, 1605 ш, 1515, 1462, 1377,
N,N'-Бис(диметиламинометил)карбамид
(12)
1261, 1189, 1030, 841, 768. Спектр ЯМР 1Н, δ, м. д.:
смолообразное вещество. Выход0.34 г
(99%),
2.13 уш. с (6Н, NСH3), 4.01 (2Н, MeNСH2NH), 4.61
смолообразное вещество. Масс-спектр, m/z (Iотн,
уш. с (2Н, HNСH2NH), 6.79 уш. с (2Н, NH2), 6.67-
%):
213.551
[М
+ K]+. Спектральные данные
6.73 м (2Н, HCAr), 7.65-7.70 м (2Н, HCAr); 6.82 уш.
приведены в работе [11].
с, 6.78 уш. с, 6.94 уш. с и 8.43 уш. с (4Н, NH).
N,N'-Бис[(диметиламино)метил]аллофанамид
Спектр ЯМР 13С, δС, м. д.: 41.93 (NСH3), 48.03
(13). Выход
0.42 г
(96%), бесцветное смоло-
(HNСH2NH),
61.79 (HNСH2NMe),
111.86 (Ph),
образное вещество. ИК спектр, ν, см-1: 3322, 2952-
121.98 (Ph), 129.37 (Ph), 150.15 (Ph), 154.89 (С=O),
2786, 1674, 1538, 1470, 1385, 1230, 1167, 1032, 769,
155.43 (С=O), 168.38 [С(O)NH2]. Масс-спектр, m/z
600. Спектр ЯМР 1Н, δ, м. д.: 2.11 уш. с (12Н,
(Iотн, %): 307.378 [М + H]+.
NСH3), 3.92 уш. с (4Н, HNСH2NH), 7.84 уш. с [2Н,
3-[({[(Диметиламино)метил][(2-метиленгид-
NHC(O)], 8.77 уш. с [1Н, C(O)NHC(O)]. Спектр
разино)карбонил]амино}метил)амино]бензамид
ЯМР 13С, δC, м. д.: 41.92 (NCH3), 61.84 (NСH2N),
(10). Выход 0.12 г (40%, метод а), 0.04 г (15%,
155.56 (С=O). Масс-спектр, m/z (Iотн, %): 218.174
метод б), смолообразное вещество кремового
[М + H]+, 236.138 [М + H2O + H]+.
цвета. ИК спектр, ν, см-1: 3401, 2860-2786, 1666,
1606, 1538, 1468, 1385, 1285, 1121, 1022, 759, 622.
N-({[(Диметиламино)метил][(2-метиленгид-
Спектр ЯМР 1Н, δ, м. д.: 2.40 уш. с (6Н, NСH3), 4.18
разино)карбонил]амино}метил)-N,N-диметил-
уш. с (2Н, MeNСH2NH), 4.54 т (2Н, NСH2NH, 3J =
амин
(14). Выход
0.32 г
(80%), бесцветное
5.9 Гц), 6.18 д и 6.82 д (2Н, N=СH2, 2J = 12.0 Гц);
смолообразное вещество. ИК спектр, ν, см-1: 3439,
6.69 м и 7.03-7.20 м (4Н, HСAr),7.38 уш. с и 8.80
2785, 1668, 1581-1536, 1469, 1384, 1335, 1143,
уш. с (2Н, NH). Спектр ЯМР 13С, δС, м. д.: 40.89
1022, 923, 612. Спектр ЯМР 1Н, δ, м. д.: 2.54 уш. с
(NСH3),
52.26 (NСH2NH),
61.43 (HNСH2NMe),
(6Н, NСH3), 4.32 д (2Н, HNСH2NH, 3J = 6.9 Гц),
113.35 (Ph), 115.07 (Ph), 117.11 (Ph), 129.25 (Ph),
6.32 д и 6.93 д (2Н, СH2=N, 2J = 12.0 Гц), 7.82 т
131.26 (N=СH2), 135.11 (Ph), 147.83 (Ph), 156.10
[1Н, CH2NHC(O), 3J = 6.9 Гц], 10.81 уш. с [1Н,
(С=O), 168.65 [С(O)NH2]. Масс-спектр, m/z (Iотн,
NNHC(O)]. Спектр ЯМР
13С, δC, м. д.:
41.00
%): 293.135 [М + H]+, 331.081 [М + K].
(NCH3), 61.12 (HNСH2NH), 133.70 (СH2=N), 155.87
(С=O). Масс-спектр, m/z (Iотн, %): 143.037 [М - H]+,
4-[({[(Диметиламино)метил][(2-метиленгид-
разино)карбонил]амино}метил)амино]бензамид
145.049 [М + H]+, 167.079 [М + Na]+.
(11). Выход 0.08 г (29%, метод а), 0.03 г (11%,
ФОНДОВАЯ ПОДДЕРЖКА
метод б), смолообразное вещество кремового
цвета. ИК спектр, ν, см-1: 3443, 2852-2796, 1659 ш,
Работа выполнена в соответствии с планом
1608, 1529, 1469, 1395, 1273, 1193, 1108, 1021, 843,
научно-исследовательских работ Института нефте-
593. Спектр ЯМР 1Н, δ, м. д.: 2.45 уш. с (6Н, NСH3),
химии и катализа Российской академии наук по
4.24 уш. с (2Н, MeNСH2NH), 4.55 уш. с (2Н,
теме
«Металлокомплексный катализ в синтезе
NСH2NH), 6.31 д и 6.89 д (2Н, N=СH2, 2J = 12.1 Гц),
гетеро- и металлогетероциклов»
(№ гос.
6.52 д (2Н, HСAr, 3J = 8.5 Гц), 6.89 д (2Н, HСAr, 3J =
регистрации АААА-А17-117012610060-7,
2017-
8.5 Гц), 6.96 уш. с и 8.96 уш. с (2Н, NH). Спектр
2019) с использованием оборудования Центра
ЯМР 13С, δС, м. д.: 41.13 (NСH3), 51.80 (NСH2NH),
коллективного пользования «Агидель».
65.35 (HNСH2NMe), 111.76 и 129.47 (Ph), 131.13
(N=СH2), 132.87 (Ph), 150.58 (Ph), 156.03 (С=O),
КОНФЛИКТ ИНТЕРЕСОВ
168.72
[С(O)NH2]. Масс-спектр, m/z (Iотн,
%):
293.142 [М + H]+.
Авторы заявляют об отсутствии конфликта
Синтез бис-гем-диаминов
12-14 (общая
интересов.
методика). Смесь 5 ммоль бис(N,N-диметиламино)-
метана, 0.1 ммоль SmCl3·6H2O и 2 ммоль карба-
CПИСОК ЛИТЕРАТУРЫ
мида, растворенного в 10 мл этилового спирта,
перемешивали в течение
8 ч при комнатной
1. El-Shamy I.E., Abdel-Mohsen A.M., Alsheikh A.A.,
температуре. Из реакционной массы методом коло-
Fouda M.M.G., Al-Deyab S.S., El-Hashash M.A.,
ночной хроматографии на SiO2 выделяли целевые
Jancar J. // Dyes and Pigments. 2015. Vol. 113. P. 357.
doi 10.1016/j.dyepig.2014.08.026
продукты.
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
2. Богданов А.В., Вазыхова А.М., Хасиятуллина Н.Р.,
Pusset J., Leroy S., Pietra F. // J. Chem. Soc. Chem.
Криволапов Д.Б., Добрынин А.Б., Волошина А.Д.,
Миронов В.Ф. // ХГС. 2016. Т. 52. № 1. C. 25;
16. Горбатова О.Н., Жербев А.В., Королева О.В. // Усп.
Bogdanov A.V., Vazykhova A.M., Khasiyatullina N.R.,
биол. хим. 2006. Т. 46. С. 323.
Krivolapov D.B., Dobrynin A.B., Voloshina A.D.,
17. Фарзалиев В.М., Аллахвердиев М.А., Магеррамов А.М.,
Mironov V.F.
// Chem. Heterocycl. Compd.
2016.
Шаринова Н.А., Джавадова Л.А., Рзаева И.А.,
Vol. 52. N 1. P. 25. doi 10.1007/s10593-016-1826-6
Халилова А.З., Алиев Ф.Ю. // ЖПХ. 2001. Т. 74. № 1.
3. Ertan M., Tayhan A.B., Yulug N. // Arch. Pharm. 1990.
С.
110; Farzaliev V.M., Allakhverdiev M.A.,
Vol. 323. P. 605. doi 10.1002ardp.19903230910
Magerramov A.M., Shirinova N.A., Dzavadova L.A.,
4. Газиева Г.А., Ложкин П.В., Кравченко А.Н. // ХГС.
Rzaeva I.A., Khalilova A.Z., Aliev F.Y. // Russ. J. Appl.
2007. Т. 43. № 11. С. 1655; Gazieva G.A., Lozhkin P.V.,
Chem. 2001. Vol. 74. N 1. P. 114. doi 10.1023/
Kravchenko A.N. // Chem. Heterocycl. Compd. 2007.
A:1012764404658
18. McKerrecher D., Allen J.V., Caulkett P.W.R., Donald C.S.,
5. Shen X.X., Shen Yi.L., Han Yi.F., Liu Qi. // Adv. Mater.
Fenwick M.L., Grange E., Johnson K.M., Johnstone C.,
Res.
2012. Vol.
441. P.
Jones C.D., Pike K.G., Rayner J.W., Walker R.P. //
Bioorg. Med. Chem. Lett. 2006. Vol. 16. P. 2705. doi
6. Maleki B., Baghayeri M. // RSC Adv. 2015. Vol. 97.
N 5. P. 79746. doi 10.1039C5RA16481H
19. Nishimura T., Iino T., Mitsuya M., Bamba M.,
7. Petersen H. // Synthesis. 1973. Vol. 5. P. 243. doi
Watanabe H., Tsukahara D., Kamata K., Sasaki K.,
Ohyama S., Hosaka H., Futamura M., Nagata Y., Eiki
10.1055/s-1973-22190
Jun-ichi // Bioorg. Med. Chem. Lett. 2009. Vol. 19.
8. Paquin A.M. // Angew. Chem. 1948. Vol. 60. P. 267.
P. 1357. doi 10.1016/j.bmcl.2009.01.053
9. Гарибов Е.Н., Рзаева И.А., Шухалиев Н.Г.,
20. More P., Patil A., Salunkhe R. // RSC Adv. 2014.
Кулиев А.И., Фарзалиев В.М., Аллахвердиев М.А. //
Vol. 96. N 4. P. 63039. doi 10.1039/c4ra09514f
ЖПХ. 2010. Т. 83. № 4. С. 655; Garibov E.N.,
Rzaeva I.A., Shykhaliev N.G., Kuliev A.I., Farzali-
21. Kiyokawa Sh., Hirata Y., Nagaoka Y., Shibano M.,
ev V.M., Allakhverdiev M.A. // Russ. J. Appl. Chem.
Taniguchi M., Yasuda M., Baba K., Uesato Sh. //
2010. Vol.
83. N
4.
P.
707. doi
10.1134/
Bioorg. Med. Chem. 2010. Vol. 18. P. 3925. doi
S1070427210040245
10.1016/j.bmc.2010.04.033
10. Burke W.J. // J. Am. Chem. Soc. 1947. Vol. 69. N 9.
22. Cai J., Wei H., Hong K.H., Wu X., Cao M., Zong X.,
Li L., Sun C., Chen J., Ji M. // Eur. J. Med. Chem. 2015.
P. 2136. doi 10.1021/ja01201a024
Vol. 96. P. 1. doi 10.1016/j.ejmech.2015.04.002
11. Хайруллина Р.Р., Гениятова А.Р., Ибрагимов А.Г.,
Джемилев У.М. // ЖОрХ. 2013. Т. 49. № 6. C.918;
23. Caldini R., Fanti E., Magnelli L., Barletta E.,
Khairullina R.R., Geniyatova A.R., Ibragimov A.G.,
Tanganelli E., Zampieri M., Chevanne M. // Vascular
Dzemilev U.M. // Russ. J. Org. Chem. 2013. Vol. 49.
Cell. 2011. Vol. 3. P. 12. doi 10.1186/2045-824X-3-12
N 6. P. 904. doi 10.1134/S1070428013060171
24. Mabkhot Y.N., Al-Majid A.M., Barakat A., Al-Showi-
12. Хайруллина Р.Р., Гениятова А.Р., Ибрагимов А.Г.,
man S.S., Al-Har M.S., Radi S., Naseer M.M.,
Джемилев У.М. // ХГС. 2014. Т. 50. № 5. C. 777;
Hadda T.B. // Int. J. Mol. Sci. 2014. Vol. 15. P. 1503.
Hairullina R.R., Geniyatova A.R., Ibragimov A.G.,
doi 10.3390/ijms15035115
Dzemilev U.M. // Chem. Heterocycl. Compd.
2014.
25. Ailan J.R., McCloy B., Paton A.D., Smith W.E.,
Vol. 50. N 5. P. 715. doi 10.1007/s10593-014-1525-0
Gerrard D.L.
// Thermochim. Acta. 1992. Vol. 205.
13. Walter A.M., Heilmayer L. Antibiotika Fibel. Stuttgart:
Thieme Verlag, 1965. S. 419.
26. Tramontini M., Angiolini L.
// Tetrahedron.
1990.
14. Movassaghi M., Siegel D.S., Han S. // Chem. Sci. 2010.
N 1. P. 561. doi 10.1039/C0SC00351D
27. Tramontini M. // Synthesis. 1973. N 12. P. 703. doi
15. Ambrosio M.D., Guerriero A., Debitus C., Ribes O.,
10.1055/s-1973-22294
210
ХАЙРУЛЛИНА и др.
Catalytic Aminomethylation of Bisaminobenzamides
with (N,N-Dimethylamino)methane and Carbamides
R. R. Khairullina*, T. V. Tyumkina, A. R. Geniyatova,
F. K. Mullagil’dina, and A. G. Ibragimov
Institute of Petrochemistry and Catalysis of the Russian Academy of Sciences, ul. Oktyabrya 141, Ufa, 450075 Russia
*e-mail: ink@anrb.ru
Received July 12, 2018; revised July 12, 2018; accepted July 16, 2018
An effective method was developed for the synthesis of acyclic aniline derivatives bearing carbamide fragments
by the reaction of carbamides with ortho-, meta-, and para-aminobenzamides and bis(N,N-dimethylamino)-
methane in the presence of NiCl2·6H2O and SmCl3·6H2O as catalysts.
Keywords: aminomethylation, aminobenzamides, bis(N,N-dimethylamino)methane, carbamides
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019