ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 2, с. 230-236
УДК 544.332;544.342-14;544.421;547.823
ГИДРАЗОН ПИРИДОКСАЛЬ-5-ФОСФАТА
И ПИРАЗИН-2-КАРБОГИДРАЗИДА:
СИНТЕЗ, УСТОЙЧИВОСТЬ, КИНЕТИКА ОБРАЗОВАНИЯ
И ВЗАИМОДЕЙСТВИЕ С ДНК
© 2019 г. Г. А. Гамов*, М. Н. Завалишин, В. В. Александрийский, В. А. Шарнин
Ивановский государственный химико-технологический университет,
пр. Шереметевский 7, Иваново, 153000 Россия
*е-mail: oxt705@isuct.ru
Поступило в Редакцию 7 июня 2018 г.
После доработки 7 июня 2018 г.
Принято к печати 14 июня 2018 г.
Синтезирован (5-гидрокси-6-метил-4-{(E)-[2-oкco-2-(пиразин-2-ил)этил]-гидразинилиденметил}пиридин-3-
ил)метилфосфат - продукт взаимодействия (гидразон) пиридоксаль-5-фосфата и пиразин-2-карбогид-
разида - и определены константы его устойчивости в водном растворе при рН = 1.9, 6.6, 7.0, 7.4.
Исследована кинетика образования и гидролиза полученного гидразона, из электронных спектров
поглощения вычислены константы скорости прямой и обратной реакции. Исследовано его
взаимодействие, а также его комплекса с Cu(II) с ДНК тимуса теленка.
Ключевые слова: гидразон, константа устойчивости, константа скорости, пиридоксаль-5-фосфат, ДНК
DOI: 10.1134/S0044460X19020100
Гидразоны привлекают внимание исследо-
ДНК делает их потенциальными противо-
вателей в качестве индикаторов благодаря своим
опухолевыми агентами [5].
хелатирующим свойствам по отношению к ионам
металлов и способности изменять структуру в
Возможная биологическая активность гидра-
зависимости от рН среды
[1,
2]. Гидразоны,
зонов зависит от их устойчивости в растворе, а
образованные витамином В6
(пиридоксаль-5-
также от скорости их гидролиза. Нами получен
фосфатом 1), а также его витамером
- пири-
гидразон 3 на основе пиридоксаль-5-фосфата 1 и
доксалем, могут проявлять полезную биологи-
пиразин-2-карбогидразида
2
и определены
ческую активность. В частности, гидразоны
константы его устойчивости, скорости образования
пиридоксаля (и их комплексы с ионами металлов)
и распада при некоторых физиологических
могут оказаться полезными при лечении болезни
значениях рН (1.9, соответствующем кислотности
Альцгеймера [3], обладают противомикробными
желудочного сока;
6.6-7.4, соответствующим
свойствами [4]. Способность гидразонов либо их
кислотности межклеточной жидкости патоло-
металлокомплексов к интеркаляции в молекулы
гических и здоровых тканей) в водном растворе.
Схема 1.
O
NH2
H2O3PO
N
O
NH
N
H2O3PO
2'
H
N
H2O
6'
4
5
4
3
5
OH
N
6
k1
OH
O
3'
3
2
+
k1
6
N
5'
3
5
6
2
+H2O
N
2
N
N
1
2
3
230
ГИДРАЗОН ПИРИДОКСАЛЬ-5-ФОСФАТА
231
(а)
(б)
λ, нм
λ, нм
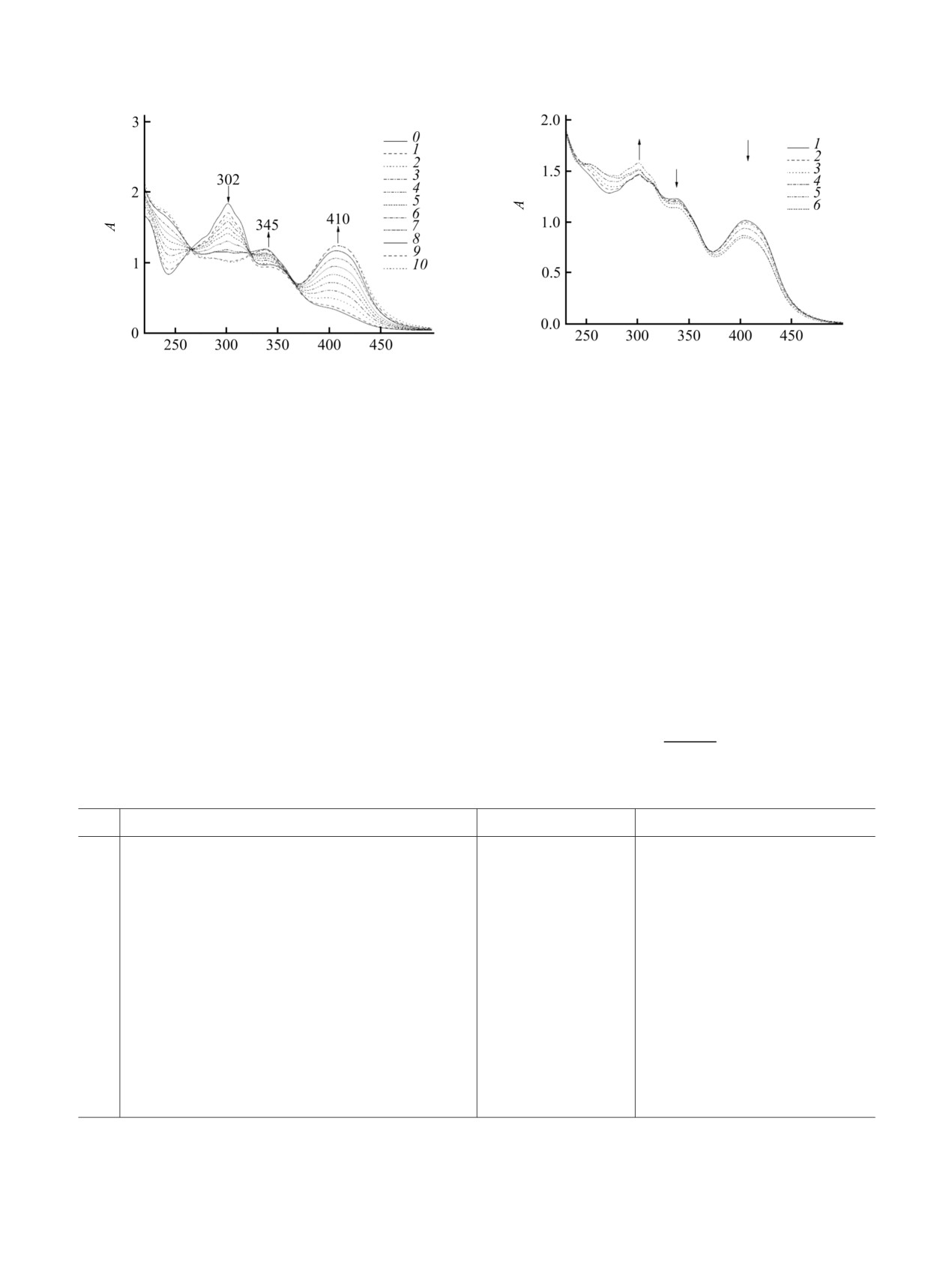
Рис. 1. Электронные спектры поглощения растворов смесей соединений 1 и 2 при рН = 1.9 (а) и 7.4 (б). Общие
концентрации соединений 1 и 2, моль/л: 1 - 1.5×10-4 и 1.5×10-5; 2 - 1.5×10-4 и 3.0×10-5; 3 - 1.5×10-4 и 4.5×10-5; 4 - 1.5×10-4 и
6.0×10-5; 5 - 1.5×10-4 и 7.5×10-5; 6 - 1.5×10-4 и 9.0×10-5; 7 - 1.5×10-4 и 1.1×10-4; 8 - 1.5×10-4 и 1.2×10-4; 9 - 1.5×10-4 и 1.4×
10-4; 10 - 1.5×10-4 и 1.5×10-4.
Изучено взаимодействие соединения 3, а также его
полуширину доверительного интервала при
комплекса с ионом меди(II) с ДНК тимуса теленка.
доверительной вероятности
0.95 (выборка из
3 опытов).
Гидразон
3 получен взаимодействием экви-
валентных количеств пиридоксаль-5-фосфата 1 и
Устойчивость гидразона исследовали по
пиразин-2-карбогидразида
2 (схема
1)
[6].
описанной ранее методике [6]. Значения lgKсф были
Образование основания Шиффа 3 подтверждено
определены при обработке электронных спектров
данными ЯМР
1Н и
13С. Характерные для
поглощения растворов соединений 1 с постоянной
альдегидной группы сигналы при
9.90
(1Н) и
концентрацией (1.5×10-4 моль/л) и 2 с перемен-
196.5 м. д.
(13С), наблюдаемые в спектре
ными концентрациями
(1.5×10-5-1.5×10-4) при
пиридоксаль-5-фосфата, исчезают при добавлении
помощи программы FTMT [8]. Принцип расчета
гидразида. Вместо них проявляются новые сигналы
заключается в аппроксимации экспериментальной
при 8.65 (1Н) и 147.7 м. д. (13С), относящиеся к
зависимости оптической плотности при несколь-
группе -СН=.
ких длинах волн от общих концентраций реа-
Образование гидразона
3
приводит к
гентов. Константы скорости образования и
существенным изменениям в электронном спектре
гидролиза гидразона
3 были определены из
поглощения (рис. 1), в частности, к образованию
зависимости оптической плотности при фикси-
интенсивной полосы при
302-306 нм,
рованном значении длины волны (соответству-
обусловленной возникновением единой сопряжен-
ющей электронному переходу в системе π-π-р-π)
ной π-π-p-π-электронной системы [7]. Константы
от времени. Вначале по значениям оптической
устойчивости, скорости образования и гидролиза
плотности рассчитывали равновесные концен-
гидразона
3 приведены в табл.
1. Величины
трации реагентов и продукта реакции
[9].
погрешностей в табл.
1 представляют собой
Полученные зависимости равновесных концен-
Таблица 1. Константы устойчивости, скорости образования и гидролиза гидразона 3 при различных значениях рН
рН
Параметр
1.9
6.6
7.0
7.4
lgKсф
5.00±0.08
4.94±0.15
4.53±0.09
4.65±0.13
k1, л/(моль·мин)
-
46.0±0.2
24.6±1.0
25.4±0.8
k-1, мин-1
-
(6±4)×10-4
(5±2)×10-4
(4±2)×10-4
lgKкин
-
4.88±0.48
4.69±0.24
4.80±0.31
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
232
ГАМОВ и др.
(а)
(б)
16×10-5
12×10-5
8×10-5
4×10-5
τ, мин
τ, мин
Рис. 2. Зависимость (a) оптической плотности при λ = 301 нм (б) и экспериментальных (точки) и расчетных (линии)
концентраций соединений 1 (1), 2 (2) и их гидразона 3 (3) от времени при pH = 6.6.
траций от времени обрабатывали при помощи
из форм соединения
1 и гидразона
3 харак-
программы Kinet
[10,
11]. Начальные концен-
теризуется собственной константой скорости [13].
трации обоих реагентов 1 и 2 составляли 1.5×
Таким образом, изменение рН среды, смещающее
10-4 моль/л. При рН = 1.9 реакция протекает
протолитические равновесия исходного реагента и
слишком быстро, чтобы надежно определить ее
продукта реакции, приводит к изменениям
кинетические характеристики.
значений k1 и k-1.
Малая величина k-1 определяет высокую
Исследование взаимодействия
различных
погрешность ее расчета (табл.
1). Исключение
соединений с ДНК представляет интерес с точки
гидролиза соединения 3 из математической модели
зрения оценки их мутагенной способности.
приводит к изменению значения k1 в пределах
Плоские гетероароматические соединения способны
статистической погрешности эксперимента. Из-за
встраиваться между основаниями ДНК [14, раздел
высокой погрешности расчета константы скорости
4.1], что приводит к сдвигу рамки считывания.
обратной реакции значения lgKкин/Kкин (Kкин = k1/k-1)
Многочисленные работы (см., например, обзоры
также характеризуются существенной погреш-
[14,
15], а также статьи
[16-20]) описывают
ностью (табл.
1).
Примеры расчетных и
результаты исследования интеркаляции органи-
экспериментальных зависимостей оптической
ческих соединений различной природы, а также их
плотности от времени приведены на рис. 2.
металлокомплексов в ДНК.
Спектр раствора смеси гидразона 3 (10-4 моль/л)
Устойчивость гидразона
3 несущественно
и ДНК тимуса теленка (2.4×10-5 моль/л) совпадает
изменяется при варьировании значения рН среды.
с суммой спектров соединения
3 и ДНК,
Константа равновесия порядка
105 (lgK
~5)
зарегистрированных по отдельности. Это означает,
характерна и для реакции между пиридоксаль-5-
что гидразон 3 не вступает во взаимодействие с
фосфатом
1 и гидразидами, производными
ДНК в указанных концентрационных условиях.
пиридина, пиразола и имидазола [6, 12]. Константа
скорости реакции образования основания Шиффа
Для детального анализа процессов, протека-
уменьшается при переходе от слабокислой среды
ющих в системе, в которой одновременно присут-
(рН = 6.6) к слабощелочной (рН = 7.4) (табл. 1).
ствуют компоненты буферной системы трис(2-
амино-2-гидроксиметилпропан-1,3-диол)-HCl, Cu2+,
Для пиридоксаль-5-фосфата 1 характерен набор
исследуемый гидразон и ДНК, необходимо знать
протолитических равновесий (отщепление протонов
константы возможных координационных равно-
от фосфатной группы и гидроксигруппы в
весий (Cu2+ + Трис, Cu2+ + ДНК, Cu2+ + 3). Система
положении 3), а также переход одного из ионов
Cu2+-Трис исследована подробно [21], константа
водорода к гетероатому азота, что приводит к
устойчивости комплекса иона меди(II) с ДНК
образованию цвиттер-иона. Для гидразона 3 также
тимуса теленка определена в работе [22].
возможны эти реакции, кроме того, для него
вероятно еще равновесие имин-кетоенамин [13].
Стехиометрический состав и устойчивость
Прямая либо обратная реакция с участием каждой
комплекса Cu2+-3 определены нами спектро-
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
ГИДРАЗОН ПИРИДОКСАЛЬ-5-ФОСФАТА
233
λ, нм
λ, нм
Рис.
3. Электронные спектры поглощения смесей
гидразона 3 и иона меди(II) при рН = 7.2 с различной
Рис.
4. Электронные спектры поглощения смесей
концентрацией гидразона 3 и Cu(II), моль/л: 0 - 1×10-4
гидразона 3, иона Cu(II) и ДНК при рН = 7.2. Общие
и 0; 1 - 1×10-4 и 7.5×10-6; 2 - 1×10-4 и 1.5×10-5; 3 - 1×10-4
концентрации гидразона и комплексообразователя
и 2.3×10-5; 4 - 1×10-4 и 3×10-5; 5 - 1×10-4 и 3.8×10-5; 6 -
равны 1×10-4 и 5×10-5 моль/л соответственно. Общая
1×10-4 и 4.5×10-5; 7 - 1×10-4 и 5.3×10-5; 8 - 1×10-4 и
концентрация ДНК в пересчете на 1 пару нуклеотидов,
6.0×10-5; 9 - 1×10-4 и 6.8×10-5; 10 - 1×10-4 и 7.5×10-5.
мкмоль/л: 1 - 0, 2 - 6, 3 - 12, 4 - 18, 5 - 24, 6 - 30.
фотометрическим методом. Пример изменения
всех протонированных форм лиганда, существу-
электронного спектра поглощения раствора
ющих при значении рН = 7.2.
гидразона с постоянной концентрацией (10-4 моль/л)
По данным рис. 3 можно рассчитать условную
при добавлении переменного количества иона
константу устойчивости комплекса ML'2 β2' (1), где
меди(II) (7.5×10-6-7.5×10-5 моль/л) приведен на
[L']'
- сумма равновесных концентраций всех
рис.
3. На основании анализа зависимостей
ионизированных форм лиганда (2), [ML'2] - сумма
оптических плотностей при длинах волн,
равновесных концентраций всех возможных форм
соответствующих максимумам поглощения металло-
комплекса
(3).
Заряды ионов опущены для
комплекса и свободного лиганда, от соотношения
удобства восприятия.
общих концентраций ион металла-лиганд
[23]
было установлено, что координационное соеди-
[ML'2]
нение Cu2+-3 может быть описано условной
(1)
,
'2 =
формулой ML'2∙L', что обозначает совокупность
[M][L']2
Таблица 2. Побочные реакции, протекающие в растворе, содержащем фосфат-ионы, ионы Cu(II), Zn(II) и гидразон
№
Реакция
lgK (ионная сила, I)
Литературная ссылка
1
H++Tris ↔ HTris
8.19 (I = 0.1)
[21]
2
Cu2+ + H2O ↔ CuOH+ + H+
-7.83 (I = 0.15)
[24]
3
Cu2+ + Tris ↔ CuTris+ + H+
-2.22 (I = 0.1)
[21]
4
Cu2+ + Tris ↔ CuTris + 2Н+
-10.51 (I = 0.1)
[21]
5
Cu2+ + 2Tris ↔ CuTris+ + Н+
1.47 (I = 0.1)
[21]
6
Cu2+ + 2Tris ↔ CuTris2 + 2Н+
-6.39 (I = 0.1)
[21]
7
Cu2+ + 2Tris ↔ CuTris– + 3Н+
-17.24 (I = 0.1)
[21]
8
2Cu2+ + 2Tris ↔ Cu2Tris2+ + 2Н+
-1.67 (I = 0.1)
[21]
9
2Cu2+ + 2Tris ↔ Cu2Tris+ + 3Н+
-9.05 (I = 0.1)
[21]
а
10
3 + H2O ↔ Продукты гидролиза
-4.53 (I = 0.25)
а См. табл. 1.
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
234
ГАМОВ и др.
[L'] = [L] + [LH] + [LH2] + … + [LH5],
(2)
условная константа связывания
{уравнение
(2)
[16]} чрезмерно упрощено. Вероятны ситуации,
[ML'2] = [ML2] + [ML2H] + [ML2H2] + … + [ML2H10], (3)
подобные описанной в настоящей работе, при
Значение условной константы β2' (1) зависит от
которой металлокомплекс с нуклеиновой кислотой
pH среды. Применение буферного раствора обеспе-
не взаимодействует, а наблюдаемые изменения в
чивает существование одного и того же набора
электронных спектрах соответствуют изменению
форм лиганда и комплекса. Для обеспечения
равновесной концентрации металлокомплекса и
независимости lgβ2' от концентрации побочных
свободного лиганда. В этом случае расчет
лигандов (Трис и гидроксид-ионов) необходимо
условной константы связывания приводит к
учесть побочные реакции с участием иона Cu2+,
бессмысленному результату, не отражающему
протекающие в растворе (табл. 2). В результате
никакого процесса. По нашему мнению, во всех
обработки зависимостей оптической плотности при
случаях расчету констант связывания должен
трех длинах волн от общих концентраций лиганда
предшествовать эксперимент, доказывающий, что
и комплексообразователя с учетом процессов
интеркаляция действительно протекает. Нам
реакций (1-10) (табл. 2) была получена величина
удалось найти единственную работу, в которой
lgβ2' = 11.85±0.17.
обсуждается способность иона меди(II) высво-
бождаться из комплекса с некоторыми три-
Рассмотрим ситуацию, когда в растворе
пептидами при взаимодействии с ДНК [26].
одновременно присутствуют ионы меди(II), Трис,
гидразон, ДНК (рис. 4). Добавление возрастающего
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
количества ДНК к раствору, содержащему
Электронные спектры поглощения зарегистри-
фиксированное количество иона металла и
рованы на двухлучевом спектрофотометре
гидразона, приводит к увеличению поглощения
Shimadzu UV1800 (США) в диапазоне длин волн
света в коротковолновой части спектра и
190-500 нм. Соответствующий буфер (дистиллиро-
уменьшению - в длинноволновой. В отсутствие
ванная вода при рН
=
1.9) использовали как
ДНК такие же изменения наблюдаются при
раствор сравнения. Ошибка определения длины
уменьшении общей концентрации меди(II) (см.
волны не превышала
0.5 нм, максимальная
рис. 3 при переходе от спектра 10 к спектру 1).
погрешность измерения оптической плотности
Следовательно, металлокомплекс не взаимо-
±0.006 ед. Температуру 298.2±0.1 K поддерживали
действует с ДНК как целое; вместо этого в
при помощи внешнего термостата. Элементный
растворе протекают конкурирующие координа-
анализ проводили на приборе FLASH EA1112
ционные равновесия с участием иона Cu2+ и Трис,
(Termo Quest, Италия). Спектры ЯМР 1H, 13С в D2O
гидразона и ДНК. Действительно, математическая
(pD ~12) зарегистрированы на ЯМР спектрометре
модель эксперимента (рис.
4), учитывающая
Avance Bruker 500 с рабочими частотами 500.17
реакции (1)-(10) (табл. 2), образование комплекса
(1H) и 125.77 (13С) МГц. Отнесение сигналов в
Cu2+-(3)2, комплексообразование медь(II)-ДНК и
спектрах исследуемых соединений проводили на
реакцию (11), неадекватна.
основании литературных данных [27].
Cu2+ + 2PLP-PCH + ДНК ↔ [Cu(PLP-PCH)2]-ДНК. (11)
Пиридоксаль-5-фосфат
(>99 мас%) исполь-
При исключении процесса интеркаляции ДНК
зовали
без
предварительной
подготовки.
комплексом меди(II) с гидразоном, наблюдаемые
Лиофилизированный препарат ДНК тимуса
на рис.
4 изменения в электронном спектре
теленка - коммерческий препарат (Sigma Aldrich,
поглощения металлокомплекса удовлетворительно
США). Пиразин-2-карбогидразид получали из
описываются набором реакций (1)-(10) (табл. 2) с
соответствующего карбоксамида при кипячении с
добавлением комплексообразования Cu2+-гидразон
гидразингидратом в этаноле. Отсутствие примесей
и Cu2+-ДНК. Аналогичный результат был получен
контролировали при помощи спектроскопии ЯМР
недавно при исследовании взаимодействия комп-
1H. Буферные растворы с рН =
6.6,
7.0,
7.4
лекса меди(II) и 3-пиридинкарбогидразоном пири-
готовили с использованием Na2HPO4∙12H2O и
доксаль 5'-фосфата с ДНК тимуса теленка [25].
NaH2PO4∙2H2O (Спектр-Хим, Россия). Значение
Таким образом, на наш взгляд, описание взаимо-
рН = 1.9 создавалось добавлением предварительно
действия металлокомплексов с ДНК при помощи
стандартизированной HCl. Кислотность буферных
единственной формулы, в которой вычисляется
растворов контролировали потенциометрически.
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
ГИДРАЗОН ПИРИДОКСАЛЬ-5-ФОСФАТА
235
Все растворы готовили на бидистиллированной
финансовой поддержке Российского фонда фунда-
воде (κ = 1.7 мкСм/см, pH = 6.6). Значение ионной
ментальных исследований (проект № 16-33-60017)
силы I = 0.25, близкое к величине I в эритроцитах
и Совета по грантам при Президенте Российской
[27], задавали за счет компонентов буферной смеси
Федерации (проект № 14.Z56.18.877-MK).
(при pH = 6.6, 7.0, 7.4) или KNO3 (pH = 1.9).
Растворы ДНК готовили на основе 20 мМ. буфера
КОНФЛИКТ ИНТЕРЕСОВ
Трис-HCl, рН = 7.2. Навеску препарата нуклеи-
новой кислоты для стокового раствора растворяли
Авторы заявляют об отсутствии конфликта
в течение 4 сут при 4°С. Соотношение оптических
интересов.
плотностей A260/A280 = 1.9 свидетельствовало о
высокой чистоте ДНК. Концентрация ДНК в
СПИСОК ЛИТЕРАТУРЫ
стоковом расторе была определена спектрофото-
1.
Su X., Aprahamian I. // Chem. Soc. Rev. 2014. Vol. 43.
метрически методом построения градуировочного
P. 1963. doi 10.1039/C3CS60385G
графика с использованием литературного значения
2.
Kejik Z., Kaplanek R., Havlik M., Briza T., Vavrinova D.,
ε260 = 6600 на нуклеотид [16].
Dolensky B., Martasek P., Kral V. // J. Luminesc. 2016.
Vol. 180. N 1. P. 269. doi 10.1016/j.jlumin.2016.08.047
(5-Гидрокси-6-метил-4-{(E)-[2-oкco-2-(пиразин-
2-ил)этил]-гидразинилиденметил}пиридин-3-ил)-
3.
D’Acunto C.W., Kaplanek R., Gbelcova H., Kejik Z.,
метилфосфат
(3). Смесь нагретого до 70-80°С
Briza T., Vasina L., Havlik M., Ruml T., Kral V. // Eur.
J. Med. Chem. 2018. Vol. 150. P. 140. doi 10.1016/
раствора
0.618 г
(2.5 ммоль) пиридоксаль-5-
j.ejmech.2018.02.084
фосфата 1 в 15 мл воды и нагретого до 70-80°С
4.
Mezey R.-S., Mathe I., Shova S., Grecu M.-N., Rosu T. //
раствора
0.345 г
(2.5 ммоль) пиразин-2-карбо-
Polyhedron. 2015. Vol. 102. P. 684. doi 10.1016/
гидразида 2 в 15 мл воды охлаждали 1 ч при
j.poly.2015.10.035
комнатной температуре. Образовавшийся кристал-
5.
Kaplanek R., Havlik M., Dolensky B., Rak J., Dzubak P.,
лический осадок отфильтровывали, промывали
Konecny P., Hajduch M., Kralova J., Kral V. // Bioorg.
небольшим количеством холодной дистиллирован-
Med. Chem. 2015. Vol. 23. N. 7. P. 1651. doi 10.1016/
ной воды и ацетона и сушили на воздухе. Выход
j.bmc.2015.01.029
0.815 г (84.6%), светло-желтые кристаллы, Rf 0.86
6.
Гамов Г.А., Александрийский В.В., Завалишин М.Н.,
(подвижная фаза
-
25%-ный водный аммиак,
Хохлова А.Ю., Шарнин В.А. // ЖOX. 2017. Т. 87.
Polygram Sil G/UV254). УФ спектр (pH = 7.4, H2O),
Вып. 6. С. 940; Gamov G.A., Aleksandriiskii V.V.,
λmax, нм (lgε): 302 (4.29); зеленая люминесценция в
Zavalishin M.N., Khokhlova A.Yu., Sharnin V.A. // Russ.
твердой фазе при λex = 365 нм. Спектр ЯМР 1H
J. Gen. Chem. 2017. Vol. 87. N. 6. P. 1161. doi
(D2O, pD ~12), δ, м. д.: 8.90 д (1Н, Н3, 4J = 0.9 Гц),
10.1134/S1070363217060093
8.65 с (1Н, СН=), 8.47 д. д (1Н, Н5', 3J = 2.4, 4J =
7.
Китаев Ю.П., Бузыкин Б.И. Гидразоны. М.: Наука,
0.9 Гц), 8.41 д (1Н, Н6', 3J = 2.4 Гц), 7.51 с (1Н, Н6),
1974. С. 105.
4.75 д (2Н, СН2, 3J = 4.3 Гц), 2.22 с (3Н, СН3).
8.
Гридчин С.Н., Кочергина Л.А., Коновалов П.Г. //
Спектр ЯМР 13С, δC, м. д.: 166.1 (C=O), 158.5 (С3),
Коорд. хим. 2003. Т. 29. Вып. 12. С. 932; Gridchin S.N.,
Kochergina L.A., Konovalov P.G. // Russ. J. Coord.
151.2 (C2), 149.4 (C2'), 147.7 (CH=), 145.6 (C3'), 144.0
Chem. 2003. Vol. 29. N 12. P. 868. doi 10.1023/
(C5'), 143.5 (C6'), 134 (C6), 130.4 (C5), 120.3 (C4), 61.7
B:RUCO.0000008399.53700.43
(CH2), 18.2 (CH3). Спектр ЯМР 31P: δР 3.79 м. д.
9.
Гамов Г.А., Завалишин М.Н., Усачева Т.Р., Шарнин В.А. //
Mасс-спектр, m/z: 368.07 [М + H]+. Найдено, %: C
ЖФХ. 2017. Т.
91.
№ 5. С. 800. doi 10.7868/
42.22; H 4.00; N 18.61. C13H14N5O6P. Вычислено, %:
S0044453717050119; Gamov G.A., Zavalishin M.N.,
С 42.52; Н 3.84; N 19.07. M 367.25.
Usacheva T.R., Sharnin V.A. // Russ. J. Phys. Chem.
(A). 2017. Vol. 91. No. 5. P. 843. doi 10.1134/
ФОНДОВАЯ ПОДДЕРЖКА
S0036024417050107
10. Практикум по физической химии. Кинетика и
Работа выполнена в Научно-исследовательском
катализ. Электрохимия / Под ред. В.В. Лунина, Е.П.
институте термодинамики и кинетики химических
Агеева. M.: Академия, 2012. С. 70.
процессов Ивановского государственного химико-
технологического
университета
в
рамках
12. Gamov G.A., Kiselev A.N., Aleksandriiskii V.V., Shar-
государственного задания Министерства науки и
nin V.A. // J. Mol. Liq. 2017. Vol. 242. P. 1148. doi
образования РФ (проект № 4.7305.2017/8.9) при
10.1016/j.molliq.2017.07.106
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
236
ГАМОВ и др.
13. Echevarria G.R., Basagoitia A., Santos J.G., Blanco F.G. //
21. Nagaj J., Stokowa-Soltys K., Kurowska E., Fraczyk T.,
J. Mol. Cat. (A). 2000. Vol. 160. P. 209. doi 10.1016/
Jezowska-Bojczuk M., Bal W. // Inorg. Chem. 2013.
S1381-1169(00)00266-1
Vol. 52. N 24. P. 13927. doi 10.1021/ic401451s
14. Sirajuddin M., Saqib A., Badshah A. // J. Photochem.
22. Яцимирский К.Б., Крисс Е.Е., Ахрамеева Т.И.
//
Photobiol. (B). 2013. Vol. 124. P. 1. doi 10.1016/
Докл. АH СССР. 1966. Т. 168. № 568. С. 840.
j.jphotobiol.2013.03.013
23. Filipsky T., Ríha M., Hrdina R., Vávrová K., Mladenka P. //
15. Erxleben A. // Coord. Chem. Rev. 2018. Vol.
360.
Bioorg. Chem. 2013. Vol. 49. P. 1. doi 10.1016/
P. 92. doi 10.1016/j.ccr.2018.01.008
j.bioorg.2013.06.002
16. Bordbar M., Tavoosi F., Yeganeh-Faal A., Zebarjadi-
24. Brown P.L., Ekberg C. Hydrolysis of Metal Ions.
an M.H. // J. Mol. Struct. 2018. Vol. 1152. P. 128. doi
Weinheim: Wiley-VCH Verlag GmbH & Co., 2016.
10.1016/j.molstruc.2017.09.088
945 p.
17. Kalaiarasi G., Rajkumar S.R.J., Dharani S., Lynch V.M.,
25. Gamov G.A., Zavalishin M.N., Sharnin V.A.
//
Prabhakaran R. // Inorg. Chim. Acta. 2018. P. 759. doi
Spectrochim. Acta (A). 2019. Vol. 206. P. 160. doi
10.1016/j.ica.2017.12.008
10.1016/j.saa.2018.08.009
18. Sedighipoor M., Kianfar A.H., Sabzalian M.R., Abyar F. //
26. Nagane R., Koshigoe T., Chikira M., Long E.C. // J.
Spectrochim. Acta (A). 2018. Vol. 198. P. 38. doi
10.1016/j.saa.2018.02.050
Inorg. Biochem. 2001. Vol. 83. N 1. P. 17. doi 10.1016/
S0162-0134(00)00129-X
19. Palanimurugan A., Kulandaisamy A. // J. Organomet.
Chem.
2018. Vol.
861. P.
263. doi
10.1016/
27. Bruno T.J., Svoronos P.D.N. Handbook of Basic Tables
j.jorganchem.2018.02.051
for Chemical Analysis. Boca Raton: CRC Press, 2011.
P. 441.
20. Neelakantan M.A., Balamurugan K., Balakrishnan C.,
Subha, L. // Appl. Organomet. Chem. 2018. Vol. 32.
28. Mouat M.F., Manchester K.L. // Comp. Haematol. Int.
N 4. doi 10.1002/aoc.4259
1998. Vol. 8. N 1. P. 58. doi 10.1007/BF02628107
Pyrazine-2-Carbohydrazone of Pyridoxal 5'-Phosphate:
Synthesis, Stability, Formation Kinetics and Interaction with DNA
G. A. Gamova*, M. N. Zavalishina, V. V. Alexandriyskiia, and V. A. Sharnina
a Ivanovo State University of Chemical Technology, pr. Sheremetevskii 7, Ivanovo, 153000 Russia
*e-mail: oxt705@isuct.ru
Received June 7, 2018; revised June 7, 2018; accepted June 14, 2018
(5-Hydroxy-6-methyl-4-{(E)-[2-oxo-2-(pyrazin-2-yl)ethyl]hydrazinylidenemethyl}pyridin-3-yl)methyl phosphate
was synthesized as a product of the interaction of pyridoxal-5-phosphate and pyrazin-2-carbohydrazide. Its
stability constants were determined in aqueous solution at pH = 1.9, 6.6, 7.0, 7.4. The kinetics of formation and
hydrolysis of the hydrazone obtained was studied, and rate constants of the direct and reverse reactions were
calculated from the electronic absorption spectra. Interaction of the obtained hydrazone and its Cu(II) complex
with calf thymus DNA was investigated.
Keywords: hydrazone, stability constant, rate constant, pyridoxal-5-phosphate, DNA
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019