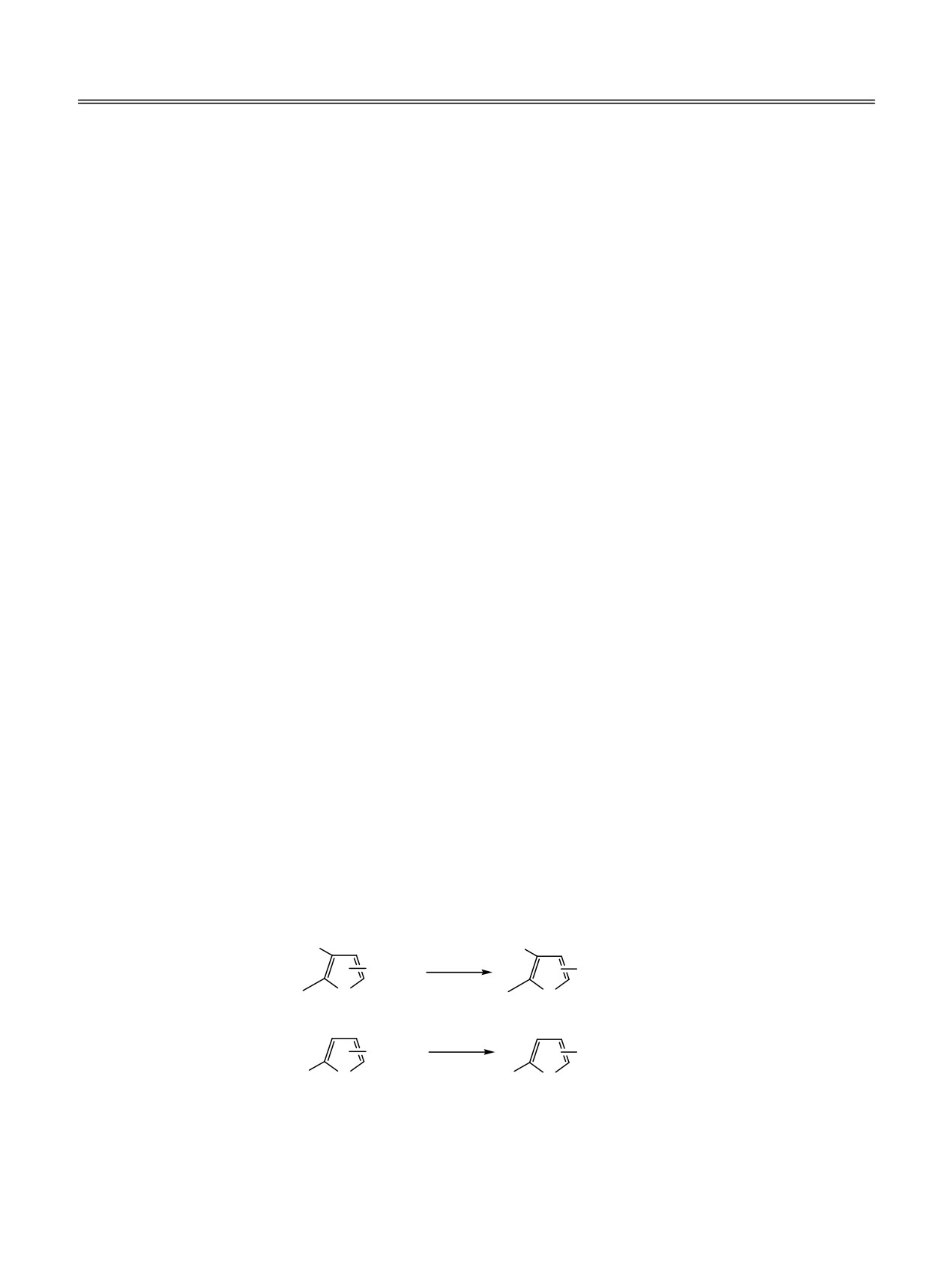ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 2, с. 244-253
УДК 547.341
СИНТЕЗ И НЕКОТОРЫЕ РЕАКЦИИ
4(5)-ФУНКЦИОНАЛИЗИРОВАННЫХ
2(3)-ФУРОИЛФОСФОНАТОВ
© 2019 г. Л. М. Певзнер*
Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
Поступило в Редакцию 5 июля 018 г.
После доработки 5 июля 2018 г.
Принято к печати 13 июля 2018 г.
Разработаны подходы к синтезу широкого круга фосфорилированных производных 3-(фурил)акриловой
кислоты и 4-(фурил)бутен-2-она с разнообразными функциональными группами в фурановом кольце.
Ключевые слова: фуроилфосфонаты, хлорметилфураны, реакция Виттига, азиды, тиоцианаты
DOI: 10.1134/S0044460X19020124
Ранее нами были синтезированы 5-замещенные
триэтилфосфитом в условиях реакции Арбузова.
2-фуроилфосфонаты и изучены их реакции с
Реакция протекает при комнатной температуре в
нуклеофилами и резонансно-стабилизированными
бензоле и завершается в течение 4-5 ч (схема 1).
фосфоранами [1]. В продолжение исследований
Выходы фосфонатов 3 и 4 составляют 95 и 93%
были получены и изучены химические свойства 4-
соответственно.
и
5-функционализованных
2- и
3-фуроилфос-
Фуроилфосфонаты 3 и 4 - свето-коричневые
фонатов соответственно. Отличительной особен-
вязкие жидкости. При нагревании в вакууме они
ностью этих изомеров является то, что заместители
разлагаются намного ниже температуры кипения.
в них максимально удалены друг от друга и из-за
Сигналы ядер фосфора в спектрах ЯМР 31Р этих
этого не способны непосредственно взаимо-
соединениях проявляются в характерной для
действовать между собой. Основное влияние они
фуроилфосфонатов области при -2.59 и -3.18 м. д.
оказывают на распределение электронной плот-
соответственно.
ности в фурановом кольце.
Ключевой стадией синтеза всей серии соеди-
Хлорангидриды
4- и
5-бутилтиометилфуран-
нений является фосфорилирование хлорангид-
карбоновых кислот
5 и
6 также гладко фос-
ридов хлорметилфуранкарбоновых кислот 1 и 2
форилируются триэтилфосфитом при комнатной
Схема 1.
R
R
P(OEt)3
C(O)Cl
X
O
O
1, 5
3, 7
P(OEt)3
C(O)Cl
X
R
O
R
O
2, 6
4, 8
R = CH2Cl (1_4), CH2SC4H9 (5_8), X = 2-P(O)(OEt)2 (3, 7), X = 3-P(O)(OEt)2 (4, 8).
244
СИНТЕЗ И НЕКОТОРЫЕ РЕАКЦИИ 4(5)-ФУНКЦИОНАЛИЗИРОВАННЫХ
245
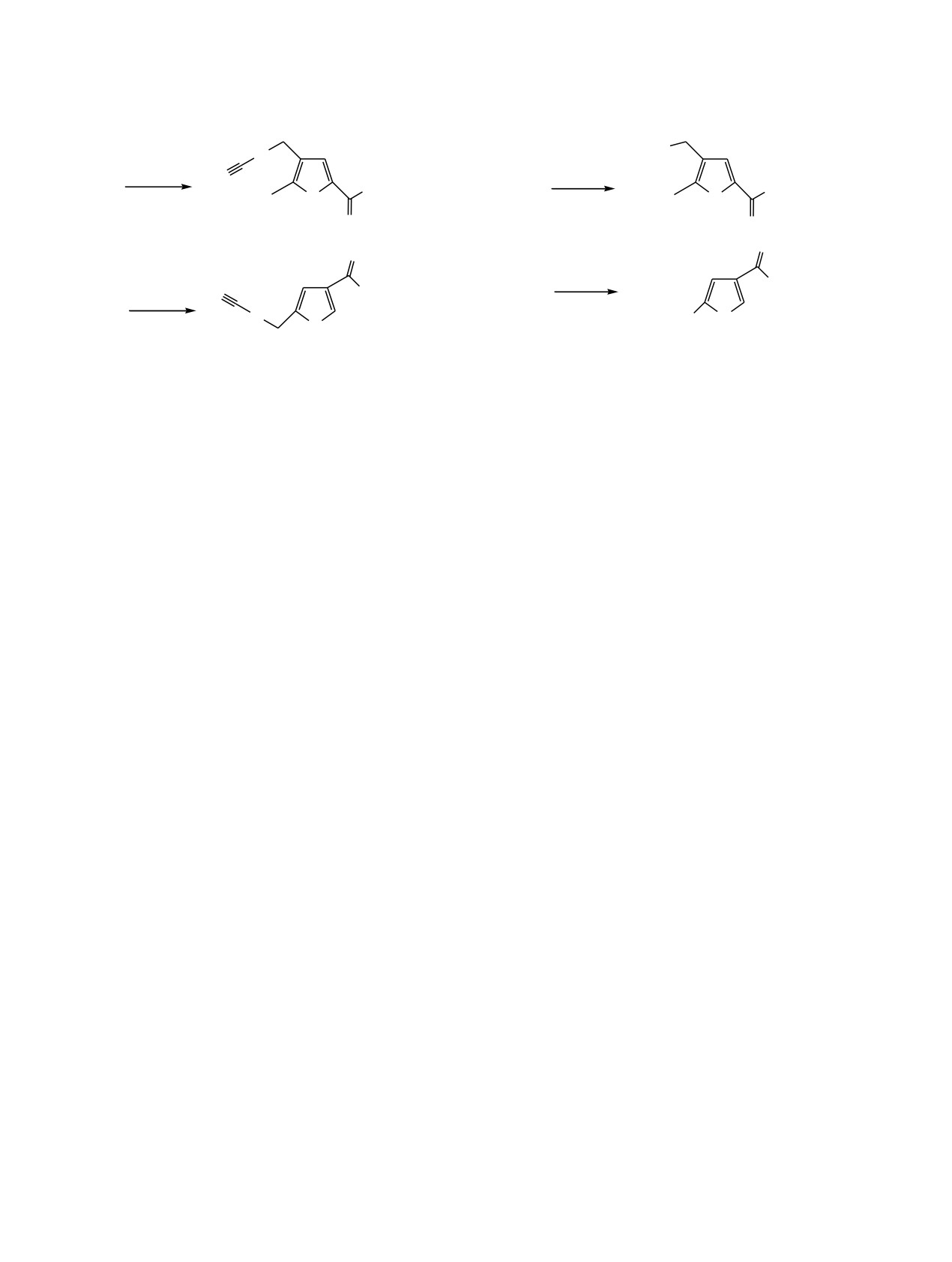
Схема 2.
Схема 3.
N3H2C
S
KSCN
NaN3
N
3
PO(OEt)2
3
PO(OEt)2
KI
O
O
KI
O
11
O
9
O
O
NaN3
PO(OEt)2
N
4
PO(OEt)2
KSCN
KI
4
KI
S
N3H2C
O
O
12
10
температуре с образованием фосфонатов 7 и 8 с
температуру процесса до 80°С с целью сокращения
выходами 96 и 94% соответственно (схема
1).
времени проведения реакции происходило
Сигналы ядер фосфора проявляются в спектрах
разложение
ацилфосфонатной
группы
и
этих соединений при -2.15 и -2.88 м. д. Соответ-
фуранового кольца с образованием сложной смеси
ственно.
продуктов. Азиды
11 и
12 были получены с
выходом 93 и 99% соответственно (схема 3). В
В отличие от гидрохлорида 5-(N-морфолино-
спектрах ЯМР полученных соединений сигнал
метил)-2-фуроилхлорида,
который
гладко
протонов азидометильной группы располагался в
фосфорилируется триэтилфосфитом в присутствии
области 4.20-4.33 м. д., а сигнал соответствующего
1 экв. триэтиламина
[1], гидрохлориды
4-(N-
атома углерода
- при
44.96 и
46.54 м. д.
морфолинометил)-5-метил-2-фуроилхлорида и 5-(N-
соответственно.
морфолинометил)-3-фуроилхлорида соответствующих
ацилфосфонатов не дают. По данным ЯМР 31Р, в
Таким образом, введение в реакцию Арбузова
результате реакции образуется сложная смесь
функционально замещенных хлорангидридов 2- и
соединений, разделить которую не удалось.
3-фуранкарбоновых кислот в сочетании с после-
дующей реакцией нуклеофильного замещения
Хлорметилфуроилфосфонаты
3 и
4 при
позволило получить довольно разнообразный по
комнатной температуре в ацетонитриле вступают в
строению ряд фуроилфосфонатов и отобрать из
реакции нуклеофильного замещения галогена с
него достаточно термически стабильные вещества
такими ионными нуклеофилами, как тиоцианат
(3,
4,
7-10), которые могли бы выдержать
калия и азид натрия (схема 2). В обоих случаях
температурные условия реакции Виттига с
реакцию проводили при мольном соотношении
резонансно-стабилизированными
фосфоранами.
фосфонат:нуклеофил
=
1:2 с использованием
Эти соединения вводили в реакцию с ацетил-
иодистого калия
(10
мол%) в качестве
метилен- и этоксикарбонилметилентфифенилфос-
катализатора. Вследствие хорошей растворимости
фораном. Процесс проводили в бензоле при 80°С
тиоцианата калия в ацетонитриле замещение хлора
при мольном соотношении фосфонат:фосфоран =
протекает в течение 6-7 ч. Реакция протекает
1:1.1 (схема 4). Во всех случаях полученный эфир
селективно с образованием соответствующих
3-(фурил)-3-(диэтоксифосфорил)акриловой кислоты
тиоцианатометилфосфонатов 9 и 10 с выходом 93 и
или 4-(фурил)-4-(диэтоксифосфорил)бут-3-ен-2-он
99%.
имел транс-расположение фосфорильной и
Полученные соединения
- вязкие светло-
карбонильной групп относительно двойной связи.
желтые масла, не перегоняющиеся в вакууме. В
Аналогичная конфигурация продуктов реакции
спектрах ЯМР соединений 9 и 10 сигнал протонов
наблюдалась и в ранее описанных случаях [2-4].
тиоцианатометильной группы располагался при
Строение полученных соединений было установ-
4.04 и 4.20 м. д., а сигнал соответствующего атома
лено методами спектроскопии ЯМР. Сигнал ядра
углерода находился при 28.45 и 30.16 м. д.
фосфора в (фуран-2-ил)алкенах 13-17 наблюдался
Замещение хлора на азидогруппу протекало в
при 14.3-14.9 м. д., а в (фуран-3-ил)производных
течение нескольких дней. При попытке повысить
18-21 - в интервале 15.7-16.2 м. д., что характерно
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
246
ПЕВЗНЕР
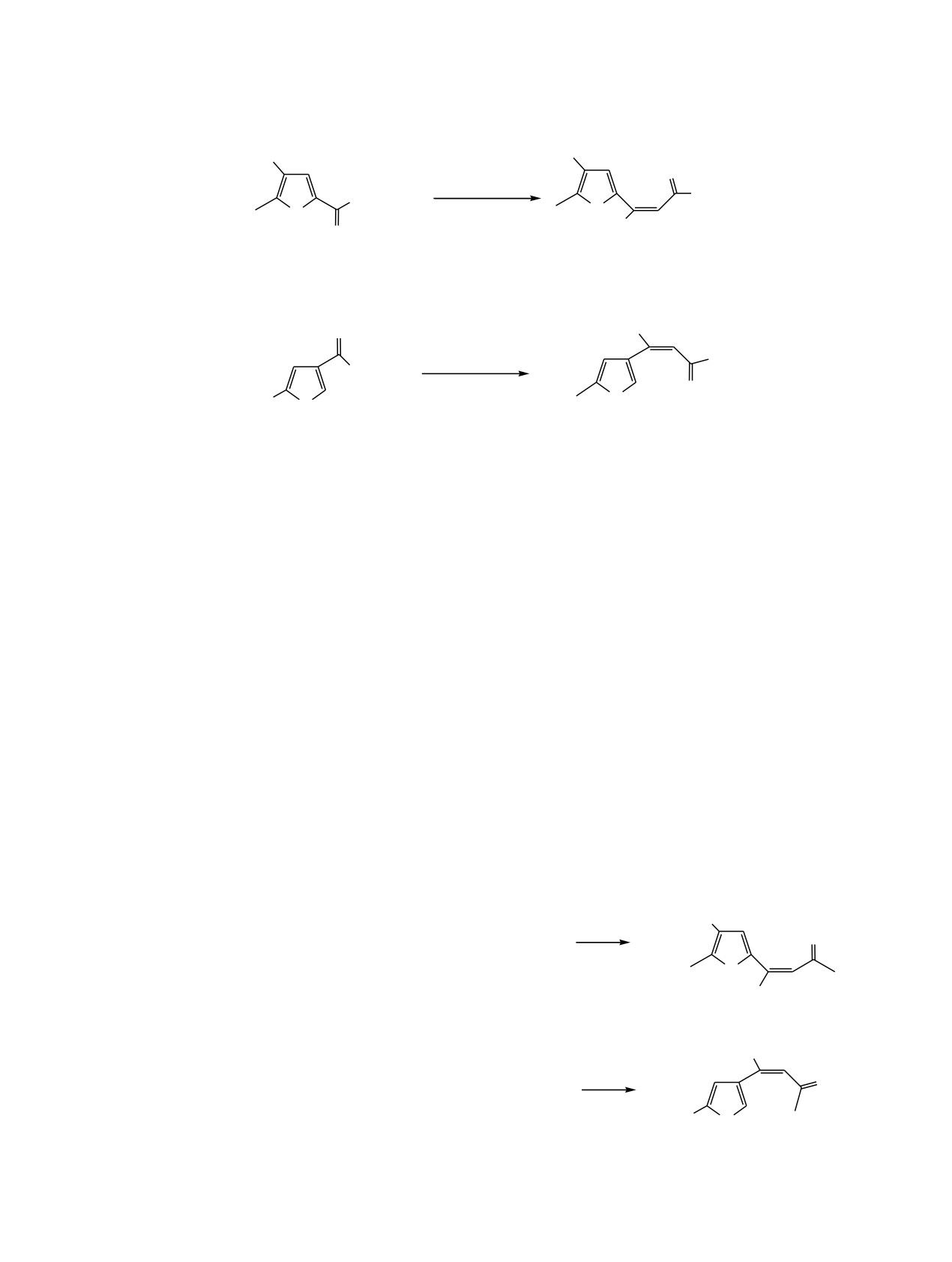
Схема 4.
XCH2
XCH2
O
Ph3P=CHCOY
Y
PO(OEt)2
O
O
P(O)(OEt)2
O
3, 7, 9
13_17
P(O)(OEt)2
O
Ph3P=CHCOY
Y
PO(OEt)2
O
O
H2CX
O
H2CX
4, 8, 10
18_21
X = Cl, Y = Me (13, 18), OEt (14); X = SBu, Y = Me (15, 19), OEt (16, 20); X = SCN, Y = Me (17, 21).
для атома фосфора при двойной связи. Во всех
по реакции с дихлорметилметиловым эфиром в
соединениях сигнал протона при двойной связи
присутствии хлористого цинка при комнатной
был расщеплен (3JPH = 24.0-24.8 Гц), что типично
температуре
[3]. Оказалось, что в случае
4-
для протонов, находящихся в цис-положении
(метоксиметилфурил)-4-(диэтоксифосфорил)бут-3-
относительно фосфора. Отметим также, что сигнал
ен-2-онов превратить метоксиметильную группу в
ядра карбонильного углерода в α,β-непредельных
хлорметильную невозможно из-за полимеризации
кетонах 13, 15, 17-19 и 21 расщеплялся от фосфора
фурилалкенов. Поэтому предложенный метод
с константой 3JPС = 20.5-21.6 Гц. В сложных
синтеза фосфорилированных непредельных хлор-
эфирах 14, 16 и 20 ее значение заметно больше
метилфурилкетонов на сегодняшний день является
(26.4-28.3 Гц).
единственным возможным способом введения
азидогруппы в рассматриваемые соединения.
Выходы продуктов реакции Виттига в случае 2-
фуроилфосфонатов ниже, чем в случае 3-фуро-
Замещение хлора на азидогруппу в соединениях
илпроизводных. Образования солей фосфония в
13 и 18 проводили в ацетонитриле при 80°С и
реакции хлорметилпроизводных
3 и
4 с фос-
мольном соотношении хлорметилфосфонат:азид
форанами не наблюдали. Тиоцианатная группа
натрия:иодистый калий = 1:2:0.1 (схема 5). Реакция
фуроилфосфонатов
9 и
10 в ходе реакции
завершалась в течение 9-10 ч. Выход азидов 22 и
сохранялась, образования изотиоцианатов не
23 составил 91 и 85% соответственно. Строение
фиксировали даже в следовых количествах. При
полученных соединений подтверждено данными
этом надо отметить, что выход алкенов 17 и 21 с
спектроскопии ЯМР.
тиоцианатометильной группой в фурановом кольце
Схема 5.
ниже, чем в случае других заместителей
приблизительно на 20% независимо от того 2- или
CH2N3
NaN3
3-фуроилфосфонаты вводились в реакцию.
O
13
KI
Термолабильность азидов 11 и 12 не позволяла
O
ввести их в реакцию Виттига. Поэтому была
P(O)(OEt)2
предпринята попытка провести нуклеофильное
22
замещение хлора в хлорметилфурилкетонах 13 и
18. Ранее аналогичным способом был синтезирован
P(O)(OEt)2
полный ряд изомеров эфиров 3-(азидометилфурил)-
NaN3
3-(диэтоксифосфорил)акриловых кислот [5]. При
O
18
этом исходные хлорметильные производные
KI
N3H2C
O
получали из соответствующих метоксиметильных
23
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
СИНТЕЗ И НЕКОТОРЫЕ РЕАКЦИИ 4(5)-ФУНКЦИОНАЛИЗИРОВАННЫХ
247
Схема 6.
CH2Cl
HN
O
N
O
O
O
O
X
O
X
P(O)(OEt)2
P(O)(OEt)2
13, 14
24, 25
P(O)(OEt)2
HN
O
O
O
20
N
O
26
X=Me (13, 24), OEt (14, 25).
Ранее было показано, что при повышенных
Полученные в аналогичных условиях азидометил-
температурах
(40-80°С) из шести изомерных
фуроилфосфонаты термически нестабильны. Все
эфиров 3-(хлорметилфурил)-3-(диэтоксифосфорил)-
синтезированные фуроилфосфонаты за исключе-
акриловых кислот только 2-хлорметилфур-3-ил- и
нием азидометильных производных вступают в
5-хлорметилфур-3-ильные производные гладко
реакцию Виттига с резонансно-стабилизиро-
алкилируют вторичные амины [3]. Во всех других
ванными фосфоранами с образованием активи-
случаях происходят неустановленные процессы с
рованных алкенов с транс-расположением фосфо-
участием двойной связи, поскольку в спектрах
рильной и карбонильной групп относительно
ЯМР 31Р проявляются сигналы ядер фосфора в
двойной связи. Хлорметилфурилалкены при действии
области 20 м. д., характерной для предельных
азида натрия дают азидометильные производные, а
фосфонатов. При изучении этой реакции на
при действии морфолина при комнатной тем-
примере соединений 13 и 18 было установлено, что
пературе образуют третичные амины.
низкоосновный морфолин в бензоле при
В результате проведенной работы разработаны
комнатной температуре гладко алкилируется до N-
методы синтеза активированных фурилалкенов с
морфолинометилфурильных производных 24 и 25
разнообразными заместителями в фурановом
(схема
6). Двойная связь в ходе процесса не
кольце, которые могут найти применение в синтезе
затрагивается. Акрилат
14 в этих условиях
соединений полициклической структуры.
реагирует аналогично с образованием эфира амино-
кислоты 26.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Таким образом, показано, что хлорангидриды
Спектры ЯМР
1Н,
13С, и 31Р получали на
4-хлорметил- и
4-бутилтиометилфуран-2-карбо-
приборе Bruker ASCENDTM-400 (400.13, 100.16 и
новой кислоты
и
5-хлорметил- и
5-бутил-
161.97 МГц 13С соответственно), растворителем
тиометилфуран-3-карбоновой кислоты фосфорили-
служил дейтерохлороформ.
руются триэтилфосфитом в условиях реакции
Эфиры бутилтиометилфуранкарбоновых кислот
Арбузова. Аналогично построенные хлорангид-
получали по методике
[6], эфиры морфолино-
риды N-морфолинометилфуранкарбоновых кислот
метилфуранкарбоновых кислот - по методике [7].
реагируют иначе образуя сложную смесь фосфор-
содержащих соединений. Хлорметилфуроилфос-
4-Бутилтиометил-5-метилфуран-2-карбоновая
фонаты при комнатной температуре вступают в
кислота. К раствору 0.80 г гидроксида калия в
реакции нуклеофильного замещения с такими
15 мл этанола прибавляли 2.62 г этилового эфира
ионными нуклеофилами, как тиоцианат калия и
4-бутилтиометил-5-метилфуран-2-карбоновой
азид натрия. В результате реакции с тиоцианат-
кислоты. Полученную смесь кипятили 8 ч, после
ионом при комнатной температуре образуются
чего отгоняли этанол. Остаток растворяли в
исключительно тиоцианатометилфуроилфосфонаты.
минимальном количестве воды и подкисляли
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
248
ПЕВЗНЕР
концентрированной соляной кислотой до рН = 2.
δ, м. д. (J, Гц): 0.93 т (3Н, СН3-бутил, J = 7.2), 1.41
Осадок отфильтровывали и сушили на воздухе.
секстет (2Н, С3Н2-бутил, J = 7.2), 1.57 квинтет (2Н,
Выход 2.30 г (98%), желтоватые кристаллы, т. пл.
С2Н2-бутил, J = 7.2), 2.53 т (2Н, CH2S, J = 7.2), 3.70
99°С. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 0.92 т (3Н,
с (фуран-CH2S), 6.58 с (1Н, Н4-фуран), 8.15 с (1Н,
СН3-бутил, J = 7.2), 1.41 секстет (2Н, С3Н2-бутил,
Н2-фуран). Спектр ЯМР 13С, δС, м. д.: 13.65 (СН3-
J = 7.2), 1.57 квинтет (2Н, С2Н2-бутил, J = 7.2), 2.39
бутил), 21.91 (С3-бутил), 27.97 (CH2S-бутил), 31.12
с (3Н, СН3-фуран), 2.46 т (2Н, CH2S, J = 7.2), 3.51 с
(С2-бутил), 31.70 (фуран-CH2S), 106.66 (С4-фуран),
(фуран-CH2S), 7.29 с (1Н, Н3-фуран), 10.04 уш. с
124.99 (С3-фуран), 151.39 (С2-фуран), 155.56 (С5-
(1Н, ОН). Спектр ЯМР 13С, δС, м. д.: 12.23 (СН3-
фуран), 159.78 (С=О).
фуран), 13.67 (СН3-бутил), 22.01 (С3-бутил), 25.70
Гидрохлорид 4-(N-морфолинометил)-5-метил-
(CH2S-бутил),
31.27 (С2-бутил),
31.30 (фуран-
фуран-2-карбоновой кислоты. К раствору 0.90 г
CH2S), 120.00 (С4-фуран), 122.44 (С3-фуран), 141.28
KOH в 30 мл этанола прибавляли 2.89 г этилового
(С2-фуран), 155.25 (С5-фуран), 163.55 (С=О).
эфира 4-(N-морфолинометил)-5-метилфуран-2-кар-
5-(Бутилтиометил)фуран-3-карбоновая кислота
боновой кислоты. Полученную смесь кипятили
получена аналогично из 2.56 г метилового эфира
10 ч, после чего подкисляли до рН = 2 спиртовым
5-(бутилтиометил)фуран-3-карбоновой кислоты.
раствором HCl. Осадок отфильтровывали и
Выход 1.85 г (77%), желтоватые кристаллы, т. пл.
промывали 10 мл этанола. Фильтрат упаривали.
62°С. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 0.92 т (3Н,
Остаток затирали с этилацетатом, полученные
СН3-бутил, J = 7.2), 1.41 секстет (2Н, С3Н2-бутил,
кристаллы отфильтровывали и сушили. Выход 2.97 г
J = 7.2), 1.58 квинтет (2Н, С2Н2-бутил, J = 7.2), 2.53
(99%), белые кристаллы, т. пл. >250°С (разл.).
т (2Н, CH2S, J = 7.2), 3.72 с (фуран-CH2S), 6.57 с
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д. (J, Гц): 2.49 с
(1Н, Н4-фуран), 8.05 с (1Н, Н2-фуран), 10.85 уш. с
(3Н, СН3-фуран), 3.06 т (4Н, N-CH2-морфолин, J =
(1Н, ОН). Спектр ЯМР 13С, δС, м. д.: 13.66 (СН3-
4.6), 3.91 т (4Н, ОCH2-морфолин, J = 4.6), 4.16 с
бутил), 22.93 (С3-бутил), 28.04 (CH2S-бутил), 31.17
(2Н, NCH2-фуран), 7.48 с (1Н, Н3-фуран), 11.74 уш.
(С2-бутил), 31.56 (фуран-CH2S), 107.07 (С4-фуран),
с (2Н, ОН, НCl). Спектр ЯМР 13С (ДМСО-d6), δС,
119.32 (С3-фуран), 148.56 (С2-фуран), 154.09 (С5-
м. д.: 12.53 (СН3-фуран), 43.06 (NCH2-фуран), 50.57
фуран), 168.65 (С=О).
(NCH2-морфолин), 63.51 (ОCH2-морфолин), 111.53
(С4-фуран), 121.21 (С3-фуран), 143.46 (С2-фуран),
Хлорангидрид
4-бутилтиометил-5-метил-
158.21 (С5-фуран), 159.50 (С=О).
фуран-2-карбоновой кислоты (5). К суспензии
2.30 г 4-бутилтиометил-5-метилфуран-2-карбоновой
Гидрохлорид хлорангидрида 4-(N-морфолино-
кислоты в
20 мл бензола прибавляли
1.0 мл
метил)-5-метилфуран-2-карбоновой кислоты.
хлористого тионила и
3 капли ДМФА. Полу-
Смесь 2.97 г гидрохлорида 4-(N-морфолинометил)-
ченную смесь кипятили
8 ч, затем отгоняли
5-метилфуран-2-карбоновой кислоты и
25 мл
легколетучие продукты. Остаток выдерживали в
хлористого тионила кипятили при перемешивании
вакууме
(1 мм рт. ст.)
1 ч при комнатной
в течение 8 ч, затем упаривали досуха. Остаток
температуре. Выход 2.36 г (94%), желтое масло.
затирали с гексаном. Выделившиеся серые
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 0.93 т (3Н, СН3-
кристаллы отфильтровывали, промывали
6 мл
бутил, J = 7.2), 1.42 секстет (2Н, С3Н2-бутил, J =
гексана и сушили в вакууме (1 мм рт. ст.) 1 ч при
7.2), 1.58 квинтет (2Н, С2Н2-бутил, J = 7.2), 2.41 с
комнатной температуре. Выход 2.74 г (85%), т. пл.
(3Н, СН3-фуран), 2.48 т (2Н, CH2S, J = 7.2), 3.51 с
177-178°С. Соединение нацело гидролизуется
(фуран-CH2S), 7.46 с (1Н, Н3-фуран). Спектр ЯМР
остаточной влагой при растворении в ДМСО.
13С, δС, м. д.: 12.52 (СН3-фуран), 13.67 (СН3-бутил),
Спектральные данные идентичны данным для
21.98 (С3-бутил), 25.56 (CH2S-бутил), 31.26 (С2-
гидрохлорида кислоты.
бутил),
31.47 (фуран-CH2S),
121.51 (С4-фуран),
Гидрохлорид 5-(N-морфолинометил)фуран-3-
128.34 (С3-фуран), 143.61 (С2-фуран), 155.04 (С5-
карбоновой кислоты. К раствору 1.30 г KOH в
фуран), 158.55 (С=О).
30 мл этанола прибавляли 3.59 г этилового эфира
Хлорангидрид
5-(бутилтиометил)фуран-3-
5-(N-морфолинометил)фуран-3-карбоновой кислоты.
карбоновой кислоты (6) получали аналогично из
Полученную смесь кипятили при перемешивании
1.84 г 5-(бутилтиометил)фуран-3-карбоновой кислоты.
8 ч, после чего подкисляли до рН = 2 раствором
Выход 1.86 г (93%), желтое масло. Спектр ЯМР 1Н,
хлористого водорода в этаноле, затем нагревали до
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
СИНТЕЗ И НЕКОТОРЫЕ РЕАКЦИИ 4(5)-ФУНКЦИОНАЛИЗИРОВАННЫХ
249
70°С. Осадок отфильтровывали и промывали 10 мл
д (С2-фуран, 2JРС = 90.6), 159.29 (С5-фуран), 183.97
горячего этанола. Фильтрат упаривали, остаток
д (С=О, 1JРС = 188.3). Спектр ЯМР 31Р: δР -2.59 м. д.
суспендировали в 5 мл ацетона, затем добавляли
Диэтил-5-хлорметил-3-фуроилфосфонат
(4).
30 мл этилацетата. Осадок отфильтровывали и
Выход
93%, светло-коричневое вязкое масло.
сушили на воздухе. Выход 2.21 г (59%), светло-
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.37 т (6Н, СН3-
серые кристаллы, т. разл. 150°С. Спектр ЯМР 1Н
этил, J = 7.2), 4.24 уш. д. к (4Н, СН2О-этил, J = 7.2,
(ДМСО-d6), δ, м. д. (J, Гц): 3.05 уш. т (4Н, NCH2-
JРH = 14.8), 4.57 с (2Н, СН2Cl), 6.79 с (1Н, Н4-
морфолин, J = 4.8), 3.80 т (4Н, ОCH2-морфолин, J =
фуран), 8.68 с (1Н, Н2-фуран). Спектр ЯМР 13С, δС,
4.6), 4.45 с (2Н, NCH2-фуран), 7.04 с (1Н, Н4-
м. д. (J, Гц): 16.34 д (СН3-этил, 3JРС = 5.7), 36.46
фуран), 8.41 с (1Н, Н2-фуран), 12.16 уш. с (2Н, ОН,
(СН2Cl), 64.17 д (СН2О-этил, 2JРС = 6.9), 107.05 д
НCl). Спектр ЯМР 13С (ДМСО-d6), δС, м. д.: 42.96
(С4-фуран, 3JРС = 8.0), 128.11 д (С3-фуран, 3JРС =
(NCH2-фуран),
50.74 (NCH2-морфолин),
63.49
70.4), 152.39 (С5-фуран), 153.44 д (С2-фуран, 3JРС =
(ОCH2-морфолин), 114.80 (С4-фуран), 121.35 (С3-
2.7), 193.02 д (С=О, 1JРС = 182.8). Спектр ЯМР 31Р:
фуран),
145.96 (С2-фуран),
150.09 (С5-фуран),
δР -3.18 м. д.
163.79 (С=О).
Диэтил-4-бутилтиометил-5-метил-2-фуроил-
Гидрохлорид хлорангидрида 5-(N-морфолино-
фосфонат (7). Выход 96%, темно-желтое сиропо-
метил)фуран-3-карбоновой кислоты. Смесь 2.19 г
образное вещество. Спектр ЯМР 1Н, δ, м. д. (J, Гц):
гидрохлорида 5-(N-морфолинометил)фуран-3-карбо-
0.92 т (3Н, СН3-бутил, J = 7.2), 1.36 секстет (2Н,
новой кислоты и
15 мл хлористого тионила
С3Н2-бутил, J = 7.2), 1.39 т (6Н, СН3-этил, J = 7.2),
кипятили при перемешивании в течение 6 ч, затем
1.57 квинтет (2Н, С2Н2-бутил, J = 7.2), 2.42 уш. с
упаривали досуха. Остаток затирали с
5 мл
(3Н, СН3-фуран), 2.47 т (2Н, CH2S, J = 7.2), 3.52 с
этилацетата до образования светло-серых кристал-
(фуран-CH2S), 4.27 д. к (4Н, СН2О-этил, J = 7.2, JРH =
лов. К полученной смеси прибавляли 20 мл гексана
14.8), 7.37 с (1Н, Н3-фуран). Спектр ЯМР 13С, δС,
и перемешивали в течение 20 мин. Осадок отфиль-
м. д. (J, Гц): 12.52 (СН3-фуран), 13.65 (СН3-бутил),
тровывали, промывали смесью 1 мл этилацетата и
16.36 д (СН3-этил, 3JРС = 5.8), 21.97 (С3-бутил),
5 мл гексана и сушили в вакууме (1 мм рт. ст.) 1 ч
25.64 (CH2S-бутил), 31.28 (С2-бутил), 31.50 (фуран-
при комнатной температуре. Выход 1.78 г (75%), т.
CH2S), 64.64 д (СН2О-этил, 2JРС = 6.9), 121.41 (С4-
пл. 129-130°С. Соединение нацело гидролизуется
фуран), 128.33 (С3-фуран), 150.18 д (С2-фуран,
остаточной влагой при растворении в ДМСО.
2JРС
= 90.1), 155.47 (С5-фуран), 183.50 д (С=О,
Спектральные данные идентичны данным для
1JРС = 187.8). Спектр ЯМР 31Р: δР -2.15 м. д.
гидрохлорида кислоты.
Диэтил-5-бутилтиометил-3-фуроилфосфонат (8).
Реакция хлорангидридов фуранкарбоновых
Выход 94%, темно-желтое сиропообразное вещество.
кислот с триэтилфосфитом (общая методика). К
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 0.89 т (3Н, СН3-
раствору
10 ммоль хлорангидрида замещенной
бутил, J = 7.2), 1.31-1.41 м (2Н, С3Н2-бутил), 1.37 т
фуранкарбоновой кислоты в 20 мл бензола прибав-
(6Н, СН3-этил, J = 7.0), 1.55 квинтет (2Н, С2Н2-
ляли при перемешивании
10.1 ммоль триэтил-
бутил, J = 7.2), 2.50 т (2Н, CH2S, J = 7.2), 3.69 с
фосфита. Реакционную массу перемешивали без
(фуран-CH2S), 4.24 д. к (4Н, СН2О-этил, J = 7.0,
охлаждения
4-5 ч, контролируя ход процесса
JРH = 14.8), 6.60 с (1Н, Н4-фуран), 8.64 с (1Н, Н2-
методом ЯМР
31Р. После окончания реакции
фуран). Спектр ЯМР 13С, δС, м. д. (J, Гц): 13.63
бензол отгоняли, остаток выдерживали в вакууме
(СН3-бутил), 16.35 д (СН3-этил, 3JРС = 5.7), 21.88
(1 мм рт. ст.) 1 ч при комнатной температуре.
(С3-бутил), 27.85 (CH2S-бутил), 31.11 (С2-бутил),
31.59 (фуран-CH2S), 64.05 д (СН2О-этил, 2JРС = 7.0),
Диэтил-4-хлорметил-5-метил-2-фуроилфосфонат
104.61д (С4-фуран, 3JРС = 8.4), 128.12 д (С3-фуран,
(3). Выход 95%, светло-коричневое вязкое масло.
2JРС = 69.9), 152.90 д (С2-фуран, 2JРС = 3.0), 154.69
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.36 т (6Н, СН3-
(С5-фуран), 193.01 д (С=О, 1JРС = 181.4). Спектр
этил, J = 7.2), 2.44 с (3Н, СН3-фуран), 4.24 д. к (4Н,
ЯМР 31Р: δР -2.88 м. д.
СН2О-этил, J = 7.2, JРH = 14.8), 4.42 с (2Н, СН2Cl),
7.91 с (1Н, Н3-фуран). Спектр ЯМР 13С, δС, м. д. (J,
Реакция хлорметилфуроилфосфонатов 3 и 4 с
Гц): 12.44 (СН3-фуран), 16.32 д (СН3-этил, 3JРС =
тиоцианатом калия (общая методика). К
5.8), 35.95 (СН2Cl), 64.23 д (СН2О-этил, 2JРС = 6.9),
раствору 10 ммоль хлорметилфуроилфосфоната в
120.92 (С4-фуран), 127.65 уш. с (С3-фуран), 150.30
25 мл ацетонитрила прибавляли при переме-
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
250
ПЕВЗНЕР
шивании 20 ммоль тиоцианата калия и 1 ммоль
фуран),
16.31 д (СН3-этил,
3JРС
=
5.7),
44.96
иодистого калия. Реакционную массу переме-
(СН2N3), 64.24 д (СН2О-этил, 2JРС = 6.9), 118.25 (С4-
шивали 6-7 ч и оставляли на ночь. На следующий
фуран), 127.60 уш. с (С3-фуран), 150.44 д (С2-
день отфильтровывали осадок хлористого калия и
фуран, 2JРС = 90.6), 159.21 (С5-фуран), 183.97 д
промывали
5 мл ацетонитрила. Фильтрат
(С=О, 1JРС = 188.6). Спектр ЯМР 31Р: δР -2.56 м. д.
упаривали, остаток затирали в хлороформе и
Диэтил-5-тиоцианатометил-3-фуроилфосфонат
отфильтровывали неорганические соли. Фильтрат
(12). Выход 99%, светло-коричневое масло. Спектр
упаривали, остаток выдерживали в вакууме (1 мм
ЯМР 1Н, δ, м. д. (J, Гц): 1.38 т (6Н, СН3-этил, J =
рт. ст.) 1 ч при комнатной температуре.
7.0), 4.24 уш. д. к (4Н, СН2О-этил, J = 7.0, JРH =
Диэтил-4-тиоцианатометил-5-метил-2-фуроил-
15.2), 4.33 с (2Н, СН2N3), 6.78 с (1Н, Н4-фуран),
фосфонат (9). Выход 93%, светло-желтое масло.
8.70 с (1Н, Н2-фуран). Спектр ЯМР 13С, δС, м. д. (J,
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.37 т (6Н, СН3-
Гц): 16.33 д (СН3-этил, 3JРС = 5.7), 46.54 (СН2N3),
этил, J = 7.2), 2.48 с (3Н, СН3-фуран), 4.04 с (2Н,
64.19 д (СН2О-этил, 2JРС = 7.0), 108.80 д (С4-фуран,
СН2SCN), 4.25 д. к (4Н, СН2О-этил, J = 7.2, JРH =
3JРС = 8.0), 128.00 д (С3-фуран, 3JРС = 70.2), 151.51
12.8), 7.91 с (1Н, Н3-фуран). Спектр ЯМР 13С, δС,
(С5-фуран), 153.50 д (С2-фуран, 3JРС = 2.8), 193.08 д
м. д. (J, Гц): 12.56 (СН3-фуран), 16.34 д (СН3-этил,
(С=О, 1JРС = 182.8). Спектр ЯМР 31Р: δР -3.17 м. д.
3JРС = 5.7), 28.45 (СН2SCN), 64.38 д (СН2О-этил,
Реакция фуроилфосфонатов с резонансно-
2JРС = 6.9), 111.29 (CN), 117.74 (С4-фуран), 127.03
стабилизированными фосфоранами (общая
уш. с (С3-фуран), 150.59 д (С2-фуран, 2JРС = 90.6),
методика). К раствору 10 ммоль фуроилфосфоната
159.63 (С5-фуран), 184.19 д (С=О, 1JРС = 189.0).
в
25 мл бензола прибавляли
11 ммоль
Спектр ЯМР 31Р: δР --2.83 м. д.
ацетилметилен- или этоксикарбонилметилентри-
Диэтил-5-тиоцианатометил-3-фуроилфосфонат
фенилфосфорана. Полученную смесь кипятили при
(10). Выход 99%, светло-желтое масло. Спектр
перемешивании 8-9 ч (контроль ЯМР 31Р), затем
ЯМР 1Н, δ, м. д. (J, Гц): 1.39 т (6Н, СН3-этил, J =
приливали к горячей смеси
70 мл гексана,
7.2), 4.20 с (2Н, СН2SCN), 4.21-4.29 м (4Н, СН2О-
перемешивали 20 мин и оставляли на ночь. На
этил), 6.88 с (1Н, Н4-фуран), 8.73 с (1Н, Н2-фуран).
следующий день декантировали раствор с осадка
Спектр ЯМР 13С, δС, м. д. (J, Гц): 16.73 д (СН3-этил,
окиси трифенилфосфина и упаривали его. Остаток
3JРС = 5.7), 30.16 (СН2SCN), 64.27 д (СН2О-этил,
выдерживали в вакууме (1 мм рт. ст.) 1 ч при
2JРС = 6.9), 108.15 д (С4-фуран, 3JРС = 8.1), 110.77
комнатной температуре. Полученные соединения
(CN), 128.26 д (С3-фуран, 3JРС = 70.6), 149.68 (С5-
представляли собой окрашенные сиропообразные
фуран), 153.75 д (С2-фуран, 3JРС = 2.9), 192.98 д
вещества.
(С=О, 1JРС = 183.2). Спектр ЯМР 31Р: δР -3.33 м. д.
4-[4-(Хлорметил)-5-метилфур-2-ил]-4-(диэток-
Реакция хлорметилфуроилфосфонатов 3 и 4 с
сифосфорил)бут-3-ен-2-он
(13)
получали из
азидом натрия (общая методика). К раствору
фуроилфосфоната 3 и ацетилметилентрифенилфос-
10 ммоль хлорметилфуроилфосфоната в 25 мл
форана. Выход 69%. Спектр ЯМР 1Н, δ, м. д. (J, Гц):
ацетонитрила прибавляли при перемешивании
1.33 т (6Н, СН3-этил, J = 7.0), 2.30 уш. с (3Н, СН3-
20 ммоль азида натрия и 1 ммоль иодистого калия.
кетон), 2.31 с (3Н, СН3-фуран), 4.07-4.21 м (4Н,
Реакционную массу перемешивали 48 ч, затем
СН2О-этил), 4.40 с (2Н, СН2Cl), 6.78 д (1Н, =СН,
отфильтровывали осадок неорганических солей и
JРН = 24.4), 6.83 с (1Н, Н3-фуран). Спектр ЯМР 13С,
промывали его
5 мл ацетонитрила. Фильтрат
δС, м. д. (J, Гц): 11.67 (СН3-фуран), 16.29 д (СН3-
упаривали, затирали в хлороформе и отфиль-
этил, 3JРС = 6.3), 30.12 (СН3-кетон), 36.94 (СН2Cl),
тровывали осадок. Фильтрат упаривали, остаток
62.88 д (СН2О-этил, 2JРС = 5.5), 115.65 д (С3-фуран,
выдерживали в вакууме (1 мм рт. ст.) 1 ч при
3JРС = 1.1), 119.22 (С4-фуран), 123.99 д (РС=, 1JРС =
комнатной температуре.
177.9), 131.93 д (=СН, 2JРС = 2.8), 145.54 д (С2-
Диэтил-4-азидометил-5-метил-2-фуроилфосфонат
фуран, 2JРС = 21.2), 152.47 (С5-фуран), 201.78 д
(11). Выход 93%, светло-коричневое масло. Спектр
(С=О, 3JРС = 20.5). Спектр ЯМР 31Р: δР 14.66 м. д.
ЯМР 1Н, δ, м. д. (J, Гц): 1.36 т (6Н, СН3-этил, J =
7.0), 2.44 с (3Н, СН3-фуран), 4.20 с (2Н, СН2N3),
Этиловый эфир 3-[4-(хлорметил)-5-метилфур-
4.21-4.25 м (4Н, СН2О-этил), 7.88 с (1Н, Н3-фуран).
2-ил]-3-(диэтоксифосфорил)акриловой кислоты
Спектр ЯМР 13С, δС, м. д. (J, Гц): 12.50 (СН3-
(14)
получали из фуроилфосфоната
3 и
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
СИНТЕЗ И НЕКОТОРЫЕ РЕАКЦИИ 4(5)-ФУНКЦИОНАЛИЗИРОВАННЫХ
251
этоксикарбонилметилентрифенилфосфорана. Выход
бутил), 31.12 (С2-бутил), 31.35 (фуран-CH2S), 61.09
57%. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.30-1.37 м
(СН2О-эфир), 62.77 д (СН2О-фосфонат, 2JРС = 5.6),
(9Н, СН3-эфир, СН3-фосфонат), 2.30 с (3Н, СН3-
116.84 д (С3-фуран, 3JРС = 1.6), 118.96 (С4-фуран),
фуран), 4.08-4.21 м (4Н, СН2О-фосфонат), 4.27 к
126.49 д (РС=, 1JРС = 173.6), 128.52 д (=СН, 2JРС =
(2Н, СН2О-эфир, J = 7.2), 4.41 с (2Н, СН2Cl), 6.67 д
12.4), 145.02 д (С2-фуран, 2JРС = 19.9), 150.88 (С5-
(1Н, =СН, JРН = 24.0), 6.87 с (1Н, Н3-фуран). Спектр
фуран), 166.55 д (С=О, 3JРС = 26.4). Спектр ЯМР
ЯМР 13С, δС, м. д. (J, Гц): 11.77 (СН3-фуран), 14.12
31Р: δР 14.75 м. д.
(СН3-эфир),
16.29 д (СН3-фосфонат, 3JРС = 6.3),
4-[4-(Тиоцианатометил)-5-метилфур-2-ил]-4-
37.05 (СН2Cl), 61.20 (СН2О-эфир), 62.91 д (СН2О-
(диэтоксифосфорил)бут-3-ен-2-он (17) получали
фосфонат, 2JРС = 5.5), 115.95 д (С3-фуран, 3JРС =
из фуроилфосфоната
3 и ацетилметилентри-
1.6), 119.09 (С4-фуран), 126.54 д (РС=, 1JРС = 177.1),
фенилфосфорана. Выход 41%. Спектр ЯМР 1Н, δ,
128.68 д (=СН, 2JРС = 6.7), 145.50 д (С2-фуран, 2JРС =
м. д. (J, Гц): 1.34 т (6Н, СН3-этил, J = 7.0), 2.32 с
19.8), 152.12 (С5-фуран),
166.32 д (С=О, 3JРС =
(3Н, СН3-фуран), 2.34 уш. с (3Н, СН3-кетон), 4.00 с
26.2). Спектр ЯМР 31Р: δР 14.37 м. д. Спектральные
(2Н, СН2SCN), 4.08-4.20 м (4Н, СН2О-этил), 6.82 д
данные согласуются с представленными ранее в
(1Н, =СН JРН = 24.4), 6.84 с (1Н, Н3-фуран). Спектр
работе [3].
ЯМР 13С, δС, м. д. (J, Гц): 11.80 (СН3-фуран), 16.14
4-[4-(Бутилтиометил)-5-метилфур-2-ил]-4-(ди-
д (СН3-этил, 3JРС = 6.7), 29.18 (СН2SCN), 30.14 (СН3-
этоксифосфорил)бут-3-ен-2-он (15) получали из
кетон), 62.99 д (СН2О-этил, 2JРС = 5.5), 111.66 (CN),
фуроилфосфоната 7 и ацетилметилентрифенилфос-
115.14 д (С3-фуран, 3JРС = 1.0), 115.90 (С4-фуран),
форана. Выход 75%. Спектр ЯМР 1Н, δ, м. д. (J,
123.93 д (РС=, 1JРС = 176.5), 131.55 д (=СН, 2JРС =
Гц): 0.89 т (3Н, СН3-бутил, J = 7.2), 1.32 т (6Н, СН3-
2.9), 146.07 д (С2-фуран, 2JРС = 19.6), 153.18 (С5-
этил, J = 7.2), 1.37 секстет (2Н, С3Н2-бутил, J = 7.2),
фуран), 201.60 д (С=О, 3JРС = 20.7). Спектр ЯМР
1.54 квинтет (2Н, С2Н2-бутил, J = 7.2), 2.25 с (3Н,
31Р: δР 14.34 м. д.
СН3-фуран), 2.29 уш. с (3Н, СН3-кетон), 2.43 т (2Н,
CH2S, J = 7.2), 3.45 с (2Н, фуран-CH2S), 4.07-4.20 м
4-[5-(Хлорметил)фур-3-ил]-4-(диэтоксифос-
форил)бут-3-ен-2-он
(18)
получали из
(4Н, СН2О-этил), 6.64 д (1Н, =СН, JРН = 24.4), 6.79
фуроилфосфоната 4 и ацетилметилентрифенилфос-
с (1Н, Н3-фуран). Спектр ЯМР 13С, δС, м. д. (J, Гц):
11.68 (СН3-фуран), 13.65 (СН3-бутил), 16.27 д (СН3-
форана. Выход 88%. Спектр ЯМР 1Н, δ, м. д. (J,
Гц): 1.31 т (6Н, СН3-этил, J = 7.2), 2.25 уш. с (3Н,
этил, 3JРС = 6.2), 21.99 (С3-бутил), 25.92 (CH2S-
СН3-кетон), 4.12 д. к (4Н, СН2О-этил, J = 7.2, JРH =
бутил), 30.07 (СН3-кетон), 31.20 (С2-бутил), 31.36
(фуран-CH2S),
62.79 д (СН2О-этил, 2JРС = 5.4),
13.2), 4.54 с (2Н, СН2Cl), 6.57 с (1Н, Н4-фуран),
7.03 д (1Н, =СН, JРН 24.8), 7.82 с (1Н, Н2-фуран).
116.53 (С3-фуран), 119.23 (С4-фуран), 124.21 д
(РС=, 1JРС = 177.6), 131.94 д (=СН, 2JРС = 2.7),
Спектр ЯМР 13С, δС, м. д. (J, Гц): 16.29 д (СН3-этил,
145.01 д (С2-фуран, 2JРС = 21.2), 151.31 (С5-фуран),
3JРС = 6.2), 30.84 (СН3-кетон), 37.07 (СН2Cl), 62.86 д
(СН2О-этил, 2JРС = 5.8), 111.03 д (С4-фуран, 3JРС =
202.05 д (С=О, 3JРС = 20.9). Спектр ЯМР 31Р: δР
6.3), 118.78 д (С3-фуран, 2JРС = 9.7), 129.55 д (РС=,
14.99 м. д.
= 10.2), 144.73 д
1JРС = 174.2), 133.16 д (=СН, 2JРС
Этиловый эфир 3-[4-(бутилтиометил)-5-метил-
(С2-фуран, 3JРС = 9.0), 150.43 (С5-фуран), 199.82 д
фур-2-ил]-3-(диэтоксифосфорил)акриловой кислоты
(С=О, 3JРС = 21.6). Спектр ЯМР 31Р: δР 15.97 м. д.
(16) получали из фуроилфосфоната 7 и этокси-
карбонилметилентрифенилфосфорана. Выход 60%.
4-[5-(Бутилтиометил)фур-3-ил]-4-(диэтокси-
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 0.88 т (3Н, СН3-
фосфорил)бут-3-ен-2-он (19) получали из фуроил-
бутил, J = 7.2), 1.30 т (2Н, СН3-эфир, J = 7.2), 1.32 т
фосфоната 8 и ацетилметилентрифенилфосфорана.
(6Н, СН3-фосфонат, J = 7.2), 1.34-1.39 м (2Н, С3Н2-
Выход 87%. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 0.89 т
бутил), 1.53 квинтет (2Н, С2Н2-бутил, J = 7.2), 2.24
(3Н, СН3-бутил, J = 7.2), 1.31 т (6Н, СН3-этил, J =
с (3Н, СН3-фуран), 2.42 т (2Н, CH2S, J = 7.2), 3.44 с
7.2), 1.36 секстет (2Н, С3Н2-бутил, J = 7.2), 1.54
(2Н, фуран-CH2S),
4.06-4.17 м
(4Н, СН2О-
квинтет (2Н, С2Н2-бутил, J = 7.2), 2.24 уш. с (3Н,
фосфонат), 4.25 к (2Н, СН2О-эфир, J = 7.2), 6.62 д
СН3-кетон), 2.49 т (2Н, CH2S, J = 7.2), 3.36 с (2Н,
(1Н, =СН, JРН = 24.0), 6.82 с (1Н, Н3-фуран). Спектр
фуран-CH2S), 4.05-4.17 м (4Н, СН2О-этил), 6.35 с
ЯМР 13С, δС, м. д. (J, Гц): 11.78 (СН3-фуран), 13.65
(1Н, Н3-фуран), 6.99 д (1Н, =СН, JРН = 24.4), 7.73 с
(СН3-бутил),
14.12 (СН3-эфир),
16.27 д (СН3-
(1Н, Н2-фуран). Спектр ЯМР 13С, δС, м. д. (J, Гц):
фосфонат, 3JРС = 6.7), 21.99 (С3-бутил), 25.92 (CH2S-
13.64 (СН3-бутил), 16.35 д (СН3-этил, 3JРС = 6.2),
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
252
ПЕВЗНЕР
21.91 (С3-бутил), 28.09 (CH2S-бутил), 30.74 (СН3-
вывали неорганические соли и промывали их 5 мл
кетон), 31.19 (С2-бутил), 31.46 (фуран-CH2S), 62.77
ацетонитрила. Фильтрат упаривали, остаток
д (СН2О-этил, 2JРС = 5.7), 108.71 д (С4-фуран, 3JРС =
суспендировали в хлороформе, полученную смесь
6.5), 118.56 д (С3-фуран, 2JРС = 9.8), 129.83 д (РС=,
фильтровали, и отгоняли хлороформ. Остаток
1JРС = 174.4), 133.21 д (=СН, 2JРС = 9.4), 143.43 д (С2-
выдерживали в вакууме (1 мм рт. ст.) 1 ч при
фуран, 3JРС = 8.8), 152.44 (С5-фуран), 200.22 д (С=О,
комнатной температуре.
3JРС = 21.9). Спектр ЯМР 31Р: δР 16.21 м. д.
4-[4-(Азидометил)-5-метилфур-2-ил]-4-(диэток-
Этиловый эфир 3-[5-(бутилтиометил)фур-3-
сифосфорил)бут-3-ен-2-он
(22).
Выход
91%.
ил]-3-(диэтоксифосфорил)акриловой кислоты (20)
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.36 т (6Н, СН3-
получали из фуроилфосфоната 8 и этоксикарбонил-
этил, J = 7.0), 2.29 уш. с (3Н, СН3-кетон), 2.30 с
метилентрифенилфосфорана. Выход 78%. Спектр
(3Н, СН3-фуран), 4.06-4.18 м (4Н, СН2О-этил), 4.11
ЯМР 1Н, δ, м. д. (J, Гц): 0.77 т (3Н, СН3-бутил, J =
с (2Н, СН2N3), 6.80 с (1Н, Н3-фуран), 6.84 д (1Н,
7.2 Гц), 1.16 т (2Н, СН3-эфир, J = 7.2), 1.20 т (6Н,
=СН, JРН = 24.4). Спектр ЯМР 13С, δС, м. д.: 11.72
СН3-фосфонат, J = 7.2), 1.27 секстет (2Н, С3Н2-
(СН3-фуран), 16.26 д (СН3-этил, 3JРС = 6.3), 30.08
бутил, J = 7.2), 1.45 квинтет (2Н, С2Н2-бутил, J =
(СН3-кетон), 45.25 (СН2N3),
62.90 д (СН2О-этил,
7.2), 2.40 т (2Н, CH2S, J = 7.2), 3.57 с (2Н, фуран-
2JРС = 5.4), 115.58 д (С3-фуран, 3JРС = 1.1), 116.46
CH2S), 3.97-4.05 м (4Н, СН2О-фосфонат), 4.10 к
(С4-фуран), 124.05 д (РС=, 1JРС = 177.9), 131.95 д
(2Н, СН2О-эфир, J = 7.2), 6.37 с (1Н, Н3-фуран),
(=СН, 2JРС = 2.9), 145.66 д (С2-фуран, 2JРС = 21.3),
6.70 д (1Н, =СН, JРН = 24.0), 7.72 с (1Н, Н2-фуран).
152.62 (С5-фуран),
201.78 д (С=О, 3JРС = 20.5).
Спектр ЯМР 13С, δС, м. д. (J, Гц): 13.57 (СН3-
Спектр ЯМР 31Р: δР 14.61 м. д.
бутил), 13.99 (СН3-эфир), 16.21 д (СН3-фосфонат,
4-[5-(Азидометил)фур-3-ил]-4-(диэтоксифос-
3JРС
= 6.1), 21.82 (С3-бутил), 27.99 (CH2S-бутил),
форил)бут-3-ен-2-он
(23). Выход
85%. Спектр
31.12 (С2-бутил), 31.30 (фуран-CH2S), 60.91 (СН2О-
ЯМР 1Н, δ, м. д. (J, Гц): 1.32 т (6Н, СН3-этил, J =
эфир), 62.69 д (СН2О-фосфонат, 2JРС = 5.7), 108.78
7.2), 2.26 уш. с (3Н, СН3-кетон), 4.08-4.19 м (4Н,
д (С4-фуран, 3JРС = 7.4), 118.38 д (С3-фуран, 2JРС =
СН2О-этил), 4.28 с (2Н, СН2N3), 6.66 с (1Н, Н4-
9.3), 130.34 д (=СН, 2JРС = 9.9), 133.45 д (РС=, 1JРС =
фуран), 7.04 д (1Н, =СН, JРН = 24.8), 7.83 с (1Н, Н2-
172.9), 143.45 д (С2-фуран, 3JРС = 7.8), 151.88 (С5-
фуран). Спектр ЯМР 13С, δС, м. д. (J, Гц): 16.29 д
фуран), 164.97 д (С=О, 3JРС = 28.3). Спектр ЯМР
(СН3-этил, 3JРС = 6.1), 30.85 д (СН3-кетон, 4JРС =
31Р: δР 15.71 м. д.
1.1), 46.76 (СН2N3), 62.87 д (СН2О-этил, 2JРС = 5.8),
4-[5-(Тиоцианатометил)фур-3-ил]-4-(диэтокси-
110.86 д (С4-фуран, 3JРС = 6.3), 118.62 д (С3-фуран,
фосфорил)бут-3-ен-2-он
(21)
получали из
2JРС = 9.9), 129.61 д (РС=, 1JРС =174.5), 131.94 д
фуроилфосфоната 10 и ацетилметилентрифенил-
(=СН, 2JРС = 2.0), 144.63 д (С2-фуран, 3JРС = 9.1),
фосфорана. Выход 56%. Спектр ЯМР 1Н, δ, м. д.:
149.39 (С5-фуран),
199.90 д (С=О, 3JРС = 21.7).
1.33 т (6Н, СН3-этил, J = 7.2), 2.27 уш. с (3Н, СН3-
Спектр ЯМР 31Р: δР 15.94 м. д.
кетон), 4.08-4.19 м (4Н, СН2О-этил), 4.16 с (2Н,
Реакция галогенметильных производных 13,
СН2SCN), 6.65 с (1Н, Н4-фуран), 7.07 д (1Н, =СН
JРН = 24.8), 7.87 с (1Н, Н2-фуран). Спектр ЯМР 13С,
14 и 18 с морфолином (общая методика). К
раствору 10 ммоль галогенметилфурана в 30 мл
δС, м. д. (J, Гц): 16.32 д (СН3-этил, 3JРС = 5.9), 30.59
бензола прибавляли 25 ммоль морфолина. Реак-
(СН2SCN), 30.93 (СН3-кетон), 62.95 д (СН2О-этил,
2JРС = 5.8), 111.01 (CN), 112.00 д (С4-фуран, 3JРС =
ционную массу перемешивали до гомогенизации и
оставляли на 3 сут. После этого ее экстрагировали
6.4), 119.03 д (С3-фуран, 2JРС = 9.9), 129.46 д (РС=,
5%-ной соляной кислотой
(3×10 мл) и под-
1JРС = 176.5), 131.56 д (=СН, 2JРС = 3.0), 145.18 д (С2-
фуран, 3JРС = 9.2), 147.53 (С5-фуран), 199.71 д
щелачивали карбонатом натрия до рН
=
9.
Полученную смесь насыщали хлористым натрием,
(С=О, 3JРС = 21.4). Спектр ЯМР 31Р: δР 15.79 м. д.
экстрагировали хлороформом (3×15 мл) и сушили
Реакция хлорметильных производных 13 и
сульфатом натрия. Отгоняли хлороформ, остаток
18 с азидом натрия (общая методика). К раствору
выдерживали в вакууме (1 мм рт. ст.) 1 ч при
10 ммоль хлорида 13 или 18 в 25 мл ацетонитрила
комнатной температуре.
прибавляли при комнатной температуре 20 ммоль
азида натрия и
1 ммоль иодида калия. Реак-
4-[4-(N-Морфолинометил)-5-метилфур-2-ил]-
ционную массу кипятили 10 ч при интенсивном
4-(диэтоксифосфорил)бут-3-ен-2-он (24). Выход
перемешивании, затем охлаждали. Отфильтро-
73%. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.31 т (6Н,
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
СИНТЕЗ И НЕКОТОРЫЕ РЕАКЦИИ 4(5)-ФУНКЦИОНАЛИЗИРОВАННЫХ
253
СН3-этил, J = 7.0), 2.27 уш. с (3Н, СН3-кетон), 2.30
7.2), 6.60 д (1Н, =СН JРН = 24.2), 6.82 с (1Н, Н3-
с (3Н, СН3-фуран), 2.87 уш. т (4Н, NСН2-морфолин,
фуран). Спектр ЯМР 13С, δС, м. д. (J, Гц): 11.94
J = 4.8), 3.25 с (2Н, фуран-СН2N), 3.67 уш. т (4Н,
(СН3-фуран),
14.13 (СН3-эфир),
16.26 д (СН3-
ОСН2-морфолин, J = 4.8), 4.06-4.20 м (4Н, СН2О-
фосфонат, 3JРС = 6.3), 46.37 (фуран-СН2N), 53.26
этил), 6.70 д (1Н, =СН JРН = 24.8), 6.78 с (1Н, Н3-
(NСН2-морфолин),
61.10 (СН2О-эфир),
62.77 д
фуран). Спектр ЯМР 13С, δС, м. д. (J, Гц): 11.83
(СН2О-фосфонат, 2JРС = 5.4), 66.92 (ОСН2-мор-
(СН3-фуран), 16.27 д (СН3-этил, 3JРС = 6.3), 30.10
фолин), 117.43 д (С3-фуран, 3JРС = 1.4), 117.86 (С4-
(СН3-кетон),
46.12 (фуран-СН2N),
53.27 (NСН2-
фуран), 126.57 д (РС=, 1JРС = 177.1), 127.49 д (=СН,
морфолин), 62.77 д (СН2О-этил, 2JРС = 5.6), 66.91
2JРС = 6.9), 144.97 д (С2-фуран, 2JРС = 20.1), 151.84
(ОСН2-морфолин), 117.11 д (С3-фуран, 3JРС = 1.0),
(С5-фуран), 166.59 д (С=О, 3JРС = 26.4). Спектр
118.09 (С4-фуран), 124.26 д (РС=, 1JРС = 177.6),
ЯМР 31Р: δР 14.78 м. д.
132.06 д (=СН, 2JРС = 2.8), 144.97 д (С2-фуран, 2JРС =
ФОНДОВАЯ ПОДДЕРЖКА
21.4), 152.25 (С5-фуран),
202.06 д (С=О, 3JРС =
20.8). Спектр ЯМР 31Р: δР 15.02 м. д.
Работа выполнена в рамках базовой части
государственного задания Министерства образо-
4-[5-(N-Морфолинометил)фур-3-ил]-4-(диэт-
вания и науки России (№ 4.5554.2017/8.9).
оксифосфорил)бут-3-ен-2-он
(25). Выход
85%.
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.27 т (6Н, СН3-
КОНФЛИКТ ИНТЕРЕСОВ
этил, J = 7.0), 2.21уш. с (3Н, СН3-кетон), 2.43 уш. с
Авторы заявляют об отсутствии конфликта
(4Н, NСН2-морфолин), 3.48 с (2Н, фуран-СН2N),
интересов.
3.67 уш. с (4Н, ОСН2-морфолин), 4.01-4.11 м (4Н,
СН2О-этил), 6.37 с (1Н, Н4-фуран), 6.95 д (1Н, =СН,
CПИСОК ЛИТЕРАТУРЫ
JРН = 24.8), 7.73 с (1Н, Н2-фуран). Спектр ЯМР 13С,
1. Певзнер Л.М., Поняев А.И. // ЖОХ. 2019. Т. 89. Вып. 1.
δС, м. д. (J, Гц): 16.26 д (СН3-этил, 3JРС = 6.1), 30.75
С. 49. doi 10.1134/S0044460X19010086; Pevzner L.M.,
(СН3-кетон),
45.84 (фуран-СН2N),
53.16 (NСН2-
Ponyaev A.I. // Russ. J. Gen. Chem. 2019. Vol. 89. N 1.
морфолин), 62.72 д (СН2О-этил, 2JРС = 5.7), 66.75
P. 42. doi 10.1134/S1070363219010080
(ОСН2-морфолин), 110.47 д (С4-фуран, 3JРС = 6.7),
2. Вreuer E., Moshe R. // Israel J. Chem. 1986. Vol 27.
118.39 д (С3-фуран, 2JРС = 9.8), 129.92 д (РС=, 1JРС =
N 1. P. 45. doi 10.1002/ijch.198600008
3. Певзнер Л.М. // ЖОХ. 2016. Т. 86. Вып. 8. С. 1327;
173.7), 133.00 д (=СН, 2JРС = 10.1), 143.76 д (С2-
Pevzner L.M. // Russ. J. Gen. Chem. 2016. Vol. 86. N 8.
фуран, 3JРС = 8.8), 151.57 (С5-фуран), 200.08 д
P. 1864. doi 10.1134/S1070363216080156
(С=О, 3JРС = 21.8). Спектр ЯМР 31Р: δР 16.17 м. д.
4. Певзнер Л.М. // ЖОХ. 2018. Т. 88. Вып. 6. С. 943;
Этиловый эфир 3-[4-(N-морфолинометил)-5-
Pevzner L.M. // Russ. J. Gen. Chem. 2018. Vol. 88. N 6.
метилфур-2-ил]-3-(диэтоксифосфорил)акриловой
P. 1124. doi 10.1134/S1070363218060130
5. Певзнер Л.М., Поняев А.И. // ЖОХ. 2017. Т. 87.
кислоты (26). Выход 58%. Спектр ЯМР 1Н, δ, м. д.
Вып. 4. С. 609; Pevzner L.M., Ponyaev A.I. // Russ. J.
(J, Гц): 1.31 т (9Н, СН3-эфир, СН3-фосфонат, J =
Gen. Chem. 2017. Vol. 87. N 4. P. 743. doi 10.1134/
7.2), 2.27 с (3Н, СН3-фуран), 2.87 уш. т (4Н, NСН2-
S1070363217040132
морфолин, J = 4.8), 3.26 с (2Н, фуран-СН2N), 3.68
6. Мнджоян А.Л., Диванян Н.М. // Докл. АН Арм. ССР.
уш. т (4Н, ОСН2-морфолин, J = 4.8), 4.07-4.20 м
1953. Т. 17. С 164.
(4Н, СН2О-фосфонат), 4.26 к (2Н, СН2О-эфир, J =
7. Мнджоян А.Л. // Арм. хим. ж. 1969. Т. 22. С. 922.
Synthesis and Some Transformations
of 4(5)-Functionalized 2(3)-Furoylphosphonates
L. M. Pevzner*
St. Petersburg State Institute of Technology (Technical University), Moskovskii pr. 26, St. Petersburg, 190013 Russia
Received July 5, 2018; revised July 5, 2018; accepted July 13, 2018
Suitable approaches to the synthesis of wide range of phosphorylated derivatives of 3-(furyl)acrylic acid and 3-
(furyl)buten-2-one with various functionalities in the furan ring were developed.
Keywords: furoylphosphonates, chloromethylfurans, Wittig reaction, azides, thiocyanates
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019