ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 2, с. 258-264
УДК 535.37;539.19;543.42.062
СПЕКТРОФОТОМЕТРИЧЕСКОЕ ИССЛЕДОВАНИЕ
КИСЛОТНО-ОСНОВНЫХ СВОЙСТВ
СУЛЬФОПРОИЗВОДНЫХ 5,10,15,20-ТЕТРАФЕНИЛ-21-ТИА-
И 5,10,15,20-ТЕТРАФЕНИЛ-21-ОКСОПОРФИРИНОВ
В СИСТЕМЕ ЭТАНОЛ-СЕРНАЯ КИСЛОТА
© 2019 г. С. А. Сырбуa, С. Г. Пуховскаяb, *, Ю. Б. Ивановаa, А. С. Вашуринb
a Институт химии растворов имени Г. А. Крестова Российской академии наук, Иваново, Россия
b Ивановский государственный химико-технологический университет,
пр. Шереметевский 7, Иваново, 153000 Россия
Поступило в Редакцию 12 июля 2018 г.
После доработки 12 июля 2018 г.
Принято к печати 16 июля 2018 г.
Методом спектрофотометрического титрования исследованы спектральные и оснóвные свойста
гетерозамещенных порфиринов анионного типа в сравнении с их структурным аналогом
-
тетрасульфокислотой тетрафенилпорфина. Определены параметры электронных спектров поглощения и
концентрационные интервалы существования моно- и дипротонированных форм соответствующих
исследуемых лигандов, а также их константы основной диссоциации. Проведен сравнительный анализ
влияния модификации реакционного центра и состава среды на основность соединений.
Ключевые слова: порфирины, спектральные и основные свойства, макрогетероциклы, моно- и
дигетеропорфирины
DOI: 10.1134/S0044460X19020148
Среди множества макрогетероциклов порфи-
характеристики соединения, сохраняя аромати-
рины являются одним из наиболее перспективных
ческий характер молекулы. Таким образом,
классов соединений для практического исполь-
модификация порфиринового ядра приводит к
зования, что обеспечивается легкостью хими-
соединениям с очень интересными свойствами,
ческой модификации их структуры, а также
которые существенно отличаются от свойств
возможностью образования комплексов практи-
классических порфиринов.
чески со всеми металлами периодической системы
Д. И. Менделеева [1]. Порфиновый макроцикл
Моно- и дигетеропорфирины известны уже
может быть преобразован двумя основными
почти три с половиной десятилетия. За это время
путями: замещением атомов водорода в β- и мезо-
разработаны различные методики синтеза лигандов
положениях макроцикла, а также на внутрицикли-
и ряда их металлопроизводных
[3-6]. Однако
ческих атомах азота и изменением самого
бóльшая часть работ по гетероатомным
макрокольца за счет введения в него гетероатомов.
порфиринам ограничивалась синтезом лигандов и
Замена пиррольного азота другими донорными
различных металлопроизводных, исследованию их
атомами, такими как О, С, S, Sе, Tе, приводит к
структурных, спектроскопических и электро-
появлению новых макроциклических систем
-
химических свойств
[7-13]. Кислотно-основные
порфириноидов или гетерозамещенных порфи-
взаимодействия гетероатомных соединений описаны
ринов [2]. Такое замещение оказывает большое
в единичных работах, при этом больший эффект
влияние на электронную структуру макроцикла,
влияния замещения по центральным атомам
тем самым изменяя физические и химические
реакционного центра авторы наблюдали для
258
СПЕКТРОФОТОМЕТРИЧЕСКОЕ ИССЛЕДОВАНИЕ
259
дигетероатомных замещенных порфиринов
[14-
SO3H
16]. Вероятно, это объясняется искажением макро-
цикла двумя большими гетероатомами, вводимыми
в молекулу, что способствует уменьшению коль-
цевого тока в π-системе. Как и N4-порфирины,
гетеропорфирины имеют интенсивную полосу
Soret и 3-4 Q-полосы в области 700-450 нм. Замена
NH
N
азота на другой гетероатом приводит к
длинноволновым смещениям как Soret, так и полос
HO3S
SO3H
Q-диапазона. Максимальные красные сдвиги
Het
HN
наблюдались для S-, Se- и Te-содержащих
гетеропорфиринов [17, 18].
Известно, что водорастворимые порфирины и
их аналоги занимают особое место среди
огромного числа производных тетрапиррольных
соединений, поскольку обладают большим потен-
SO3H
циалом практического использования в медицине,
Het = N (1), S (2), O (3).
биологии и промышленности в качестве лекар-
ственных препаратов, катализаторов, ингибиторов
и сенсибилизаторов различных реакций [19-22]. В
достаточно хорошо в нем растворяются. Кроме
настоящей работе представлены результаты
того, при низких концентрациях использованных в
исследования спектральных и кислотно-основных
работе порфиринов
(~10-5) не наблюдались
свойств гетерозамещенных порфиринов анионного
эффекты самоассоциации
[25]. Согласно
типа в сравнении с их структурным аналогом -
литературным данным, система этанол-серная
тетрасульфокислотой тетрафенилпорфина.
кислота хорошо изучена в интервале концентраций
Порфирины (H2P) в органических раство-
кислоты от 0.01 до 11.22 моль/л [26]. Получено
рителях проявляют амфотерные свойства, а в
более полутора десятков констант ионизации для
присутствии кислот могут протонироваться по
различных производных дифениламинов, которые
внутрициклическим атомам азота. В первом
по численным значениям рKHL+ перекрывают
приближении (без участия растворителя и
интервал от -6.21 (для 4,4'-динитродифениламина)
стабилизации образующихся частиц противо-
до 1.36 (для 4-метоксидифениламина). Зависимость
lg(cHL+/cL) от Но для этих соединений представляет
ионами) процессы протонирования в частности для
порфирина
1 могут быть представлены
прямую линию с тангенсом угла наклона, равным
уравнениями (1), (2).
единице. Зависимость функции Гаммета (Но
-
функция кислотности, характеризующая протоно-
Kb1
(1)
донорную способность среды) от концентрации
H3P+
H2P + H+,
серной кислоты в системе этанол-серная кислота
Kb2
+
описывается уравнением (3).
H4P2
H3P+ + H+.
(2)
2.0482 + 0.7776c 4.3027c2
(3)
Вероятно, аналогичные уравнения должны
H=
1 + 8.7975c 0.2413c2 + 8.7975c3
характеризовать взаимодействия c протоном и
гетерозамещенных порфиринов 2 и 3.
Это позволило вычислить показатели констант
Известно, что одним из наиболее важных
основности исследованных соединений
1-3 по
факторов, влияющих на силу основания, является
формуле (4) согласно работе [26].
природа растворителя [23, 24]. В данной работе
рKHL+ = Но + lgInd,
(4)
лиганды
1-3 исследовали спектрофотометри-
где lgInd = lg(cHL+/cL) индикаторное отношение,
ческим методом в системе H2SO4-C2H5OH при
вычисленное как lg[(Аt - Аmin)/(Amax - Аt)] или
298 K. Выбор этанола в качестве среды в нашем
случае обусловлен тем, что он инертен по
lg[(Amax - Аt)/(Аt - Аmin), где Аt, Amax, Аmin - текущее,
максимальное и минимальное значения оптических
отношению к порфиринам и соединения
1-3
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
260
CЫРБУ и др.
Схема 1.
N
N
N
N
N
N
+H+
+H+
H
H
H
H
H
H
H
H
H+
H
H+
N
N
N
N
N
N
H2P
H3
P+
H4P2+
Схема 2.
NH
HN
N Het
H3P+
N
NH
NH
HN
+H+
+H+
H
H+
H+
NH Het
NH Het
N
HN
HP
H4P2+
NH Het
H3
P+
плотностей растворов порфиринов в зависимости
440, 496, 616 (соединение 2); 422, 445, 602, 706 и
от типа максимума (возрастающего или
419, 448, 598, 693 (соединение
3). Параметры
убывающего).
электронных спектров поглощения порфиринов 1-
3 и их протонированных форм приведены в
Согласно данным электронной спектроскопии
таблице.
поглощения соединений
1-3 в этаноле при
титровании раствором
серной кислоты с
Определение точек перегиба на кривых титрования
концентрацией 0.01 моль/л, во всех случаях с
позволило вычленить области концентраций
увеличением концентрации серной кислоты в ЭСП
титранта, при которых возможно существование
наблюдалось образование двух семейств
моно- и дважды-протонированных форм
спектральных кривых, каждому из которых
порфиринов
1-3. Анализ представленных в
соответствовало свое семейство изосбестических
таблице данных показал, что ЭСП свободных
точек, что свидетельствовало о двухстадийном
оснований 1 и 3 практически не отличаются друг
процессе протонирования. Первой и второй
от друга. В то же время при переходе от порфирина
ступеням протонирования соединений
1-3
1 к тиазамещенному аналогу
2 наблюдаются
соответствовали следующие семейства изосбести-
значительные батохромные сдвиги полос погло-
ческих точек (λ, нм): 426, 466, 560, 596 и 429, 452,
щения как в области полосы Соре, так и в видимой
498, 620 (соединение 1); 348, 433, 476, 549 и 393,
части ЭСП, что обусловлено замещением централь-
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
СПЕКТРОФОТОМЕТРИЧЕСКОЕ ИССЛЕДОВАНИЕ
261
Параметры электронных спектров поглощения молекулярных и ионных форм порфиринов
1-3 и значения
ступенчатых и суммарной констант протонирования pKb1,2
λ, нм (lgε)
Cоединение, форма
pKb1
pKb2
pKb1,2
полоса Cоре
λ
4
λ3
λ2
λ1
1, Н2T(4-SO3HPh)P
415
488
512
547
644
2.51
1.54
4.05
(5.40)
(4.29)
(3.70)
(3.71)
(4.25)
591
(3.95)
Н3T(4-SO3HPh)P+
416
435
489
513
647
(5.06)
(5.04)
(4.11)
(3.98)
(4.12)
Н4T(4-SO3HPh)P2+
437
488
-
-
649
(5.24)
(4.29)
(4.35)
2, НT(4-SO3HPh)SP
426
511
545
615
674
2.02
1.01
3.03
(5.26)
(4.29)
(3.97)
(3.82)
(3.85)
Н2T(4-SO3HPh)SP+
428
512
548
-
677
(5.03)
(4.04)
(3.97)
(3.90)
Н3T(4-SO3HPh)SP2+
375 пл (4.31)
459
-
696
438 пл (4.80)
(5.11)
(4.34)
307 пл (4.52)
434
505
575
2.08
1.37
3.45
3, НT(4-SO3HPh)OP
413 (4.95)
(4.81)
(3.90)
(4.05)
Н2T(4-SO3HPh)OP+
304 (4.42)
433
577
651
416 пл (4.78)
(4.95)
(3.91)
(3.74)
Н3T(4-SO3HPh)OP2+
431
-
615
651
(5.01)
(3.88)
(3.93)
ного атома азота на больший по размеру атом серы
ринов уменьшается в ряду: Н2T(4-SO3HPh)P > НT(4-
и, как следствие, внутриплоскостной деформацией
SO3HPh)OP > НT(4-SO3HPh)SP. Однако количест-
макроцикла. При протонировании ядра тетрапир-
венное снижение констант кислотной диссоциации
рольного макроцикла происходит последователь-
катионных форм исследованных лигандов, не
ное формирование моно- и дважды ионизирован-
превышает одного порядка. Можно предположить,
ных форм, что сопровождается изменением
что такие небольшие различия в основности
симметрии молекулы (схемы 1, 2) и, следователь-
соединений
1-3 связаны с нивелирующим
но, как и в случае N4-порфиринов, значительными
эффектом растворителя, а значения pKb2 и pKb1,2
спектральными изменениями (см. таблицу).
включают в себя константы равновесий взаимо-
действия протонированных форм с растворителем,
При этом, очевидно, из-за близости констант диссо-
что, по мнению авторов
[27], может оказать
циации протонированных форм [уравнения (1), (2)]
влияние на численные значения показателей
для всех трех лигандов концентрация монопрото-
основности.
нированной формы оказывается меньше по срав-
нению с концентрациями свободного основания и
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
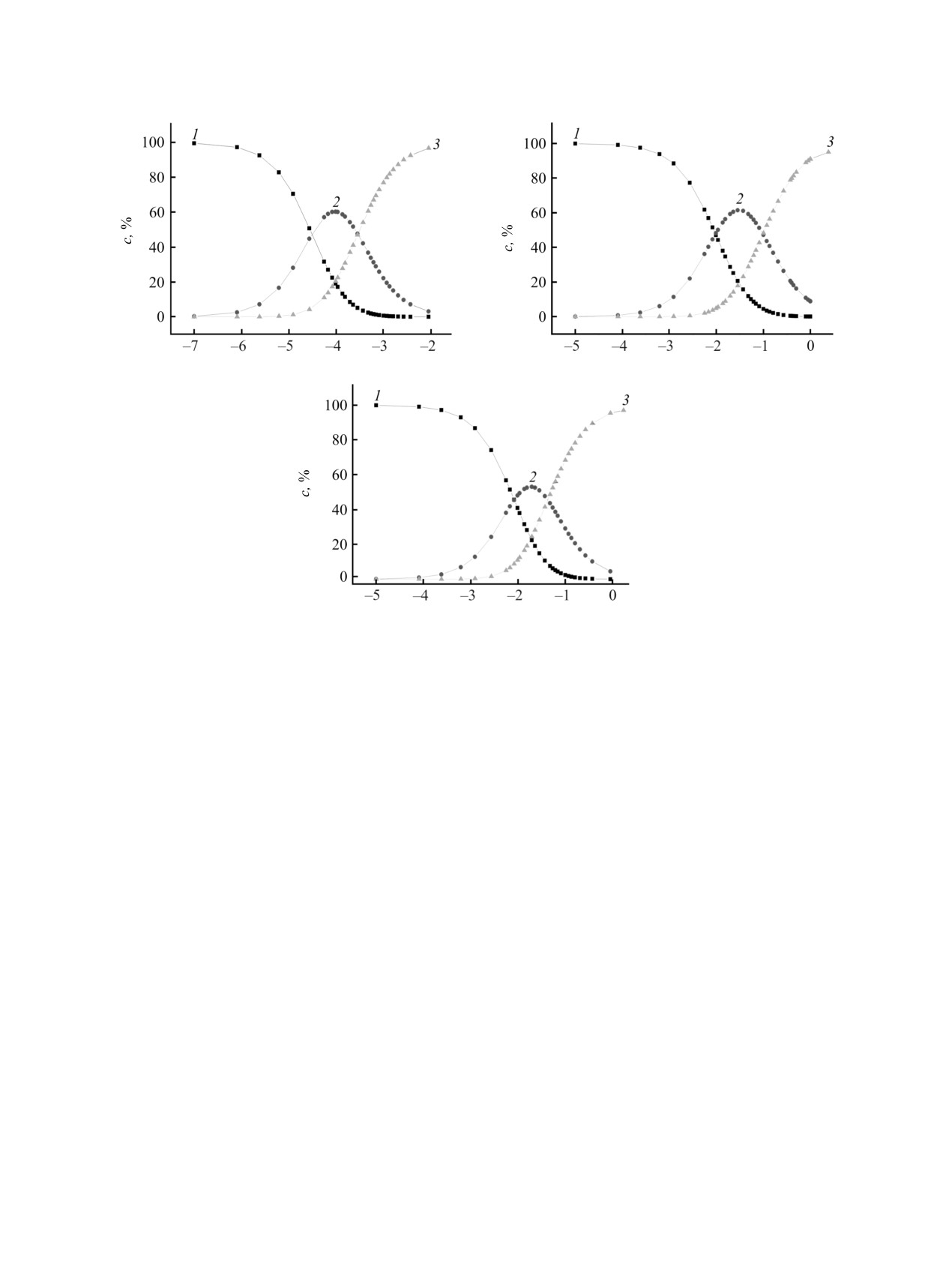
дважды протонированной формы (см. рисунок).
На основании полученных данных определено,
Электронные спектры поглощения (ЭСП)
что в системе C2H5OH-H2SO4 основность порфи-
измеряли на спектрофотометрах Shimadzu UV-1800
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
262
CЫРБУ и др.
(а)
( б)
H0
H0
(в)
H0
Распределение концентраций молекулярных (1), моно- (2) и дважды депротонированных форм (3) для порфиринов 1 (а),
2 (б) и 3 (в) в ходе титрования.
и Hitachi U-2000. Использованные в работе
СПИСОК ЛИТЕРАТУРЫ
растворители (серная кислота, этанол) очищали по
методикам
[28,
29]. Методика проведения
1. Kadish K.M., Smith K.M., Guilard R. The Porphyrin
эксперимента и обработки экспериментальных
Handbook. San Diego: Academic Press, 2000. Vol. 3.
P. 364.
данных описана работах [30, 31]. Погрешность в
2. Kadish K.M., Smith K.M., Guilard R. The Porphyrin
определении констант ионизации составляла 3-5%.
Handbook. New York: Academic Press, 2000. Vol. 2.
Использованные в работе гетеропорфирины 1-3
P. 361.
синтезированы по известным методикам [32, 33] и
3. Ambre R.,. Yu C.-Y, Mane S. B., Yao C.-F., Hung C.-H. //
идентифицированы методами электронной
Tetrahedron. 2011. Vol. 67. N 25. P. 4680. doi 10.1016/
абсорбционной, ИК, 1Н ЯМР спектроскопии.
j.tet.2011.04.034
4. Broadhurst M.J., Grigg R., Johnson A.W. // J. Chem.
Авторы выражают благодарность М.И. Разумову
Soc. (D).
1969. Vol.
24. P.
1449. doi
10.1039/
(Ивановский государственный химико-технологи-
C29690001480
ческий университет) за любезно предоставленные
5. Broadhurst M.J., Grigg R., Johnson A.W. // J. Chem.
объекты исследования.
Soc. (D). 1970. P. 807. doi 10.1039/C29700000807
6. Broadhurst M.J., Grigg R. // J. Chem. Soc. (C). 1971.
ФОНДОВАЯ ПОДДЕРЖКА
P. 3681. doi 10.1039/J3971000368.1
Работа выполнена при поддержке Российского
7. Chmielewski P.J., Latos-Grażyński L. // Inorg. Chem.
научного фонда (проект № 16-13-10453).
1998. Vol. 37. P. 4179. doi 10.1021/ic971387i
8. Sridevi B., Narayanan S.J., Srinivasan A., Chandra-
КОНФЛИКТ ИНТЕРЕСОВ
shekar T.K., Subramanian J. // J. Chem. Soc. Dalton
Авторы заявляют об отсутствии конфликта
Trans. 1998. P. 1979. doi 10.1039/A801934G
интересов.
9. Chmielewski L., Latos-Grażyński L., Olmstead M.M.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
СПЕКТРОФОТОМЕТРИЧЕСКОЕ ИССЛЕДОВАНИЕ
263
Balch A.L. // Chem. Eur. J. 1997. Vol. 3. N 2. P. 268.
21. Dickinson T.A., White J., Kauer J.S., Walt D.R. //
doi 10.1002/chem.19970030216
10. Latos-Grażyński L., Pacholska E., Chmielewski P.J.,
22. Ethirajan M., Chen Y., Joshi P., Pandey R.K. // Chem.
Olmstead M.M., Balch A.L. // Inorg. Chem.
1996.
Soc. Rev. 2011. Vol. 40. P. 340. doi 10.1039/B915149B
Vol. 35. P. 566. doi 10.1021/ic950329z
23. Andrianov V.G., Malkova O.V. // Macroheterocycles.
2009. Vol. 2. P. 130.
24. Фиалков Ю.Я. Растворитель как средство управле-
acs.chemrev.6b00496
ния химическим процессом. Л.: Химия, 1990. C. 240.
12. Lash T.D., Ferrence G.M. // Inorg. Chem. 2017. Vol. 56.
25. Кнюкшто В.Н., Старухин А.С., Крук Н.Н., Горский А.В. //
N 18. P. 11426. doi 10.1021/acs.inorgchem.7b01946
ЖПС. 2017. Т. 84. № 6. С. 877; Knyukshto V.N.,
Starukhin A.S., Kruk M.M., Gorskii A.V. // J. Appl.
Latos-Grażyński L. // Inorg. Chem. 2006. Vol. 45. N 21.
Spectr. 2018. Vol. 84. N 6. doi 10.1007/10812-018-
P. 8664. Doi 10.1021/ic061091p
0571-2
14. Tagawa K., Mori S., Okujima T., Takase M., Uno H. //
26. Dolman D., Stewart R. // Can. J. Chem. 1967. Vol. 45.
Tetrahedron.
2017. Vol.
73. P.
794. doi 10.1016/
P. 903. doi 10.1139/v67-156
j.tet.2016.12.067
27. Sheinin V.B., Shabunin S.A., Bobritskaya E.V., Agee-
15. Stilts C.E., Nelen M.I., Hilmey D.G., Davies S.R.,
va T.A., Koifman O.I. // Macroheterocycles.
2012.
Gollnick S.O., Oseroff A.R., Gibson S.L., Hiff R.,
Vol. 5. N 3. P. 252. doi 10.6060/mhc2012.120989s
Detty M.R. // J. Med. Chem. 2000. Vol. 43. P. 2403. doi
28. Вайсберг А., Проскауэр Э., Риддик Дж., Тупс Э.
10.1021/jm000044i
Органические растворители. Физические свойства и
16. Hilmey D.G., Abe M., Nelen M.I., Stilts C.E., Baker G.A.,
методы очистки. М.: ИЛ, 1958. C. 518.
Baker S.N., Bright F.V., Davies S.R., Gollnick S.O.,
29. Гордон А., Форд Р. Спутник химика. М.: Мир, 1976.
Oseroff A.R., Gibson S.L., Hilf R., Detty M.R. // J. Med.
C. 541.
Chem. 2002. Vol. 45. P. 449. doi 10.1021/jm0103662
30. Pukhovskaya S., Ivanova Yu., Nama D.T., Vashurin A.//
17. You Y., Gibson S.L., Hilf R., Davies S.R., Oseroff A.R.,
J. Porph. Phthalocyan. 2015. Vol. 19. P. 858. doi
Roy I., Ohulchanskyy T.Y., Bergey E.J., Detty M.R. //
10.1142/S1088424615500649
J. Med. Chem. 2003. Vol. 46. P. 3734. doi 10.1021/
31. Иванова Ю.Б.,Чурахина Ю.И., Мамардашвили Н.Ж. //
jm030136i
ЖОХ. 2008. Т. 78. № 4. С. 691; Ivanova Yu.B.,
18. O’Connor A.E., Gallagher W.M., Byrne A.T.
//
Photochem. Photobiol. 2009. Vol. 85. N 5. P 1053. doi
Chem. 2008. Vol. 78. N 4. P. 673. doi 10.1134/
S1070363208040269
19. Marydash B., Madhuri B. // J. Med. Chem. 2018. Vol. 61.
32. Bushy C.A., Dinello R.K., Dolphin D.A. // Can. J. Chem.
N 11. P. 5009. doi 10.1021/acs.jmedchem.8b00460
20. Cassidy C.M., Tunney M.M., McCarron P.A., Donnelly R.F. //
33. Ramasany P., Pandian P., Tavarekere K., Chandra-
J. Photochem. Photobiol. (B). 2009. Vol. 95. N 2. P. 71.
shekar K. // J. Chem. Soc. Dalton Trans. 1993. Vol. 1.
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
264
CЫРБУ и др.
Spectrophotometric Study of the Acid-Base Properties
of Sulfo Derivatives of 5,10,15,20-Tetraphenyl-21-Tia-
and 5,10,15,20-Tetraphenyl-21-oxoporphyrines
in Ethanol-Sulfuric Acid System
S. A. Syrbua, S. G. Pukhovskayab*, Yu. B. Ivanovaa, and A. S. Vashurinb
a G.A. Krestov Institute of Chemistry of Solutions of the Russian Academy of Sciences, Ivanovo, Russia
b Ivanovo State University of Chemistry and Technology, pr. Sheremetevskii 7, Ivanovo, 153000 Russia
*e-mail: svetlana.puhovskaya@mail.ru
Received July 12, 2018; revised July 12, 2018; Accepted July 16, 2018
Spectrophotometric titration method was used to study the spectral and basic properties of heterosubstituted
anionic porphyrins in comparison with their structural analogue, tetraphenylporphine tetrasulfonic acid. The
parameters of the electronic absorption spectra and the concentration ranges for the existence of mono- and
diprotonated forms of the corresponding ligands, as well as their basic dissociation constants, were determined.
A comparative analysis of the effect of modification of the reaction site and the medium composition on the
basicity of the compounds was carried out.
Keywords: porphyrins, spectral and basic properties, macroheterocycles, mono- and diheteroporphyrins
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019