ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 2, с. 271-276
УДК 544.65;541.23
РЕДОКС-ПРОЦЕССЫ С УЧАСТИЕМ ХИНОНОВ
НА ПОВЕРХНОСТИ СТЕКЛОУГЛЕРОДА,
МОДИФИЦИРОВАННОГО ПЛЕНКОЙ
ПОЛИ-3,4-ЭТИЛЕНДИОКСИТИОФЕНА
© 2019 г. С. Миаоa, Е. Г. Толстопятоваb, В. В. Кондратьевb,*
a Университет г. Хейлоуцзян, Школа химии и наук о материалах,
Проблемная лаборатория функциональных неорганических материалов, Харбин, Китай
b Санкт-Петербургский государственный университет, Институт химии,
Университетская наб. 7-9, Санкт-Петербург, 199034 Россия
*е-mail: vkondratiev@mail.ru
Поступило в Редакцию 12 июля 2018 г.
После доработки 12 июля 2018 г.
Принято к печати печати 2 августа 2018 г.
Методом циклической вольтамперометрии исследованы редокс-превращения с участием редокс-пары
хинон-гидрохинон на стеклоуглеродном электроде и стеклоуглеродном электроде, покрытом пленкой
поли-3,4-этилендиокситиофена.
Ключевые слова: редокс-пара гидрохинон-бензохинон, поли-3,4-этилендиокситиофен, циклическая
вольтамперометрия
DOI: 10.1134/S0044460X19020161
Реакции хинонов ранее были хорошо изучены
важным является поиск систем с высокой скоростью
на ртутном электроде. На полярограммах о- и п-
редокс-процессов, стабильностью редокс-превраще-
хинонов при достаточно положительных потен-
ний при длительном циклировании и отсутствием
циалах наблюдалась обратимая двухэлектронная
побочных процессов. Это определяется как
волна, соответствующая переходу хинон-гидро-
природой органического соединения, так и
хинон [1, 2]. Исследованию электрохимических
природой электролита и материала электрода.
процессов с участием хинонов на твердых и
химически модифицированных электродах уделялось
Известно, что в зависимости от природы среды
гораздо меньшее внимание [3-5]. В последние годы
и природы электрода механизмы процессов с
наметилась тенденция к возвращению интереса
участием хинонов могут заметно отличаться. Так, в
исследователей к редокс-поведению простых и
апротонных растворителях имеет место форми-
замещенных хинонов, как потенциальных компонен-
рование стабильных промежуточных частиц
тов электрохимических систем для хранения энергии.
анионной и радикальной природы, что приводит к
Они могут рассматриваться как молекулярные
взаимодействию с компонентами электролита и
компоненты для органических редокс-батарей, как
формированию ряда промежуточных продуктов и
компоненты, удерживаемые в составе полимерных
часто ведет к осложнению процессов. Кроме того,
и углеродных матриц для композитных материалов
особенностью редокс-реакций с хинонами в
энергозапасающих устройств, таких как суперкон-
апротонной среде является формирование димеров,
денсаторы или литий-ионные батареи
[6-15].
а иногда и полимеризация на электродах [6, 9, 10].
Редокс-активность хинонов и величины количества
Наличие на вольтамперограммах относительно
электричества, требуемые для редокс-превраще-
простых откликов с одной парой редокс-пиков
ний, определяются наличием характерных C=O
свидетельствует о протекании процесса через
групп в ароматическом кольце. Во всех случаях
серию промежуточных стадий. Как правило,
271
272
МИАО и др.
заметно более простые механизмы процессов
водных электролитов, где процесс восстановления
наблюдаются для перезарядки соединений с хинон-
хинонной группы включает последовательное
содержащими группами в кислых растворах
протонирование и перенос электрона [3].
O
OH
+ 2e + 2H+
(1)
O
OH
O
OH
OH
OH
(2)
+ 1e + H+
+ 1e + H+
O
O
O.
OH
В настоящей работе редокс-превращения с
обусловленные заряжением поверхности электрода
участием редокс-пары хинон-гидрохинон иссле-
и редокс-превращениями с участием возможных
дованы с помощью циклической вольтамперо-
примесей (например, растворенного кислорода).
метрии (ЦВА) на стекло-углеродном (СУ)
При введении в раствор 0.5 М. Н2SO4 гидрохинона
электроде и электроде, покрытом пленкой поли-3,4-
(0.2
M.) на вольтамперограммах стекло-
этилендиокситиофена (СУ/PEDOT). В задачу
углеродного электрода наблюдается пара хорошо
исследования входило определение условий проте-
выраженных пиков, которые сильно разделены по
кания обратимых редокс-процессов с участием
шкале потенциалов. Среднее значение формаль-
исследуемых хинонов на разных по природе
ного потенциала редокс-процесса, найденное как
электродах.
полусумма потенциалов катодного и анодного
пиков, близко к 482 мВ. Разность потенциалов
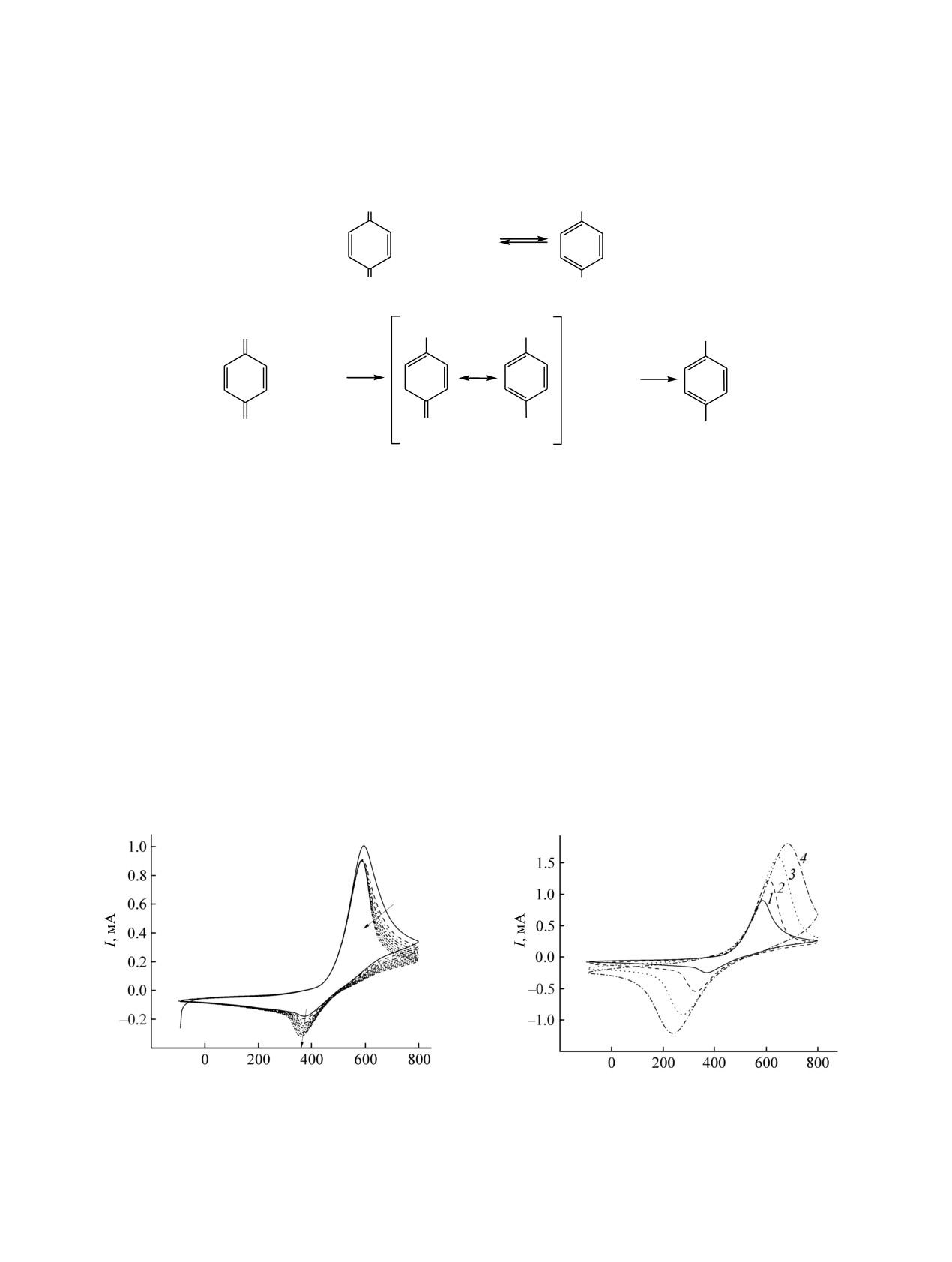
На рис. 1 и 2 приведены ЦВА для стекло-
катодного и анодного пиков (ΔЕ) при скоростях
углеродного электрода в растворе 0.5 М. H2SO4 в
развертки потенциала 10, 20, 50, 100 мВ/с (рис. 2)
присутствии гидрохинона. В отсутствие в растворе
составляла 216, 282, 370 и 442 мВ соответственно.
редокс-активных компонентов стеклоуглеродный
Большое различие в потенциалах пиков говорит о
электрод показывает низкие фоновые токи,
необратимом протекании электрохимического
E, мВ
E, мВ
Рис. 1. Циклические вольтамперограммы гидрохинона
Рис. 2. Зависимость ЦВА гидрохинона на стеклоуглерод-
на стеклоуглеродном электроде в 0.5 М. H2SO4 (v =
ном электроде в 0.5 М. H2SO4 от скорости развертки
10 мВ/с, 8 циклов развертки потенциала).
потенциала, мВ/с: 1 - 10, 2 - 20, 3 - 50, 4 - 100.
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
РЕДОКС-ПРОЦЕССЫ С УЧАСТИЕМ ХИНОНОВ
273
E, мВ
E, мВ
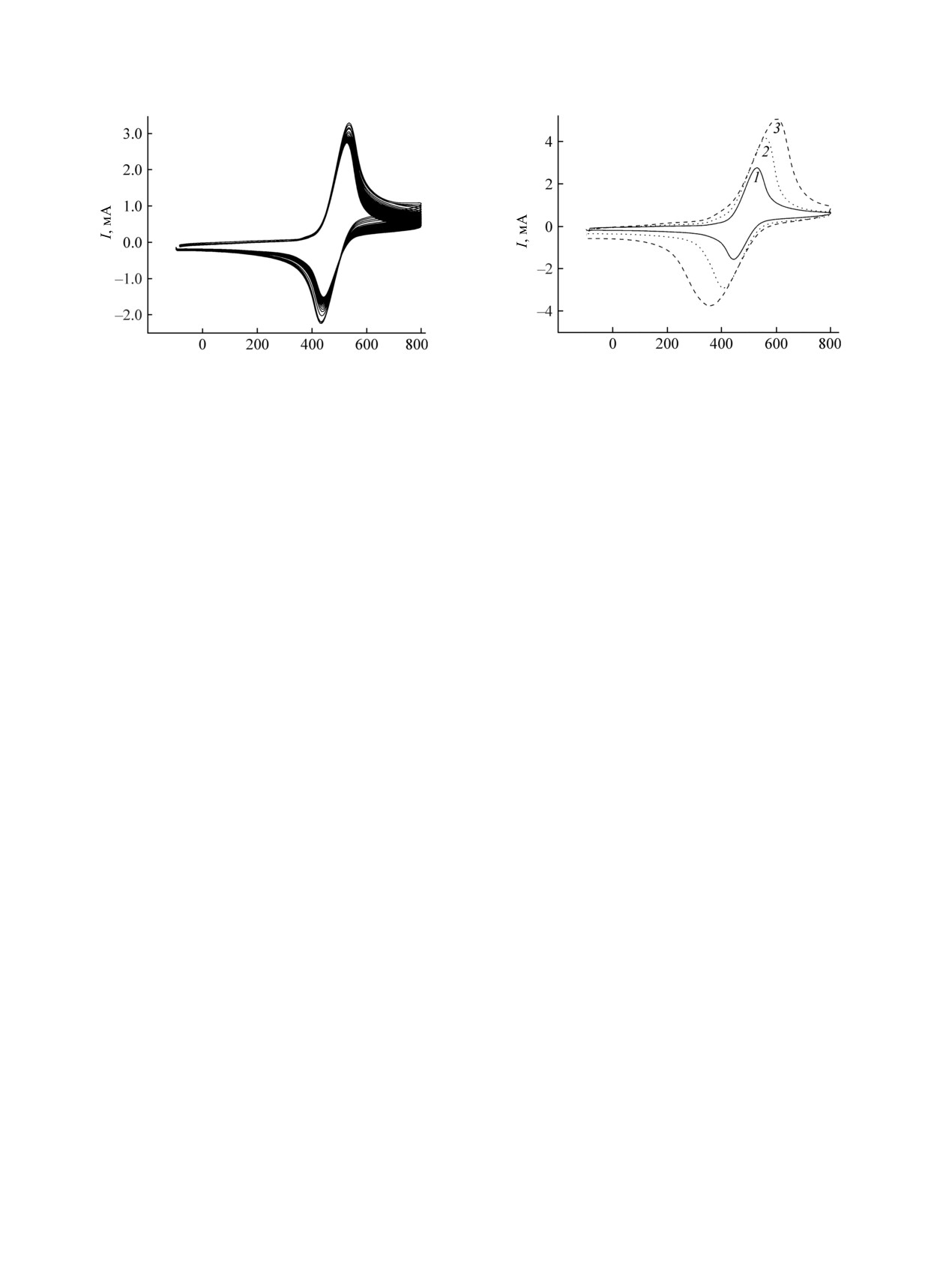
Рис. 3. Циклические вольтамперограммы гидрохинона
Рис. 4. Зависимость ЦВА гидрохинона на электроде
на электроде СУ/PEDOT в 0.5 М. H2SO4 (v = 20 мВ/с,
СУ/PEDOT в 0.5 М. H2SO4 от скорости развертки
40 циклов развертки потенциала).
потенциала, мВ/с: 1 - 10, 2 - 20, 3 - 50.
процесса. При этом имеет место двухэлектронный
работам
[1,
2], таким продуктом могут быть
процесс с участием в суммарной реакции двух
формирующиеся малорастворимые димерные и
протонов. В ходе циклического изменения потен-
олигомерные продукты окисления гидрохинона [в
циала наблюдалось изменение формы вольтам-
частности, хингидронные соединения, уравнение (2)].
перограмм от цикла к циклу: резкое уменьшение
интенсивности катодного пика, особенно при
В случае пленочного электрода СУ/PEDOT в
низких скоростях развертки потенциала.
растворе
0.5 М. Н2SO4 в присутствии
0.2 М.
гидрохинона также наблюдали одну пару хорошо
С ростом числа циклов редокс-превращений
выраженных пиков окисления-восстановления,
пары хинон-гидрохинон (рис.
1) наблюдалось
которые имели заметно меньшую разность
постепенное изменение соотношения токов
потенциалов, чем в случае стекло-углеродного
катодного и анодного пиков, увеличивался
электрода (рис. 3). Среднее значение формального
дисбаланс зарядов для прямого и обратного
потенциала редокс-процесса, найденное как
процессов. Таким образом, для стеклоуглеродного
полусумма потенциалов катодного и анодного
электрода отмечается нестабильность токов
пиков, близко к 470 мВ. При переходе от стекло-
окисления и восстановления, уменьшение заряда
углеродного электрода к СУ/PEDOT-электроду
под катодной и анодной кривыми с ростом числа
наблюдается резкое уменьшение разности
циклов. В целом, при длительном циклировании
потенциалов между катодным и анодным пиками
потенциала (до
50 циклов) у поверхности
до величины ΔЕ = 86 мВ (при v = 20 мВ/с). При
электрода в неперемешиваемом растворе наблю-
увеличении скорости развертки потенциала (рис. 4)
далось формирование облака взвешенного осадка
эта разность (ΔЕ) составляла 154 мВ (при v =
продуктов окисления гидрохинона. Замена
50 мВ/с) и 245 мВ (при v = 100 мВ/с). Это
отработанного раствора гидрохинона свежим
указывает на заметное каталитическое влияние
приводит к восстановлению соотношения катодного
поверхности проводящего полимера на скорость
и анодного пиков до начального, что свидетель-
процессов с участием гидрохинона. По-видимому,
ствует о влиянии накопления побочных продуктов
взаимодействие молекул хинона с поверхностными
реакции на редокс-превращения на электроде.
группами проводящего полимера приводит к росту
Сравнительно низкая стабильность токового
константы скорости редокс-процесса с участием
отклика на ЦВА для стеклоуглеродного электрода
хинона. Появление таких взаимодействий может
в присутствии пары хинон-гидрохинон может
приводить к стабилизации промежуточных состо-
быть результатом протекания побочных процессов,
яний продукта, образующегося на стадии реакции
ведущих к формированию промежуточных продук-
(2) на поверхности полимера и предотвращению
тов окисления, обладающих, как следует из
заметного протекания реакции димеризации.
эксперимента, достаточно низкой растворимостью,
Можно предположить, что наиболее вероятными
что приводит к появлению осадка. Согласно
являются π-π-взаимодействия между аромати-
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
274
МИАО и др.
ческими и псевдоароматическими кольцами
расходуемого на процесс количества электричества
хинонов и проводящего полимера, а также
примерно на 20%, а затем величина расходуемого
возможное формирование водородных связей
заряда стабилизируется. Снижение количества
между кислородсодержащими группами хинона и
расходуемого электричества за первые циклы
поверхностными атомами кислорода и серы
можно связать с установлением стационарного
проводящего полимера. Однако надежное прямое
режима подвода-отвода вещества к поверхности
установление характера взаимодействия, приво-
электрода в условиях неперемешиваемого
дящего к заметному росту тока, осложнено
раствора, включая массоперенос в объеме пленки.
необходимостью проведения in situ измерений на
Дальнейшая стабильность отклика указывает на
электродах в ходе протекания процессов.
хорошую обратимость редокс-процессов с
участием хинона на поверхности пленки поли-3,4-
Одновременно с уменьшением разности потен-
этилендиокистиофена.
циалов между катодным и анодным пиками
наблюдается заметное возрастание токов пиков.
Таким образом, установлено, что в растворах
Это может быть связано с ростом площади
0.5 М. Н2SO4 при переходе от стеклоуглеродного к
поверхности электрода, доступной для редокс-
СУ/PEDOT-электроду наблюдается заметное увели-
превращений молекул гидрохинона из раствора
чение обратимости процесса редокс-превращений
электролита, поскольку пленки полимера PEDOT
в паре хинон-гидрохинон. В обоих случаях имеет
характеризуются высокой пористостью. Таким
место двухэлектронный редокс-переход, степень
образом, наблюдается заметное ускорение про-
обратимости которого заметно увеличивается при
цесса переноса заряда в паре хинон-гидрохинон на
переходе от стеклоуглеродного электрода к СУ/
поверхности покрытого проводящим полимером
PEDOT-электроду. Нестабильность электрохими-
PEDOT стеклоуглеродного электрода по
ческого отклика, наблюдающегося для стекло-
сравнению с чистым стеклоуглеродным элек-
углеродного электрода в присутствии хинона,
тродом и увеличение селективности процесса
связана с процессами димеризации проме-
восстановлении хинона в сторону получения
жуточных продуктов его восстановления. В случае
конечного продукта - гидрохинона. Эти данные
СУ/PEDOT-электрода существенное увеличение
демонстрируют возможность резкого увеличения
обратимости протекания редокс-процесса с
редокс-емкости полимерной пленки в присутствии
участием хинона и стабильности электрохими-
электроактивного
компонента (хинона)
в
ческого отклика связано со стабилизацией про-
электролите.
межуточных продуктов восстановления, адсорби-
рованных на поверхности полимера. Показано, что
С ростом скорости развертки потенциала
использование электроактивного компонента
наблюдался рост токов пиков, однако он
может существенно увеличивать емкость
постепенно замедлялся, переходя от прямо
электрода, что может быть использовано при
пропорциональной зависимости тока пика к
разработке энергозапасающих материалов.
зависимости с наклоном, близким к 0.5 (рис. 4).
Такой переход указывает на переход процесса к
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
диффузионному ограничению токов, связанному с
замедленной поставкой молекул хинона к
В качестве рабочего электрода использовали
поверхности электрода. Можно предполагать, что
стеклоуглеродный дисковый электрод (СУ-2000,
формирование диффузионных слоев с измененной
S = 0.07 см2). Перед нанесением пленок поверх-
концентрацией хинона начинается в толще пленки
ность стеклоуглеродного электрода тщательно
(где процесс массопереноса в пористой структуре
полировали порошком оксида алюминия (размер
пленки более медленный) и затем происходит
частиц 1-3 мкм) и промывали деионизованной
развитие диффузионного слоя с изменяющейся
водой.
концентрацией хинона вблизи поверхности
Электрохимический синтез пленок поли-3,4-
электрода.
этилендиокситиофена проводили в гальвано-
Из зависимости относительной величины заряда
статических условиях при плотности тока 1 мА/см2.
(для анодного процесса) от числа циклов
Для синтеза пленок использовали растворы,
изменения потенциала электрода видно, что за
содержащие
0.05 М.
3,4-этилендиокситиофена
первые несколько циклов происходит снижение
(EDOT),
0.1 М. LiClO4 в ацетонитриле. Для
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
РЕДОКС-ПРОЦЕССЫ С УЧАСТИЕМ ХИНОНОВ
275
приготовления растворов использовали 3,4-этилен-
2. Hammerich O., Speiser B. Organic Electrochemistry.
диокситиофен (Aldrich), безводный перхлорат
Boca Raton: CRC Press, 2015. 1716 р.
лития (ХЧ), безводный ацетонитрил (abcr GmbH,
3. Bailey S.I., Ritchie I.M. // Electrochim. Acta
1985.
Германия).
Vol. 30. P. 3. doi 10.1016/0013-4686(85)80051-7
4. Brousse T., Cougnon C., Bélanger D. // J. Braz. Chem.
В работе использовали гидрохинон (ХЧ),
Soc.
2018. Vol.
29. P.
989. doi
10.21577/0103-
серную кислоту (ОСЧ). Растворы готовили на
5053.20180015
деионизированной воде, полученной с помощью
5. Malinauskas A., Holze R. // Ber. Bunsenges. Phys.
системы очистки Millipore Direct-Q UV (Millipore
Chem.
1996. Vol.
100. P.
1740. doi
10.1002/
Corp., США).
bbpc.19961001012
6. Pirnat K., Mali G., Gaberscek M., Dominko R. // J. Power
Электрохимические измерения проводили в
Sources.
2016. Vol.
315. P.
169. doi
10.1016/
стеклянной трехэлектродной ячейке с платиновым
j.jpowsour.2016.03.010
противоэлектродом при комнатной температуре
7. Chen H., Armand M., Demailly G., Dolhem F., Poizot P.,
(20±2°C). Измеряемые потенциалы приведены
Tarascon J.-M. // ChemSusChem 2008. Vol. 1. P. 348.
относительно хлоридсеребряного электрода в
doi 10.1002/cssc.200700161
насыщенном растворе NaCl. Вольтамперомет-
8. Genorio B., Pirnat K., Cerc-Korosec R., Dominko R.,
рические измерения проводили на потенциостате-
Gaberscek M. // Angew. Chem. Int. Ed. 2010. Vol. 49.
гальваностате GAMRY Interface
1000 (Gamry,
P. 7222. doi 10.1002/anie.201001539
США). Скорости развертки потенциала в измере-
9. Liang Y., Tao Z., Chen J. // Adv. Energy Mater. 2012.
ниях ЦВА изменялись в диапазоне 10-100 мВ/с.
Vol. 2. P. 742. doi 10.1002/aenm.201100795
10. Nokami T., Matsuo T., Inatomi Y., Hojo N., Tsukagoshi T.,
ФОНДОВАЯ ПОДДЕРЖКА
Yoshizawa H., Shimizu A., Kuramoto H., Komae K.,
Tsuyama H., Yoshida J. // J. Am. Chem. Soc. 2012.
Работа выполнена при финансовой поддержке
Vol. 134. P. 19694. doi 10.1021/ja306663g
Санкт-Петербургского государственного универ-
11. Zhou Y., Wang B., Liu C., Han N., Xu X., Zhao F., Fann J.,
ситета (грант
№ 26455158, мероприятие
3,
Lin Y. // Nano Energy. 2015.Vol. 15. P. 654. doi
«Разработка перспективных материалов для
10.1016/j.nanoen.2015.05.029
электрохимических источников тока»).
12. Harish S., Sridharan D., Senthil Kumar S., Joseph J.,
Phani K.L.N. // Electrochim. Acta. 2009. Vol.
54.
КОНФЛИКТ ИНТЕРЕСОВ
P. 3618. doi 10.1016/j.electacta.2009.01.032
13. Rębiś T., Nilsson T.Y., Inganäs O. // J. Mater. Chem.
Авторы заявляют об отсутствии конфликта
(A). 2016. Vol. 4. P. 1931. doi 10.1039/C5TA06821E
интересов.
14. Boota M., Hatzell K.B., Kumbur E.C., Gogotsi Y. //
ChemSusChem 2015. Vol. 8. P. 835. doi 10.1002/
СПИСОК ЛИТЕРАТУРЫ
cssc.201402985
15. Vonlanthen D., Lazarev P., See K.A., Wudl F., Heeger A.J. //
1. Майрановский С.Г., Страдынь Я.П., Безуглый В.Д.
Adv. Mater. 2014. Vol. 26. P. 5095. doi 10.1002/
Полярография в органической химии. Л.: Химия,
adma.201400966
1975. 352 с.
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
276
МИАО и др.
Redox Processes with Participation of Quinones
on Poly-3,4-Ethylenedioxythiophene-Modified
Glass-Carbon Surface
S. Miaoa, E. G. Tolstopyatovab, and V. V. Kondrat’evb*
a Heilongjiang University, School of Chemistry and Materials Science,
Problem Laboratory of Functional Inorganic Materials, Harbin, China
bSt. Petersburg State University, Institute of Chemistry, Universitetskaya nab. 7-9, St. Petersburg, 199034 Russia
*e-mail: vkondratiev@mail.ru
Received July 12, 2018; revised July 12, 2018; accepted August 2, 2018
Redox transformations with the participation of the quinone-hydroquinone redox pair on a glassy carbon
electrode and a glassy carbon electrode coated with a poly-3,4-ethylenedioxythiophene film were studied by
cyclic voltammetry method.
Keywords: hydroquinone-benzoquinone redox pair, poly-3,4-ethylenedioxythiophene, cyclic voltammetry
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019