ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 2, с. 301-308
УДК 547.455.522:546.59
СИНТЕЗ
4-[ω-(МЕРКАПТОАЛКИЛ)ОКСИ]БЕНЗОИЛГИДРАЗОНОВ
МОНО- И ДИСАХАРИДОВ КАК ПОТЕНЦИАЛЬНЫХ
ГЛИКОЛИГАНДОВ НАНОЧАСТИЦ БЛАГОРОДНЫХ
МЕТАЛЛОВ
© 2019 г. А. Ю. Ершовa,b, *, А. А. Мартыненковa, И. В. Лагодаc, А. В. Якиманскийa,d
a Институт высокомолекулярных соединений Российской академии наук,
Большой пр. В. О. 31, Санкт-Петербург, 199004 Россия
*е-mail: ershov305@mail.ru
b Санкт-Петербургский государственный технологический институт (технический университет),
Санкт-Петербург, Россия
c Государственный научно-исследовательский испытательный
институт военной медицины Министерства обороны РФ, Санкт-Петербург, Россия
d Санкт-Петербургский государственный университет, Санкт-Петербург, Россия
Поступило в Редакцию 9 августа 2018 г.
После доработки 9 августа 2018 г.
Принято к печати 13 августа 2018 г.
Разработан метод синтеза неизвестных ранее 4-[ω-(меркаптоалкил)окси]бензоилгидразонов альдоз (Alk =
гексил, децил; D-глюкоза, D-галактоза, D-мальтоза, D-лактоза)
- перспективных гликолигандов
наночастиц благородных металлов. Методами спектроскопии ЯМР 1Н и 13С показано, что 4-[ω-(меркап-
тоалкил)окси]бензоилгидразоны D-глюкозы, D-мальтозы и D-лактозы в кристаллическом состоянии и в
растворах в ДМСО-d6 имеют исключительно циклическое пиранозное строение, представленное α,β-
конфигурационными изомерами. 4-[ω-(Меркаптоалкил)окси]бензоилгидразоны D-галактозы находятся в
растворе в ДМСО-d6 в виде таутомерной смеси циклической пиранозной и линейной ацилгидразонной
форм.
Ключевые слова: тиолсодержащие ацилгидразоны моно- и дисахаридов, кольчато-цепная таутомерия
DOI: 10.1134/S0044460X19020203
Интерес к тиолированным углеводам обусловлен
качестве иммунохимических маркеров и биосен-
их применением в качестве лигандов в синтезе
соров [2-4], обладают бактерицидными и противо-
гликонаночастиц благородных металлов (чаще
вирусными свойствами [10].
всего Ag и Au), нашедших за последнее 10-15 лет
широкое применение в клеточной биологии и
Обычно гликонаночастицы Ag и Au получаются
биомедицине. Данные объекты, благодаря
при взаимодействии тиолсодержащих углеводов с
разветвленной сети углеводных фрагментов,
солями благородных металлов в присутствии
имитируют естественную клеточную поверхность
восстанавливающих агентов различной природы
и обладают высоким сродством к природным
[1-10]. При этом первоначально образующаяся
гликопротеиновым молекулам (лектинам), а
коллоидная частица благородного металла обвола-
наличие в их составе металлического ядра, придает
кивается гидрофильными углеводными фрагмен-
им уникальные оптические свойства
[1-9].
тами путем создания связи сера-металл
[11].
Действительно, гликонаночастицы Ag(Au) активно
Методы синтеза исходных тиолсодержащих глико-
применяются при диагностике и лечении
лигандов - многостадийные процессы, включаю-
онкологических заболеваний [1-6], используются в
щие, как правило, О-аллилирование атома углерода
301
302
ЕРШОВ и др.
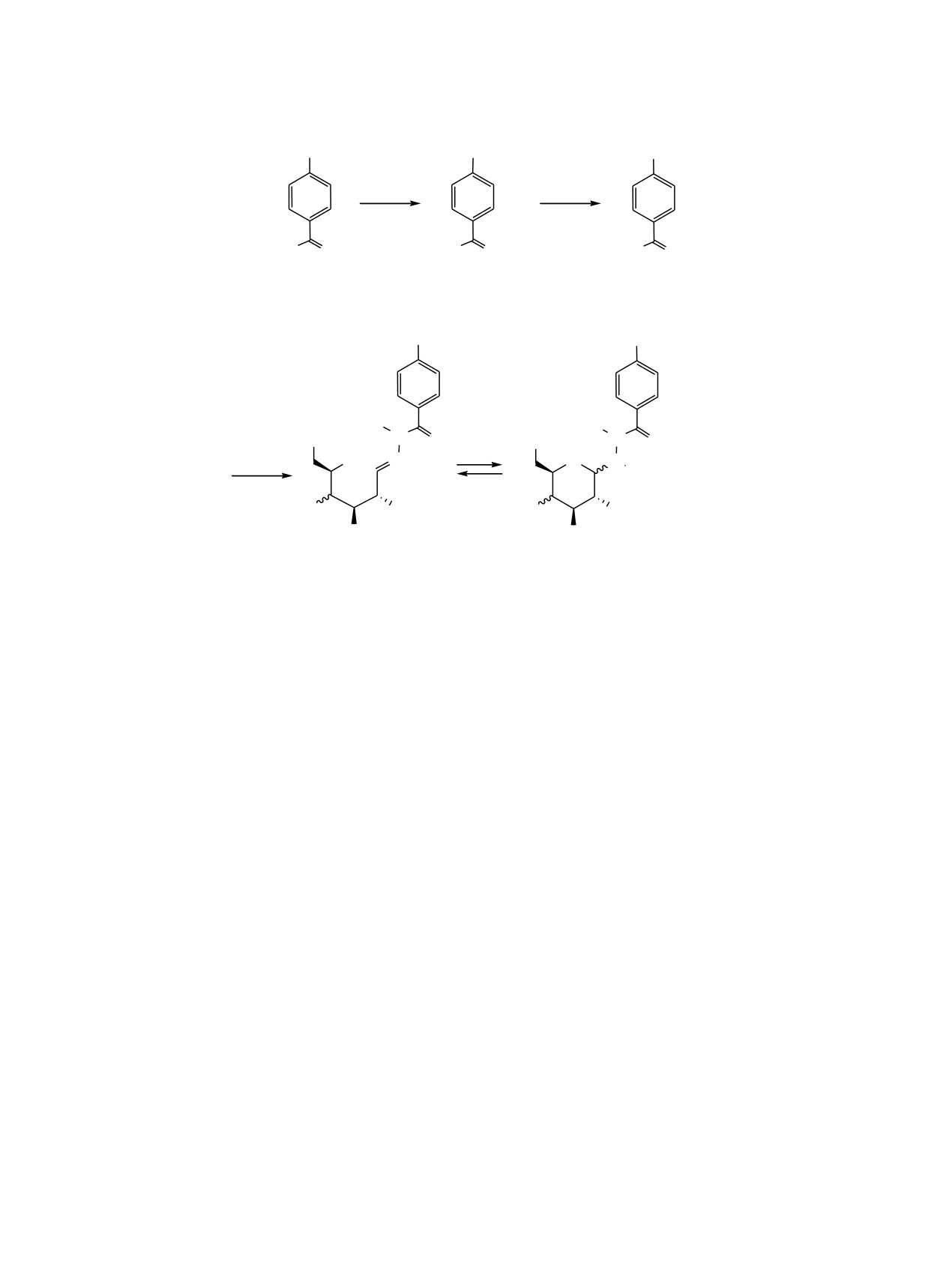
Схема 1.
O(CH2)nBr
O(CH2)nSAc
O(CH2)nSH
AcSH
NH2NH2
MeO O
MeO O
H2NHN O
1а, б
2а, б
3а, б
O(CH2)nSH
O(CH2)nSH
H
H
N
N
OH
O
OH
O
C6H11O6X
OH N
5
O 1 N
6
H
4
3
XO
OH
XO
2
OH
OH
OH
4а5г
4а5г
A
Б
1-3, n = 6 (a), 10 (б); 4а-г, n = 6; 5а-г, n = 10; Х = Н, D-глюкоза (а), D-галактоза (б), Х = С6Н11О5, D-мальтоза (в),
D-лактоза (г).
С1 в молекуле углевода и последующую реакцию
технологию синтеза тиолированных сахаров и
алкеновой гидротиолизации [12-14]. Такие методы
гликонаночастиц благородных металлов на их
требуют предварительной защиты гидро-ксильных
основе [21-25], мы изучили возможности получе-
групп углеводного фрагмента молекулы и ее
ния тиолированных гликолигандов на примере
снятие на завершающей стадии процесса.
метиловых эфиров 4-[ω-(бромалкил)окси]бензой-
ных кислот (схема 1).
Оригинальные методики синтеза гликонано-
частиц Ag и Au, не требующие предварительной
Для решения поставленной задачи нами был
защиты гидроксильных групп углеводного фраг-
разработан и осуществлен трехстадийный синтез
мента, с использованием в качестве лигандов
целевых продуктов 4а-5г, включающий замещение
тиолсодержащих гидразидов, приведены в
атома брома соединений 1а, б на S-ацетильную
работах [15-20]. Так, авторы [17] получили серию
группу, последующий гидразинолиз метиловых
гликонаночастиц Au взаимодействием природных
эфиров 2а, б, идущий с одновременным снятием S-
моносахаридов с коллоидным золотом, модифици-
ацетильной защиты и взаимодействие полученных
рованным гидразидами тиолсодержащих кислот в
4-[ω-(меркаптоалкил)окси]бензоилгидразинов 3а, б
условиях микроволнового облучения.
с серией моно- и дисахаридов (схема 1). Синтез
метиловых эфиров 4-[6-(бромгексил)окси]- и 4-[10-
Ранее нами был предложен простой метод
(бромдецил)окси]бензойных кислот 1а и 1б был
синтеза гликонаночастиц Ag и Au на основе
осуществлен по известной методике [26].
продуктов конденсации гидразидов тиогликолевой,
3-меркаптопропионовой и
2-меркаптобензойной
Взаимодействие соединений 1а, б с тиоуксусной
кислот с серией моно- и дисахаридов, а также
кислотой проходит в молярном соотношении 1:1.5
показана высокая антивирусная и антимикробная
при кипячении исходных реагентов в метаноле в
активность полученных конъюгатов
[21,
22].
течение 10-12 ч в присутствии эквивалентного (по
Развивая разработанную нами ранее гидразидную
отношению к тиоуксусной кислоте) количества
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
СИНТЕЗ 4-[ω-(МЕРКАПТОАЛКИЛ)ОКСИ]БЕНЗОИЛГИДРАЗОНОВ
303
гидрок-сида калия и приводит к образованию
сигналов наблюдается для атома С1 в спектре ЯМР
метиловых эфиров 4-[ω-(ацетилтиоалкил)окси]бен-
13С: 88.21 м. д. (α-изомер) и 91.34 м. д. (β-изомер).
зойной кислоты 2а, б с выходами 80-85%. Харак-
Аналогичная ситуация имеет место для раствора в
терным спектральным признаком соединений 2а, б
ДМСО-d6 соединения 5а - продукта конденсации
является присутствие сигнала метильной группы S-
гидразида
4-[10-(меркаптодецил)окси]бензойной
ацетильного фрагмента при 2.30 м. д. в спектрах
кислоты с D-глюкозой; при этом соотношение α,β-
ЯМР 1Н, а также слабопольного сигнала при
изомеров по сравнению с содержанием этих форм
195.32 м. д. (SС=О) в спектрах ЯМР 13С.
для соединения 4а изменяется незначительно.
Гидразиды 4-[ω-(меркаптоалкил)окси]бензойных
Переход от продуктов конденсации гидразидов
кислот 3а, б образуются после кипячения в этаноле
4-[ω-(меркаптоалкил)окси]бензойной кислоты с D-
в течение 10-12 ч соответствующих метиловых
глюкозой к производным на основе D-галактозы
эфиров 2а, б в присутствии 10-кратного избытка
(соединения 4б и 5б) приводит к появлению в их
гидразингидрата. Важно подчеркнуть, что
растворах в ДМСО-d6 кольчато-цепного тауто-
образование гидразидного фрагмента сопровожда-
мерного равновесия между пиранозной формой Б и
ется одновременным удалением S-ацетильной
линейной ацилгидразонной формой А. В
группы, что сокращает общее количество стадий и
кристаллическом состоянии и в свежеприготов-
в значительной степени упрощает синтез
ленных растворах в ДМСО-d6 соединения 4б и 5б
тиолсодержащих гидразидов.
имеют пиранозное строение Б, представленное
единственным β-изомером. Постепенно в спектрах
Завершающим этапом синтеза тиолированных
ЯМР 1Н и 13С соединений 4б и 5б начинают
сахаров 4а-5г является взаимодействие гидразидов
появляться наборы сигналов, отвечающие второму
4-[ω-(меркаптоалкил)окси]бензойных кислот 3а, б
конфигурационному изомеру, а также линейной
с серией природных моно- и дисахаридов (схема 1).
форме А. Характерными признаками формы А в
Данная реакция проходит при кипячении
спектрах ЯМР 1Н соединений 4б и 5б являются
эквимолярных количеств исходных реагентов в
сигналы азометинового протона HС=N при 7.70 м. д.
водно-спиртовом растворе в течение
5 ч и
и протона группы NHCO при 11.40 м. д., а в
приводит к образованию целевых продуктов 4а-5г
спектрах ЯМР 13С - сигналы атома углерода связи
с выходом 75-85%.
C=N при 153.39 м. д. Через 48 ч после растворения
SH-Ацилгидразоны моно- и дисахаридов 4a-5г -
в ДМСО-d6 спектры соединений 4б и 5б перес-
сложные в таутомерном плане системы, способ-
тают изменяться, что указывает на установление
ные к нахождению как в линейной гидразонной
кольчато-цепного таутомерного равновесия, в
форме А, так и в циклической пиранозной форме
котором линейной форме А (30-35%) противо-
Б. При этом также необходимо учитывать, что
стоит пиранозная форма Б, представленная двумя
форма Б способна существовать в виде двух
конформационными изомерами: α-форма (20%) и
пространственных
α,β-изомеров
вследствие
β-форма (45-50%).
мутаротации.
Выбор между возможными
таутомерными формами А и Б соединений 4а-5г
Продукты конденсации гидразидов 4-[ω-(мер-
основан на установленных нами ранее критериях и
каптоалкил)окси]бензойных кислот с дисахари-
закономерностях в спектрах ЯМР 1Н и 13С [21-25].
дами 4в, г и 5в, г вновь проявляют склонность к
нахождению в единственной циклической
В спектре ЯМР 1Н в ДМСО-d6 соединения 4а -
пиранозной форме Б, представленной в растворе в
продукта конденсации гидразида 4-[ω-(меркапто-
ДМСО-d6 двумя α,β-изомерами. Аналогичная
алкил)окси]бензойной кислоты с D-глюкозой
-
тенденция к стабилизации пиранозной формы для
наблюдается удвоение отдельных сигналов,
тиолированных ацилгидразонов дисахаридов была
обусловленное наличием α,β-конфигурационной
отмечена нами ранее при изучении строения
изомерии при аномерном атоме углерода С1
продуктов конденсации D-мальтозы и D-лактозы с
пиранозной формы Б. При этом основному
гидразидами тиогликолевой и 3-меркаптопропи-
дублетному сигналу Н1 при 3.85 м. д. с величиной
оновых кислот [23], использовавшихся нами при
КССВ 8.5 Гц следует приписать β-конфигурацию.
синтезе гликонаночастиц серебра [22] и золота [24].
Сигнал атома Н1 α-изомера, обнаруживаемый в
более слабом поле при 4.43 м. д., имеет меньшую
Поскольку для всех исследованных продуктов
величину КССВ 4.5 Гц. Обратное расположение
конденсации моно- и дисахаридов с тиолсодер-
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
304
ЕРШОВ и др.
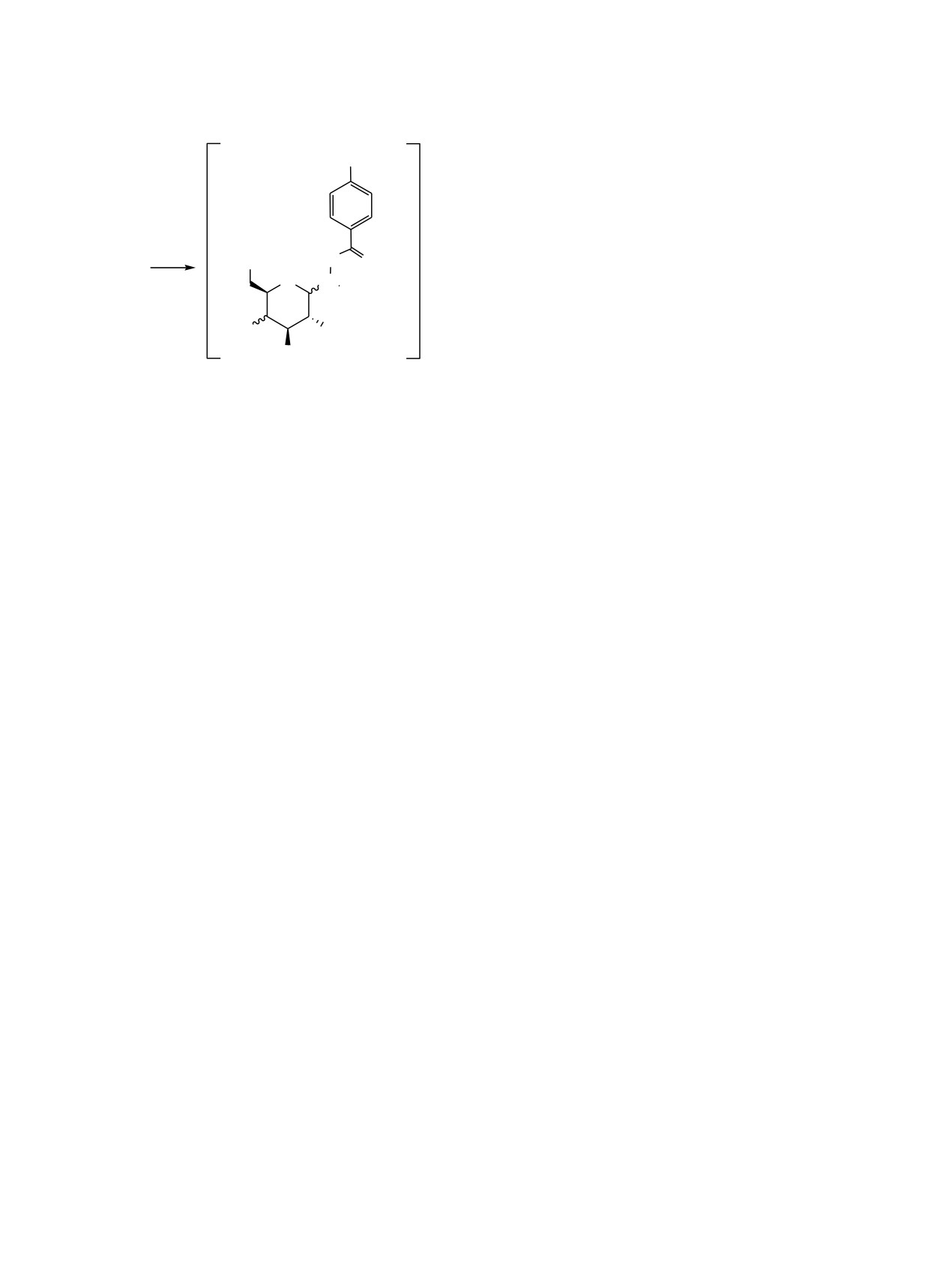
Схема 2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
S
O(CH2)n
Элементный анализ проводили на анализаторе
Hewlett-Packard
185B. Спектры ЯМР
1Н и 13С
снимали на спектрометре Bruker AV-400 при
рабочих частотах 400 и 100 МГц соответственно.
Удельное оптическое вращение определяли на
H
OH
N
O
поляриметре П-161М при длине волны
4а5г
O N
плоскополяризованного света 589 нм. Контроль за
H
протеканием реакций осуществляли методом ТСХ
на пластинках марки Silufol UV-254 в системе
XO
OH
бензол-ацетон, 4:1.
OH
2
Метиловые эфиры
4-[6-(бромгексил)окси]-
жащими гидразидами форма А наблюдалась лишь
бензойной кислоты 1а и 4-[10-(бромдецил)окси]-
для производных D-галактозы 4б и 5б и ее доля в
бензойной кислоты
1б получены по известной
растворах не превышала
35%, термин
«SH-
методике [26].
ацилгидразон» для подобных систем носит
Метиловые эфиры 4-[ω-(ацетилтиоалкил)окси]-
условный характер.
бензойной кислоты (2а, б). К раствору 0.85 г
Соединения
4а-5г оказались склонными к
(15 ммоль) KОН в 60 мл МеОН добавляли 1.15 г
окислению при длительном хранении в незащи-
(15 ммоль) AcSH, 10 ммоль соединения 1а, б и
щенных от кислорода воздуха местах с образо-
0.001 г KI. Смесь кипятили 5 ч, затем выдерживали
ванием продуктов димеризации (схема 2).
при 25°С в течение 12 ч. Растворитель удаляли при
пониженном давлении, к остатку добавляли 60 мл
Образование продуктов димеризации (около 15-
воды. Кристаллы отфильтровывали, промывали
20%) наблюдается также при съемке спектров ЯМР
водой, сушили и перекристаллизовывали из МеОН.
1Н и 13С соединений 4а-5г через 48 ч после их
растворения в ДМСО-d6. Характерными признаками
Метиловый эфир 4-[6-(ацетилтиогексил)окси]-
присутствия продуктов димеризации в спектрах
бензойной кислоты (2а). Выход 87%, т. пл. 64-67°С.
ЯМР 13С является заметное уменьшение интенсив-
Спектр ЯМР 1Н, δ, м. д.: 1.38 м (4Н, СН2), 1.52 м
ности сигнала атома углерода группы СН2SH при
(2Н, СН2), 1.71 м (2Н, СН2), 2.31 с (3Н, СН3), 2.83 т
23.85 м. д. и появление сигнала при 38.45 м. д.
(2Н, СН2S, J = 7.2 Гц), 3.80 с (3Н, СН3O), 4.02 т
(СН2SSCH2). Положение сигналов других атомов
(2Н, СН2O, J = 6.5 Гц), 7.01 д (2Н, Ar, J = 8.7 Гц),
углерода в спектрах ЯМР 13С меняется незначительно.
7.89 д (2Н, Ar, J = 8.7 Гц). Спектр ЯМР 13С, δС,
м. д.: 25.01 (СН2), 27.91 (СН2), 28.35 (СН2), 28.42
Таким образом, предложен метод синтеза
(СН2), 29.14 (СН2), 30.59 (СН3), 51.81 (СН3), 67.80
тиолированных моно- и дисахаридов - перспек-
(СН2), 114.44, 121.74, 131.27, 162.63 (Ar), 165.96
тивных лигандов для получения гликонаночастиц
(C=O), 195.32 (SC=O). Найдено, %: С 61.84; Н 7.06.
серебра и золота. Важно подчеркнуть, что
С16Н22О4S. Вычислено, %: С 61.91; Н 7.14.
разработанный метод может быть распространены
на продукты конденсации гидразидов
4-[ω-
Метиловый эфир 4-[10-(ацетилтиодецил)окси]-
(меркаптоалкил)окси]бензойных кислот с другими
бензойной кислоты (2б). Выход 84%, т. пл. 61-63°С.
природными моносахаридами; он не предполагает
Спектр ЯМР 1Н, δ, м. д.: 1.25 м (6Н, СН2), 1.29 м
предварительной защиты гидроксильных групп
(4Н, СН2), 1.39 м (2Н, СН2), 1.48 м (2Н, СН2), 1.70
исходного углевода, что в значительной степени
м (2Н, СН2), 2.30 с (3Н, СН3), 2.80 т (2Н, СН2S, J =
упрощает синтез тиолсодержащих сахаров и
7.0 Гц), 3.80 с (3Н, СН3O), 4.02 т (2Н, СН2O, J =
гликонаночастиц благородных металлов на их
6.5 Гц), 7.01 д (2Н, Ar, J = 8.5 Гц), 7.89 д (2Н, Ar,
основе. Следует однако обратить внимание на
J = 8.5 Гц). Спектр ЯМР 13С, δС, м. д.: 25.41 (СН2),
склонность
4-[ω-(меркаптоалкил)окси]бензоилгидра-
28.14 (СН2), 28.36 (СН2), 28.40 (3СН2), 28.69 (СН2),
зонов альдоз к окислению в дисульфиды и
28.80 (СН2), 29.11 (СН2), 30.53 (СН3), 51.73 (СН3),
связанной с этим необходимостью их использо-
67.86 (СН2), 114.39, 121.70, 131.21, 162.62 (Ar),
вания в качестве лигандов непосредственно после
165.91 (C=O), 195.30 (SC=O). Найдено, %: С 65.49;
получения.
Н 8.20. C20H30O4S. Вычислено, %: С 65.54; Н 8.25.
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
СИНТЕЗ 4-[ω-(МЕРКАПТОАЛКИЛ)ОКСИ]БЕНЗОИЛГИДРАЗОНОВ
305
Гидразиды
4-[(меркаптоалкил)окси]бензой-
(0.5Н, Ar, J = 8.5 Гц), 9.76 уш. с (0.25Н, NHCO);
ной кислоты (3а, б). Смесь 10 ммоль соединения
форма β-Б (75%), 1.40 м (3Н, СН2), 1.55 м (1.5Н,
2а, б и 5 г (100 ммоль) гидразингидрата в 25 мл
СН2), 1.64 м (0.5Н, СН2), 2.71 т (1.5Н, СН2S, J =
EtOH кипятили в течение
15 ч. Растворитель
7.0 Гц), 3.85 д (0.75Н, Н1, J = 8.5 Гц), 4.01 м (1.5Н,
удаляли при пониженном давлении, к остатку
СН2O), 6.97 д (1.5Н, Ar, J = 8.5 Гц), 7.83 д (1.5Н,
добавляют 20 мл воды и смесь нейтрализовали
Ar, J = 8.5 Гц), 9.87 уш. с (0.75Н, NHCO). Спектр
1 М. раствором HCl. Кристаллы отфильтровывали,
ЯМР 13С, δС, м. д.: форма α-Б, 23.87 (СН2), 25.21
сушили и перекристаллизовывали из EtOH.
(СН2), 27.61 (СН2), 28.58 (СН2), 33.45 (СН2), 61.07
(С6), 67.74 (СН2), 70.30 (С4), 71.27 (С5), 71.93 (С2),
Гидразид 4-[6-(ацетилтиогексил)окси]бензой-
73.75 (С3), 88.21 (С1), 114.14, 125.21, 129.17, 161.24
ной кислоты (3а). Выход 73%, т. пл. 89-91°С.
(Ar), 165.10 (C=O); форма β-Б, 23.87 (СН2), 25.10
Спектр ЯМР 1Н, δ, м. д.: 1.40 м (4Н, СН2), 1.55 м
(СН2), 27.61 (СН2), 28.62 (СН2), 33.45 (СН2), 61.52
(2Н, СН2), 1.63 м (2Н, СН2), 1.70 т (1Н, SН, J =
(С6), 67.74 (СН2), 70.54 (С4), 71.44 (С2), 76.81 (С3),
7.0 Гц), 2.70 т (2Н, СН2S, J = 7.0 Гц), 3.99 м (2Н,
78.09 (С5), 91.34 (С1), 114.14, 124.82, 129.38, 161.37
СН2O), 4.42 уш. с (2Н, NH2), 6.95 д (2Н, Ar, J =
(Ar), 165.99 (C=O). Найдено, %: С 52.94; Н 6.97; N
8.5 Гц), 7.77 д (2Н, Ar, J = 8.5 Гц), 9.60 уш. с (1Н,
6.58. С19Н30N2О7S. Вычислено, %: С 53.01; Н 7.02;
NHCO). Спектр ЯМР 13С, δС, м. д.: 23.86 (СН2),
N 6.51.
25.10 (СН2), 27.61 (СН2), 28.62 (СН2), 33.46 (СН2),
67.65 (СН2), 114.03, 125.43, 128.84, 161.00 (Ar),
4-[6-(Меркаптогексил)окси]бензоилгидразон
167.78 (C=O). Найдено, %: С 58.09; Н 7.60; N 10.37.
D-галактозы (4б). Выход 72%, т. пл. 181-183°С,
25
C13H20N2O2S. Вычислено, %: С 58.18; Н 7.51; N 10.44.
[α]
10.1° (c = 1.25, ДМФА). Спектр ЯМР 1Н, δ,
м. д.: форма А (30%), 1.41 м (1.2Н, СН2), 1.56 м
Гидразид 4-[10-(меркаптодецил)окси]бензой-
(0.6Н, СН2), 1.64 м (0.6Н, СН2), 2.70 м (0.6Н, СН2S),
ной кислоты (3б). Выход 92%, т. пл. 108-110°С.
4.01 м (0.6Н, СН2O), 7.01 д (0.6Н, Ar, J = 8.5 Гц),
Спектр ЯМР 1Н, δ, м. д.: 1.26 м (6Н, СН2), 1.31 м
7.77 д (0.3Н, HC=N, J = 3.5 Гц), 7.85 д (0.6Н, Ar, J =
(4Н, СН2), 1.39 м (2Н, СН2), 1.48 м (2Н, СН2), 1.60
8.5 Гц), 11.41 уш. с (0.3Н, NHCO); форма α-Б
м (СН2), 1.70 т (1Н, SН, J = 7.0 Гц), 2.67 т (2Н,
(20%), 1.41 м (0.8Н, СН2), 1.56 м (0.4Н, СН2), 1.64 м
СН2S, J = 7.0 Гц), 3.99 м (2Н, СН2O), 4.46 уш. с
(0.4Н, СН2), 2.70 т (0.4Н, СН2S, J = 7.0 Гц), 4.01 м
(2Н, NH2), 6.95 д (2Н, Ar, J = 8.5 Гц), 7.78 д (2Н, Ar,
(0.4Н, СН2O), 4.44 д (0.2Н, Н1, J = 4.0 Гц), 6.97 д
J = 8.5 Гц), 9.57 уш. с (1Н, NHCO). Спектр ЯМР
(0.4Н, Ar, J = 8.5 Гц), 7.79 д (0.4Н, Ar, J = 8.5 Гц),
13С, δС, м. д.: 23.86 (СН2), 25.56 (CH2), 27.86 (СН2),
9.80 уш. с (0.2Н, NHCO); форма β-Б (50%), 1.41 м
28.60 (СН2), 28.69 (СН2), 28.85 (СН2), 29.02 (2СН2),
(2.0Н, СН2), 1.56 м (1Н, СН2), 1.64 м (1Н, СН2), 2.70
33.50 (СН2), 67.68 (СН2), 113.97, 125.39, 128.79,
т (1Н, СН2S, J = 7.0 Гц), 3.54 д (0.5Н, Н1, J =
160.97 (Ar), 165.70 (C=O). Найдено, %: С 62.87; Н
8.5 Гц), 4.01 м (1Н, СН2O), 6.97 д (1Н, Ar, J =
8.77; N 8.57. C17H28N2O2S. Вычислено, %: С 62.93;
8.5 Гц), 7.85 д (1Н, Ar, J = 8.5 Гц), 9.93 уш. с (0.5Н,
Н 8.70; N 8.63.
NHCO). Спектр ЯМР 13С, δС, м. д.: форма А, 23.85
Синтез 4-[6-(меркаптогексил)окси]- и 4-[10-
(СН2), 25.20 (СН2), 27.58 (СН2), 28.58 (СН2), 33.43
(меркаптодецил)окси]бензоилгидразонов
D-
(СН2), 63.23 (С6), 67.72 (СН2), 68.38 (С4), 68.66 (С2),
глюкозы, D-галактозы, D-мальтозы и D-лактозы
69.95 (С3), 73.61 (С5), 114.16, 125.40, 129.59 (Ar),
(4a-г, 5а-г). Раствор 5 ммоль соединения 3а или 3б
153.39 (С=N), 161.04 (Ar), 162.62 (C=O); форма
и 5 ммоль соответствующего моно- или дисахарида
α-Б, 23.85 (СН2), 25.08 (СН2), 27.58 (СН2), 28.61
в 10 мл смеси EtOH-H2O (9:1) кипятили в течение
(СН2), 33.43 (СН2), 60.69 (С6), 67.72 (СН2), 68.93
3 ч. После охлаждения белые кристаллы
(С2), 70.03 (С3), 70.85 (С4), 72.48 (С5), 88.56 (С1),
отфильтровывали, сушили в вакууме и хранили в
114.08, 125.22, 129.14, 161.20 (Ar), 165.02 (C=O);
эксикаторе над Р2О5.
форма β-Б, 23.85 (СН2), 25.08 (СН2), 27.58 (СН2),
28.61 (СН2), 33.43 (СН2), 60.59 (С6), 67.72 (СН2),
4-[6-(Меркаптогексил)окси]бензоилгидразон
69.28 (С4), 70.46 (С2), 73.63 (С3), 76.65 (С5), 92.15
D-глюкозы (4а). Выход 68%, т. пл. 148-150°С,
25
(С1), 114.08, 124.84, 129.38, 161.32 (Ar),
165.97
[α]
10.5° (c = 1.25, ДМФА). Спектр ЯМР 1Н, δ,
(C=O). Найдено,
%: С
53.07; Н
6.95; N
6.47.
м. д.: форма α-Б (25%), 1.40 м (1Н, СН2), 1.55 м
С19Н30N2О7S. Вычислено, %: С 53.01; Н 7.02; N 6.51.
(0.5Н, СН2), 1.64 м (0.5Н, СН2), 2.71 т (0.5Н, СН2S,
J = 7.0 Гц), 4.01 м (0.5Н, СН2O), 4.43 д (0.25Н, Н1,
4-[6-(Меркаптогексил)окси]бензоилгидразон
J = 4.5 Гц), 6.97 д (0.5Н, Ar, J = 8.5 Гц), 7.78 д
D-мальтозы (4в). Выход 65%, т. пл. 159-161°С,
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
306
ЕРШОВ и др.
25
[α]
28.3° (c = 1.25, ДМФА). Спектр ЯМР 1Н, δ,
4-[10-(Меркаптодецил)окси]бензоилгидразон
м. д.: форма α-Б (25%), 1.40 м (1Н, СН2), 1.63 м
D-глюкозы (5а). Выход 84%, т. пл. 124-126°С,
25
(0.5Н, СН2), 1.70 м (0.5Н, СН2), 2.69 т (0.5Н, СН2S,
[α]
25.3° (c = 1.25, ДМФА). Спектр ЯМР 1Н, δ,
J = 7.0 Гц), 3.99 м (0.5Н, СН2O), 4.45 д (0.25Н, Н1,
м. д.: форма α-Б (20%), 1.26 м (1.2Н, СН2), 1.31 м
J =4.5 Гц), 5.42 д (0.50Н, Н1', J = 3.5 Гц), 6.94 д (1Н,
(0.8Н, СН2), 1.39 м (0.4Н, СН2), 1.55 м (0.4Н, СН2),
Ar, J = 8.5 Гц), 7.78 д (1Н, Ar, J = 8.5 Гц), 9.77 уш. с
1.70 м (0.4Н, СН2), 2.68 т (0.4Н, СН2S, J = 7.0 Гц),
(0.25Н, NHCO); форма β-Б (75%), 1.40 м (3Н, СН2),
4.01 м (0.4Н, СН2O), 4.43 д (0.2Н, Н1, J = 7.5 Гц),
1.63 м (1.5Н, СН2), 1.70 м (0.5Н, СН2), 2.69 т (1.5Н,
6.96 д (0.4Н, Ar, J = 8.0 Гц), 7.78 д (0.4Н, Ar, J =
СН2S, J = 7.0 Гц), 3.90 д (0.75Н, Н1, J = 8.5 Гц), 3.99
8.0 Гц), 9.76 уш. с (0.2Н, NHCO); форма β-Б (80%),
м (1.5Н, СН2O), 5.42 д (0.50Н, Н1', J = 3.5 Гц), 6.97 д
1.26 м (4.8Н, СН2), 1.31 м (3.2Н, СН2), 1.39 м (1.6Н,
(1.5Н, Ar, J = 8.5 Гц), 7.82 д (1.5Н, Ar, J = 8.5 Гц),
СН2), 1.55 м (1.6Н, СН2), 1.70 м (1.6Н, СН2), 2.68 т
9.89 уш. с (0.75Н, NHCO). Спектр ЯМР 13С, δС,
(1.6Н, СН2S, J = 7.0 Гц), 3.85 д (0.8Н, Н1, J =
м. д.: форма α-Б, 23.87 (СН2), 25.09 (СН2), 27.60
7.5 Гц), 4.01 м (1.6Н, СН2O), 6.96 д (1.6Н, Ar, J =
(СН2), 28.62 (СН2), 33.45 (СН2), 61.02 (C6, С6'), 67.67
8.0 Гц), 7.82 д (1.6Н, Ar, J = 8.0 Гц), 9.86 уш. с
(СН2), 70.32 (C4'), 70.92 (C2'), 72.04 (C3'), 73.48 (C5,
(0.8Н, NHCO). Спектр ЯМР 13С, δС, м. д.: форма α-
C5'), 73.71 (C2), 76.58 (C3), 80.04 (C4), 87.79 (C1),
Б, 23.83 (СН2), 25.53 (СН2), 27.80 (СН2),
28.62
100.94 (C1'), 116.16, 125.43, 129.38, 161.03 (Ar),
(2СН2), 28.81 (СН2),
28.98
(2СН2), 33.45 (СН2),
165.81 (C=O); форма β-Б, 23.87 (СН2), 25.21 (СН2),
61.35 (С6), 67.91 (СН2), 70.75 (С4), 71.48 (С5), 72.49
27.60 (СН2), 28.62 (СН2), 33.45 (СН2), 61.02 (C6, С6'),
(С2), 73.69 (С3), 88.13 (С1), 114.42, 124.01, 129.06,
67.67 (СН2), 70.09 (C4'), 70.92 (C2'), 72.61 (C3'), 73.45
161.18 (Ar), 165.02 (C=O); форма β-Б, 23.83 (СН2),
(C5, C5'), 73.36 (C2), 76.53 (C3), 80.22 (C4), 91.28 (C1),
25.53 (СН2), 27.80 (СН2), 28.62 (2СН2), 28.81 (СН2),
100.10 (C1'), 116.16, 124.80, 128.87, 161.39 (Ar),
28.98 (2СН2), 33.45 (СН2), 61.49 (С6), 67.49 (СН2),
166.00 (C=O). Найдено, %: С 50.59; Н 6.96; N 6.47.
70.52 (С4), 71.41 (С2), 76.79 (С3), 78.02 (С5), 91.31
С25Н40N2О12S. Вычислено, %: С 50.66; Н 7.02; N 6.51.
(С1), 114.04, 124.01, 129.27, 161.31 (Ar),
165.86
(C=O). Найдено, %: С 56.70; Н 7.94; N 5.69.
4-[6-(Меркаптогексил)окси]бензоилгидразон
25
C23H38N2O7S. Вычислено, %: С 56.77; Н 7.87; N 5.76.
D-лактозы (4г). Выход 74%, т. пл. 172-175°С, [α]
16.8° (c = 1.25, ДМФА). Спектр ЯМР 1Н, δ, м. д.:
4-[10-(Меркаптодецил)окси]бензоилгидразон
форма α-Б (25%), 1.37 м (1Н, СН2), 1.60 м (0.5Н,
D-галактозы (5б). Выход 72%, т. пл. 164-166°С,
25
СН2), 1.68 м (0.5Н, СН2), 2.66 т (0.5Н, СН2S, J =
[α]
11.7° (c = 1.25, ДМФА). Спектр ЯМР 1Н, δ,
7.0 Гц), 3.97 м (0.5Н, СН2O), 4.43 д (0.25Н, Н1, J =
м. д.: форма А (35%), 1.27 м (2.1Н, СН2), 1.31 м
4.5 Гц), 5.62 д (0.25Н, Н1', J = 3.5 Гц), 6.96 д (0.5Н,
(1.4Н, СН2), 1.40 м (0.7Н, СН2), 1.57 м (0.7Н, СН2),
Ar, J = 8.5 Гц), 7.81 д (0.5Н, Ar, J = 8.5 Гц), 9.87 уш.
1.71 м (0.7Н, СН2), 2.68 м (0.7Н, СН2S), 4.01 м
с (0.25Н, NHCO); форма β-Б (75%), 1.37 м (3Н,
(0.7Н, СН2O), 6.98 д (0.7Н, Ar, J = 8.5 Гц), 7.79 д
СН2), 1.60 м (1.5Н, СН2), 1.68 м (1.5Н, СН2), 2.66 т
(0.35Н, HC=N, J = 3.5 Гц), 7.89 д (0.6Н, Ar, J =
(1.5Н, СН2S, J = 7.0 Гц), 3.97 м (1.5Н, СН2O), 3.75 д
8.5 Гц), 11.38 уш. с (0.35Н, NHCO); форма α-Б
(0.75Н, Н1, J = 8.5 Гц), 3.97 м (1.5Н, СН2O), 5.62 д
(20%), 1.27 м (1.2Н, СН2), 1.31 м (0.8Н, СН2), 1.40 м
(0.75Н, Н1', J = 3.5 Гц), 6.96 д (1.5Н, Ar, J = 8.5 Гц),
(0.4Н, СН2), 1.57 м (0.4Н, СН2), 1.71 м (0.4Н, СН2),
7.81 д (1.5Н, Ar, J = 8.5 Гц), 9.91 уш. с (0.75Н,
2.68 т (0.4Н, СН2S, J = 7.0 Гц), 4.01 м (0.4Н, СН2O),
NHCO). Спектр ЯМР 13С, δС, м. д.: форма α-Б,
4.92 д (0.2Н, Н1, J = 4.0 Гц), 6.97 д (0.4Н, Ar, J =
23.93 (СН2), 25.44 (СН2), 27.64 (СН2), 28.66 (СН2),
8.5 Гц), 7.79 д (0.4Н, Ar, J = 8.5 Гц), 9.82 уш. с
33.48 (СН2), 60.95 (C6, С6'), 67.79 (СН2), 68.32 (C4'),
(0.20Н, NHCO); форма β-Б (45%), 1.27 м (2.7Н,
70.78 (C2'), 71.33 (C3'), 73.45 (C5, C5'), 75.05 (C2),
СН2), 1.31 м (1.8Н, СН2), 1.40 м (0.9Н, СН2), 1.57 м
75.71 (C3), 80.98 (C4), 88.07 (C1), 104.01 (C1'), 114.22,
(0.9Н, СН2), 1.71 м (0.9Н, СН2), 2.68 т (0.9Н, СН2S,
125.21, 129.28, 161.34 (Ar), 165.31 (C=O); форма β-
J = 7.0 Гц), 3.55 д (0.45Н, Н1, J = 8.0 Гц), 4.01 м
Б, 23.93 (СН2), 25.26 (СН2), 27.64 (СН2),
28.66
(0.9Н, СН2O), 6.97 д (0.9Н, Ar, J = 8.5 Гц), 7.83 д
(СН2), 33.48 (СН2), 60.59 (C6, С6'), 67.79 (СН2), 68.32
(0.9Н, Ar, J = 8.5 Гц), 9.89 уш. с (0.45Н, NHCO).
(C4'), 70.78 (C2'), 71.33 (C3'), 73.45 (C5, C5'), 75.05
Спектр ЯМР 13С, δС, м. д.: форма А, 23.82 (СН2),
(C2), 75.71 (C3), 81.01 (C4), 91.14 (C1), 104.01 (C1'),
25.52 (СН2), 27.80 (СН2), 28.53 (СН2), 28.63 (2СН2),
114.82, 124.82, 129.28, 161.44 (Ar), 166.05 (C=O).
28.79 (СН2), 28.98 (СН2), 33.44 (СН2), 63.18 (С6),
Найдено, %: С 50.70; Н 7.09; N 6.58. С25Н40N2О12S.
67.74 (СН2), 68.34 (С4), 68.63 (С2), 69.99 (С3), 72.41
Вычислено, %: С 50.66; Н 7.02; N 6.51.
(С5), 114.44, 125.37, 129.49 (Ar),
153.25 (С=N),
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
СИНТЕЗ 4-[ω-(МЕРКАПТОАЛКИЛ)ОКСИ]БЕНЗОИЛГИДРАЗОНОВ
307
161.12 (Ar), 162.65 (C=O); форма α-Б, 23.82 (СН2),
NHCO); форма β-Б (75%), 1.26 м (4.5Н, СН2), 1.31
25.52 (СН2), 27.80 (СН2), 28.53 (СН2), 28.63 (2СН2),
м (3Н, СН2), 1.39 м (1.5Н, СН2), 1.51 м (1.5Н, СН2),
28.79 (СН2), 28.98 (СН2), 33.44 (СН2), 60.63 (С6),
1.70 м (1.5Н, СН2), 2.67 т (1.5Н, СН2S, J = 7.0 Гц),
67.74 (СН2), 68.87 (С2), 70.85 (С3), 70.84 (С4), 72.16
4.00 м (1.5Н, СН2O), 3.63 д (0.75Н, Н1, J = 4.5 Гц),
(С5), 88.49 (С1), 114.05, 125.19, 129.05, 161.40 (Ar),
5.62 д (0.75Н, Н1', J = 3.5 Гц), 6.96 д (1.5Н, Ar, J =
164.90 (C=O); форма β-Б, 23.82 (СН2), 25.52 (СН2),
8.5 Гц), 7.82 д (1.5Н, Ar, J = 8.5 Гц), 9.78 уш. с
27.80 (СН2), 28.53 (СН2), 28.63 (2СН2), 28.79 (СН2),
(0.75Н, NHCO). Спектр ЯМР 13С, δС, м. д.: форма α-
28.98 (СН2), 33.44 (СН2), 60.53 (С6), 67.74 (СН2),
Б, 23.87 (СН2), 25.52 (СН2), 27.83 (СН2), 28.58 (СН2),
69.93 (С4), 72.44 (С2), 73.61 (С3), 76.60 (С5), 92.11
28.65 (2СН2), 28.82 (СН2), 33.47 (СН2), 60.79 (С6),
(С1), 113.99, 124.81, 131.25, 161.26 (Ar),
165.86
67.83 (СН2), 70.66 (С4), 71.03 (С5), 71.33 (С2), 73.65
(C=O). Найдено, %: С 56.83; Н 7.94; N 5.81.
(С3), 81.06 (C4), 87.81 (С1), 103.92 (C1'), 114.17,
C23H38N2O7S. Вычислено, %: С 56.77; Н 7.87; N 5.76.
125.26, 129.17, 161.23 (Ar), 166.02 (C=O); форма β-
Б, 23.87 (СН2), 25.55 (СН2), 27.83 (СН2), 28.58 (СН2),
4-[10-(Меркаптодецил)окси]бензоилгидразон
28.65 (2СН2), 28.82 (СН2), 33.47 (СН2), 60.54 (C6,
D-мальтозы (5в). Выход 72%, т. пл. 179-182°С,
25
С6'), 67.79 (СН2), 68.28 (C4'), 69.91 (C2'), 70.76 (C3'),
[α]
34.8° (c = 1.25, ДМФА). Спектр ЯМР 1Н, δ,
73.37 (C5, C5'), 74.97 (C2), 75.60 (C3), 81.41 (C4),
м. д.: форма α-Б (25%), 1.26 м (1Н, СН2), 1.31 м
92.16 (C1), 103.92 (C1'), 114.04, 124.78, 128.82, 161.36
(0.5Н, СН2), 1.39 м (0.5Н, СН2), 1.55 м (0.5Н, СН2),
(Ar), 165.87 (C=O). Найдено, %: С 53.61; Н 7.39; N 4.28.
1.69 м (0.5Н, СН2), 2.67 т (0.5Н, СН2S, J = 7.0 Гц),
C29H48N2O12S. Вычислено, %: C 53.69; H 7.46; N 4.32.
3.99 м (0.5Н, СН2O), 4.45 д (0.25Н, Н1, J = 4.0 Гц),
5.60 д (0.25Н, Н1', J = 3.5 Гц), 6.95 д (0.5Н, Ar, J =
КОНФЛИКТ ИНТЕРЕСОВ
8.5 Гц), 7.82 д (0.5Н, Ar, J = 8.5 Гц), 9.74 уш. с
Авторы заявляют об отсутствии конфликта
(0.25Н, NHCO); форма β-Б (75%), 1.26 м (3Н, СН2),
интересов.
1.31 м (1.5Н, СН2), 1.39 м (1.5Н, СН2), 1.55 м (1.5Н,
СН2), 1.69 м (1.5Н, СН2), 2.67 т (1.5Н, СН2S, J =
СПИСОК ЛИТЕРАТУРЫ
7.0 Гц), 3.89 д (0.75Н, Н1, J = 7.0 Гц), 3.99 м (1.5Н,
1. Engineered carbohydrate-based materials for biomedical
СН2O), 3.99 м (1.5Н, СН2O), 5.60 д (0.75Н, Н1', J =
applications:
polymers,
surfaces,
dendrimers,
7.5 Гц), 6.95 д (1.5Н, Ar, J = 8.5 Гц), 7.78 д (1.5Н,
nanoparticles, and hydrogels / Ed. R. Narain. New
Ar, J = 8.5 Гц), 9.87 уш. с (0.75Н, NHCO). Спектр
2011.
424 p. doi
ЯМР 13С, δС, м. д.: форма α-Б, 23.89 (СН2), 25.58
10.1002/9780470944349.ch6
(СН2), 27.85 (СН2), 28.66 (2СН2), 28.87 (СН2), 29.03
Eds S.-C. Hung, M.M.L. Zulueta. Hoboken: John
(2СН2), 33.49 (СН2), 60.86 (C6, С6'), 67.80 (СН2),
Wiley & Sons, Inc., 2016. 576 p. doi 10.1002/978111
70.11 (C2'), 71.57 (C3'), 73.51 (C5, C5'), 74.49 (C2),
9006435.ch16
75.20 (C3), 80.01 (C4), 87.75 (C1), 101.05 (C1'),
3. Carbohydrate nanotechnology / Ed. K.J. Stine. New
114.01, 124.79, 129.09, 161.26 (Ar), 165.78 (C=O);
Jersey: John Wiley & Sons,
2016.
470 p. doi
форма β-Б, 23.89 (СН2), 25.58 (СН2), 27.85 (СН2),
10.1002/9781118860212.ch3
28.66
(2СН2), 28.87 (СН2),
29.03
(2СН2),
33.49
4. Nanobiomaterials in cancer therapy: applications of
(СН2), 61.03 (C6, С6'), 67.80 (СН2), 70.11 (C4'), 71.05
nanobiomaterials
/ Ed. A. Grumezescu. Oxford:
(C2'), 72.60 (C3'), 73.42 (C5, C5'), 73.51 (C2), 76.52
Elsevier Science Publishing Co Inc., 2016. 588 p. doi
(C3), 80.16 (C4), 91.27 (C1), 101.05 (C1'), 114.01,
10.1016 /B978-0-323-42863-7.00002-5
5. Федотчева Т.А., Оленин А.Ю., Старостин К.М.,
124.79, 128.83, 161.36 (Ar), 165.95 (C=O). Найдено,
Лисичкин Г.В., Банин В.В., Шимановский Н.Л. //
%: С 53.75; Н 7.52; N 4.26. C29H48N2O12S. Вычислено,
Хим.-фарм. ж. 2015. Т. 49. № 4. С. 11; Fedotche-
%: C 53.69; H 7.46; N 4.32.
va T.A., Olenin A.Yu., Starostin K.M., Lisichkin G.V.,
4-[10-(Меркаптодецил)окси]бензоилгидразон
25
Vol. 49. N 4. P. 220. doi 10.1007/s11094-015-1260-6
D-лактозы (5г). Выход 68%, т. пл. 169-171°С, [α]
6. Marin M.J., Schofield C.L., Field R.A., Russell D.A. //
11.7° (c = 1.25, ДМФА). Спектр ЯМР 1Н, δ, м. д.:
Analyst.
2015. Vol.
140. P.
59. doi
10.1039/
форма α-Б (25%), 1.26 м (1.5Н, СН2), 1.31 м (1Н,
C4AN01466A
СН2), 1.39 м (0.5Н, СН2), 1.51 м (0.5Н, СН2), 1.70 м
7. de la Fuente J.M., Penades S. // Biochim. Biophys.
(0.5Н, СН2), 2.67 т (0.5Н, СН2S, J = 7.0 Гц), 4.00 м
Acta. 2006. Vol. 1760. N 4. P. 636. doi 10.1016/
(0.5Н, СН2O), 4.47 д (0.25Н, Н1, J = 4.5 Гц), 5.31 д
j.bbagen.2005.12.001
(0.25Н, Н1', J = 3.5 Гц), 6.96 д (0.5Н, Ar, J = 8.5 Гц),
8. Vetro M., Safari D., Fallarini S., Salsabila K., Lahmann M.,
7.79 д (0.5Н, Ar, J = 8.5 Гц), 9.77 уш. с (0.25Н,
Penades S., Lay L., Marradi M., Compostella F. //
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019
308
ЕРШОВ и др.
Nanomedicine. 2017. Vol. 12. N 1. P. 13. doi 10.2217/
Vol. 52. P. 966. doi 10.1039/C5CC09215A
nnm-2016-0306
21. Ершов А.Ю., Васильева М.Ю., Лагода И.В.,
9. Jazayeri M.H., Amani H., Pourfatollah A.A., Avan A.,
Байгильдин В.А., Наследов Д.Г., Кулешова Л.Ю.,
Ferns G.A., Pazoki-Toroudi H. // Cancer Gene Therapy.
Якиманский А.В. // ЖОХ. 2018. Т. 88. Вып. 1. С. 108;
2016. Vol. 23. P. 365. doi 10.1038/cgt.2016.42
Ershov A.Yu., Vasileva M.Yu., Lagoda I.V., Baygil-
10. Veerapandian M., Lim S.K., Nam H.M., Kuppannan G.,
din V.A., Nasledov D.G., Kuleshova L.Yu., Yakiman-
Yun K.S. // Analyt. Bioanalyt. Chem. 2010. Vol. 398.
sky A.V. // Russ. J. Gen. Chem. 2018. Vol. 88. N 1.
P. 867. doi 10.1007/ s00216-010-3964-5
P. 103. doi 10.1134/S1070363218010164
11. Perfezou M., Turner A., Merkoci A. // Chem. Soc. Rev.
22. Васильева М.Ю., Ершов А.Ю., Байгильдин В.А.,
2012. Vol. 41. P. 2606. doi 10.1039/C1CS15134G
Лагода И.В., Кулешова Л.Ю., Штро А.А., Зарубаев В.В.,
12. Love J.C., Estroff L.A., Kriebel J.K., Nuzzo R.G.,
Якиманский А.В. // ЖОХ. 2018. Т. 88. Вып. 1. С. 115;
Whitesides G.M. // Chem. Rev. 2005. Vol. 105. P. 1103.
Vasileva M.Yu., Ershov A.Yu., Baygildin V.A., Lagoda I.V.,
doi 10.1021/cr0300789
Kuleshova L.Yu., Shtro A.A., Zarubaev V.V., Yakiman-
13. Wang С., Zhou Y.-L., Baker D.C. // Arkivoc.
2009.
sky A.V. // Russ. J. Gen. Chem. 2018. Vol. 88. N 1.
Vol. 14. P. 171.
P. 109. doi 10.1134/S1070363218010176
14. van Seeventer P.B., van Dorst J.A.L.M., Siemerink J.F.,
23. Ершов А.Ю., Васильева М.Ю., Лагода И.В.,
Kamerling J.P., Vliegenthart J.F.G. // Carbohyd. Res.
Якиманский А.В. // ЖОХ. 2018. Т. 88. Вып.
6.
1997. Vol. 300. P. 369. doi 10.1016/S0008-6215(97)
С. 1020; Ershov A.Yu., Vasileva M.Yu., Lagoda I.V.,
Yakimansky A.V. // Russ. J. Gen. Chem. 2018. Vol. 88.
15. Yang H., Cheng Q. // Analyst. 2017. Vol. 142. P. 2654.
N 6. P. 1199. doi 10.1134/S1070363218060245
24. Васильева М.Ю., Ершов А.Ю., Байгильдин В.А.,
16. Zhang J., Misra R.D.K. // Acta Biomater. 2007. Vol. 3.
Шабсельс Б.М., Лагода И.В., Якиманский А.В. //
ЖОХ. 2018. Т. 88. Вып. 6. С. 1027; Vasileva M.Yu.,
17. Chuang Y.-J., Zhou X., Pan Z., Turchi C. // Biochem.
Ershov A.Yu., Baygildin V.A., Shabsels B.M., Lagoda I.V.,
Biophys. Res. Comm. 2009. Vol. 389. P. 22. doi
Yakimansky A.V. // Russ. J. Gen. Chem. 2018. Vol. 88.
N 6. P. 1205. doi 10.1134/S1070 36321806027
18. Zhi Z., Powell A., Turnbull J. // Anal. Chem. 2006.
25. Ershov A.Yu., Lagoda I.V., Yakimovich S.I., Kuleshova L.Yu.,
Vol. 78. N 14. P. 4786. doi 10.1021/ac060084f
Vasileva M.Yu., Korovina I.S., Shamanin V.V. // Open
19. Coxon T.P., Fallows T.W., Gough J.E., Webb S.J. // Org.
Ass. Lib. J.
2016. Vol.
3. e2646. doi
10.4236/
Biomol. Chem. 2015. Vol. 13. N 43. P. 10751. doi
oalib.1102646
10.1039/ C5OB 01591J
26. Xu J., Toh C.L., Liu X., Wang S., He C., Lu X. //
20. Gurav D., Varghese O.P., Hamad O.A., Nilsson B.,
Macromolecules. 2005. Vol. 38. N 5. P. 1684. doi
Hilborn J., Oommen O.P. // Chem. Commun. 2016.
10.1021/ma047999l
Synthesis of 4-[ω-(Mercaptoalkyl)oxy]benzoylhydrazones
of Mono- and Disacсharides as Potential Glycoligands
of Noble Metal Nanoparticles
A. Yu. Ershova,b*, A. A. Martynenkova, I. V. Lagodac, and A. V. Yakimanskya,d
a Institute of Macromolecular Compounds of the Russian Academy of Sciences, Bol’shoy pr. V. O. 31, St. Petersburg, 199004 Russia
*e-mail: ershov305@mail.ru
b St. Petersburg State Institute of Technology (Technical University), St. Petersburg, Russia
c State Research Testing Institute of Military Medicine, Ministry of Defense of the Russian Federation, St. Petersburg, Russia
d St. Petersburg State University, St. Petersburg, Russia
Received August 9, 2018; revised August 9, 2018; accepted August 13, 2018
Method for the synthesis of previously unknown aldose 4-[ω-(mercaptoalkyl)oxy]benzoylhydrazones (Alk =
hexyl, decyl; D-glucose, D-galactose, D-maltose, D-lactose), promising glycoligands of noble metal
nanoparticles, was developed. By 1H and 13C NMR data, 4-[ω-(mercaptoalkyl)oxy]benzoylhydrazones of
D-glucose, D-maltose, and D-lactose in the crystalline state and in solutions in DMSO-d6 exist exclusively as
cyclic pyranose forms represented by α,β-configurational isomers. 4-[ω-(Mercaptoalkyl)oxy]benzoylhydrazones
of D-galactose are in DMSO-d6 solution as a tautomeric mixture of cyclic pyranose and linear acylhydrazone
forms.
Keywords: thiol-containing acylhydrazones of mono- and disaccharides, ring-chain tautomerism
ЖУРНАЛ ОБЩЕЙ ХИМИИ ТОМ 89 № 2 2019